胰岛素抵抗与2型糖尿病患者脑功能的相关性研究
葛 飞,程千鹏,周玉玲,王 雪,陈 曦,吕肖锋
·论著·
胰岛素抵抗与2型糖尿病患者脑功能的相关性研究
葛 飞,程千鹏,周玉玲,王 雪,陈 曦,吕肖锋*
目的探讨2型糖尿病(T2DM)患者脑功能变化与胰岛素抵抗指数(HOMA-IR)的相关性。方法选取2015年8月—2016年9月就诊于陆军总医院内分泌科的T2DM患者31例为T2DM组;选择同时期体检非T2DM者28例为对照组。测量身高、体质量、血压,计算体质指数(BMI)。检测空腹胰岛素(FINS)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)水平,计算HOMA-IR。采用3.0 T磁共振扫描仪监测并收集受试者自发大脑活动变化数据,运用低频振荡幅度法对数据进行处理。采用Pearson相关性分析HOMA-IR与相应脑区低频振荡幅度(ALFF)值的相关性。结果两组性别、年龄、BMI、收缩压、舒张压比较,差异均无统计学意义(P>0.05);T2DM组HbA1c高于对照组(P<0.05)。T2DM组ALFF值小于对照组的有左后扣带回、小脑、左侧颞中回、右侧颞极颞上回、左侧三角部额下回、左侧额中回、左侧颞上回、左顶下小叶;T2DM组ALFF值大于对照组的有左侧海马旁回、右额上内侧回。Pearson相关性分析结果显示,HOMA-IR与小脑、右侧颞中回ALFF值呈负相关(r=-0.362,P=0.047;r=-0.383,P=0.038)。结论胰岛素抵抗对T2DM患者脑功能活动产生影响,可能与抑郁有关。
糖尿病,2型;胰岛素抵抗;脑功能
本研究创新点:
本研究跨学科利用了影像学脑功能磁共振技术对临床2型糖尿病患者静息态脑功能改变进行监测,直观地反映出2型糖尿病患者不同脑区的基础代谢水平以及较正常人增强或减低。通过将胰岛素抵抗水平与不同脑区的低频振荡幅度(ALFF)值进行相关性分析,探索2型糖尿病患者胰岛素抵抗水平与不同脑区基础代谢水平异常的关联。胰岛素抵抗是糖尿病发病的主要机制之一,同时伴有糖尿病的发生以及发展的整个过程。本文从不同角度提供新的证据证明胰岛素抵抗可能与2型糖尿病患者精神行为异常有关。
糖尿病引起脑功能异常日益受到研究者的重视,情绪障碍是脑功能损伤的表现之一[1];在长期高血糖对糖尿病患者的不利影响受到广泛关注的同时,胰岛素抵抗对糖尿病患者的重要性也逐渐受到重视[2]。国内研究认为胰岛素抵抗可能通过β淀粉样蛋白(Aβ)沉积、炎性反应、氧化应激等机制导致脑功能异常[3]。国外也有报道降低胰岛素抵抗能使患者脑功能有所改善[4]。但关于胰岛素抵抗与脑功能的关联及机制目前仍不是很明确。本研究主要分析胰岛素抵抗与脑功能变化的相关性,以期为临床治疗提供参考。
1 对象与方法
1.1 研究对象 选取2015年8月—2016年9月就诊于陆军总医院内分泌科的2型糖尿病(T2DM)患者31例为T2DM组,其中男13例,女18例;年龄30~65岁,平均年龄(51.3±9.9)岁;病程5~10年。选择同时期体检非T2DM者28例为对照组,其中男12例,女16例;年龄30~65岁,平均年龄(50.4±9.8)岁。T2DM组均符合世界卫生组织(WHO)糖尿病诊断及分类标准(1999)[5]。排除标准:有糖尿病急症者(如:酮症酸中毒等);近期有严重应激情况者(如:手术等);严重心、肝、肾功能不全者;其他内分泌疾病者(如:甲状腺功能亢进、自身免疫性疾病等);有冠状动脉支架手术史者;有脑梗死、脑出血病史者;依从性差者。研究对象均知情同意并签署知情同意书。
1.2 方法
1.2.1 一般资料 对受试者进行体检,测量身高、体质量、血压,计算体质指数(BMI)。
1.2.2 实验室指标 患者入院后次日清晨和对照组受试者体检当日清晨抽取空腹静脉血,送至陆军总医院检验科进行实验室检测。在37 ℃下,以2 400 r/min离心15 min,离心半径为19 cm,分离上清液置于-70 ℃中保存。采用美国Beckman公司生产的Beckman-CX4全自动生化检测仪及其配套试剂盒检测血清空腹血糖(FPG)水平,采用放射免疫分析方法检测空腹胰岛素(FINS)水平。采用美国Bio-Rad公司生产的DiaSTAT糖化血红蛋白分析仪及其配套试剂盒检测血清糖化血红蛋白(HbA1c)水平。胰岛素抵抗指数(HOMA-IR)=(FINS×FPG)/22.5,其中FINS单位为mU/L,FPG单位为mmol/L。由于计算结果为非正态分布,分析时取自然对数[6]。
1.2.3 磁共振数据采集 采用GE Medical Systems 3.0 T磁共振扫描仪,使用8HRBRAIN线圈接收磁共振扫描仪扫描信号。扫描时运用梯度回波平面成像序列采集静息态脑功能信息,受试者被要求放松、闭眼(不能入睡)、不要有特定思想活动,保持头部不动(减少伪影),基本扫描参数为:扫描层数39层,重复时间(TR)2 000 ms,回波时间(TE)30 ms,层厚3.4 mm,矩阵64×64,扫描视野(FOV)240 cm,采集时间点为210个。
静息态数据预处理:在MATLAB 2015B平台上使用DPARSF、SPM 5.0对静息态数据进行预处理,DICOM格式转换为NIFTI格式;剔除前10个时间点的数据;进行时间层次校正(slice timing):总层数为39层;头动校正(realign);空间标准化(normalize):将受试者脑结构估计到标准空间;空间平滑(smooth);去线性漂移(detrend);滤波(filer);计算低频振荡幅度(ALFF)值。

2 结果
2.1 一般资料比较 两组性别、年龄、BMI、收缩压、舒张压比较,差异均无统计学意义(P>0.05);T2DM组HbA1c高于对照组,差异有统计学意义(P<0.05,见表1)。
2.2 两组ALFF值比较 T2DM组ALFF值小于对照组的有左后扣带回、小脑、左侧颞中回、右侧颞极颞上回、左侧三角部额下回、左侧额中回、左侧颞上回、左顶下小叶;T2DM组ALFF值大于对照组的有左侧海马旁回、右额上内侧回(见表2、图1,本文彩图见本刊官网www.chinagp.net电子期刊相应文章)。
表1 对照组与T2DM组一般资料比较
Table1 Comparison of general data between control group and T2DM group
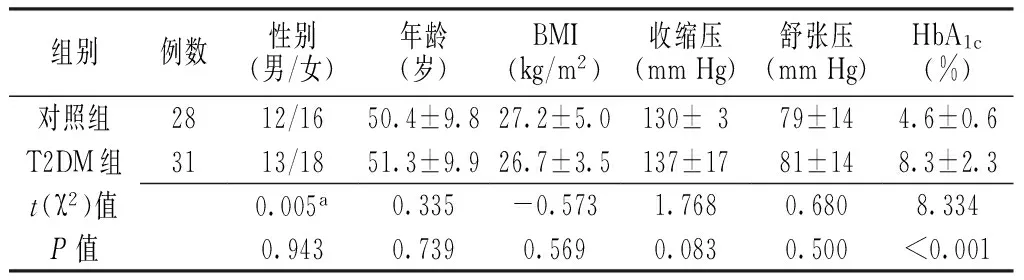
组别例数性别(男/女)年龄(岁)BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)HbA1c(%)对照组2812/1650.4±9.827.2±5.0130±379±144.6±0.6T2DM组3113/1851.3±9.926.7±3.5137±1781±148.3±2.3t(χ2)值0.005a0.335-0.5731.7680.6808.334P值0.9430.7390.5690.0830.500<0.001
注:T2DM=2型糖尿病,BMI=体质指数,HbA1c=糖化血红蛋白;a为χ2值
2.3 HOMA-IR与各脑区ALFF值相关性分析 Pearson相关性分析结果显示,HOMA-IR与小脑、右侧颞中回ALFF值呈负相关(r=-0.362,P=0.047;r=-0.383,P=0.038,见图2、3);HOMA-IR与左后扣带回、左侧颞中回、右侧颞极颞上回、左侧三角部额下回、左侧额中回、左侧颞上回、左顶下小叶、左侧海马旁回、右额上内侧回的ALFF值均无直线相关关系(r=-0.349,P=0.088;r=0.029,P=0.889;r=0.306,P=0.070;r=0.055,P=0.804;r=-0.148,P=0.478;r=0.155,P=0.455;r=-0.095,P=0.581;r=-0.077,P=0.720;r=0.259,P=0.224)。
表2 T2DM组与对照组脑功能ALFF信号比较
Table2 Comparison of ALFF value between T2DM group and control group
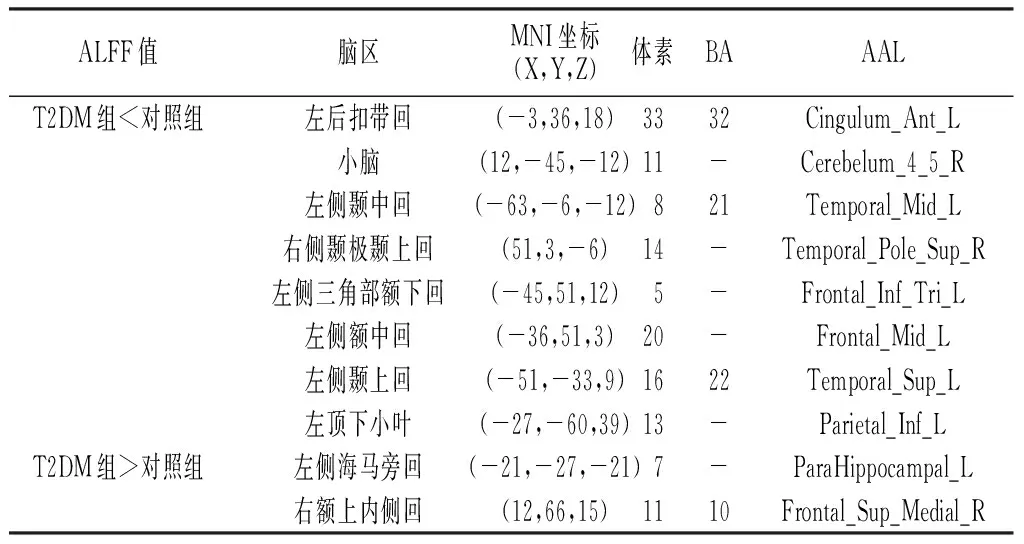
ALFF值脑区MNI坐标(X,Y,Z)体素BAAALT2DM组<对照组左后扣带回(-3,36,18)3332Cingulum_Ant_L小脑(12,-45,-12)11-Cerebelum_4_5_R左侧颞中回(-63,-6,-12)821Temporal_Mid_L右侧颞极颞上回(51,3,-6)14-Temporal_Pole_Sup_R左侧三角部额下回(-45,51,12)5-Frontal_Inf_Tri_L左侧额中回(-36,51,3)20-Frontal_Mid_L左侧颞上回(-51,-33,9)1622Temporal_Sup_L左顶下小叶(-27,-60,39)13-Parietal_Inf_LT2DM组>对照组左侧海马旁回(-21,-27,-21)7-ParaHippocampal_L右额上内侧回(12,66,15)1110Frontal_Sup_Medial_R
注:ALFF=低频振荡幅度,BA=布洛德曼脑区,AAL为由蒙特利尔神经病学研究所(MNI)提供的全脑分区;X/Y/Z为MNI坐标轴(mm);-为未发现
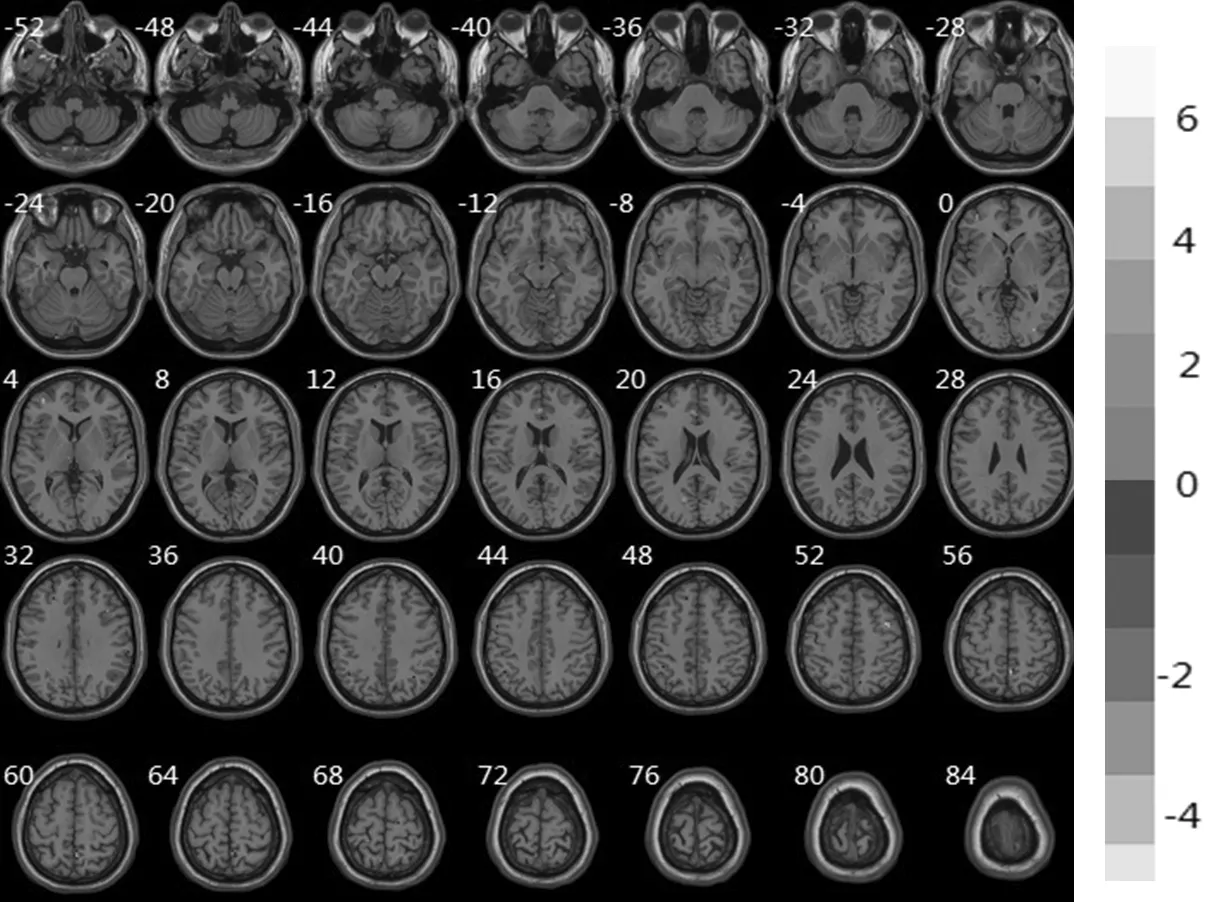
注:红色代表减弱区,蓝色代表增强区
图1 T2DM组与对照组ALFF值有差异脑区
Figure1 ALFF signal difference between T2DM group and control group
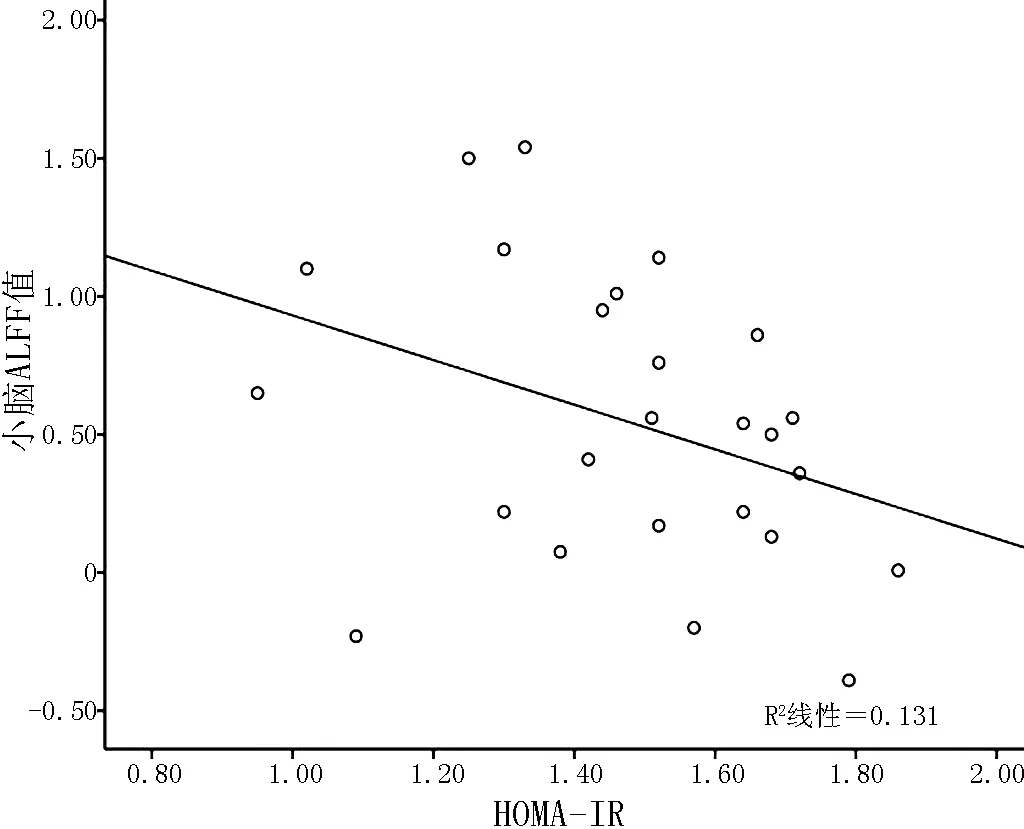
注:HOMA-IR=胰岛素抵抗指数,ALFF=低频振荡幅度
图2 HOMA-IR与小脑ALFF值相关性散点图
Figure2 Scatter diagram of the correlation between the HOMA-IR and ALFF value in cerebellum
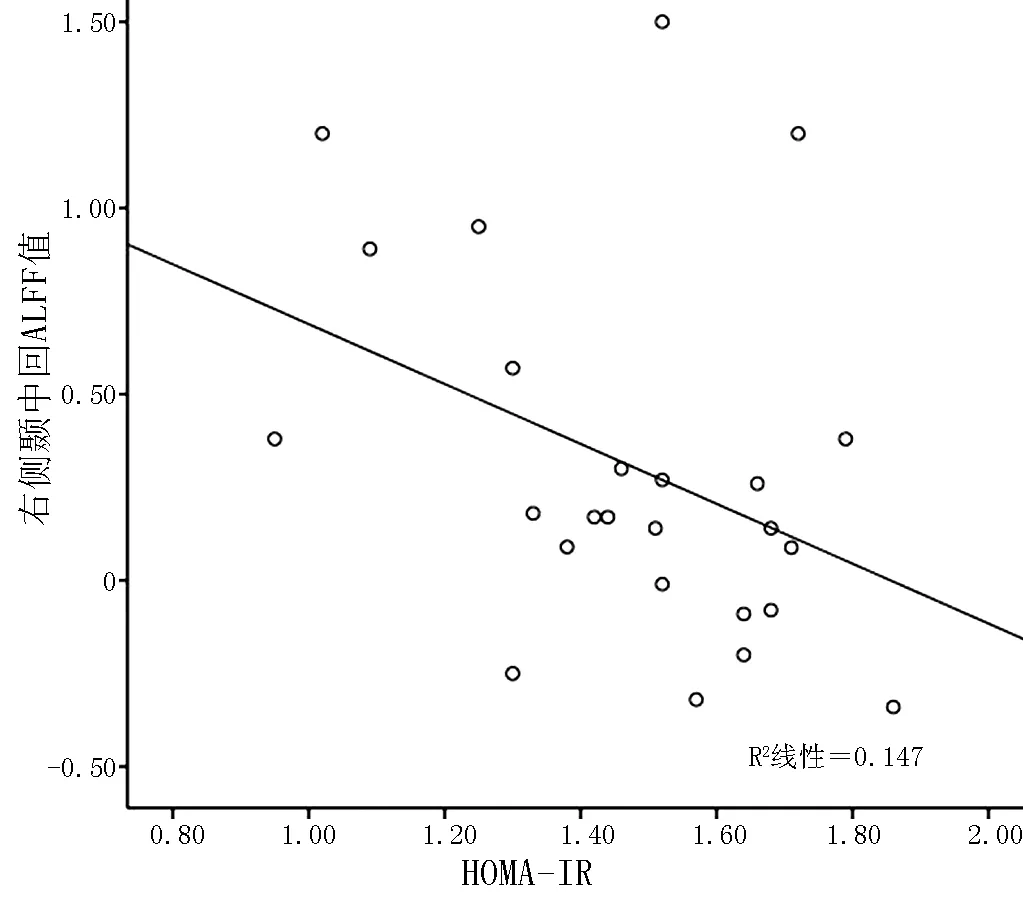
图3 HOMA-IR与右侧颞中回ALFF值相关性散点图
Figure3 Scatter diagram of the correlation between the HOMA-IR and ALFF value in right middle temporal gyrus
3 讨论
胰岛素抵抗是T2DM的特点[2],高胰岛素血症和胰岛素敏感性降低在患糖尿病前很长一段时间就已经存在。胰岛素抵抗时机体为应对高血糖,胰岛素分泌增加,产生高胰岛素血症;胰岛素抵抗一直受到研究者们高度关注[7]。血氧水平依赖的ALFF是反映静息态功能磁共振图像的新方法,可以度量每个体素神经元的自发性活动强度。目前已广泛应用于临床及科研,其优点有准确、直观反映脑功能活动范围及部位,还有无创性、无放射性等[8]。能测量出静息状态下局部脑区神经元自发性活动。目前ALFF已经被用于区别不同患者之间大脑自发活动的差异,也有用于研究T2DM患者与健康对照组之间静息态脑功能变化[9-10]。
本研究中T2DM组左后扣带回、小脑、左侧颞中回、右侧颞极颞上回、左侧三角部额下回、左侧额中回、左侧颞上回、左顶下小叶的ALFF值降低,提示这些脑区功能受损。同时还发现左侧海马旁回、右额上内侧回的ALFF值有所增高,之前有研究发现左侧颞下回、双侧眶部额下回和小脑前叶ALFF值增加[11],本研究中并未发现,具体机制有待进一步研究与分析,ALFF值增高可能是部分脑区出现代偿效应。Pearson相关分析结果显示,HOMA-IR与小脑、右侧颞中回ALFF值呈负相关,提示胰岛素抵抗与小脑、右侧颞中回的受损有关,与其他脑区未发现直线相关性也并不表示没有关联。有研究发现T2DM患者HOMA-IR与额、颞叶与顶叶区域的神经活动呈负相关[12]。
本研究中异常脑区有左后扣带回、小脑、左侧颞中回、右侧颞极颞上回、左侧三角部额下回、左侧额中回、左侧颞上回、左顶下小叶。国内也有相似研究显示颞叶、顶下小叶、小脑、扣带回ALFF值降低[11,13]。颞叶在大脑活动如识别、记忆等中的作用已经得到证实[14-15],并与面部情绪的识别有关,可能参与了人类大脑对社会感知[16-17]。关于小脑功能众人所熟知的是与平衡,即运动的协调以及控制有关,而关于小脑的感知觉,即情绪的加工与处理方面的功能以及小脑与额叶皮质、边缘系统等的神经纤维连接也逐渐被研究者们发现[18-19]。后扣带回在额叶与前扣带回和纹状体之间起中继作用,是情绪回路的重要组成部分[20-21]。大脑额叶在认知功能和情感活动中发挥着重要作用,如内侧前额叶皮质一般角色就是情感的加工;顶下小叶是大脑中一个复杂的区域,主要负责回忆、巩固和提取短期记忆信息[22],顶下小叶和颞叶还协同完成记忆工作[23]。这些脑区代谢异常,脑功能也会出现异常。可以看出信号异常主要发生的脑区位于额叶、颞叶、小脑以及边缘系统,主要分布于抑郁症神经解剖环路“边缘系统-皮质-纹状体-苍白球-丘脑”[24]。说明这些脑区代谢异常可能与抑郁有关,而近年糖尿病抑郁患病率也逐年上升。LOPEZ-DE-ANDRÉS等[25]对2001—2011在西班牙住院T2DM患者进行统计,T2DM患者抑郁症的患病率从2001年的3.54%增加到2011年的5.80%。究其原因,目前一种观点认为与Aβ沉积有关。胰岛素抵抗可引起不溶性Aβ沉积[26],累积的Aβ会使胰岛素与胰岛素受体(INSR)亲和力减小。长时间的外周高胰岛素血症也会影响血-脑脊液屏障功能以及INSR的活性,其结果是通过血-脑脊液屏障运输到脑组织中的胰岛素减少[27-28]。有报道神经递质释放、微管蛋白活动、神经元生存和突触可塑性是由胰岛素直接调节的。脑组织中胰岛素浓度减少,与葡萄糖利用、氧浓度高低直接相关,进而在磁共振图像上有所显示,即不同脑区的异样表现可能与脑组织中胰岛素浓度,胰岛素受体活性有关。
本次研究的样本量相对较小,很有必要开展大样本量的前瞻性研究,探究其具体机制。
综上所述,胰岛素抵抗可能通过Aβ沉积机制影响脑细胞能量代谢,从而对大脑细胞神经活动产生影响,是T2DM患者脑功能受损的重要影响因素,对T2DM患者脑功能受损程度有一定预测意义。本研究对胰岛素抵抗与T2DM患者脑功能受损进行的仅是初步探讨,其具体机制仍然需要大样本及基础研究来进一步观察与分析。
作者贡献:葛飞进行文章的构思与设计,统计学处理,结果的分析与解释,论文的撰写及修订,对文章整体负责,监督管理;葛飞、周玉玲、王雪、陈曦进行研究的实施与可行性分析、数据收集及整理;程千鹏、吕肖锋负责文章的质量控制及审校。
本文无利益冲突。
[1]VAGELATOS N T,ESLICK G D.Type 2 diabetes as a risk factor for Alzheimer′s disease:the confounders,interactions,and neuropathology associated with this relationship[J].Epidemiol Rev,2013,35(1):152-160.DOI:10.1093/epirev/mxs012.
[2]GHAREEB D A,MOHAMED S,ELSAYED M.The interrelationship between insulin resistane and Alzheimer development[J].J Biomed Sci,2013,6(7):754-773.DOI:10.4236/jbise.2013.67093.
[3]朱责梅,杨丝丝,伍迪,等.胰岛素抵抗与糖尿病脑病[J].生理科学进展,2016,47(5):395-400.
ZHU Z M,YANG S S,WU D,et al.Insulin resistance and diabetic encephalopathy[J].Progress in Physiological Sciences,2016,47(5):395-400.
[4]UMEGAKI H.Therapeutic potential of antidiabetic medications in the treatment of cognitive dysfunction and dementia[J].Drugs Aging,2016,33(6):1-11.DOI:10.1007/s40266-016-0375-0.
[5]World Health Organization.Definition,diagnosis and classification of diabetes mellitus and its complication:report of a WHO consultation[R].Geneva:WHO,1999.
[6]张家庆.HOMA2-IR是个较好的胰岛素抵抗指数[J].中华内分泌代谢杂志,2005,21(4):304-305.DOI:10.3760/j.issn:1000-6699.2005.04.005.
ZHANG J Q.HOMA2-IR is a good basal insulin resistance index[J].Chinese Journal of Endocrinology and Metabolism,2005,21(4):304-305.DOI:10.3760/j.issn:1000-6699.2005.04.005.
[7]王廷伟,陈秋.胰岛素抵抗与胰岛素信号通路的相关关系研究进展[J].西南军医,2014,24(1):71-73.DOI:10.3969/j.issn.1672-7193.2014.01.028.
WANG T W,CHEN Q.Research progress of relationship between insulin resistance and insulin signaling pathway[J].Journal of Military Surgeon in Southwest China,2014,24(1):71-73.DOI:10.3969/j.issn.1672-7193.2014.01.028.
[8]FARO S H,MOHAMED F B.BOLD fMRI[M].New York:Springer,2010.
[9]WANG L,DAI W,SU Y,et al.Amplitude of low-frequency oscillations in first-episode,treatment-naive patients with major depressive disorder:a resting-state functional MRI study[J].PLoS One,2012,7(10):e48658.DOI:10.1371/journal.pone.0048658.
[10]WANG C X,FU K L,LIU H J,et al.Spontaneous brain activity in type 2 diabetics revealed by amplitude of low-frequency fluctuations and its association with diabetic vascular disease:a resting-state FMRI study.[J].PLoS One,2014,9(10):e108883.DOI:10.1371/journal.pone.0108883.
[11]刘姗姗,王晓艳,王鹏程,等.伴有视网膜病变的2型糖尿病患者大脑静息态功能磁共振成像低频振幅研究[J].中国医学物理学杂志,2016,33(11):1149-1154.DOI:10.3969/j.issn.1005-202X.2016.11.013.
LIU S S,WANG X Y,WANG P C,et al.Amplitude of low frequency fluctuation in resting-state functional magnetic resonance imaging for patients with type 2 diabetes retinopathy[J].Chinese Journal of Medical Physics,2016,33(11):1149-1154.DOI:10.3969/j.issn.1005-202X.2016.11.013.
[12]CUI Y,JIAO Y,CHEN Y C,et al.Altered spontaneous brain activity in type 2 diabetes:a resting-state functional MRI study[J].Diabetes,2014,63(2):749-760.DOI:10.2337/db13-0519.
[13]严永,王中领,葛晓敏,等.2型糖尿病视网膜病变功能磁共振成像研究[J].常州大学学报(自然科学版),2014,26(4):45-48.DOI:10.3969/j.issn.2095-0411.2014.04.009.
YAN Y,WANG Z L,GE X M,et al.A fMRI study in type 2 diabetic retinopathy[J].Journal of Changzhou University(Natural Science Edition),2014,26(4):45-48.DOI:10.3969/j.issn.2095-0411.2014.04.009.
[14]EICHENBAUM H,YONELINAS A R,RANGANATH C.The medial temporal lobe and recognition memory[J].Annu Rev Neurosci,2007,30(1):123-152.DOI:10.1146/annurev.neuro.30.051606.094328.
[15]SOLDAN A,PETTIGREW C,LU Y,et al.Relationship of medial temporal lobe atrophy,APOE genotype,and cognitive reserve in preclinical Alzheimer′s disease[J].Hum Brain Mapp,2015,36(7):2826-2841.DOI:10.1002/hbm.22810.
[16]CAETANO S C,FONSECA M,HATCH J P,et al.Medial temporal lobe abnormalities in pediatric unipolar depression[J].Neurosci Lett,2007,427(3):142-147.DOI:10.1016/j.neulet.2007.06.014.
[17]RADUA J,PHILLIPS M L,RUSSELL T,et al.Neural response to specific components of fearful faces in healthy and schizophrenic adults[J].Neuroimage,2010,49(1):939-946.DOI:10.1016/j.neuroimage.2009.08.030.
[18]SCHMAHMANN J D.Disorders of the cerebellum:ataxia,dysmetria of thought,and the cerebellar cognitive affective syndrome[J].J Neuropsychiatry Clin Neurosci,2004,16(3):367-378.DOI:10.1176/jnp.16.3.367.
[19]NIXON P.The cerebellum and cognition[J].J Psychophysiol,2012,14(4):253-255.DOI:10.1027//0269-8803.14.4.253.
[20]CAVANNA A E,TRIMBLE M R.The precuneus:a review of its functional anatomy and behavioural correlates[J].Brain,2006,129(Pt 3):564-583.DOI:10.1093/brain/awl004.
[21]VLASSENKO A G,VAISHNAVI S N,COUTURE L,et al.Spatial correlation between brain aerobic glycolysis and amyloid-β (Aβ) deposition[J].Proc Natl Acad Sci U S A,2010,107(41):17763-17767.DOI:10.1073/pnas.1010461107.
[22]WIG G S,GRAFTON S T,DEMOS K E,et al.Medial temporal lobe BOLD activity at rest predicts individual differences in memory ability in healthy young adults[J].Proc Natl Acad Sci U S A,2008,105(47):18555-18560.DOI:10.1073/pnas.0804546105.
[23]SESTIERI C,CORBETTA M,ROMANI G L,et al.Episodic memory retrieval,parietal cortex,and the default mode network:functional and topographic analyses[J].J Neurosci,2011,31(12):4407-4420.DOI:10.1523/JNEUROSCI.3335-10.2011.
[24]赖丽莎,陈少琼,张建生,等.抑郁症患者边缘系统-皮层-纹状体-苍白球-丘脑神经环路相关结构的磁共振成像研究[J].中华临床医师杂志(电子版),2010,4(6):766-771.DOI:10.3877/cma.j.issn.1674-0785.2010.06.016.
LAI L S,CHEN S Q,ZHANG J S,et al.Study on neural circuit in patients with depression by 1H MR spectroscopy and diffusion tensor imaging[J].Chinese Journal of Clinicians (Electronic Version),2010,4(6):766-771.DOI:10.3877/cma.j.issn.1674-0785.2010.06.016.
[25]LOPEZ-DE-ANDRÉS A,JIMÉNEZ-TRUJILLO M I,HERNNDEZ-BARRERA V,et al.Trends in the prevalence of depression in hospitalized patients with type 2 diabetes in Spain:analysis of hospital discharge data from 2001 to 2011[J].PLoS One,2015,10(2):e0117346.DOI:10.1371/journal.pone.0117346.
[26]杨雁,马德琳,胡蜀红,等.皮下胰岛素注射减轻2型糖尿病大鼠大脑AD样改变[EB/OL].(2012-04-09)[2016-07-16].http://www.paper.edu.cn/releasepaper/content/201204-109.
YANG Y,MA D L,HU S H,et al.Insulin subcutaneous injection ameliorates tau hyperphosphorylation in brain of type 2 diabetic rat[EB/OL].(2012-04-09)[2016-07-16].http://www.paper.edu.cn/releasepaper/content/201204-109.
[27]KAIYALA K J,PRIGEON R L,KAHN S E,et al.Obesity induced by a high-fat diet is associated with reduced brain insulin transport in dogs[J].Diabetes,2000,49(9):1525-1533.
[28]SAHIN I,ALKAN A,KESKIN L,et al.Evaluation of in vivo cerebral metabolism on proton magnetic resonance spectroscopy in patients with impaired glucose tolerance and type 2 diabetes mellitus[J].J Diabetes Complications,2008,22(4):254-260.DOI:10.1016/j.jdiacomp.2007.03.007.
RelationshipbetweenInsulinResistanceandBrainFunctioninPatientswithType2DiabetesMellitus
GEFei,CHENGQian-peng,ZHOUYu-ling,WANGXue,CHENXi,LYUXiao-feng*
DepartmentofEndocrinology,ArmyGeneralHospital,Beijing100700,China
*Correspondingauthor:LYUXiao-feng,Chiefphysician;E-mail:892659277@163.com
ObjectiveTo investigate the relationship between spontaneous brain activity changes and HOMA-IR in patients with type 2 diabetes mellitus(T2DM).MethodsFrom August 2015 to September 2016,31 T2DM patients treated in Department of Endocrinology,Army General Hospital were selected as T2DM group.At the same time,28 non-T2DM physical examination cases were selected as control group.Body height,body mass and blood pressure were measured,and body mass index (BMI) was calculated.The levels of fasting insulin (FINS),fasting blood glucose (FPG) and glycosylated hemoglobin (HbA1c) were measured and the HOMA-IR was calculated.3.0 T magnetic resonance scanner was used to monitor and collect the data of spontaneous brain activity changes,and the low frequency oscillation amplitude (ALFF) was used to process the data.Pearson correlation analysis was conducted to investigate the correlation between HOMA-IR and ALFF values in the corresponding brain regions.ResultsThere were no significant differences in gender,age,BMI,systolic blood pressure and diastolic blood pressure between the two groups (P> 0.05).HbA1cin T2DM group was higher than that in control group (P<0.05).The ALFF values in T2DM group were smaller than those in the control group,including left posterior cingulate gyrus,cerebellum,left middle temporal gyrus,right temporal superior temporal gyrus,left triangle,inferior frontal gyrus,left frontal gyrus,left superior temporal gyrus,and left inferior parietal lobule.The ALFF values in T2DM group were higher than those in the control group,including the left parahippocampal gyrus and the right superior frontal gyrus.Pearson correlation analysis showed that HOMA-IR was negatively correlated with ALFF value in cerebellum and right middle temporal gyrus (r=-0.362,P=0.047;r=-0.383,P=0.038).ConclusionInsulin resistance has an effect on brain function in T2DM and may be associated with depression.
Diabetes mellitus,type 2;Insulin resistance;Brain function
R 587.1
A
10.3969/j.issn.1007-9572.2017.05.y08
葛飞,程千鹏,周玉玲,等.胰岛素抵抗与2型糖尿病患者脑功能的相关性研究[J].中国全科医学,2017,20(35):4372-4377.[www.chinagp.net]
GE F,CHENG Q P,ZHOU Y L,et al.Relationship between insulin resistance and brain function in patients with type 2 diabetes mellitus[J].Chinese General Practice,2017,20(35):4372-4377.
100700北京市,陆军总医院内分泌科
*通信作者:吕肖锋,主任医师;E-mail:892659277@163.com
2016-10-25;
2017-04-16)
陈素芳)

