高脂饮食对西藏小型猪胰岛素抵抗及肝胰岛素受体底物1、2表达的影响
潘永明,戎亦骊,黄俊杰,徐孝平,陈诚,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
研究报告
高脂饮食对西藏小型猪胰岛素抵抗及肝胰岛素受体底物1、2表达的影响
潘永明,戎亦骊,黄俊杰,徐孝平,陈诚,陈民利*
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
目的探讨高脂饮食对西藏小型猪胰岛素抵抗(IR)及肝胰岛素受体底物(IRS)1、2表达的影响。方法将10只西藏小型猪随机分为正常对照组(Ctr)5只饲喂普通饲料、IR模型(IR model)组5只饲喂高脂饲料,连续造模12周。造模12周后,称重并测量体长,计算体质量指数(BMI),空腹取前腔静脉血测定总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、甘油三酯(TG)、游离脂肪酸(FFA)、空腹血糖(FBG)和胰岛素(insulin),计算胰岛素抵抗指数(homeostasis model assessment-estimated insulin resistance,HOMA-IR);同时进行糖耐量试验,并计算糖耐量曲线下面积(AUC);取肝组织检测IRS-1和IRS-2基因和蛋白表达,并行油红O、PAS和HE染色,分别观察肝脂质沉积、糖原及组织病理变化。结果与正常对照组比,IR模型组体重、BMI指数、TC、LDL-C、HDL-C、FFA、FBG、insulin和HOMA-IR指数均显著升高(P<0.05,P<0.01);糖耐量试验显示血糖和胰岛素水平曲线下降延缓,而AUC血糖和AUC胰岛素均明显升高(P<0.05,P<0.01);肝组织中出现脂质沉积、糖原增加和局部肝细胞浊肿、部分胞核消失或被挤向一端,偶见淋巴细胞浸润;同时肝组织中IRS-1和IRS-2 mRNA和蛋白表达均显著降低(P<0.05,P<0.01)。结论高脂饮食可引起西藏小型猪胰岛素抵抗,肝组织IRS-1和IRS-2表达降低是高脂饮食影响西藏小型猪胰岛素敏感性的分子机制之一。
西藏小型猪;高脂饮食;胰岛素抵抗;胰岛素受体底物
高热量饮食能促进代谢综合征(metabolic syndrome,MS)的发生,并且富含高脂和碳水化合物的饮食与胰岛素抵抗(insulin resistance,IR)明显相关[1,2]。据报道[3],约有25%的正常人群、60%~75%的糖耐量减低人群及85%~90%的2型糖尿病患者均存在IR,可见,IR不仅是2型糖尿病发生发展的启动因素和重要环节,还是肥胖、高血压、高血脂和心血管疾病的共同土壤[4]。然而胰岛素敏感性受损的患者并不是所有都将发展至2型糖尿病,但高发病率和高死亡率都存在于IR的患者中[5]。在所有IR发生的靶器官中,肝不仅是维持机体糖脂代谢平衡的重要器官,也是IR发生的靶器官之一。肝胰岛素信号转导通路的缺陷,均会影响到全身IR的发生和2型糖尿病的发病进程。胰岛素受体底物(insulin receptor substrate,IRS)是胰岛素信号转导中的重要因子,主要以IRS-1和IRS-2为主,在IR的发生中起着关键的作用。西藏小型猪(Tibet minipig,TMP)作为我国特有的小型猪品种,本课题组前期发现高脂饮食诱导能产生高脂血症、糖耐量异常、高血压和动脉粥样硬化[6],但是否与肝胰岛素受体底物表达异常有关,还尚不清楚。为此,本研究采用高脂诱导西藏小型猪发生IR,观察肝组织中IRS-1和IRS-2的表达情况,为完善构建小型猪IR动物模型的制备提供实验依据。
1 材料与方法
1.1 实验动物
普通级4~5月龄雄性西藏小型猪(TMP),体重为10~14 kg,10只,购自南方医科大学实验动物中心【SCXK(粤)2011-0015】;饲养于本中心普通级小型猪实验室【SYXK(浙)2013-0164】,室内温度:20℃~22℃,相对湿度:40%~65%,12 h/12 h明暗交替,自由饮水,并按实验动物使用的3R原则给予人道主义关怀。
1.2 试剂与仪器
空腹血糖(FBG)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)试剂盒均购自上海申能德赛诊断技术有限公司;胰岛素(insulin)和游离脂肪酸(FFA)ELISA试剂盒均购自南京建成生物工程研究所;油红O购自Sigma公司;PAS染色试剂盒购自南京建成科技有限公司;荧光定量试剂盒(SYBR Premix Ex TaqTMII)购自日本TaKaRa公司;IRS-1和IRS-2抗体购自Santa Cruz公司;7020全自动生化分析仪(日本日立公司)、Thermo Varioskan Flash连续光谱酶标仪(芬兰Thermo Fisher公司)、IQ5 PCR仪(美国Bio-Rad公司)、ASP 200S封闭式组织自动脱水机、RM2245型石蜡切片机和CM1950型冰冻切片机(美国徕卡公司)、滨松NanoZoomer数字切片扫描仪(滨松光子公司)、Wes全自动蛋白质印迹定量分析系统(美国ProteinSimple 公司)。
1.3 西藏小型猪IR模型的建立
所有西藏小型猪经适应性饲养后,空腹取前腔静脉肝素抗凝血,检测糖脂代谢、肝肾功能和血常规指标均无异常后开始正式实验。将西藏小型猪随机分成正常对照组(control group,Ctr)和IR模型组(insulin resistance group,IR model)各5只,其中正常对照组饲喂基础饲料;IR模型组饲喂高脂饲料(1.5%胆固醇、15%起酥油、10%蛋黄粉、0.5%食盐和73%基础饲料),摄食量每天按2.5%体重分两次等量给予,连续12周。
1.4 观察指标
1.4.1 表型特性
造模12周时,禁食12 h后称重并测量体长(体长以两耳中间线至尾根部的距离),计算体质量指数,即:体重(kg)/体长(m2),同时取前腔静脉肝素抗凝血,分离血浆,在7020全自动生化分析仪上测定血浆中空腹血糖(FBG)、TC、LDL-C、HDL-C、TG水平的变化,同时采用ELISA法测量胰岛素水平的变化,计算胰岛素抵抗指数(HOMA-IR),即空腹血糖×空腹胰岛素/22.5。
1.4.2 糖耐量试验
试验前先对小型猪进行吊床适应训练,然后试验当天将小型猪禁食不禁水18 h,并称重后保定于吊床中,于小型猪右耳缘静脉建立静脉通路,随后稳定30 min后,从静脉通路中取给糖前(0 min)的静脉血,此后向静脉内注射0.5 g/kg的葡萄糖注射液,并在2 min内注射完毕,然后在静脉通路中取给糖后5、15、30、60、90、120 min的静脉血,检测血糖和胰岛素水平,计算曲线下面积AUC。
1.4.3 RT-PCR法检测肝组织中IRS-1和IRS-2 mRNA
取各组肝组织,先后用TaKaRa公司的总RNA提取试剂盒和逆转录试剂盒依次提取肝组织总RNA和逆转录合成cDNA,然后采用TaKaRa SYBR Premix Ex TaqTMⅡ试剂盒进行RT-PCR扩增。mRNA 引物序列见表1,由生工生物工程(上海)有限公司设计并合成,反应条件为95℃预变性30 s,循环次数1次;95℃变性5 s和60℃退火34 s,循环次数40次;GAPDH作为内参,并在Bio-Rad iQ5 PCR仪上检测并获得目的基因Ct值,并用2-△△Ct法计算IRS-1和IRS-2 mRNA的相对表达量。

表1 引物序列Tab.1 Sequences of the used primers
1.4.4 Simple Western法检测肝组织中IRS-1和IRS-2蛋白
取肝组织80 mg,用凯基全蛋白试剂盒提取总蛋白。根据ProteinSimple操作说明书进行简单Western分析。即在预装了必需试剂的微孔板中加入肝组织蛋白样本和一抗IRS-1或IRS-2(用Wes Antibody Diluent II以1∶5稀释),然后将微孔板和一次性的毛细管卡盒插入仪器中,用Compass软件(ProteinSimple)分析数字图像,检测IRS-1和IRS-2蛋白含量,并以β-action作为内参进行对照,以二者的比值代表IRS-1和IRS-2蛋白的表达。
1.4.5 肝脂质、糖原沉积和组织病理观察
取同部位新鲜肝组织分成两份,其中一份用包埋剂包埋并冷冻后,在冰冻切片机上切片,厚度为8 μm,行油红O染色15 min,50%乙醇分色并水洗,封胶,观察脂质沉积情况;另一份固定于4%甲醛溶液中,脱水、透明、浸蜡和包埋,用切片机切成4 μm薄片,分别行苏木素-伊红(HE)染色和PAS染色,观察肝组织病理和肝糖原的变化。
1.5 统计学处理
所有数据均用±标准差表示,采用SPSS 22.0软件进行统计,两两比较采用独立样本t检验,P<0.05表示有统计学差异。
2 结果
2.1 高脂饮食对西藏小型猪表型特征的影响
高脂饮食12周后,IR模型组小型猪体重、BMI指数、血浆TC、LDL-C、HDL-C、FFA、FBG和insulin水平及HOMA-IR指数均显著高于正常对照组(P<0.05,P<0.01);但TG水平差异无显著性(P>0.05)(表2)。
2.2 高脂饮食对西藏小型猪糖耐量的影响
静脉注射葡萄糖耐量试验显示,高脂饮食12周后IR模型组小型猪在给糖前、给糖后15~120 min各时间点的血糖浓度均明显高于正常对照组(P<0.05,P<0.01);同时胰岛素水平在给糖后5~60 min 和90 min时均显著高于正常对照组(P<0.05,P<0.01);且IR模型组血糖和胰岛素曲线下面积AUC均显著高于正常对照组(P<0.05,P<0.01)(图1)。
2.3 高脂饮食对西藏小型猪肝组织IRS-1和IRS-2基因和蛋白表达的影响
高脂饮食诱导12周后IR模型组西藏小型猪肝组织IRS-1和IRS-2 mRNA和蛋白表达均明显低于正常对照组(P<0.05,P<0.01)(图2)。
2.4 高脂饮食对西藏小型猪肝组织的病理变化
HE染色显示,正常对照组肝小叶轮廓清晰且结构完整,肝细胞以中央静脉为中心呈放射状,胞质丰富,胞核蓝染,偶见双核,排列整齐,未见炎症细胞浸润;IR模型组部分肝小叶边界不清,肝细胞层次排列紊乱,局部肝细胞浊肿,大小不一,且部分胞核消失或被挤向一端,偶见散在淋巴细胞浸润。油红O染色显示,正常对照组肝组织未见脂质沉着,而IR模型组肝组织中有少量的脂质沉着;此外,PAS染色显示,IR模型组肝糖原含量明显高于正常对照组(图3)。

表2 高脂饮食对西藏小型猪表型特性的观测Tab.2 Observation on phenotypic characteristics of the Tibet minipigs induced by high fat diet
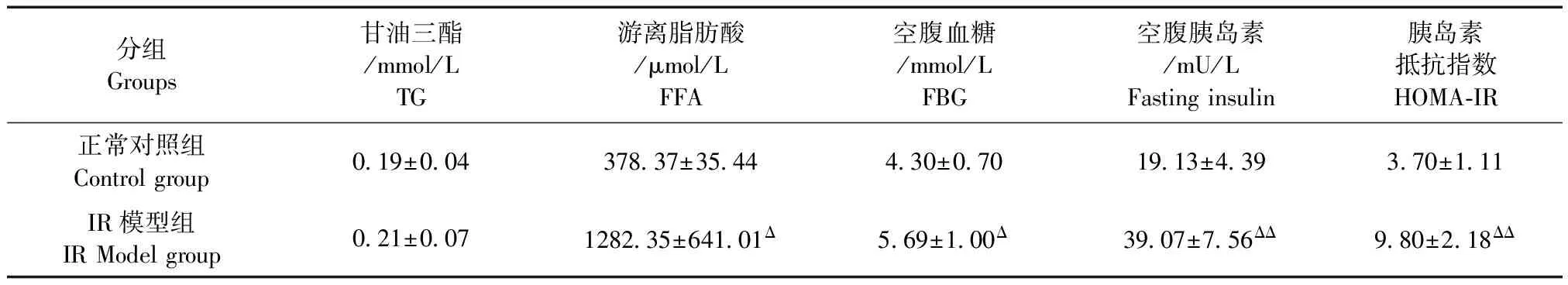
分组Groups甘油三酯/mmol/LTG游离脂肪酸/μmol/LFFA空腹血糖/mmol/LFBG空腹胰岛素/mU/LFastinginsulin胰岛素抵抗指数HOMA⁃IR正常对照组Controlgroup0 19±0 04378 37±35 444 30±0 7019 13±4 393 70±1 11IR模型组IRModelgroup0 21±0 071282 35±641 01Δ5 69±1 00Δ39 07±7 56ΔΔ9 80±2 18ΔΔ
注:与正常对照组比,ΔP<0.05,ΔΔP<0.01。
Note.Compared with the control group,ΔP<0.05,ΔΔP<0.01.

注:糖耐量曲线时间-血糖效应图(A);糖耐量曲线下面积(B);糖耐量曲线时间-胰岛素效应图(C);胰岛素曲线下面积(D);与正常对照组比,ΔP<0.05,ΔΔP<0.01。图1 高脂饮食对西藏小型猪糖耐量的影响Note.A,glucose tolerance curve time-blood glucose effect; B,area under curve of glucose tolerance; C,glucose tolerance curve time-insulin effect; D,area under curve of insulin.Compared with the control group,ΔP<0.05,ΔΔP<0.01.Fig.1 Effects of high fat diet on glucose tolerance in the Tibet minipigs
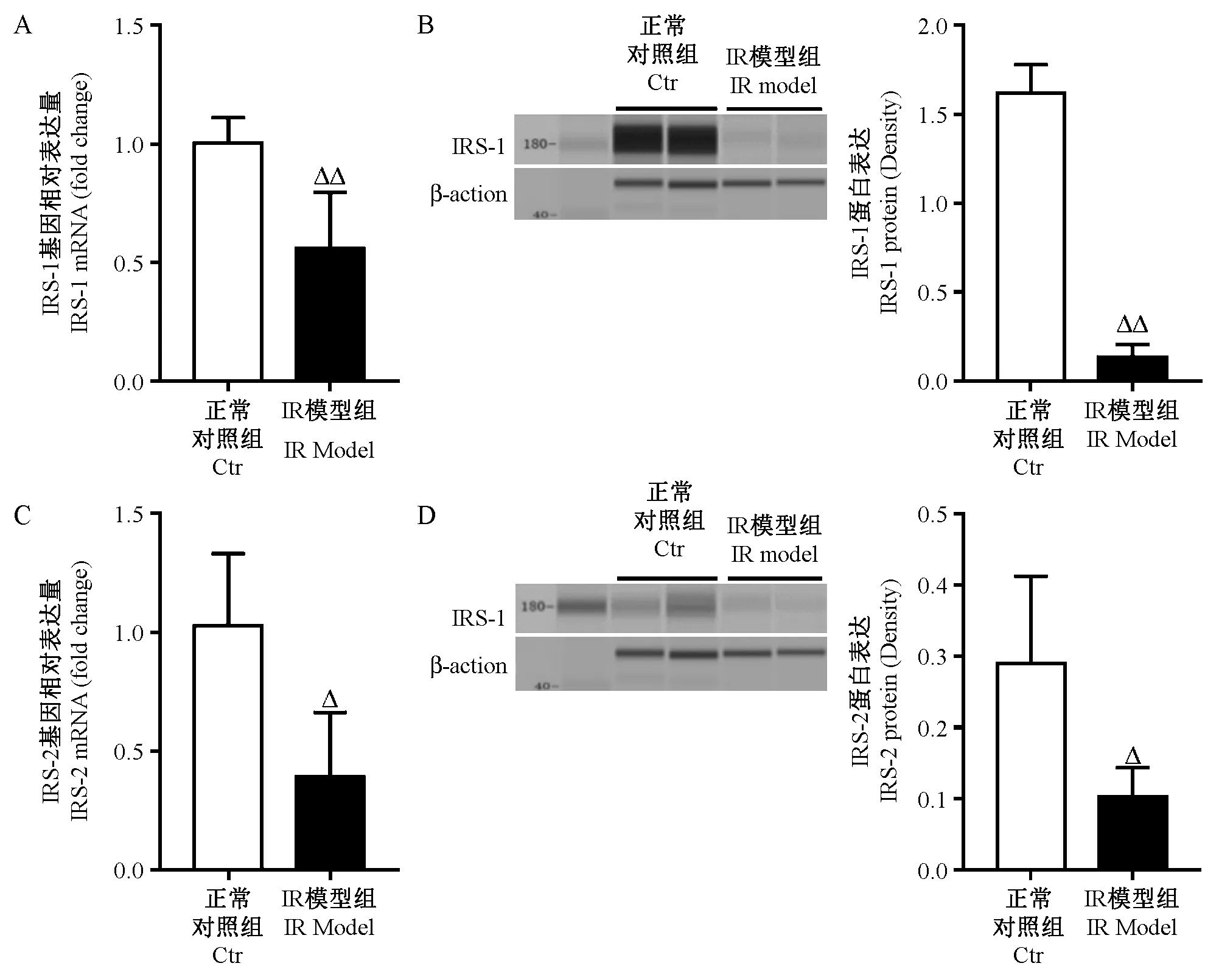
注:肝组织中IRS-1mRNA(A)和蛋白(B)表达;肝组织中IRS-2 mRNA(C)和蛋白(D)表达;与正常对照组比,ΔP<0.05,ΔΔP<0.01。图2 高脂饮食对西藏小型猪肝组织IRS-1和IRS-2基因和蛋白表达的影响Note.The expression of IRS-1 mRNA (A) and protein (B) in liver tissue.The expression of IRS-2 mRNA (C) and protein (D) in liver tissue; Compared with the control group,ΔP<0.05,ΔΔP<0.01.Fig.2 Effects of high fat diet on expressions of IRS-1 and IRS-2 gene and protein in the liver tissue of Tibet minipigs
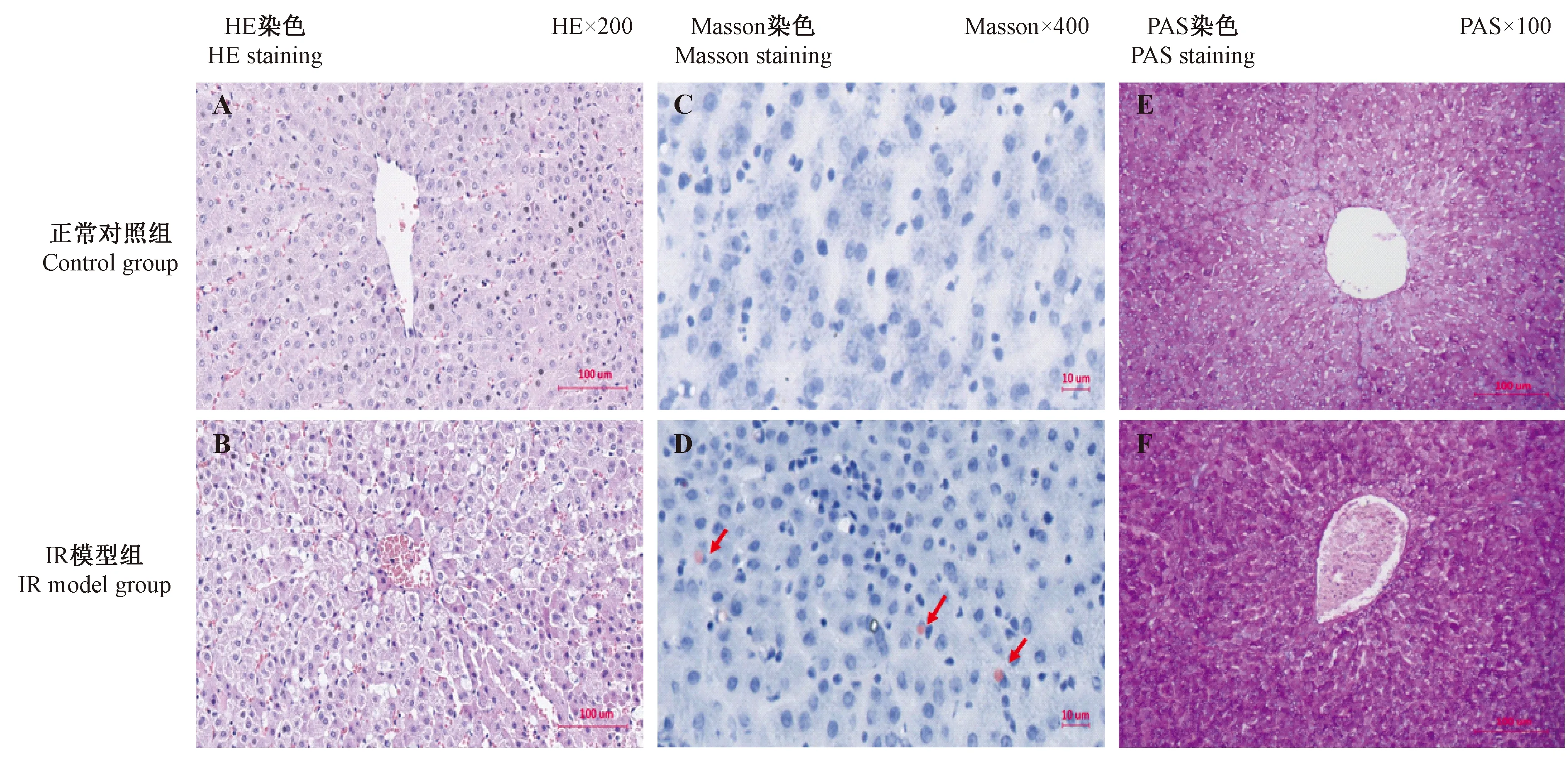
注:肝组织HE染色:正常对照组(A)和IR模型组(B),× 200;肝组织油红O染色:正常对照组(C)和IR模型组(D),红色箭头表示脂质沉着,× 400;肝组织PAS染色:正常对照组(E)和IR模型组(F),× 100。图3 高脂饮食对西藏小型猪肝脂质沉积、肝糖原和组织病理的变化Note: HE staining in liver tissue: Ctr group (A) and IR model group (B),oil red O staining.Ctr group (C) and IR model group (D),red arrows show lipid deposition,PAS staining.Ctr group (E) and IR model group (F).Fig.3 Changes of lipid deposition,glycogen and histopathological changes in the liver tissues of Tibet minipigs fed with high fat diet
3 讨论
IR指胰岛素促进葡萄糖摄取和利用的生物效应下降,导致代偿性分泌过多的胰岛素,故高胰岛素血症是其的重要标志。虽然IR在很大程度上与遗传因素有关,如近年发现胰岛素及胰岛素受体基因突变所致胰岛素失活或活性降低,或胰岛素信号传导障碍而使胰岛素作用丧失或减弱;但膳食和生活方式等环境因素与IR的发生也密切相关,如高脂摄入、高饱和脂肪酸、低膳食纤维等都会引起IR。王德峰等[7]研究表明饮食因素参与了IR的发生,且高脂饮食的作用强于高糖饮食;而且高脂饮食能促进糖脂代谢的紊乱,导致胰岛素敏感性的下降,从而产生IR。近来无论是小型猪还是大猪品系在模拟人类MS和在优化治疗策略研究评价中均已体现出较大的应用价值,因其不仅能使用标准的诊断和治疗技术,并能收集足够的体液和组织样本,加快临床转化。尽管已知高脂饮食能诱导IR和升高血浆TC水平,但不同品系猪对IR发生存在一定的差异,如Larsen等[8]发现高脂饮食3个月可使雄性Göttingen小型猪空腹血糖受损和胰岛素水平增加,发生IR;Dyson等[9]报道雌性Ossabaw猪高脂饮食9周即可形成IR、糖耐量受损、血脂紊乱、高血压和早期动脉粥样硬化;但雄性Yucatan小型猪即使高热量饮食20周也不能形成MS[10]。相比国外品系的小型猪,国内小型猪IR的发生大多采用高糖高脂饮食,如陈华等[11]报道五指山小型猪和巴马小型猪用高脂高糖饲料诱导5~6个月后出现胰岛素升高和胰岛素敏感性下降,而中国农大小型猪则不敏感;席守民等[12]发现高脂高糖饲料诱导2~3个月出现血糖和胰岛素水平升高,出现IR,并在8个月时出现糖尿病和动脉粥样硬化;而对高脂诱导IR发生的报道甚少。为此,本研究发现高脂饮食能诱发西藏小型猪产生了一系列的糖脂代谢紊乱,如空腹血糖、胰岛素和血脂水平的升高,导致体内游离FFA的剧增,显著升高胰岛素抵抗指数,提示高脂饮食能引起西藏小型猪产生IR,这与本课题组前期西藏小型猪动脉粥样硬化模型制备中IR形成时间较为接近[13],表明高脂诱发西藏小型猪IR形成是可再现的,也证实了糖脂代谢异常是产生IR的主要原因之一,其形成的可能原因:长期给予高脂饮食后西藏小型猪肥胖,如BMI指数升高,使得机体神经内分泌功能对胰岛β细胞的作用发生改变,降低了胰岛素的敏感性;另外,为维持体内血糖水平,需要刺激胰岛β细胞增加胰岛素的分泌,进而导致血浆胰岛素水平的升高,引发IR;此外,糖耐量试验也显示高脂饮食导致西藏小型猪葡萄糖耐量减低,促进了脂肪分解并转化为游离FFA,而高游离FFA水平又会加重机体IR[14,15]。
目前发现高血浆游离FFA可诱发肝IR[16],而且肝代谢的早期变化与IR、肥胖及2糖尿病的发生发展十分密切。高脂饮食也可导致西藏小型猪产生肝代谢的早期变化,表现为肝组织中有少量脂质沉着、肝糖原增加,局部肝细胞浊肿,且部分胞核消失或被挤向一端,并可偶见散在淋巴细胞浸润。肝糖原是葡萄糖聚合物以糖原的形式贮存于肝,一旦机体需要时便可分解成葡萄糖并转化为能量。本研究发现高脂诱导后西藏小型猪肝糖原增加,这与张小华等[4]报道高脂饮食促进IR大鼠肝糖原升高的结果较为一致,其可能与机体血浆FFA增加的同时胰岛素分泌增多,抑制了肝糖原的分解,使得肝葡萄糖输出的能力降低,导致肝糖原储存增加;而且肝葡萄糖输出依赖于胰岛素的调节作用,故不同于处于2型糖尿病或IR存在胰岛素作用缺陷时的状态,此时由于机体合成和降解肝糖原的能力发生紊乱,导致肝葡萄糖输出增加,会引起肝糖原减少和血糖升高[17]。此外,现已证实IR的发生与胰岛素信号转导障碍有关,而IRS是胰岛素信号转导途径中受体后水平的重要信号蛋白,以IRS-1和IRS-2起主要作用。除骨骼肌和脂肪组织外,肝也是IRS-1表达和胰岛素作用的靶组织,且发现IRS-1主要调节胰岛素的分泌。已有的研究发现,FFA增高可促进肝IRS-1丝氨酸307位点的磷酸化而诱发IRS-1降解[18]。IRS-2主要在肝和胰腺β细胞中大量表达,Withers等[19]发现抑制IRS-2表达会损害外周胰岛素信号通路和胰腺β细胞功能;Kubota等[20]发现小鼠敲除IRS-2基因后发生肝IR。同样体外细胞实验也发现慢性胰岛素刺激可使IRS-1和IRS-2蛋白水平降低[21]。在本试验也发现高脂饮食对西藏小型猪肝组织中IRS-1和IRS-2 mRNA和蛋白表达出现明显降低,提示长期高脂饮食所致高胰岛素血症也参与了IRS表达的降低。
综上所述,高脂饮食可引起西藏小型猪胰岛素抵抗、肝脂质沉积和肝糖原蓄积、脂质紊乱、糖耐量减低、FFA和胰岛素水平升高,导致肝组织中IRS-1和IRS-2表达的降低,使得胰岛素信号传导障碍,降低了胰岛素敏感性,这可能是高脂饮食导致西藏小型猪胰岛素抵抗的分子机制之一。
[1] Putakala M,Gujjala S,Nukala S,et al.Beneficial effects of phyllanthus amarus against high fructose diet induced insulin resistance and hepatic oxidative stress in male Wistar rats [J].Appl Biochem Biotechnol,2017,https://doi.org/10.1007/s12010-017-2461-0
[2] Saki F,Kazuki M,Masaya S,et al.Insulin resistance induced by a high-fat diet is associated with the induction of genes related to leukocyte activation in rat peripheral leukocytes [J].Life Sci,2010,10(1): 1-7.
[3] 罗邦尧.胰岛素抵抗和代谢综合征 [J].药物与人,2003,22(8): 66.
[4] 张小华,张汝学,贾正平,等.高脂饮食和地塞米松联合诱导胰岛素抵抗大鼠模型 [J].中国实验动物学报,2008,16(5): 325-329.
[5] Fujiwara T,Saitoh S,Takagi S,et al.Development and progression of atherosclerotic disease in relation to insulin resistance and hyperinsulinemia [J].Hypertens Res,2005, 28(8): 665-670.
[6] Pan YM,Cai ZW,Ma YC,et al.Involvement of peroxisome proliferator-activated receptors in cardiac and vascular remodeling in a novel minipig model of insulin resistance and atherosclerosis induced by consumption of a high-fat/cholesterol diet [J].Cardiovasc Diabetol,2015,14(1): 6.
[7] 王德峰,孙力,杨晓刚,等.膳食对大鼠胰岛素抵抗和骨骼肌糖原合成酶mRNA表达的影响 [J].营养学报,2006,28(6): 538-539.
[8] Larsen MO,Rolin B,Wilken M,et al.High-fat high-energy feeding impairs fasting glucose and increases fasting insulin levels in the Göttingen minipig: results from a pilot study [J].Ann N Y Acad Sci,2002,967: 414-423.
[9] Dyson MC,Alloosh M,Vuchetich JP,et al.Components of metabolic syndrome and coronary artery disease in female Ossabaw swine fed excess atherogenic diet [J].Comp Med,2006,56: 35-45.
[10] Neeb ZP,Edwards JM,Alloosh M,et al.Metabolic syndrome and coronary artery disease in Ossabaw compared with Yucatan swine [J].Comp Med,2010,60(4): 300-315.
[11] 陈华,刘亚千,李春海,等.三个品系小型猪Ⅱ型糖尿病模型的比较研究 [J].实验动物科学,2007,24(6): 49-55.
[12] 席守民,廉馨,王宗保,等.高脂高蔗糖饲料诱导贵州小香猪发生糖尿病和动脉粥样硬化病变 [J].中国动脉硬化杂志,2004,12(1): 5-10.
[13] 马毅超,潘永明,陈亮,等.胰岛素抵抗动脉粥样硬化小型猪模型的研究 [J].中国比较医学杂志,2014,24(1): 12-17.
[14] Pereira S,Yu WQ,Moore J,et al.Effect of a p38 MAPK inhibitor on FFA-induced hepatic insulin resistance in vivo [J].Nutr Diabetes,2016,6(5): e210.
[15] 何冰,赵晟,张巍,等.水杨酸钠对胰岛素抵抗大鼠胰岛素受体底物-1的影响 [J].中国实验动物学报,2010,18(6): 520-522.
[16] Pereira S,Yu WQ,Frigolet ME,et al.Duration of rise in free fatty acids determines salicylate’s effect on hepatic insulin sensitivity [J].J Endocrinol,2013,217(1): 31-43.
[17] 程静,吴涛,向明,等.南苜蓿总皂苷对2型糖尿病大鼠血液流变学及胰岛素抵抗作用的研究 [J].辽宁中医杂志,2017,44(2): 389-392.
[18] Yu C,Chen Y,Cline GW,et al.Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1 (IRS-1)-associated phosphatidylinositol 3-kinase activity in muscle [J].J Biol Chem,2002,277(52): 50230-50236.
[19] Withers DJ,Gutierrez JS,Towery H,et al.Disruption of IRS-2 causes type 2 diabetes in mice [J].Nature,1998,391(6670): 900-904.
[20] Kubota N,Tobe K,Terauchi Y,et al.Disruption of insulin receptor substrate 2 cause type 2 diabetes because of liver insulin resistance and lack of compensatory beta-cell hyperplasia [J].Diabetes,2000,49(11): 1880-1889.
[21] Rui L,Fisher TL,Thomas J,et al.Regulation of insulin/insulin-like growth factor-1 signaling by proteasome-mediated degradation of insulin receptor substrate-2 [J].J Biol Chem,2001,276(43): 40362-40367.
Influenceofhighfatdietoninsulinresistanceandexpressionofliverinsulinreceptorsubstrate1and2inTibetminipigs
PAN Yong-ming,RONG Yi-li,HUANG Jun-jie,XU Xiao-ping,CHEN Cheng,CHEN Min-li*
(Laboratory Animal Research Center/ Institute of Comparative Medicine,Zhejiang Chinese Medical University,Hangzhou 310053,China)
ObjectiveTo explore the effects of high fat diet on insulin resistance (IR) and the expression of liver insulin receptor substrate (IRS) 1 and 2 in Tibet minipigs.MethodsTen Tibet minipigs were randomly divided into 2 groups,normal control (Ctr,n=5) group was fed with normal diet,and IR model (n=5) group fed with high fat/cholesterol diet for 12 weeks.After the establishment of pig models for 12 weeks,the body weight and body length were measured and body mass index (BMI) was calculated,and the changes of total cholesterol (TC),low density lipoprotein (LDL-C),high density lipoprotein (HDL-C),triglyceride (TG),free fatty acids (FFA),fasting blood glucose (FBG),fasting insulin (insulin) and homeostasis model assessment-insulin resistance (HOMA-IR) were detected.Glucose tolerance test was performed,the area under the curve of glucose tolerance (AUC) was also calculated,and the expressions of IRS-1 and IRS-2 gene and protein in liver tissue were detected.The lipid deposition,liver glycogen and pathological changes were examined by pathology using oil-red O,PAS and HE staining,respectively.ResultsCompared with the control group,the body weight,BMI index,TC,LDL-C,HDL-C,FFA,FBG,insulin and HOMA-IR were significantly increased (P<0.05,P<0.01).Intravenous glucose tolerance test showed that the curve of blood glucose and insulin levels were slowed down,while AUCglucoseand AUCinsulinwere significantly increased (P<0.05,P<0.01).Lipid deposition and liver glycogen were increased,and partial hepatocyte swelling,part of the nuclei disappeared or were pushed to one end,occasionally scattered infiltration of lymphocytes in the liver tissue.Furthermore,the expressions of IRS-1 and IRS-2 mRNA and protein were significantly decreased (P<0.05,P<0.01).ConclusionsHigh fat diet can induce insulin resistance in Tibet minipigs.The decreased IRS-1 and IRS-2 expression in the liver may be one of the molecular mechanisms involved in the effects of high fat diet on insulin sensitivity in Tibet minipigs.
Tibet minipig; High fat diet; Insulin resistance; Insulin receptor substrate
CHEN Min-li.E-mail: cmli991@aliyun.com.
浙江省科技厅公益性项目(No.2015C37106);国家自然科学基金项目(No.31572346);浙江省自然科学基金项目(No.LY16C040001);浙江中医药大学校级科研基金项目(No.2015ZG19);浙江中医药大学比较医学创新团队(No.XTD201301)。
潘永明(1979-),男,副研究员,研究方向:实验动物与比较医学。E-mail: pym918@126.com
陈民利(1963-),女,教授,研究方向:实验动物与比较医学。E-mail: cmli991@aliyun.com
Q95-33
A
1005-4847(2017) 06-0611-07
10.3969/j.issn.1005-4847.2017.06.005
2017-04-12

