肾茶总黄酮的提取纯化工艺优化
蓝伦礼 刘梦楚 邹晓红 曾元儿 曹骋 刘庆飞 李小莹 江滨
·论著·
肾茶总黄酮的提取纯化工艺优化
蓝伦礼 刘梦楚 邹晓红 曾元儿 曹骋 刘庆飞 李小莹 江滨
目的应用Box-Behnken效应面法优化肾茶提取工艺,运用大孔吸附树脂优选肾茶总黄酮的纯化工艺。方法以肾茶总黄酮得率为评价指标,以乙醇体积分数,液料比和提取时间为考察因素,采用Box-Behnken效应面法优化加热回流提取工艺,并进行预测分析。通过静态和动态吸附试验考察大孔吸附树脂对肾茶总黄酮的纯化效果,并研究各因素条件对其纯化效果的影响,筛选主要影响指标的最佳工艺条件。结果肾茶最佳提取工艺为:乙醇体积分数为52.52%,液料比(mL∶g)为15∶1,提取时间为90分钟。DM-130大孔吸附树脂较适合肾茶总黄酮的纯化,静态吸附生药浓度为0.1 g/mL,药液pH值为2;动态吸附上样量为60 mL,吸附时间为50分钟,除杂水用量为3倍柱体积,洗脱剂为70%乙醇,洗脱剂用量为3倍树脂体积。结论Box-Behnken效应面法用于优选肾茶的提取工艺是可行的,建立的数学模型和实验观察数据相符,DM-130大孔吸附树脂较适合肾茶总黄酮的纯化。
肾茶; 总黄酮; Box-Behnken效应面法; 大孔吸附树脂
肾茶为唇形科植物Clerodendranthusspicatus(Thunb.)C. Y.WuexH.的全草,因其花朵形似猫须,故又名猫须草,是东南亚常见的草药,广泛分布于印度东部、泰国、印度尼西亚与澳大利亚等地。中国所产肾茶,主产于广西、广东、云南、福建、台湾等地。傣医药称其为“雅娜妙”,据“贝叶经”版傣医药《档哈雅》记载,傣家人饮用肾茶已有上千年历史,被历代医家和宫廷尊为“圣茶”[1]。肾茶全草入药,性凉味甘、淡、微苦,具利尿消炎、抗菌排石、清热除湿之功,是著名的药食两用植物。药理研究表明,肾茶具有利尿、排尿石、抗炎、抗菌、健肾、改善慢性肾功能衰竭和免疫调节作用[2]。
肾茶含有的化学成分主要为黄酮类、酚酸类、二萜类、甾体皂苷类、烷基糖苷类、木脂素类化合物、蒽醌类、多肽、有机酸等[3]。
肾茶中的黄酮类成分是一类生物活性较强的成分[4],其中肾茶的七种甲氧基黄酮作为腺苷A1受体拮抗剂,具有较强的利尿作用,故分离纯化肾茶总黄酮的研究需加快,以有助于推动肾茶的开发与应用。本试验以肾茶为原料,以乙醇为提取溶剂,采用NaNO2—Al(NO3)3比色法检测肾茶中总黄酮的含量,选择Box-Behnken效应面法优化肾茶总黄酮的提取工艺,采用大孔吸附树脂法对肾茶乙醇提取物中的总黄酮进行纯化,优化最佳纯化工艺,以期为肾茶总黄酮的后期制剂开发提供一定的参考。
1 材料
1.1 药物
肾茶,采自云南省西双版纳,批号20140605,由中国医学科学院药用植物研究所西双版纳分所李学兰教授鉴定为唇形科肾茶属肾茶Clerodendranthusspicatus(Thunb.) C. Y. Wu的地上部分。芦丁对照品(成都普菲德生物技术有限公司,批号131208,纯度≥98%)。
1.2 试剂
DM-130大孔吸附树脂(郑州勤实科技有限公司,批号20140805)。色谱甲醇购自德国默克有限公司,其余化学试剂均为分析纯,水为纯化水。
1.3 仪器
LC-20AT髙效液相色谱仪(日本岛津公司),色谱柱Unitary C18(4.6 mm×250 mm,5 μm,华谱新创科技有限公司),L5S型紫外-可见分光光度计(上海仪电分析仪器有限公司)。HH-2K6二列六孔水浴锅(公益市予华仪器有限责任公司),KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司),7C-15套式恒温器(海宁市新华医疗器械厂),旋转蒸发仪RE-2000(上海亚荣生化仪器厂),AEG-220型分析天平。
2 方法与结果
2.1 肾茶乙醇提取物的制备
肾茶药材,用粉碎机粉碎,过10目筛,备用。称取肾茶粉末5 g,置圆底烧瓶中,按设定的提取条件(乙醇体积分数、液料比和提取时间)进行回流提取,提取时将反应容器置于套式恒温器中,提取结束后得肾茶提取液,过滤,蒸干,称重,测定总黄酮含量,计算肾茶总黄酮提取率。
2.2 肾茶总黄酮的含量测定
2.2.1 供试品溶液的制备 称取“2.1”项下蒸干的肾茶提取物1 g置于50 mL容量瓶,甲醇定容,再取10 mL置于25 mL容量瓶,甲醇定容,超声,即得。
2.2.2 对照品溶液的制备 精密称取芦丁对照品50 mg,精密测定,置25 mL量瓶中,加甲醇适量,置水浴上微热使溶解,放冷,加甲醇至刻度,摇匀,精密量取10 mL,置100 mL容量瓶中,加水至刻度,摇匀,即得芦丁含量为0.2 mg/mL的对照品溶液。
2.2.3 标准曲线的绘制 精密量取对照品1 mL、2 mL、3 mL、4 mL、5 mL与6 mL,分别置25 mL量瓶中,各加水至6.0 mL,加5%亚硝酸钠溶液1 mL,混匀,放置6分钟,加10%硝酸铝溶液1 mL,摇匀,放置6分钟,加氢氧化钠试液10 mL,再加水至刻度,摇匀,放置15分钟,以相应的试剂为空白,按照紫外-可见分光光度法,在500 nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,以吸光值(X)和芦丁含量(Y)绘制总黄酮含量标准曲线:Y=12.566X+0.0249(r=0.9998),表明对照品溶液在0.008 mg/mL~0.048 mg/mL范围内与吸光度之间呈良好的线性关系。
2.2.4 样品黄酮类物质含量的测定 精密称取肾茶样品溶液3 mL置于25 mL容量瓶中,按照“2.2.3”项下方法进行显色反应,于波长500 nm处测定吸光度,计算总黄酮的含量。
2.3 Box-Behnken效应面法优选提取工艺条件
2.3.1 试验设计与验证 预试验结果显示,肾茶提取较显著的影响因素有:乙醇体积分数、提取温度、液料比和提取时间和提取次数。数据结果在模型拟合中,由于处理非连续变量比较困难,提取温度暂定为微沸,提取次数为2次,根据Box-Behnken的中心组合试验设计原理对各因素进行3水平试验设计,各因子编码值、试验设计方案和试验结果见表1和表2。按其选择的因素和水平进行提取,提取液过滤,蒸干,称重,再取一定量干粉用蒸馏水溶解,定容于25 mL容量瓶,超声助溶,作为供试品溶液。取供试品溶液适量,其余操作同2.2.4项,测定供试品中总黄酮含量。
2.3.2 模型拟合及二次回归模型的建立及显著性检验 将所得数据用Design-Expert 8.05b软件进行效应面试验分析,以肾茶总黄酮得率(Y)为效应值,3个参数(A、B、C)为自变量分别对各因素(自变量)进行多元线性回归和二项式方程拟合。多元线性的回归方程为:Y=+34.14+1.44×A+0.098×B+1.12×C(R2=0.4719);二次回归模型方程为Y=+34.77+1.44×A+0.098×B+1.12×C+1.26×A×B-0.51×A×C-0.61×B×C-1.71×A2+0.39×B2-0.025×C2(R2=0.8544,P<0.05),由上述两个方程可知,对于肾茶总黄酮的得率,二次多项式的拟合度优于多元线性模型,方差分析结果表明:拟合得到的回归方程P<0.05,表示该模型在本试验研究的范围内有统计学意义。从肾茶总黄酮得率的方差分析结果可知,在本试验设定的区域范围内,乙醇体积分数和提取时间对肾茶总黄酮有显著的影响,二次项中的A2的偏回归系数达显著性水平P<0.05,较好地反映了肾茶总黄酮与乙醇体积分数、提取时间的关系。而交互项AB、AC、BC无显著影响(P>0.05),失拟项检验值为0.292(P>0.05),说明未知因素对试验结果干扰很小,对模型是有利的,因此可用该回归方程代替试验真实点对试验结果进行分析。另外,此模型的变异系数(CV)为3.17%,且在可接受范围内,表明此模型的重复性较好。
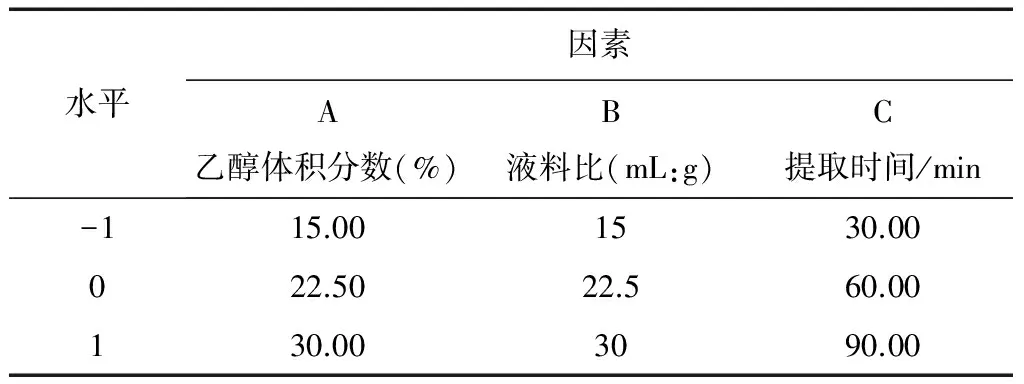
表1 Box-Behnken 试验设计因素与水平
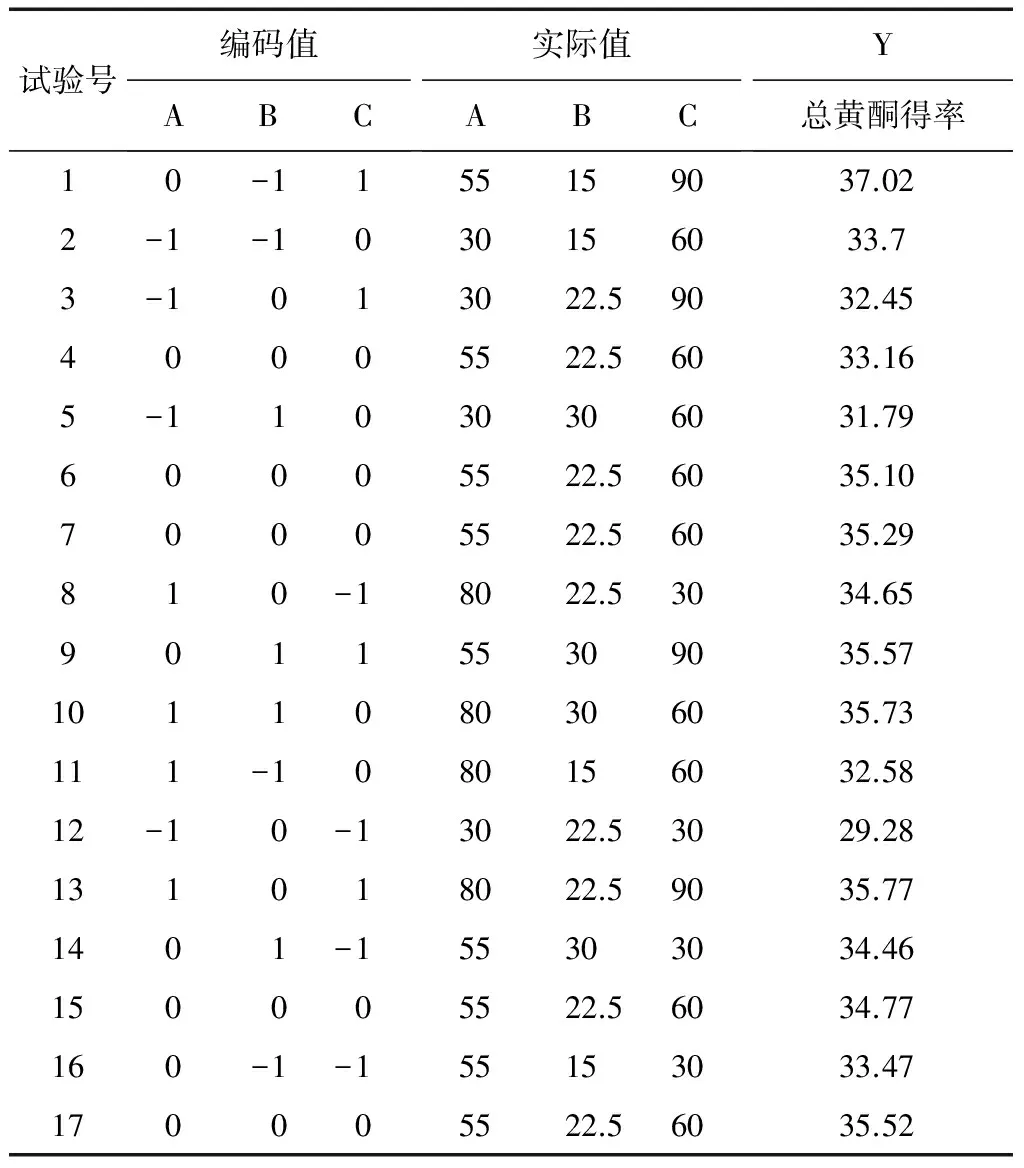
表2 Box-Behnken 试验设计与结果
2.3.3 效应面优化和预测 根据二次多项式模型,根据Design-Expert8.05b软件画等高曲线及效应曲面图,考察三个自变量乙醇体积分数,液料比,提取时间对肾茶总黄酮得率影响,结果见图1~3。
根据回归模型进行预测分析,肾茶总黄酮得率最优值为:乙醇体积分数为52.52%,液料比(mL∶g)为15∶1,提取时间为90分钟,预测值为36.78%。
根据预测最优条件下,进行5次平行实验进行验证,结果见表3,总黄酮的平均得率为37.24%,偏差率为(37.24-36.78)/36.78×100%=1.25%,实际结果与理论预测值接近,表明所建立的数学模型的预测性良好,所选工艺条件具有较好的重现性[5]。
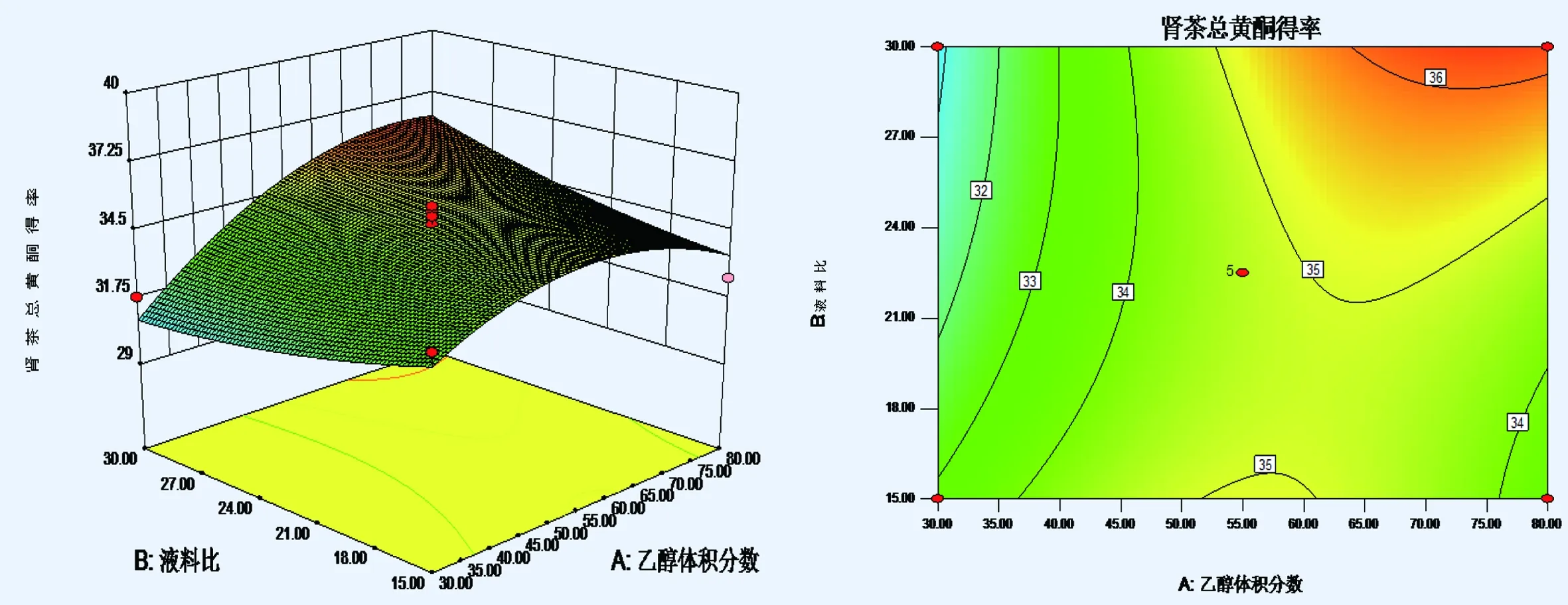
图1 乙醇体积分数和提取时间对肾茶总黄酮得率的响应曲面图和等高线图
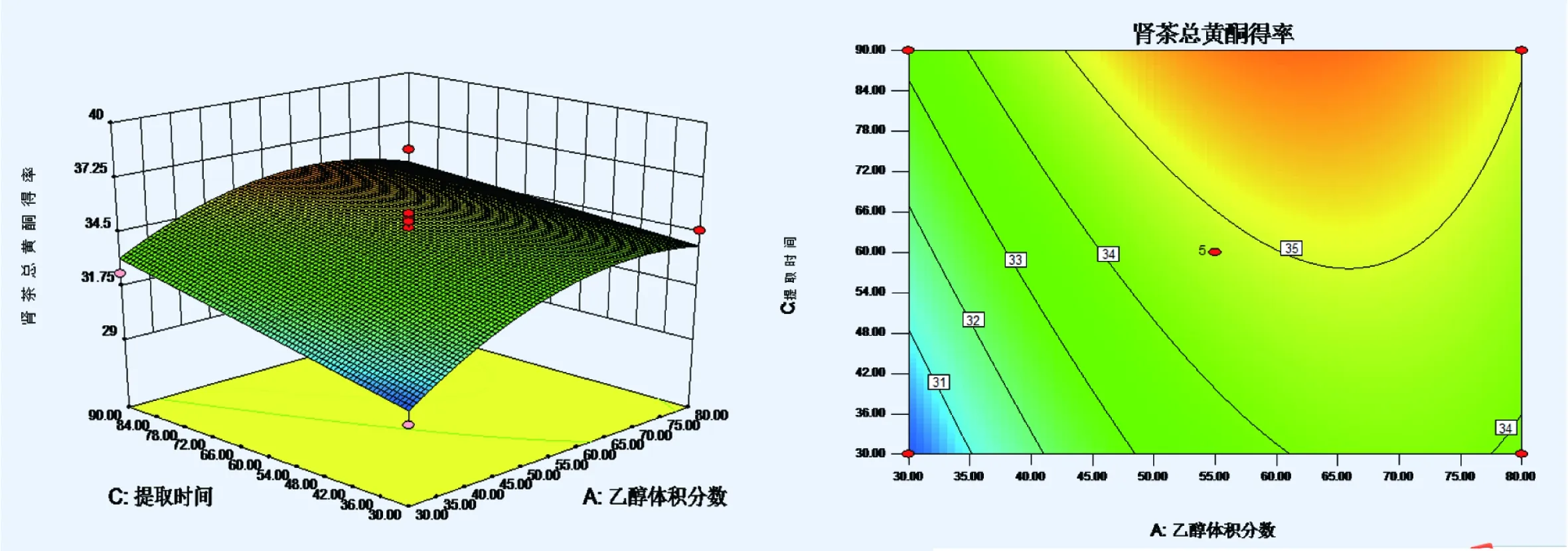
图2 乙醇体积分数和液料比对肾茶总黄酮得率的响应曲面图和等高线图
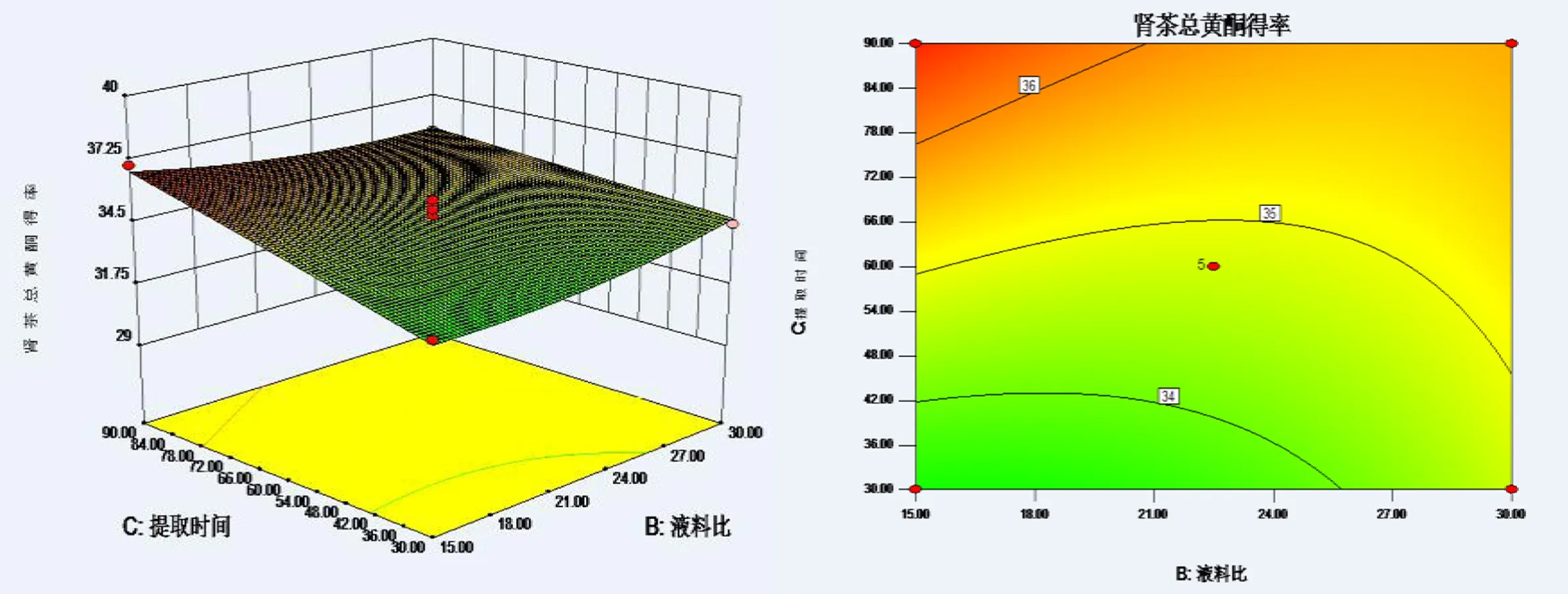
图3 提取时间和液料比对肾茶总黄酮得率的响应曲面图和等高线图

编号总黄酮得率(%)平均得率(%)RSD(%)1234536.0337.6138.6937.2935.5737.242.73
2.4 大孔吸附树脂纯化肾茶总黄酮
肾茶经过乙醇提取后,即得乙醇粗提物,首先筛选最适宜肾茶总黄酮纯化的大孔树脂类型,并通过单因素试验考察该树脂对肾茶总黄酮的最优吸附和解吸附条件,确立大孔树脂纯化肾茶总黄酮的最佳纯化工艺。
2.4.1 大孔吸附树脂的预处理 取DM-130大孔吸附树脂适量,湿法装柱后,于无水乙醇浸泡24小时后放出浸液,继续用95%乙醇冲洗至洗出液加水(1∶5)不出现白色浑浊为止,再用蒸馏水洗至无醇味,取出树脂,密封保存,备用。
2.4.2 药液质量浓度对DM-130大孔树脂吸附的影响 分别量取肾茶醇提物1.03 g、2.06 g、3.09 g、4.12 g、5.15 g、6.18 g溶于50 mL水中(分别相当于生药浓度0.1 g/mL,0.2 g/mL,0.3 g/mL,0.4 g/mL,0.5 g/mL,0.6 g/mL),配制后,分别置于6个加有5 g经预处理后的DM-130大孔吸附树脂的250 mL锥形瓶中,置于恒温振荡器,在25℃条件下,以120 rpm振荡24小时。静态吸附12小时后,各吸取上层药液1 mL测吸光度,并算出吸附率,结果见表4。
结果表明,上样质量浓度是影响吸附纯化的重要因素。本次试验中当上样质量浓度在0.1 g/mL~0.6 g/mL浓度范围时,上样质量浓度越小,吸附率越高,总黄酮被吸附量越大,因此选择最佳吸附质量浓度为0.1 g/mL。
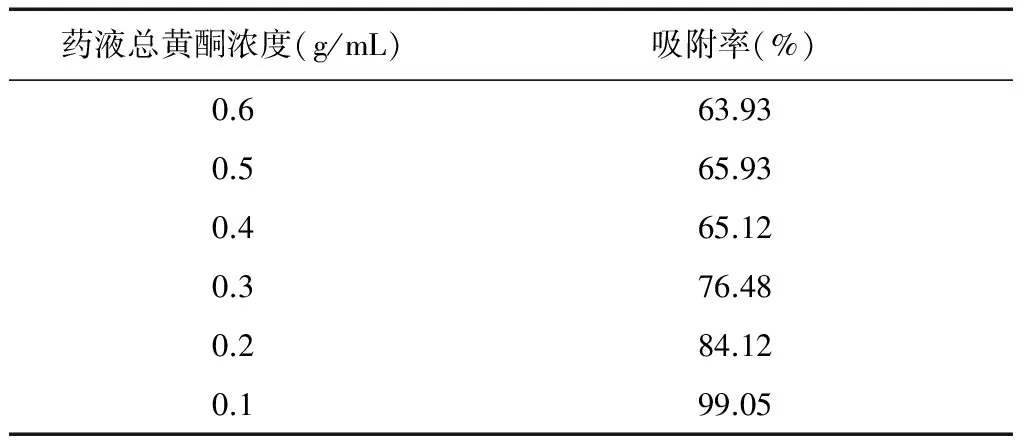
表4 生药浓度对吸附的影响
2.4.3 药液pH值对DM-130大孔树脂吸附的影响 称取经预处理好的树脂5 g共9份,分别置于250 mL锥形瓶中,精密加入50 mL质量浓度为0.1 g/mL,pH值分别为2、3、4、5、6、7、8、9、10的药液,依“2.5.2”项下同法振荡,静态吸附12小时后,各吸取上层药液1 mL测吸光度,并计算吸附率。结果pH为2、3、4、5、6、7、8、9、10时的吸附率分别为92.51%、90.98%、84.56%、71.99%、70.15%、68.98%、67.89%、61.30%和57.69%,由此可见吸附率随着pH值得升高逐渐降低,在pH值为2的时候,吸附率最高,所以选择把药液的pH值调为2。
2.4.4 药液上样量的考察 称取湿树脂28 g,量得树脂高10 cm,1 BV=39 mL,湿法装柱后,加入浓度为0.1 g/mL,pH值为2的药液,以3 BV/H的流速即约为60滴/min收集洗脱液,每10 mL收集一次,测量其吸光度并算出总黄酮的含量及泄漏率。经实验结果可知当上样量超过60 mL时泄漏量增多,故最佳上样量为60 mL。泄露曲线的绘制如图4。
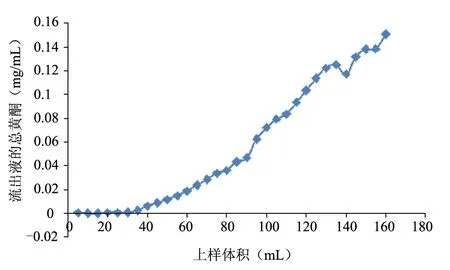
图4 泄漏曲线的绘制
2.4.5 除杂蒸馏水用量的考察 取5根吸附生药浓度为0.1 g/mL,pH值为2的肾茶药液至饱和状态的DM-130大孔吸附树脂柱,分别用1 BV、2 BV、3 BV、4 BV的蒸馏水冲洗,每根柱每1 BV收集洗脱液一份,共收集20份洗脱液,测定洗脱液中总黄酮的量。结果见图5。结果表明,吸附后用蒸馏水冲洗对已经吸附的总黄酮有一定的损失,而蒸馏水冲洗的体积越大,损失量就越多,但蒸馏水洗可以除去非黄酮类,提高总黄酮的纯度。经综合考虑,冲洗杂质用水体积以3 BV为宜。
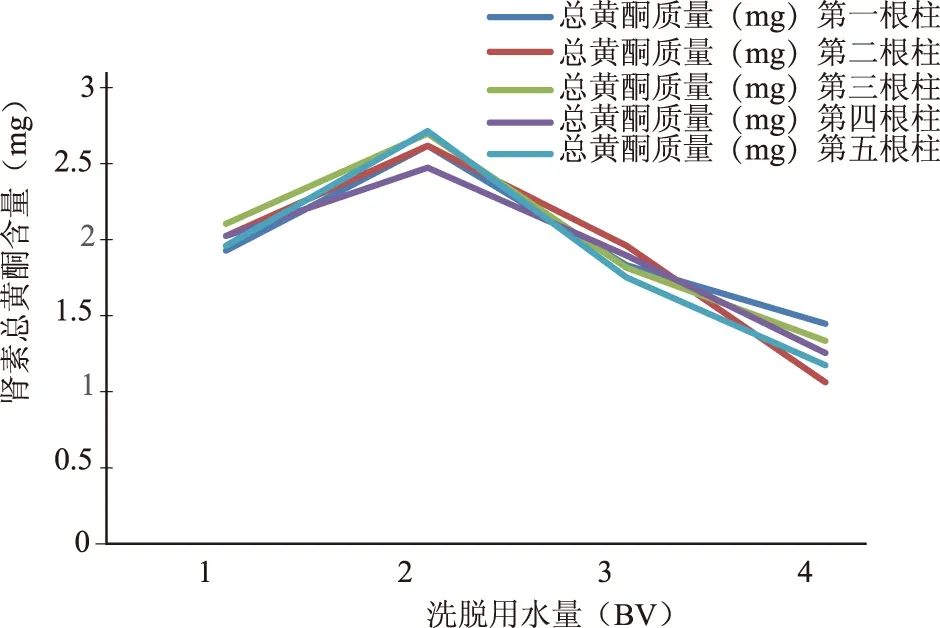
图5 洗脱用水量对肾茶总黄酮含量的影响
2.4.6 洗脱剂浓度的考察 取5根经吸附浓度为0.1 g/mL,pH值为2的肾茶药液至饱和的DM-130大孔树脂,分别用水洗脱除杂至无色,然后用体积分数分别为50%、60%、70%、80%、90%的乙醇进行洗脱,分别收集洗脱剂,测定洗脱剂中总黄酮的量,并算出总黄酮的洗脱率。并取洗脱液过0.45 μm微孔滤膜,取20 μL进行HPLC分析。色谱条件为:Unitary C18色谱柱,以甲醇-水(含0.1%甲酸)为流动相,梯度洗脱见表5,流速:1 mL/min,柱温:30℃,检测波长:254 nm。结果见表6、图6。从上而下分别为:50%乙醇洗脱液,60%乙醇洗脱液,70%乙醇洗脱液,80%乙醇洗脱液,90%乙醇洗脱液。
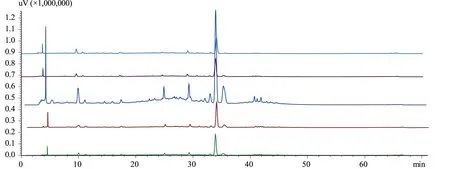
图6 不同浓度的乙醇洗脱液HPLC图
由表6和图6得知:体积分数为50%、60%、70%、80%、90%的乙醇洗脱之后,洗脱剂中总黄酮的含量分别为87.96%、91.00%、96.01%、75.64%和94.71%,可见使用体积分数为70%的乙醇洗脱后,洗脱剂中总黄酮含量和总黄酮的洗脱率均最高,由图6可知,70%乙醇洗脱液的峰面积较大,含量较高,故选择体积分数70%乙醇为洗脱剂。
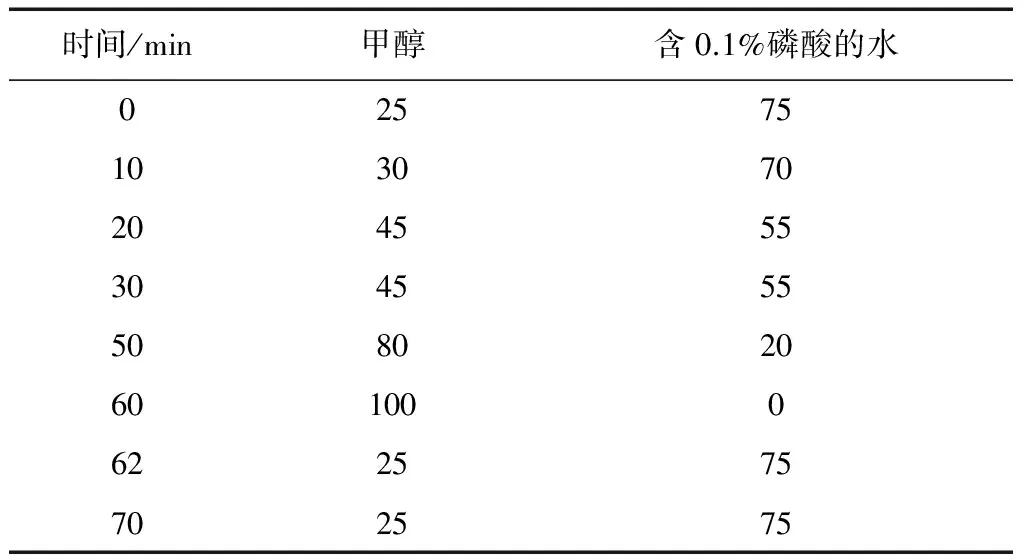
表5 梯度洗脱程序
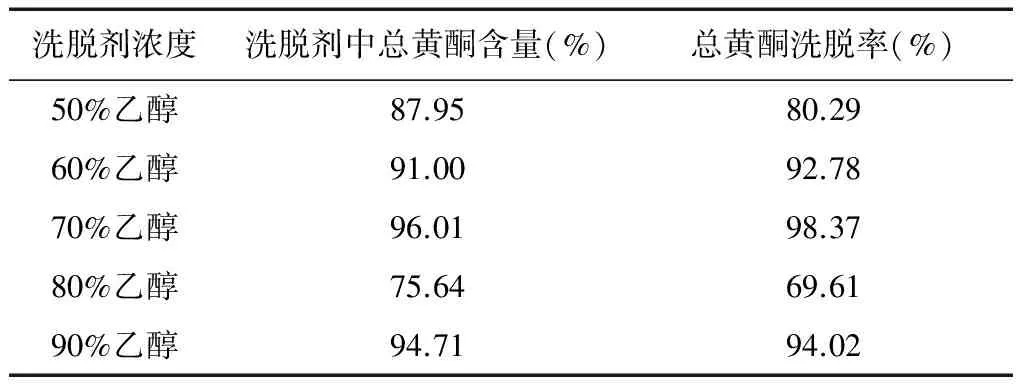
表6 洗脱剂浓度对肾茶总黄酮含量的影响
2.4.7 吸附时间的考察 精密吸取0.1 g/mL,pH值为2的肾茶醇提物溶液60 mL(按泄漏时上样量确定),分别通过5根预处理好的DM-130树脂柱后,分别静置吸附20分钟、30分钟、40分钟、50分钟、60分钟,5根树脂柱分别用3 BV蒸馏水洗脱至洗脱液无色,再用70%乙醇洗脱,收集乙醇洗脱液,同“2.2.3”标准曲线制备项下的方法,自“加水至6 mL”起依法测定吸收度,测定其总黄酮的量,计算总黄酮洗脱率,并且按权重比例计算(权重比例=洗脱液中总黄酮含量×0.5+总黄酮洗脱率×0.5)。结果见表7。由结果显示,静置50分钟后洗脱液中总黄酮洗脱率最高,静置时间过长过短均偏低,这可能与时间过长解吸困难,时间过短吸附不完全有关。根据权重比例筛选最优吸附时间,可通过结果发现静置50分钟时权重比例最高,故确定最佳吸附时间为50分钟。
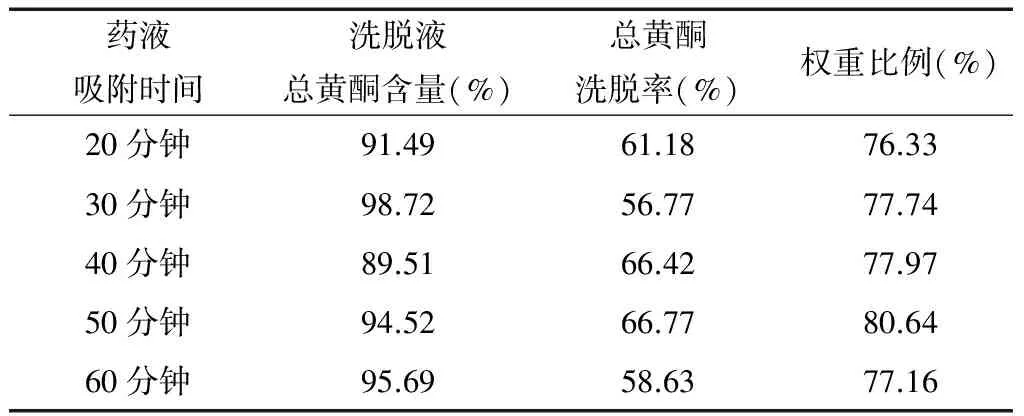
表7 吸附时间的对总黄酮含量的影响
2.4.8 洗脱剂用量的考察 取含生药浓度为0.1 g/mL,pH值为2的肾茶药液至饱和的DM-130大孔树脂,用3 BV的水洗脱除杂,再用体积分数为70%乙醇进行洗脱,每0.5 BV收集一份洗脱液,共收集6份,平行操作3根层析柱,测定其总黄酮的含量及总黄酮的洗脱率。结果见图7。结果表明,当洗脱剂的用量高于3BV时,总黄酮的含量略低,可以认为树脂上吸附的总黄酮已经接近洗脱完全。故确定洗脱剂的用量为3BV。
2.4.9 验证试验 取60 mL生药浓度为0.1 g/mL、pH值为2的肾茶乙醇提液通过已经处理好的DM-130树脂柱,吸附50分钟后,先用3 BV的蒸馏水洗脱至无色,再用3 BV的70%乙醇洗脱,收集洗脱液,干燥,即得大孔树脂纯化的肾茶总黄酮,并且计算总黄酮洗脱率。相同条件的试验重复5次,原液提取物中总黄酮含量均值为36.37%,纯化后总黄酮含量均值达90.01%,RSD值为3.36%;总黄酮洗脱率均值达91.75%,RSD值为3.673%。可见经过DM-130大孔吸附树脂纯化的肾茶总黄酮的含量由原来的36.37%提高到90.01%,故该工艺基本稳定可行。
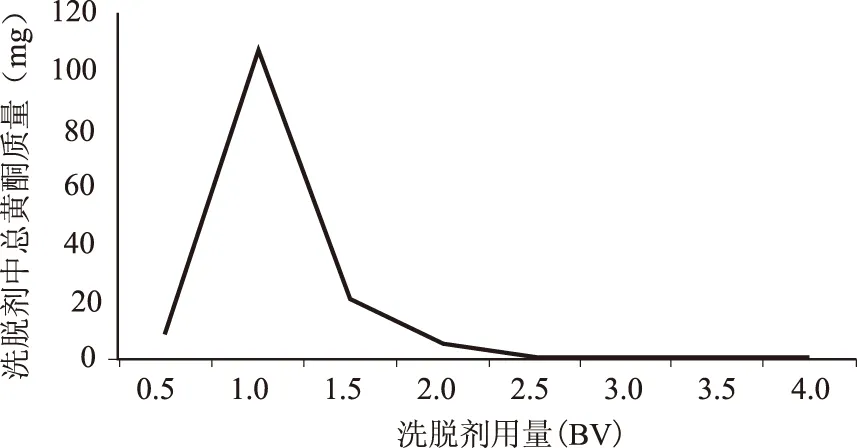
图7 洗脱剂用量的考察
3 讨论
随着对肾茶总黄酮研究的深入,发现其生物活性广泛,具有较强的抗氧化活性[6],对肾脏系统的相关疾病有较明显的防治作用。肾茶总黄酮对6-羟基多巴胺诱导的帕金森病大鼠模型和细胞模型具有明显的保护作用,其可能的作用机制与减少抗氧化应激引起的细胞损伤相关。因此优化出最佳的肾茶总黄酮提取纯化工艺尤为重要。
在多指标工艺筛选的试验设计中,不同指标间通常相互影响,对某一项指标有利的条件但可能不利于另一指标,最终选择条件往往依据这些指标的综合效应。本实验采用Box-Behnken法考察肾茶总黄酮提取工艺优化中3个指标,并成功建立数学模型进行优化与预测分析,优选的制备工艺实测值与预测值较好地吻合,乙醇体积分数和提取时间对肾茶总黄酮得率均有显著性影响,各因素间存在不同程度的交互作用,由结果可知,Box-Behnken法设计的理论值与试验值相差小,采用非线性拟合模型较接近客观事实,效应面三维图使因素对指标的影响更为直观、方便,且试验精度高,避免了传统的正交设计和均匀设计法的不足,具有实验精度高、模型预测性好的优点[8],为肾茶总黄酮的提取工艺提供了较为合理的数据。
DM-130大孔吸附树脂纯化肾茶总黄酮具有吸附快、解吸率高等特点,DM-130大孔吸附树脂对肾茶总黄酮有良好的吸附性能,筛选出最佳纯化工艺为:以60 mL质量浓度为0.1 g/mL、pH值为2的肾茶提取液上DM-130大孔吸附树脂柱(约28 g),吸附饱和50分钟后,用3 BV的蒸馏水洗脱至溶液无色,弃去,再用3BV的70%乙醇洗脱,收集洗脱液,干燥,即得大孔树脂纯化的肾茶总黄酮。在此条件下,用DM-130大孔吸附树脂纯化肾茶总黄酮,肾茶总黄酮的含量由原来的37.24%提高到90.01%。且大孔树脂可回收再利用,适用于工业化的大提取,故确定了肾茶总黄酮分离纯化的最佳工艺条件。本次实验的结果说明了肾茶总黄酮的提取受多因素的影响,选用Box-Behnken法对乙醇体积分数、料液比提取时间等三个主要变量进行了优化以获得最高的提取效率,说明Box-Behnken法是一种有效的和确实可行的提取肾茶总黄酮的方法。肾茶乙醇提取物经DM-130大孔吸附树脂纯化后肾茶总黄酮的纯度得到最大提高,对肾茶总黄酮后期的研究和开发提供了一些基础。但大孔树脂纯化总黄酮需要控制的因素较多,需要前期科学的实验设计和后期精准的操作。
[1] 林艳芳,依专,赵应红,等.中国傣医药彩色图谱[M].昆明:云南民族出版社,2003:408.
[2] 陈寿元,段建红.猫须草临床应用举偶[J].四川中医,2013(11):51-52.
[3] 赵爱华,赵勤实,李蓉涛,等.肾茶的化学成分[J]. 云南植物研究,2004,(5):563-568.
[4] Yuliana ND,Khatib A,Link-Struensee AM,et al. Adenosine A1 receptor binding activity of methoxy flavonoids from Orthosiphon Planta stamineus[J].Planta Med ,2009,75(2):132-136.
[5] Mishra,Shikha.Optimization of microwave-assisted extraction conditions for preparinglignan-rich extract from Saraca asoca bark using Box-Behnken design[J]. Pharm Biol,2015,(11):1-8.
[6] Xie H R,Hu L S,L I G Y.SH-SY5Y human neuroblastoma cell line:in vitro cell model of dopaminergic neurous in Parkinson’s disease[J].chin Med J(Engl),2010,123(8):1086-1092.
[7] 游建军,李光,李宇赤,等. 肾茶总黄酮对帕金森病的神经保护作用[J]. 中国实验方剂学杂志,2015,(4):139-143.
[8] 张建海,冯彬彬,牛小花. 超声辅助响应面法优化巫山淫羊藿中朝藿定C和淫羊藿苷共同提取工艺研究[J]. 中国中医药信息杂志,2016,(3):85-88.
OptimizationofextractionandpurificationtechnologyofgeneralflavonefromClerodendranthusspicatus(Thunb.)C.Y.
WuLANLunli,LIUMengchu,ZOUXiaohong,etal.
TraditionalChinesemedicineanalysislaboratory,CollegeoftraditionalChinesemedicine,GuangzhouuniversityofChinesemedicineinstitute,Guangzhou,510006
JIANGBin,E-mail:gzjiangbin@hotmail.com
ObjectiveTo optimize extraction- technology of total flavonoids fromClerodendranthusspicatus(Thunb) C.Y.Wu by Box-Behnken design response surface methodology. To establish the purification technology of total flavonoids ofClerodendranthusspicatus.MethodsEthanol content, liquid-solid ratio and extraction time were used to examine the yield of total flavonoids. The Box-Behnken effect surface method was used to optimize the extraction process of heating reflux. The static and dynamic adsorption was used to observe the macroporous adsorption resin purification effect of total flavonoids ofClerodendranthusspicatus. The best purification process conditions were screened out and optimized.ResultsThe best extraction technology:Optimum process parameters were obtained as followings: the ethanol content was 52.52%, liquid-solid ratio was 15∶1, extraction duration was 90 min. DM-130 macroporous adsorption resin was suitable for purification of total flavonoids, The static adsorption concentration was 0.1 g/mL, pH was 2; Loading quantity of sample of dynamic adsorption was 60 mL, the adsorption time was 50 minutes. Water usage of edulcoration was three times as much as column volume; elution solvent was 70% ethanol, elution solvent volume was 3 three times as much as resin volume.ConclusionBox-Behnken design for optimization of extraction technology ofClerodendranthusspicatus(Thunb.)C.Y.Wu is feasible, The established mathematical model agrees well with the experimental observations. DM-130 is the best kind of macroporous resin for purification ofClerodendranthusspicatus(Thunb.)C.Y.Wu.
Clerodendranthusspicatus(Thunb.)C.Y.Wu; General flavone; Box-Behnken design response surface methodology; Macroporous resin
南药研究协同创新中心专项基金(2011)
510006 广州中医药大学中药学院中药分析实验室[蓝伦礼(博士研究生)、刘梦楚、邹晓红、曾元儿、曹骋、刘庆飞、李小莹、江滨]
蓝伦礼(1981- ),女,2013级在读博士研究生。研究方向:中药质量分析。E-mail:lanlunli@yeah.net
江滨(1954- ),女,本科,教授。研究方向:中药质量分析。E-mail:gzjiangbin@hotmail.com
R284.2
A
10.3969/j.issn.1674-1749.2017.09.001
2016-09-22)
(本文编辑: 董历华)

