增氧条件下的碱性硫脲浸金实验
白安平,宋永胜,李文娟,屈 伟
增氧条件下的碱性硫脲浸金实验
白安平,宋永胜,李文娟,屈 伟
(北京有色金属研究总院 生物冶金国家工程实验室,北京 100088)
碱性硫脲浸金需要用氧化剂来调节溶液的氧化电势,氧化剂的氧化电势既要大于金溶解形成Au[CS(NH2)2]2+的电势(0.38 V),由于电势太高硫脲易被氧化而失效,故氧化剂的氧化电热不能太高。在碱性溶液中,氧的标准电极电势为0.40 V,因此,理论上空气中氧是理想而经济的氧化剂。然而,水的饱和溶氧量小,自然溶氧速度慢,从而使氧用作氧化剂受到限制。通过在搅拌浸出槽底部接入螺旋空气管、微孔材料的方法改变发泡方式,进而在持续增氧(空气中氧作氧化剂)的条件下对碱性硫脲浸出低品位金矿石进行具体地研究。发泡方式的改变既增大空气中氧向水中传递的速率,又改善搅拌效果。结果表明:增氧条件下浸出体系的充氧能力越强,碱性硫脲浸金效果则越好。在相同充气量条件下,微孔材料发泡增氧的效果最好,浸出率最高。而且在一定范围内,金浸出率随着充气量的增加而增大,而充气量过大时则会降低金浸出率。
增氧;碱性;硫脲;浸金
在众多非氰浸金药剂中,硫脲以其低毒环保、贱金属耐受性好等优点受到关注。目前,硫脲浸金的研究主要有酸性体系和碱性体系两类,酸性体系的研究较为充分,碱性体系则研究不多。碱性硫脲浸金克服了酸性体系下存在的一些不足,如强酸严重腐蚀设备;酸性条件硫脲对伴生金属(Fe、Co、Ni、Cu等)也有很好的溶解性等[1−4]。
硫脲是一种具有还原性质的易溶于水的有机配合剂,能与很多金属离子形成络合物。硫脲在碱性溶液中易被氧化分解,一般认为硫脲首先被氧化为二硫甲脒,二硫甲脒可进一步被氧化为硫化物、氨基氰以及硫单质等。虽然Na2SO3、Na2SiO3、(NaPO3)6等化学物质(称之为稳定剂)能在一定程度上抑制碱性溶液中硫脲的不可逆分解,但稳定效果有限[1, 5]。
碱性硫脲浸金属于电化学腐蚀过程。一般浸金过程中,Au被氧化形成Au+,Au+/Au电对的标准电极电势为1.68 V;当有硫脲存在时,Au+在溶液中形成配离子Au[SC(NH2)2]2+,Au[SC(NH2)2]2+/Au电对的标准电极电势为0.38 V,电极电势的降低使金很容易被氧化溶解于硫脲溶液中。碱性硫脲浸金过程中,溶液的氧化电势则需要用氧化剂来调节,没有氧化剂参与就不能形成微电池,溶金就无法进行。氧化剂电势越高,氧化能力也就越强,金越易溶解。但是,由于硫脲易被氧化分解,氧化剂氧化能力过强则会造成硫脲大量消耗、金被硫脲分解产物钝化等负面影响。这就使得硫脲浸金只有控制在合适的氧化电势范围内进行,保证金被氧化溶解的同时硫脲又不被氧化,才可以实现高的浸出速率和较低的硫脲消耗。所以,选择适宜的温和氧化剂是碱性硫脲浸金的关键问题。文献[6−10]中常用的氧化剂有Na2S2O8、K3Fe(CN)6。
从电化学角度出发,碱性硫脲浸金氧化剂的氧化电势必须大于金溶解形成Au[SC(NH2)2]2+的电势0.38 V,浸金过程才能顺利进行。在碱性介质中,氧的氧化还原反应为:

由式(1)可知,理论上空气中的氧是碱性硫脲浸金理想而又便宜的氧化剂,但水的饱和溶氧量小,自然溶氧速度又慢,而且矿浆含泥多,黏稠度大,与空气接触面小,因而氧溶解就更少了。标准大气压下,温度为29 ℃时水的饱和溶氧量仅有7.77 mg/L[11−12]。水的饱和溶氧量是纯水在一定的温度、大气压力下,通过水表面气液膜(双膜),向水中溶解氧气而能达到的最大值。水表面膜的溶氧性能在给定大气压与温度下是不能改变的,氧也不会由低浓度向高浓度扩散,所以通过水表面膜向水体中溶解氧气,无论运用何种方式都不可能使水体中的溶氧值大于其饱和溶氧值[13]。
但是,利用空气泵向水中不断鼓入空气形成气泡,增大气液接触面积,可以加速空气向水中传递氧的过程。本文作者通过在搅拌浸出槽底部接入螺旋空气管、微孔材料的方法改变发泡方式,进而在持续增氧(空气中氧作氧化剂)的条件下对碱性硫脲浸出低品位金矿石进行具体研究。发泡方式的改变既增大了空气中氧向水中传递的速率,又强化了搅拌效果。结果表明在相同充气量条件下,发泡方式的不同对碱性硫脲浸金效果有显著影响。
1 实验
1.1 样品
1.1.1 样品的采取与制备
试验样品由埃塞俄比亚 NMIC 公司采自埃塞俄比亚 Werri Gold and base mine。样品经四段破碎筛分后,使其粒度全部在2 mm以下,混匀后取样2 kg进行球磨,磨矿时间为14 min,使样品中粒径<74 μm的颗粒含量占95 %以上,再次混匀,然后采用割环法将样品分为100份实验用样,每份20 g左右。
1.1.2 样品的性质样品的多元素分析结果见表1。

表1 样品化学多元素分析
试验样品是含金、银、铅、锌、铜等元素的多金属硫化物矿石。其中贵金属元素金、银的矿物量极少,对样品光片进行显微镜下观察及 MLA分析,均未见有任何含金矿物出露。通过对富集后的重砂样品进行扫描电镜(见图1)、能谱分析(见图2)及 MLA 分析可以确定:该样品中的含金矿物主要是银金矿[Au,Ag],另有微量自然金[Au]。
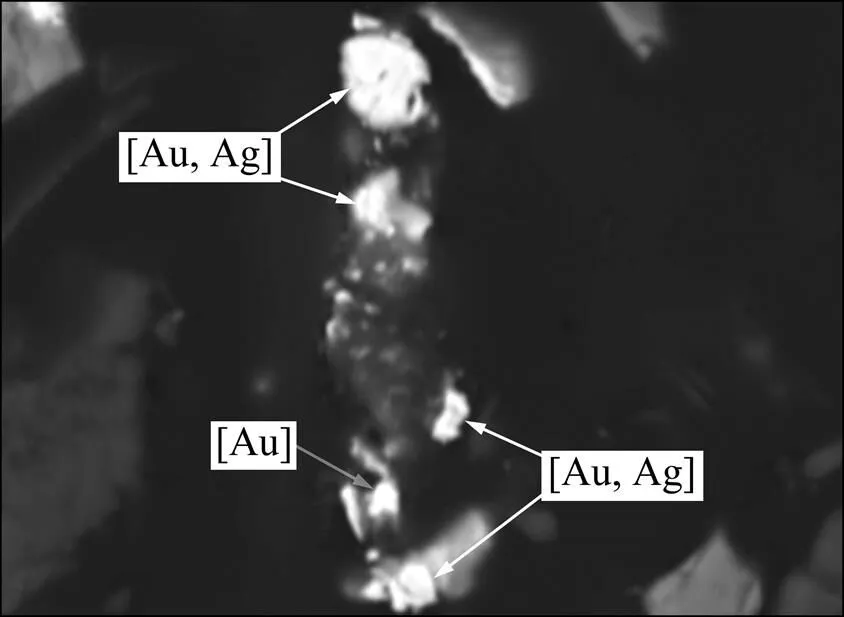
图1 含金矿物的SEM像
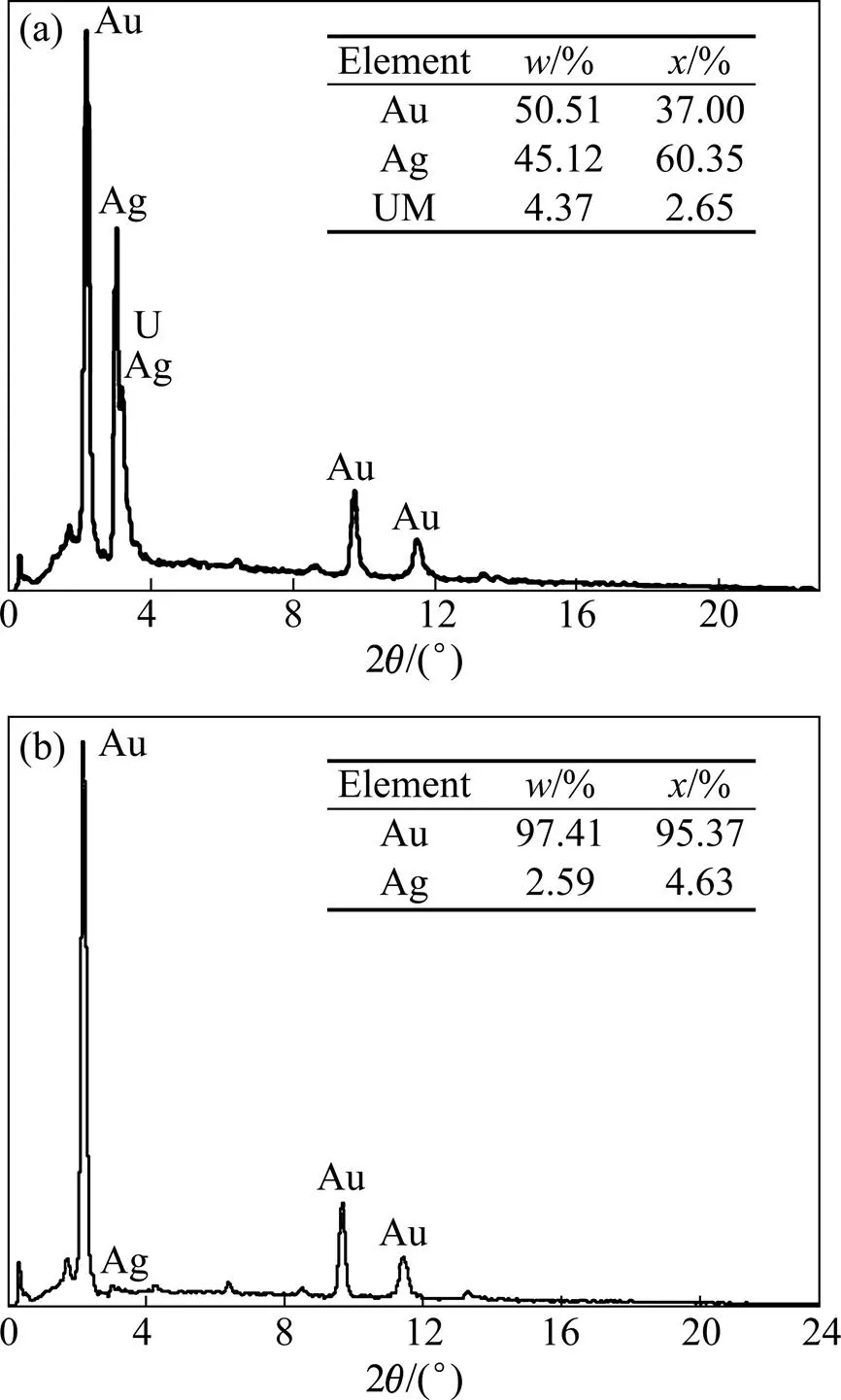
图2 银金矿和金银矿的EDS分析结果
1.2 仪器设备与药剂
仪器设备:采用美国Agilent Technologies 700系ICP−OES进行化学多元素分析;Nippon Tekno JSM−6510型SEM-EDS对重砂样品进行观察分析;XMQ−67型240×90锥形球磨机进行磨矿;JJ−4B数显六联电动搅拌器进行搅拌浸出试验;GGX−9原子吸收分光光度计进行活性炭富集原子吸收光谱法分析金;梅特勒AG−285型电子分析天平进行药剂称量;JPB−607A型便携式溶解氧测定仪测定溶解氧;采用空气泵进行鼓气增氧;用玻璃转子流量计进行充气量调节及测量。
试验药剂:硫脲、六偏磷酸钠、氢氧化钠、无水亚硫酸钠、氯化钴,均为分析纯。
1.3 碱性硫脲浸金试验
称取矿石试样20 g置于浸出槽中,量取60 mL蒸馏水调节矿浆液固比为3:1,用分析天平称取适量六偏磷酸钠、硫脲,并搅拌溶解于矿浆中,滴加氢氧化钠溶液调节矿浆pH≈11.5。将空气泵、玻璃转子流量计与浸出槽导气管进行连接,设置电动搅拌器搅拌桨转速为300 r/min,持续增氧条件下搅拌浸出12 h。浸出过程完成后,矿浆经真空过滤机固液分离得到浸渣。浸渣经干燥箱干燥后利用原子吸收分光光度计运用活性炭富集原子吸收光谱法分析金含量[14],然后根据(2)式计算浸出率()[15]。
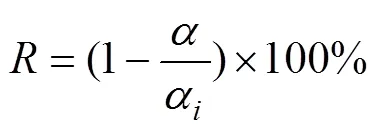
1.4 发泡方式及特点
1.4.1 常规发泡
采用将内径4 mm的导气管直接接入浸出槽底部的方式对浸金溶液进行不间断鼓气增氧,如下图3所示。此方式产生的气泡直径明显较大,空气泡在出气口处形成并快速合并进一步增大,迅速从溶液底部上升至溶液表面破裂,逸出空气。气泡主要集中于出气口及其上方,向周围溶液扩散的效果较差,增加的气液接触面积十分有限。

图3 常规发泡示意图
1.4.2 螺旋空气管发泡
采用将内径4 mm、用直径0.4 mm串珠针均匀打孔的橡胶导气管螺旋状平铺于浸出槽底部的方式对浸金溶液进行不间断鼓气增氧,相邻小孔间距、管体间距约3 mm,如下图4所示。此方式产生的气泡直径较小,微小空气泡在通气小孔处不断形成,小气泡脱离管壁快速上升,上升过程中不断与其他气泡合并增大,直至到达溶液表面破裂,逸出空气。气泡在溶液中,整体分布较为均匀,气泡直径由下层至上层逐渐增大,但由于管体气孔密度有限及管体间隙存在,气泡在溶液中的密集程度不高。
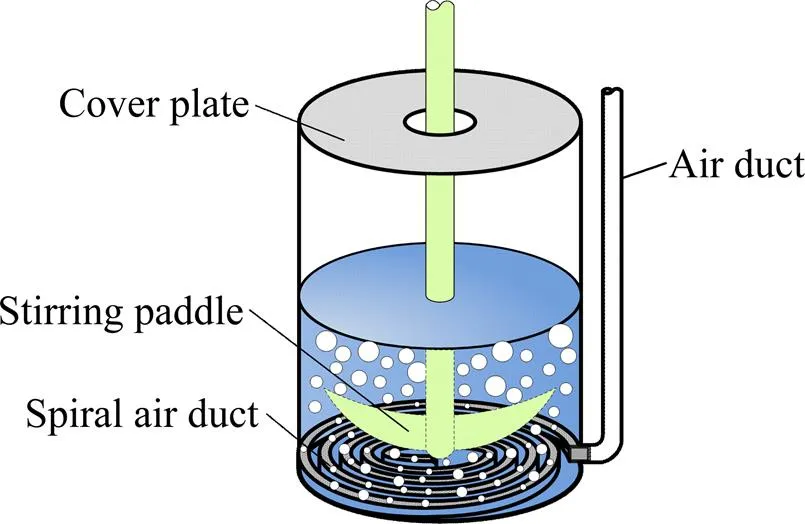
图4 螺旋空气管发泡示意图
1.4.3 微孔材料发泡
采用由白刚玉、金刚砂高温烧结而成的微孔材料铺满浸出槽底部的方式对浸金溶液进行不间断鼓气增氧,如图5所示。此方式产生的气泡直径更小,空气泡在多微孔材料表面大量形成,脱离表面后快速上升,上升过程中不断与其它气泡合并增大,直至到达溶液表面破裂,逸出空气。气泡在溶液中,由下层至上层呈直径逐渐递增式分布,而且整体分布更加密集,产生很大的气液接触面。

图5 微孔材料发泡示意图
1.5 氧总转移系数测定
影响氧转移的因素有水质、水温、氧分压、气液接触面积和时间、水的絮流程度等。氧转移的机理主要是双膜理论:在气液两相接触界面两侧存在着气膜和液膜,气体分子从气相以分子扩散的方式经过气膜和液膜进入液相,氧转移的动力为气膜中的氧分压梯度和液膜中的氧浓度梯度,传递的阻力主要存在于液膜中。液膜内氧转移的基本方程式为
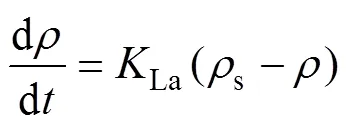
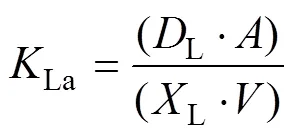
式中:d/d为水中氧转移速率,mg/(L·min);s为液膜内气液界面处饱和溶解氧浓度,mg/L;为水体中溶解氧浓度,mg/L;La为氧总转移系数,min−1;L为氧分子在液膜中的扩散系数,m2/min;为气液两相接触界面面积,m2;L为液膜厚度,m;为曝气液体积,m3。
氧总转移系数La是评价增氧系统氧传递速率快慢的指标。采用蒸馏水充氧实验分别测定3种发泡方式增氧的La值。在浸出槽中加入200 mL蒸馏水,将无水亚硫酸钠20 mg与氯化钴0.4 mg溶解于水中进行脱氧,使水中溶解氧为0。然后调节充气量为0.6 L/min用空气泵增氧,从溶解氧测定仪读数产生变化开始每隔10 s记录一次溶解氧值。
将(3)式积分可得:
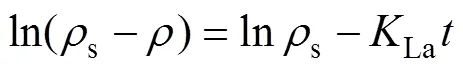
以ln(s−)为纵坐标,为横坐标,作ln(s−)和的关系曲线,其斜率即为La值[16]。
2 结果与讨论
2.1 充氧能力评价
分别在常规发泡、螺旋空气管发泡、微孔材料发泡3种发泡方式增氧条件下对浸出槽进行蒸馏水充氧实验,测定不同发泡方式增氧的氧总转移系数La值,测量时水温为29 ℃,s取7.77 mg/L,结果如图6 所示。
实验结果显示,常规发泡、螺旋空气管发泡、微孔材料发泡3种发泡方式增氧的La值分别为0.43、1.00、1.27 min−1,证明微孔材料发泡增氧的充氧能力最强,即微孔材料发泡增氧时空气中氧向水中传递的速率最快,碱性硫脲浸金过程中矿浆中氧含量补充最及时,更有利于金的快速溶解,使空气中氧作为碱性硫脲浸出低品位金矿石的氧化剂成为可能。
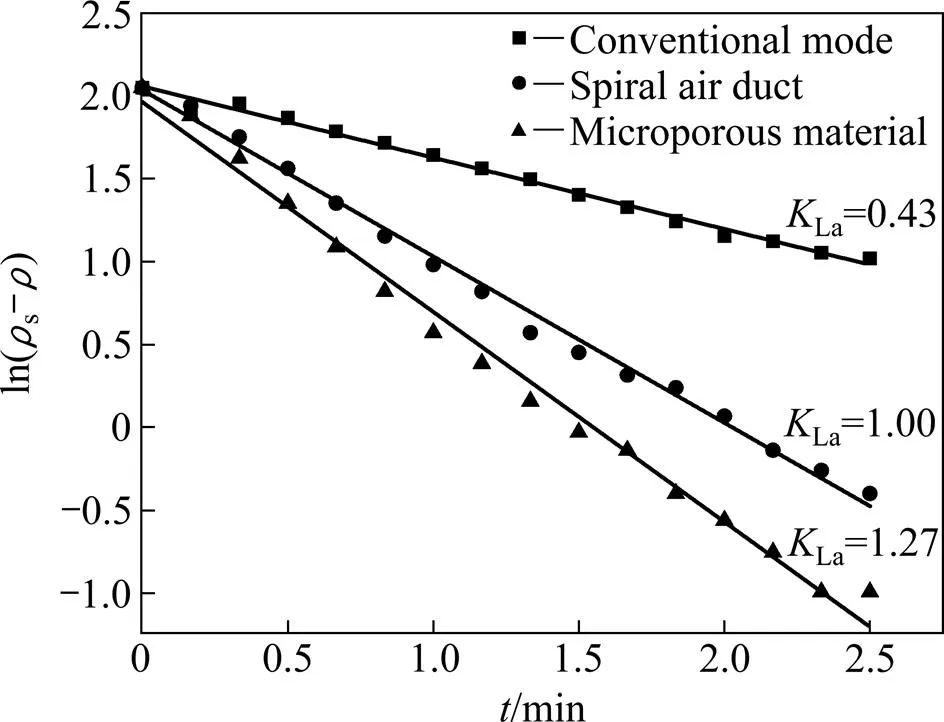
图6 不同发泡方式的ln(ρs−ρ)与t关系
2.2 浸金效果
2.2.1 发泡方式的影响
采用常规发泡、螺旋空气管发泡、微孔材料发泡3种不同的发泡方式,在持续增氧条件下进行碱性硫脲浸金试验,固定充气量为0.6 L/min,硫脲用量为0.03 g,试验结果如表2所列。
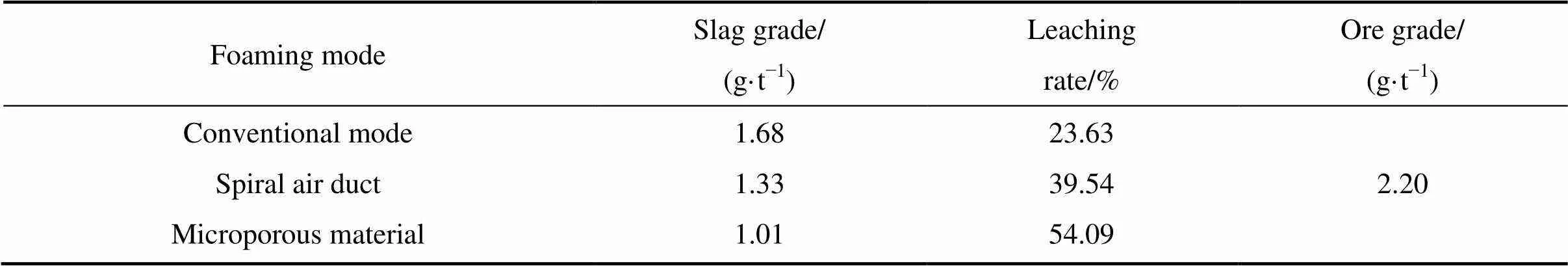
表2 不同发泡方式下的浸金试验结果
试验结果显示,在常规发泡、螺旋空气管发泡、微孔材料发泡方式下增氧得到的金浸出率依次增大,且增长幅度较为显著,发泡方式是增氧条件下碱性硫脲浸金的重要影响因素。其中,微孔材料发泡方式下的浸出率可达54.09%,效果最佳。在相同充气量条件下,微孔材料发泡所产生的气泡直径最小、气泡密集程度最高,生成的气液接触面积最大,理论上具有更快的氧传递速率以及更好的搅拌效果。
碱性硫脲浸金体系中,当采用空气中的氧作为氧化剂时,金与硫脲形成配位阳离子溶解于溶液的反应方程式为[17]:

反应式(6)中Tu是SC(NH2)2的缩写,Au与O2的化学计量数之比为4:1,而试验取矿石试样20 g,金品位2.2 g/t,含金44 μg,假设金全部溶解理论上仅需耗氧约1.8 μg。试验中加水体积60 mL,水中溶解氧在饱和值内可以满足溶解全部金。但矿浆中含有大量其他耗氧物质,矿浆氧含量更快得到补充则有利于金更快溶解,硫脲易分解的特性使得越快地溶金能够获得越高的浸出率。另外,微孔材料发泡所产生的搅拌效果使得矿浆中形成大量局部湍流,可以显著增大矿浆中药剂分子与矿物颗粒表面接触的机率,同时也可以加快Au[SC(NH2)2]2+从金微粒矿浆界面向液相中扩散,最终加速整个浸出过程的进行,提高金浸出率。所以,氧传递速率最快、附加搅拌效果最好的微孔材料发泡增氧能够获得最高的浸出率。
2.2.2 硫脲量的影响
选用浸金效果最好的微孔材料发泡方式,在持续增氧条件下进行碱性硫脲浸金试验,固定充气量为0.6 L/min,不同硫脲用量下的金浸出率如图7所示。

图7 硫脲用量对金浸出率的影响
试验结果显示,硫脲添加量从0.01g增加到0.09g时,金的浸出率增长平缓,且用量过大时浸出率略有下降趋势,表明硫脲用量在大于0.01g时,已基本满足反应需要;当硫脲用量过大时,反而不利于金浸出,可能是硫脲被氧化分解生成的硫化物等对金有钝化影响。虽然硫脲用量在0.07g时浸出率最高,但相比用量在0.03g时浸出率仅提高3.18%,故选择0.03g为最佳用量更为合适。
2.2.3 充气量的影响
选用微孔材料发泡方式,在持续增氧条件下进行碱性硫脲浸金试验,固定硫脲用量为0.03 g,不同充气量条件下的金浸出率如图8所示。
试验结果显示,在一定充气量范围内,金浸出率随着充气量的增加而增大,且在0.6 L/min到1.0 L/min的充气量范围内浸出率增幅变得平缓;当充气量达到1.0 L/min时,浸出率达到最高;当充气量达到1.2 L/min时,浸出率反而略有下降。表明在一定范围内,充气量越大浸金效果越好,但当充气量过大时,则会对浸出产生不利影响,观察发现充气量过大时,溶液中气泡太过密集且气泡流对溶液产成很大扰动,加速了气泡的合并与上升逸出速度,不利于空气中氧向水中的传递,从而恶化了浸出效果。所以最佳充气量选择在能耗较低、浸出率较高的区间0.6 L/min到0.8 L/min之内较为合适。
综合上述试验结果可知,最佳条件下碱性硫脲浸金的浸出率最高可达60%左右,而剩余的金难以浸出可能是因为硫脲氧化分解的部分难溶产物会粘附在矿物颗粒表面,阻碍溶金反应的进行。
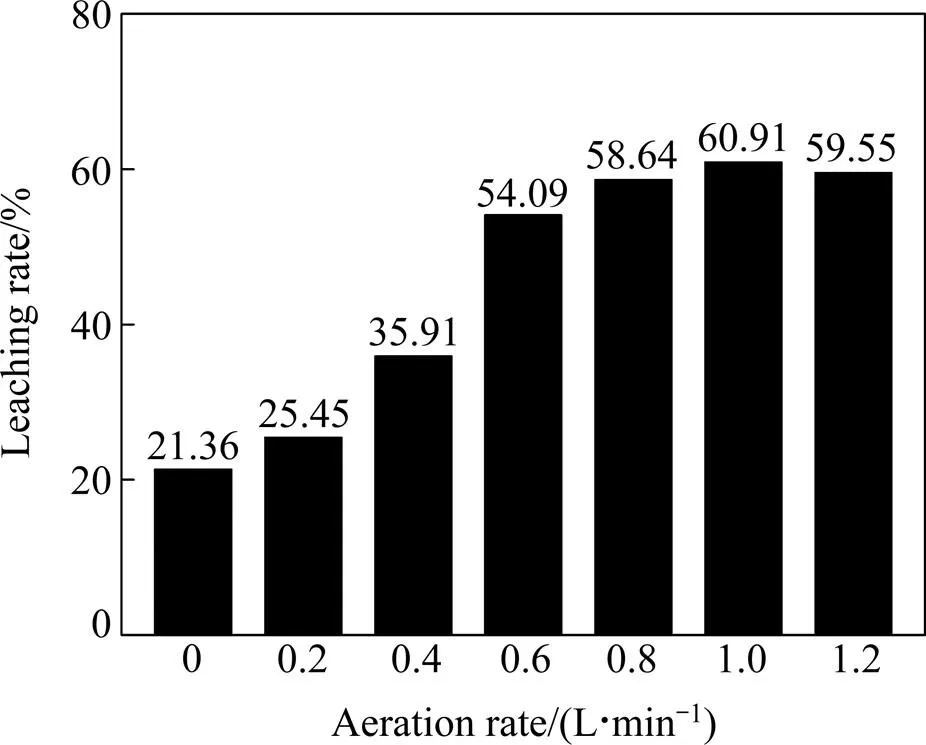
图8 充气量对金浸出率的影响
3 结论
1) 增氧条件下碱性硫脲浸金体系的充氧能力越强,氧传递速率越快,越有利于金快速溶解,浸出效果则越好。
2) 在相同充气量条件下,常规发泡、螺旋空气管发泡、微孔材料发泡3种方式中,微孔材料发泡增氧的效率最高,浸出率最大。
3) 微孔材料发泡增氧条件下,在一定范围内,碱性硫脲浸金率随着充气量的增加而增大,充气量过大时,则会恶化浸金效果。
[1] 刘有才, 朱忠泗, 符剑刚, 李丽峰, 林清泉, 陈凯达, 李志辉. 碱性硫脲浸金的研究现状与发展趋势[J]. 贵金属, 2013, 34(2): 78−81.LIU You-cai, ZHU Zhong-si, FU Jian-gang, LI Li-feng, LIN Qing-quan, CHEN Kai-da, LI Zhi-hui.Investigation status and development trend of leaching gold with alkaline thiourea[J]. Precious Metals, 2013, 34(2): 78−81.
[2] 白成庆. 非氰浸金试剂的应用现状及发展[J]. 矿业快报, 2008, 476: 12−17. BAI Cheng-qing. Application status and development of non-cyanide gold leaching reagents[J]. Express Information of Mining Industry, 2008, 476: 12−17.
[3] 赵留成, 孙春宝, 李绍英, 龚道振. 石硫合剂对金精矿浸出特性的影响[J]. 中国有色金属学报, 2015, 25(3): 786−792. ZHAO Liu-cheng, SUN Chun-bao, LI Shao-ying, GONG Dao-zhen. Effects of lime sulphur synthetic solution on leaching characteristic of gold concentrates[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(3): 786−792.
[4] 杨喜云, 刘政坤, 郭孔彬, 徐 徽, 石西昌. 硫脲−硫氰酸钠浸出难处理金矿及浸出剂的稳定性[J]. 中国有色金属学报, 2014, 24(8): 2164−2170. YANG Xi-yun, LIU Zheng-kun, GUO Kong-bin, XU Hui, SHI Xi-chang. Leaching of Au from refractory gold ore in thiourea-thiocyanate solutions and stability of lixiviants[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(8): 2164−2170.
[5] 张 静, 兰新哲, 宋永辉, 王碧霞, 邢相栋. 酸性硫脲法提金的研究进展[J]. 贵金属, 2009, 30(2): 75−82. ZHANG Jing, LAN Xin-zhe, SONG Yong-hui, WANG Bi-xia, XING Xiang-dong. Study on the extraction of gold with acidic thiourea[J]. Precious Metals, 2009, 30(2): 75−82.
[6] 郑 粟, 王云燕, 柴立元, 张晓飞. 高稳定性碱性硫脲体系对不同类型金矿的适应性[J]. 过程工程学报, 2005, 5(3): 289−294. ZHENG Su, WANG Yun-yan, CHAI Li-yuan, ZHANG Xiao-fei. Adaptability of gold leaching from different ores in highly stable alkaline thiourea solutions[J]. The Chinese Journal of Process Engineering, 2005, 5(3): 289−294.
[7] 王云燕, 柴立元. 硫脲在碱性介质中的电化学行为[J]. 中国有色金属学报, 2008, 18(4): 733−737. WANG Yun-yan, CHAI Li-yuan. Electrochemical behaviors of thiourea in alkaline medium[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(4): 733−737.
[8] 郑 粟, 王云燕, 柴立元. 基于配位理论的碱性硫脲选择性溶金机理[J]. 中国有色金属学报, 2005, 15(10): 153−159. ZHENG Su, WANG Yun-yan, CHAI Li-yuan. Mechanism of gold dissolution selectively in alkaline thiourea solutions based on complex theory[J]. The Chinese Journal of Nonferrous Metals, 2005, 15(10): 153−159.
[9] 涂 博, 张亚辉, 尤大海, 黄俊玮. 难处理金矿非氰提金方法研究现状[J]. 贵金属, 2013, 34(4): 73−81. TU Bo, ZHANG Ya-hui, YOU Da-hai, HUANG Jun-wei. Research status of non-cyanide leaching technologies for refractory gold ores[J]. Precious Metals, 2013, 34(4): 73−81.
[10] 钟 俊. 非氰浸金技术的研究及应用现状[J]. 黄金科学技术, 2011, 19(6): 57−61. ZHONG Jun. Research and application status of non-cyanide gold leaching technology[J]. Gold Science and Technology, 2011, 19(6): 57−61.
[11] 严永谋, 孟 奇, 崔毅琦, 朱 坤, 杨 富, 杨同正. 硫脲浸金技术研究现状[J]. 黄金, 2014, 35(2) : 50−53. YAN Yong-mou, MENG Qi, CUI Yi-qi, ZHU Kun, YANG Fu, YANG Tong-zheng. Current study situations of gold leaching technology by thiourea[J]. Gold, 2014, 35(2): 50−53.
[12] 张朝能. 水体中饱和溶解氧的求算方法探讨[J]. 环境科学研究, 1999 , 12(2): 57−58. ZHANG Chao-neng. Study on calculation method of saturation values of dissolved oxygen in waters[J]. Research of Environmental Sciences, 1999, 12(2): 57−58.
[13] 茆晴生. 高密度养鱼增氧方法分类与溶解氧超饱和度及水中气泡直径大小阈值的关系研讨[J]. 渔业机械仪器, 1987, 4: 3−5, 9. MAO Qing-sheng. Deliberation of the relation between classification of aerating methods for high density fish farming and supersaturation of dissolved oxygen and a value range of air bubbles in the water[J]. Fishery Machinery and Instrument, 1987, 4: 3−5, 9.
[14] 罗永红, 韦真周. 活性炭富集−原子吸收分光光度法测定金[J]. 湿法冶金, 2014, 33(4): 332−334. LUO Yong-hong, WEI Zhen-zhou. Determination of gold by activated carbon adsorption-atomic absorption spectro- photometry[J]. Hydrometallurgy of China, 2014, 33(4): 332−334.
[15] 刘有才, 朱忠泗, 符剑刚, 李丽峰, 林清泉, 李志辉. 某金矿石的石硫加碱催化合剂法浸金研究[J]. 稀有金属, 2013, 37(1): 123−129. LIU You-cai, ZHU Zhong-si, FU Jian-gang, LI Li-feng, LIN Qing-quan, LI Zhi-hui. Leaching gold ores by lime-sulphur- synthetic-solution with alkali-catalyzed process[J]. Chinese Journal of Rare Metals, 2013, 37(1): 123−129.
[16] 袁金华, 王有乐. 清水充氧实验中饱和溶解氧值确定方法的探讨[J]. 水资源保护, 2008, 24(2): 79−81. YUAN Jin-hua, WANG You-le. Saturation values of dissolved oxygen in oxygenated clean water experiments[J]. Water Resources Protection, 2008, 24(2): 79−81.
[17] WEI Da-wei, CHAI Li-yuan, ICHINO R, OKIDO M. Gold leaching in an alkaline thiourea solution[J]. Journal of the Electrochemical Society, 1999, 146(2): 559−563.
(编辑 李艳红)
Gold leaching of alkaline thiourea under oxygen supplementation
BAI An-ping, SONG Yong-sheng, LI Wen-juan, QU Wei
(National Engineering Laboratory of Biohydrometallurgy,General Research Institute of Nonferrous Metals, Beijing 100088, China)
During alkali thiourea Au-leaching process, the oxidation potential of the solution is needed to be adjusted by oxidation reagents. The oxidation potential should be higher than 0.38 V, which is the potential for gold to dissolve, and to form Au[CS(NH2)2]2+. However, the thiourea will be decomposed rapidly if the oxidation potential level is too high. In alkaline solution, the standard electrode potential of oxygen is 0.40V, which indicates that theoretically oxygen in the air is an economical oxidant for alkali thiourea Au-leaching system. The use of oxygen as oxidant is negatively impacted due to the low saturation and the slow natural dissolution rate of oxygen in water. The bubble generation type was changed by adding spiral air ducts or microporous material at the bottom of agitating leaching tank, and then the alkali thiourea Au-leaching system for low grade gold ore was studied under the condition of continuous oxygen supplementation (oxygen used as oxidant in the air). The change of bubble generation not only increases the oxygen transfer rate from air to water, but also improves the mixing effect. The test results show that the stronger the oxygenation capacity of the leaching system is, the better the leaching effect of gold with alkaline thiourea will be. Under condition of the same aeration rate, the foaming efficiency of microporous material with the highest leaching rate is the best. Within a certain range, the gold leaching rate increase with the aeration rate increasing, but an extremely high aeration rate will decrease the gold leaching rate.
oxygen supplementation; alkaline; thiourea; gold leaching
Project(51504031) supported by the National Natural Science Foundation of China
2016-06-28;
2017-04-07
LI Wen-juan; Tel: +86-10-82241312; E-mail: juanzi88888@126.com
10.19476/j.ysxb.1004.0609.2017.11.23
1004-0609(2017)-11-2363-07
TD953
A
国家自然科学基金资助项目(51504031)
2016-06-28;
2017-04-07
李文娟,高级工程师,硕士;电话:010-82241312;E-mail: juanzi88888@126.com

