深低温停循环选择性脑灌注最小安全流量的临床研究
刘 畅,陈 杨,朱悉煜,王东进
·临床研究·
深低温停循环选择性脑灌注最小安全流量的临床研究
刘 畅,陈 杨,朱悉煜,王东进
目的总结主动脉夹层患者深低温停循环(DHCA)顺行选择性脑灌注(ASCP)流量的选择,探讨选择性脑灌注流量的最小安全范围,从而减少术后神经系统并发症的发生。方法选择南京大学医学院附属鼓楼医院2016年1月至2016年12月Stanford A 型夹层动脉瘤患者107例,全组患者均在DHCA+ASCP体外循环方式下行主动脉全弓置换+支架象鼻手术,术前颈动脉超声检查结果示颈动脉中重度狭窄患者和/或合并有脑血管疾病病史被排除研究之外。根据术中不同的ASCP流量分为 3 ml/(kg·min)小流量组(M 组 )、 5 ml/(kg·min)低流量组(D 组 )。术中应用近红外光谱(NIRS)监测仪连续监测DHCA+ASCP流量下5个时间点。分别为:麻醉诱导后(T1)、阻断升主动脉后(T2 )、恢复循环10 min(T3)、开放升主动脉10 min(T4)和停体外循环后5 min(T5)。记录双侧局部大脑氧饱和度(rSO2)数值、静脉血乳酸含量及术后恢复情况。结果所有患者无术后严重神经系统并发症发生。两组患者ASCP时间、主动脉阻断时间、 转机时间、手术时间、转中最低温度、术中输血量、各个时间点乳酸浓度差异无统计学意义,两组患者T3、T4两个时间点rSO2变化有统计学差异,M组低于D组(P<0.05)但M组的rSO2仍在安全范围内,可维持患者脑氧代谢,其余各时间点rSO2变化无统计学差异、患者术后机械辅助通气时间、监护室停留时间、术后二次开胸止血时间差异均无统计学意义。结论主动脉夹层行DHCA+ASCP,在一定时间内3~5 ml/(kg· min)的脑灌注流量时rSO2在可接受的范围内。能够为大脑提供足够的血流,满足大脑氧代谢所需,均能获得满意的脑保护效果。
深低温停循环;选择性脑灌注;脑血氧饱和度;体外循环
自从1975年,Griepp首次利用低温技术脑保护完成弓部手术以来,涉及主动脉弓部的主动脉手术多采用深低温停循环(deep hypothermic circulatory arrest,DHCA)技术来实现脑及其他脏器的保护。临床研究表明脑组织的氧耗随着温度的降低而相应降低,18℃时脑的安全时限为30~60 min[1],虽然深低温可以降低脑代谢率,从而减少延长脑缺血的耐受时间,但是包括脑组织缺血缺氧、体外循环引起炎症反应等因素,所造成的神经系统损伤、凝血功能异常、器官功能障碍、肺损伤等并发症也引起较多关注[2]。因此,结合DHCA不同的脑保护方式应运而生,目前大多数中心仍采用DHCA+顺行选择性脑灌注(antegrade selective cerebral perfusion,ASCP)的方式行脑保护,常用的ASCP流量为5~10 ml/(kg·min)。但是较高流量的ASCP,会导致脑水肿及颅内压脑升高增加术后神经并发症的发生[3],有动物实验表明3 ml/(kg·min)ASCP流量能满足脑需氧量[4]。本研究旨在探讨脑保护所需的最小安全灌注流量。
1 资料与方法
1.1一般资料 回顾分析南京鼓楼医院2016年1月至2016年12月收治Stanford A型主动脉夹层动脉瘤择期手术患者107例。排除合并有脑血管疾病病史和术前颈动脉超声检查结果示颈动脉中重度狭窄患者。全部患者均择期行DHCA+ASCP主动脉全弓置换+支架象鼻手术。按照脑灌注流量不同分为:3 ml/(kg·min)小流量组(M 组 )41例;5 ml/(kg·min)低流量组(D 组 )66例。
1.2手术和麻醉方法 两组患者均采用DHCA+ASCP的体外循环方式行主动脉全弓置换+支架象鼻手术,其中M组同期行Bentall术 11例,Wheat术 2例,冠状动脉旁路移植术3例,D组同期行Bentall术 24例,Wheats术5例,冠状动脉旁路移植术4例(表1)。采用静脉吸入复合麻醉,监测ECG、左侧桡动脉压、左足背动脉压、脉搏氧饱和度、中心静脉压、鼻咽温和直肠温及混合静脉血氧饱和度、红细胞比容及血浆胶体渗透压等。
1.3体外循环管理 采用Sorin C5型体外循环机、泰尔茂成人膜式氧合器。预充液采用复方乳酸钠林格注射液2 000 ml全晶体液预充,机器内加入肝素2 000 U。应用含血停搏液(晶体∶血液为1∶4)行心肌保护。动脉插管为右侧腋动脉插管,根据实际情况增加股动脉插管,静脉插管右心房和/或上、下腔静脉建立体外循环,降温至鼻咽温32℃,阻断升主动脉,经主动脉根部或切开升主动脉直接经冠状动脉开口灌注心脏停搏液,术中采用顺行灌注+逆行灌注相结合的灌注方式行心肌保护。继续降温,当鼻咽温降至18~21℃时,行DHCA+ASCP。脑灌注流量为3~5 ml/(kg·min),近端分别阻断无名动脉、左颈总动脉及左锁骨下动脉。主动脉弓部手术操作完成后分次、20 ml/(kg·min)、30 ml/(kg·min)、40 ml/(kg·min)逐步提升流量至全流量恢复全身循环。全流量灌注10~15 min、混合静脉血氧饱和度>75%时,开始复温,期间需维持直肠温度与水箱温差<10℃,鼻咽温与直肠温度差<5℃,鼻咽及直肠温恢复至36.5℃停止体外循环。充分止血后鱼精蛋白中和。拔除动脉静脉插管。
1.4NIRS监测 麻醉后将近红外光谱(near-infrared spectroscopy,NIRS)(FORE-SIGHT,美国CAS Medical Systems,Inc)探头置于患者双侧前额,使用头环将探头固定。分别于麻醉诱导后(T1)、阻断升主动脉后(T2)、恢复循环10 min(T3)、开放升主动脉10 min(T4)和停体外循环后5 min(T5)时记录双侧脑血氧饱和度(regional cerebraloxygention,rSO2)数值。并且记录各个时间点静脉血乳酸含量及术后恢复情况。

2 结 果
两组患者术前基本资料包括:性别、年龄、体重、术前心脏功能和合并疾病等差异均无统计学意义(P>0.05),见表1。
两组患者ASCP时间、主动脉阻断时间、转机时间、手术时间、转中最低温度、乳酸浓度差异无统计学意义(P>0.05),见表2。
rSO2各时点无统计学差异(P>0.05), 比较两组患者各时点rSO2,其中T1、T2、T5三个时间点rSO2差异无统计学意义(P>0.05),T3、T4两个时间点rSO2差异有统计学意义(P<0.05),见表3。
两组患者术后机械辅助通气时间、监护室停留时间、二次开胸止血差异均无统计学意义(P>0.05),见表4。
M组2例患者死亡,其中1例出现循环功能衰竭,1例肺部感染。D组4例患者死亡,其中3例出现循环功能衰竭,1例出现双下肢缺血。其余患者均康复出院,均未出现严重神经系统并发症。

表1 两组患者术前资料及术中合并手术比较
注:COPD:慢性阻塞性肺疾病;CABG:冠状动脉旁路移植术。
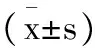
表2 两组患者术中情况比较
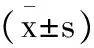
表3 各时点双侧rSO2值比较

表4 术后机械辅助通气时间、监护室停留时间、二次开胸止血比较
3 讨 论
在深低温的条件下,应间断行脑灌注,为脑组织提供氧供。即ASCP脑保护可有效的延长DHCA时间。有研究表明少量的脑血流也会在保护中枢神经系统功能上起一定的作用。最低只需 5~10 ml/(kg·min)的脑灌注流量即可起到保护大脑的作用[5]。因此,对主动脉弓部手术的患者,一般常规选择DHCA+ASCP行脑保护。但是DHCA+ASCP会给患者带来脑水肿等神经系统的损伤,到底多大的流量能够即安全的实现脑保护,同时能够最小程度的脑损伤,目前仍没有定论,有文献报道动物实验3~10 ml/(kg·min)的脑灌注流量即能满足脑需氧量[6]。笔者通过总结本中心主动脉夹层手术DHCA时的不同ASCP流量选择,探讨最小安全ASCP流量,以期减少术后神经系统并发症的发生。
rSO2能反应大脑氧代谢的供需平衡,尤其是在涉及主动脉弓部手术的主动脉夹层患者中,ASCP更需要能够反映氧代谢的指标[7]。而有研究报道脑血氧饱和度仪的使用能够为术中神经系统的动态变化提供明确的指征,术中及时调整手术方案,进行脑保护相关方面的治疗对于术后认知功能障碍的减少、减少术后监护室滞留时间和住院时间提供了一定的依据[8]。主动脉夹层术后中风的比例约为10%,90%是因为颈动脉的狭窄或者腋动脉插管导致的动脉内膜的翻转[9],另外术中、术后血压剧烈的波动导致的血栓、斑块、内膜片的脱落都会引起rSO2数值的剧烈变化。而心脏术后发生中风的比例约为5%,平均发生在术后1.5天,大多数发生在右侧大脑半球,且为梗死性[10]。所以术中根据rSO2的监测对术中脑缺血尤其是右侧大脑半球的判断有明确的意义。rSO2正常值为55%~75%,术中连续的监测及各个时间段的对比有明确的意义。
本研究中各个时间点,全组患者双侧大脑rSO2值均处于正常范围之内,术后无严重神经系统并发症发生。不同脑灌注流量比较,rSO2值均随着手术的进行即温度的变化而变化,开始手术降温至深低温选择性脑灌注,rSO2值呈上升趋势,DHCA结束开始复温至手术结束,rSO2值呈下降趋势,其中体外循环前(T1)、升主动脉阻断后10 min(T2)、停机后5 min(T5)三个时间点rSO2值的变化趋势差异并无统计学意义。恢复循环10 min(T3)、开放升主动脉10 min(T4),两个时间点rSO2值的变化趋势差异存在统计学意义。但3 ml/(kg·min)的小流量组rSO2值仍然处于安全阈值范围以上,提示大脑血液供应仍然充足,能够满足大脑氧的代谢需求。本研究同时观察围术期两组患者血浆乳酸水平,各时间点静脉血乳酸值并无差异,均在可接受的范围内,提示3 ml/(kg·min)较5 ml/(kg·min)没有增加脑的无氧代谢。本研究中对合并有脑血管疾病病史或术前颈动脉超声检查结果示颈动脉中重度狭窄患者被排除在该研究之外。不足之处是术前未对患者进行大脑Willis环的完整性进行评估,但术中无患者存在双侧rSO2值的显著差异。
本研究显示,通过DHCA+ASCP的体外循环方式行主动脉全弓置换+支架象鼻手术治疗Stanford A 型夹层动脉瘤患者时,除常规通过左侧挠动脉压力间接监测脑灌注压力外,还可以通过 NIRS持续监测提供的rSO2值来判断大脑氧供情况。在一定时间内 3~5 ml/(kg·min)的脑灌注流量能够为大脑提供足够的血流, 满足大脑氧代谢所需,均能获得满意的脑保护效果。
[1]Griepp RB, Stinson EB, Hollingsworth JF,etal. Prosthetic replacement of the aortic arch[J]. J Thorac Cardiovasc Surg, 1975, 70(6):1051-1063.
[1]Chong SY, Chow MY, Kang DS,etal. Deep hypothermic circulatory arrest in adults undergoing aortic surgery: Local experience[J]. Ann Acad Med Singapore, 2004, 33(3):289-293.
[2]Kamiya H, Hagl C, Kropivnitskaya I,etal. The safety of moderate hypothermic lower body circulatory arrest with selective cerebral perfusion: a propensity score analysis[J]. J Thorac Cardiovasc Surg, 2007, 133(2):501-509.
[3]Haldenwang PL1, Strauch JT, Amann I,etal. Impact of pump flow rate during selective cerebral perfusion on cerebral hemodynamics and metabolism[J]. Ann Thorac Surg, 2010, 90(6):1975-1984.
[4]Jonsson O, Morell A, Zemgulis V,etal. Minimal safe arterial blood flow during selective antegrade cerebral perfusion at 20° centigrade[J]. Ann Thorac Surg, 2011, 91(4):1198-1205
[5]Misfeld M, Leontyev S, Borger M A,etal. What is the best strategy for brain protection in patients undergoing aortic arch surgery? A single center experience of 636 patients[J]. Ann Thorac Surg, 2012, 93(5):1502-1508.
[6]Habertheuer A, Wiedemann D, Kocher A,etal. How to Perfuse: Concepts of cerebral protection during arch replacement[J]. Biomed Res Int, 2015, 2015(3):981813.
[7]Jr E H. 2010 standard of care for central nervous system monitoring during cardiac surgery[J]. J Cardiothorac Vasc Anesth, 2010, 24(4):541-543.
[8]Apostolidou I, Morrissette G, Sarwar MF,etal. Cerebral oximetry during cardiac surgery: the association between cerebral oxygen saturation and perioperative patient variables[J]. J Cardiothorac Vasc Anesth, 2012, 26(6):1015-1021.
[9]Ohara T, Koga M, Tokuda N,etal. Rapid Identification of Type A Aortic Dissection as a Cause of Acute Ischemic Stroke[J]. J Stroke Cerebrovasc Dis, 2016, 25(8):1901-1906.
[10]Korn-Lubetzki I, Oren A, Asher E,etal. Strokes after cardiac surgery: mostly right hemispheric ischemic with mild residual damage[J]. J Neurol, 2007, 254(12):1708-1713.
Minimalsafeperfusionflowofselectivecerebralperfusionduringdeephypothermiccirculatoryarrest
Liu Chang, Chen Yang, Zhu Xi-yu, Wang Dong-jin
DepartmentofThoracicCardiacSurgery,GulouHospital,Nanjing210008,China
WangDong-jinEmail:gldjw@163.com
ObjectiveTo identify whether a minimal perfusion flow of selective cerebral perfusion (SCP) during deep hypothermic circulatory arrest (DHCA) was still safe in the surgery of aortic dissection (AD) patients, and to evaluate. The protective effects of it on decreasing neurological complications after surgery.MethodsA retrospective analysis of 107 patients with Stanford type A aortic dissection in our center since Jan. 2016 to Dec. 2016 was performed. Patients with moderate or severe carotid artery occlusion or cranial vascular diseases were excluded by ultrasound examination. All patients enrolled were
total arch replacement and frozen elephant trunk implantation during surgery accompanied with DHCA and SCP. We divided all patients into two groups, M group (3 ml/(kg·min)) and D group (5 ml/(kg·min)), according to the perfusion flow. Near infrared reflectance spectroscopy (NIRS) was settled to evaluate bilateral cerebral oxygen saturation (rSO2) continuously. Meanwhile, lactate levels were also recorded at several time points during surgery, such as after anesthesia induction (T1), after aortic cross clamp (ACC) (T2), 10 min after circulatory restoration (T3), 10 min after ACC releasing (T4) and 5 min after cardiopulmonary bypass (CPB) (T5).ResultsAll patients enrolled in our study were received DHCA and SCP during operations, and none of them were suffered from severe neurological complications. There were no significant differences in perfusion time, ACC time, CPB time and operation time. Also, no differences were found among lactate levels, mechanical ventilation time, intensive care unit duration and post-operative complications. We only found that the levels of rSO2were a bit lower in M group than those in D group at T3 and T4 time points (P<0.05). However, the value of rSO2in M group was still safe for patients to maintain cerebral oxygen metabolism.ConclusionIt is acceptable that minimal perfusion flow (3 ml/(kg·min)) is still safe during DHCA. Moreover, it can provide enough flow and ensure oxygen metabolism to meet the requirement of cerebral protection.
Deep hypothermic circulatory arrest; Antegrade selective cerebral perfusion; Cerebral oxygen saturation; Extracorporeal circulation
10.13498/j.cnki.chin.j.ecc.2017.04.04
210008 南京,南京大学医学院附属鼓楼医院心胸外科
王东进,Email:gldjw@163.com
2017-06-19)
2017-08-08)

