高脂高糖食物下中缅树鼩脂肪组织的形态学比较
左木林, 柏春玲, 朱万龙, 董馨忆, 曾天雷, 王政昆
(1. 云南师范大学 生命科学学院 云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室, 昆明 650500; 2. 云南师范大学附属镇雄中学,云南昭通 657200; 3. 昆明医科大学 科研实验中心, 昆明 650500; 4. 水富县第一中学, 云南昭通 657800)
高脂高糖食物下中缅树鼩脂肪组织的形态学比较
左木林1,2, 柏春玲3, 朱万龙1, 董馨忆3, 曾天雷4, 王政昆1
(1. 云南师范大学 生命科学学院 云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室, 昆明 650500; 2. 云南师范大学附属镇雄中学,云南昭通 657200; 3. 昆明医科大学 科研实验中心, 昆明 650500; 4. 水富县第一中学, 云南昭通 657800)
采用石蜡组织切片和HE染色方法、免疫组织化学染色、免疫荧光染色方法研究中缅树鼩(Tupaiabelangeri)在高脂高糖食物下脂肪组织的形态学变化。结果显示:中缅树鼩脂肪细胞在高脂高糖食物作用下会发生形态改变,小脂滴的多泡脂肪细胞大量出现,脂肪滴直径明显变大。白色脂肪组织与褐色脂肪组织在28 d时UCP1阳性表达增强,49 d时UCP1阳性表达减少。表明白色脂肪组织中存在米色脂肪细胞,高热量食物对产热具有诱导作用,过于肥胖时,动物的产热会减少。
中缅树鼩;高脂高糖食物;脂肪组织;米色脂肪细胞
随着生活水平的提高,超重并且肥胖的人越来越多,各类高脂高糖高蛋白食物的风靡,肥胖正以一股流行趋势在人群中蔓延。肥胖伴随着一些疾病的发生,如糖尿病、高血脂、心脑血管疾病、脂肪肝等,因此,肥胖现已受到科学家和医学界的广泛关注[1]。人体内的脂肪细胞数量增多和体积增大,或者只存在其中一种状况,致使身体内的脂肪增多,就会产生肥胖[2]。现今,世界卫生组织已将肥胖确认为一种疾病。研究表明,肥胖与许多慢性疾病包括高血压、糖尿病、心脑血管疾病等有着非常密切的联系,因此肥胖者相对于正常人患这些疾病的概率大大增加[3]。
哺乳动物体内主要分为白色脂肪组织(white adipose tissue,WAT)和褐色脂肪组织(brown adipose tissue,BAT)。“米色脂肪”是在白色脂肪和肌肉中存在的一种诱导性棕色脂肪,亦称为beige或brite。产热基因线粒体解偶联蛋白1(uncoupling protein 1,UCP1)可以通过米色脂肪细胞表达,在特定条件下,如锻炼和寒冷刺激的诱发下,米色脂肪细胞会出现于白色脂肪组织中[4],该变化我们将其称为WAT的褐变。
中缅树鼩(Tupaiabelangeri)属攀鼩目(Scandentia)树鼩科(Tupaiidae),是在热带和亚热带地区分布的一种小型哺乳动物。我国现有中缅树鼩一种,其主要在云南、四川西南部、西藏东南部、贵州、广西、海南等地分布[5]。中缅树鼩列为实验动物模型,主要依据有:1)树鼩是小型哺乳动物,繁殖速度快,易饲养,进化程度高[6-7];2)该物种分布于我国的亚热带地区,具有其适应环境的独特生理生态学特征;3)中缅树鼩和灵长类具有较近的亲缘关系,因此具有建立人类重大疾病如肥胖模型的潜力。为了预防肥胖,研究肥胖以及其与多类慢性疾病之间的关系,要对肥胖与非肥胖之间进行研究[3]。现在关于中缅树鼩脂肪组织[8]的研究报道相对较少,因此,本研究通过饲喂中缅树鼩高脂高糖食物,探讨树鼩在高脂高糖食物下的脂肪组织的形态学变化,使用中缅树鼩的WAT和 BAT[9-12]分别制备苏木素-伊红切片、免疫组织化学染色切片、免疫荧光染色切片,观察WAT和BAT在高脂高糖食物催肥作用下是否存在可塑性转变,寻找WAT中米色脂肪细胞的科学依据[13-15],为中缅树鼩WAT、BAT研究提供形态学的基础材料。
1 材料和方法
1.1 实验动物及饲养
中缅树鼩30只,雌雄各半,清洁级,非繁殖期成年个体,体重差异不显著,购自中国医学科学院医学生物学研究所灵长类研究中心。动物在云南师范大学生命科学学院动物饲养房饲养,每一只动物均采用单笼室温饲养(饲养笼的规格长宽高:120 mm×200 mm×300 mm)。
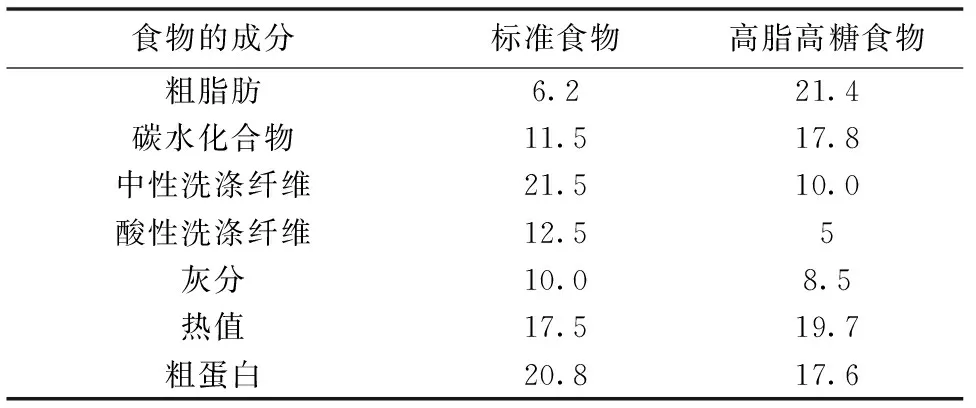
表1 饲养食物组成成分(所占干物质重量的百分比)
1.2 实验用品
实验器材与仪器:恒温箱、石蜡切片机、解剖器械、载玻片、普通光学显微镜、荧光显微镜等。
实验试剂:4%多聚甲醛,40%乙醇,80%乙醇,90%乙醇,95%乙醇,无水乙醇,二甲苯,苏木素染色液,伊红染液,过氧化氢,封闭用正常羊血清,封闭用正常驴血清,DAB显色液,抗淬灭封片剂(含DAPI),PBS,PV9000试剂盒等(免疫组织化学染色切片与免疫荧光染色切片使用的UCPl抗体均购于Abcam公司)。
实验材料:中缅树鼩褐色脂肪组织和白色脂肪组织。
1.3 样品采集与处理
分别将对照组、高脂高糖食物诱导28 d组、高脂高糖食物诱导49 d组中缅树鼩断颈处死,无菌操作下取样:在腋下,用剪刀剪取树鼩的褐色脂肪组织;在腹部皮下,剪取白色脂肪组织。切取的组织块不宜太大,以便固定剂穿透,常以5 mm×5 mm×2 mm或10 mm×10 mm×2 mm为宜。取下所需要的脂肪组织,切成 2~3 mm厚的一小块,放于装有生理盐水的培养皿中,用生理盐水冲洗干净,用滤纸将水分吸干,将脂肪组织样品放入4%的多聚甲醛溶液中,以备制作切片,剩余样品放入PBS中,用于进行流式细胞分析。
1.4 石蜡切片制备
洗涤:放入包埋盒中的材料固定后,用清水冲洗组织24 h,以除去多聚甲醛。
脱水:由于固定后的组织中的水分不能与石蜡这种非水溶性的物质融合,因此在浸蜡前必须用脱水剂除去组织内的水分。其步骤如下:80%乙醇(8 h)→90%乙醇(过夜,≥12 h) →95%乙醇I(l h,如果组织较小30 min即可) →95%乙醇Ⅱ(30~60 min) →无水乙醇I(30~60 min) →无水乙醇Ⅱ(15~30 min)。
透明:二甲苯I(30~60 min),二甲苯Ⅱ(15~20 min)。
透蜡:将透明好的组织块置入在温箱内已熔化的58℃~60℃石蜡内,共2杯蜡,第1杯蜡1 h,第2杯蜡4 h,使之逐步排出组织中的透明剂二甲苯,让石蜡易于渗入。
包埋:将过滤好的新蜡倾入包埋器中,尽快将浸透蜡的组织块放到里面。将组织块的切面朝下,组织与蜡之间不能留有空隙,组织力求摆正摆平,尽量与包埋器底板接触,最后放上标纸。
连续切片:用石蜡切片机将石蜡块切成5 μm厚的切片。
贴片:切好的石蜡组织片先放入40%酒精中,再转入约40℃度的温水中。最后再用经过多聚赖氨酸包被处理的载玻片将组织切片捞起并贴附于载玻片上。
烤片:将石蜡切片完毕的载玻片放置于载玻片架上,在60℃烤箱烘烤过夜。
1.5 苏木素—伊红染色切片制备
常规脱蜡、水化:二甲苯I 10 min→二甲苯Ⅱ10 min→无水乙醇10 min→95%乙醇5 min→90%乙醇5 min→80%乙醇5 min→70%乙醇5 min→蒸馏水I 5 min→蒸馏水Ⅱ5 min; 0.01 mol/L PBS、蒸馏水分别洗涤3次,5 min 1次;滴加苏木素染色液,室温孵育2 min;蒸馏水洗去浮色,1%盐酸酒精分化2 s;蒸馏水终止分化;滴加伊红染色液,室温孵育1 min;蒸馏水终止显色10 min;梯度酒精脱水,75%乙醇(10 min)→80%乙醇(10 min)→85乙醇(10 min)→90%乙醇(10 min)→100%乙醇(10 min)→100%乙醇(10 min);二甲苯透明,30 min;中性树胶封片,光学显微镜下观察显色结果并拍照。
1.6 免疫组织化学染色切片制备
常规脱蜡、水化:二甲苯I 10 min→二甲苯Ⅱ10 min→无水乙醇10 min→95%乙醇5 min→90%乙醇5 min→80%乙醇5 min→70%乙醇5 min→蒸馏水I 5 min→蒸馏水Ⅱ5 min。0.01 mol/LPBS、蒸馏水分别洗涤3次,5 min 1次。3%过氧化氢封闭,避光,室温孵育30 min。0.01 mol/L PBS洗涤3次,5 min 1次。用滤纸将切片周围的水分吸干后,用组化笔在切片周围画圆圈,防止后续染色过程中液体漏出。5%羊血清室温封闭60 min,去除多余液体。加一抗,4℃冰箱过夜,37℃复温45 min。0.01 mol/L PBS洗涤4次,5 min 1次。滴加PV9000 试剂Ⅰ,37℃孵育30 min。0.01 mol/L PBS洗涤3次,5 min 1次。滴加PV9000试剂Ⅱ,37℃孵育30 min。0.01 mol/LPBS洗涤4次,5 min 1次。配制DAB显色液,1 mL buffer中,加入50 μL DAB底物,混匀后,避光暂存,现用现配。每张组织切片上滴加100 μL DAB显色液,室温避光孵育5 min。蒸馏水终止显色10 min。梯度酒精脱水,75%乙醇(10 min)→80%乙醇(10 min)→85乙醇(10 min)→90%乙醇(10 min)→100%乙醇(10 min)→100%乙醇(10 min)。二甲苯透明,30 min。中性树胶封片,光学显微镜下观察显色结果并拍照。
1.7 免疫荧光染色切片制备
常规脱蜡、水化:二甲苯I 10 min→二甲苯Ⅱ10 min→无水乙醇10 min→95%乙醇5 min→90%乙醇5 min→80%乙醇5 min→70%乙醇5 min→蒸馏水I 5 min→蒸馏水Ⅱ5 min;0.01 mol/L PBS、蒸馏水分别洗涤3次,5 min 1次;5%驴血清室温封闭60 min,去除多余液体;加入PV9000试剂盒中的一抗,4℃冰箱过夜,37℃复温45 min;0.01 mol/L PBS洗涤4次,5 min 1次;加入合适浓度的PV9000试剂盒中的荧光标记二抗,避光、室温孵育2 h;0.01 mol/LPBS洗涤4次,5 min 1次;蒸馏水避光洗涤3次,5 min 1次;用滤纸将多余的水滴吸取,每张组织片上滴加50 μL的抗淬灭封片剂(含DAPI),避光,室温孵育5 min;加装无菌清洁的盖玻片,避光、待稍阴干后,立即在荧光显微镜下观察结果拍照。
2 结果
2.1 苏木素—伊红染色切片
从对照组、高脂高糖食物28 d组、高脂高糖食物49 d组的中缅树鼩腹部皮下白色脂肪组织苏木素-伊红染色切片中(图 1)可以看出对照组为典型的单泡脂肪细胞,细胞中央有一大脂滴。在切片中可以发现,高脂高糖食物诱导28 d时,单泡脂肪细胞中分化出少量具有小脂滴的多泡脂肪细胞。而在高脂高糖食物诱导49 d时,更多具有小脂滴的多泡脂肪细胞出现。这说明在高脂高糖食物下,中缅树鼩白色脂肪细胞的形态发生了改变,多泡脂肪细胞的增加导致白色脂肪组织增多。
在中缅树鼩腋下褐色脂肪组织苏木素-伊红染色切片中(图 2)可以发现,随着实验的进行,与对照组相比,在28 d时实验组中缅树鼩腋下褐色脂肪细胞中脂肪滴直径明显变大,且分布的褐色脂肪细胞脂滴排列相对疏松。在49 d时,实验组中缅树鼩腋下褐色脂肪细胞中细胞脂滴相较于28 d组有着更多脂肪滴直径变大的细胞出现,因此排列更疏松,猜测其有往白色脂肪细胞发展的趋势。
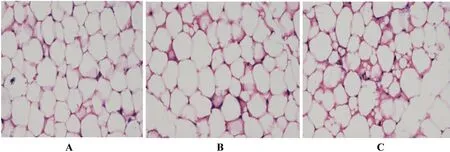
图1 中缅树鼩腹部皮下白色脂肪组织苏木素-伊红染色切片
A:对照组中缅树鼩腹部皮下白色脂肪组织形态(×200);B:高脂高糖食物28 d组中缅树鼩腹部皮下白色脂肪组织形态(×200);C:高脂高糖食物49 d组中缅树鼩腹部皮下白色脂肪组织形态(×200)
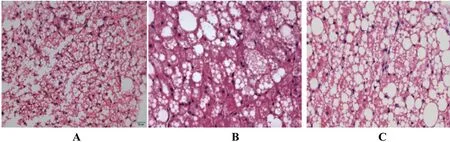
图 2中缅树鼩腋下褐色脂肪组织苏木素-伊红染色切片
A:对照组中缅树鼩褐色脂肪组织形态(×200);B:高脂高糖食物28 d组中缅树鼩褐色脂肪组织形态(×200);C:高脂高糖食物49 d组中缅树鼩褐色脂肪组织形态(×200)
2.2 免疫组织化学染色切片
在中缅树鼩腹部皮下白色脂肪组织免疫化学染色切片中(图 3)可以观察到,与对照组相比,28 d中缅树鼩腋下白色脂肪组织中UCP1表达有部分黄褐色区域,49 d白色脂肪组织中UCP1表达的黄褐色区域非常少。这表明,随着实验的进行,实验组开始出现UCP1表达增加产热,在49 d时UCP1表达区域减少,产热减少。白色脂肪细胞被UCP1抗体表达显现黄褐色区域,这是属于褐色脂肪细胞的特征,因此,推测阳性区域UCP1表达的部分为米色脂肪细胞。猜测中缅树鼩在高脂高糖食物的喂养下产生的肥胖可以诱发树鼩腹部大网膜的米色脂肪细胞的出现。

图3 中缅树鼩腹部皮下白色脂肪组织免疫化学染色切片
A:对照组中缅树鼩腹部皮下白色脂肪组织形态(×200);B:高脂高糖食物28 d组中缅树鼩腹部皮下白色脂肪组织形态(×200);C:高脂高糖食物49 d组中缅树鼩腹部皮下白色脂肪组织形态(×200)
在中缅树鼩腋下褐色脂肪组织免疫化学切片中(图 4),28 d中缅树鼩腋下褐色脂肪组织中UCP1表达的黄褐色区域较多,随着高脂高糖食物诱导时间的延长,同一组织部位的UCP1阳性黄褐色面积减小,且颜色变浅,说明中缅树鼩在长胖期间产热增加,UCP1表达量增加,但肥胖后产热减少,UCP1表达量也减少。
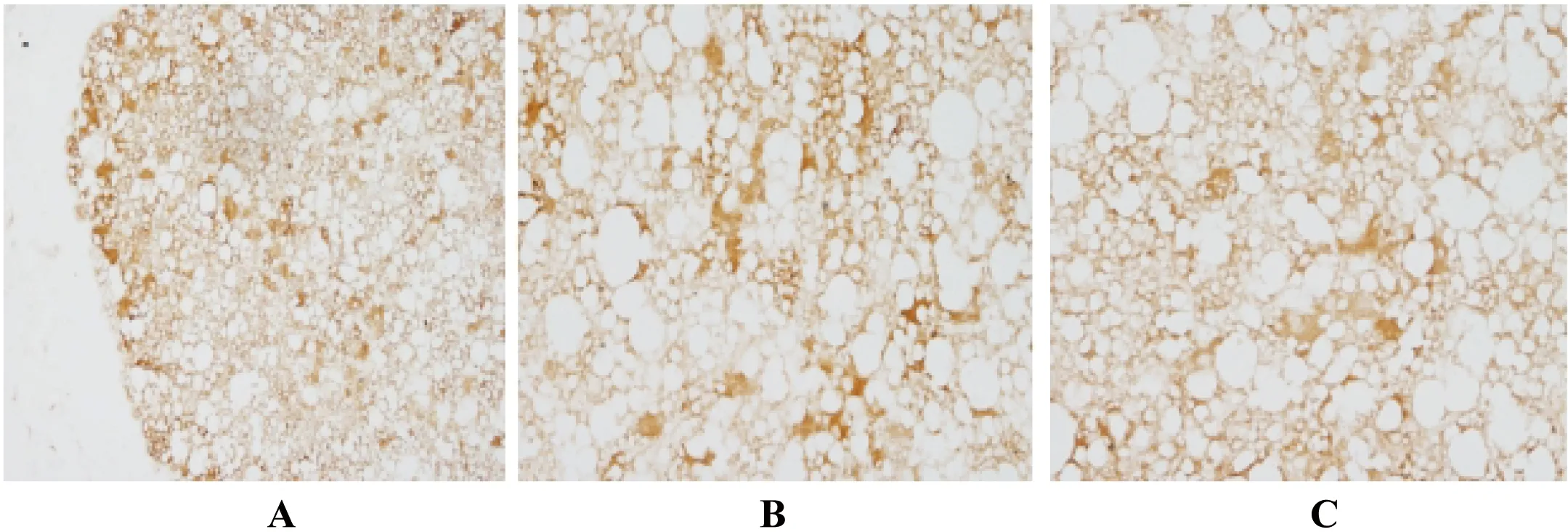
图4 中缅树鼩腋下褐色脂肪组织免疫化学染色切片
A:对照组中缅树鼩褐色脂肪组织形态(×200);B:高脂高糖食物28d组中缅树鼩褐色脂肪组织形态(×200);C:高脂高糖食物49d组中缅树鼩褐色脂肪组织形态(×200)
2.3 免疫荧光染色切片
从中缅树鼩腹部皮下白色脂肪组织免疫荧光染色切片中可以看到(图 5),对照组与高脂高糖实验49 d组白色脂肪组织中UCP1阳性红色荧光较少且暗淡,而高脂高糖实验28 d组腹部大网膜的白色脂肪组织中发现一些UCP1阳性红色荧光的椭圆点,很有可能是线粒体中UCP1的表达。这些细胞可能是高脂高糖食物诱导的米色脂肪细胞。此结果与免疫组织化学染色切片的结果相同。
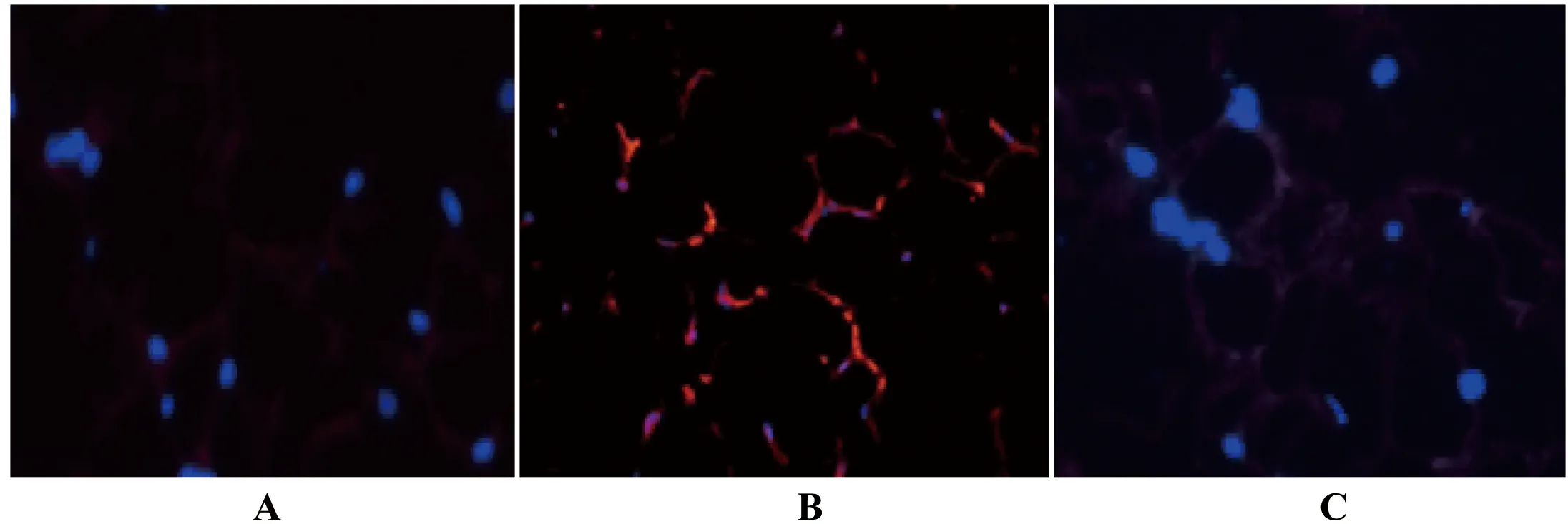
图5 中缅树鼩腹部皮下白色脂肪组织免疫荧光染色切片
A:对照组中缅树鼩腹部皮下白色脂肪组织形态(×200);B:高脂高糖食物28 d组中缅树鼩腹部皮下白色脂肪组织形态(×200);C:高脂高糖食物49 d组中缅树鼩腹部皮下白色脂肪组织形态(×200)
中缅树鼩腋下褐色脂肪组织免疫荧光染色切片中(图 6),高脂高糖实验28 d组腋下褐色脂肪组织中发现较多UCP1阳性红色荧光的椭圆点,这是线粒体中UCP1的表达。对照组与实验组49 d腋下褐色脂肪组织中的UCP1表达都相对较少。这表明,高脂高糖食物增加了树鼩褐色脂肪组织UCP1的表达,但过于肥胖的情况下,产热开始减少,同免疫组织化学染色切片的结果相同。本实验对中缅树鼩脂肪组织形态的研究中,已切出了米色脂肪细胞的形态学切片,也证明了高脂高糖食物可以诱导产热。

图 6中缅树鼩腋下褐色脂肪组织免疫荧光染色切片
A:对照组中缅树鼩褐色脂肪组织形态(×200);B:高脂高糖食物28 d组中缅树鼩褐色脂肪组织形态(×200);C:高脂高糖食物49 d组中缅树鼩褐色脂肪组织形态(×200)
3 讨论
近年已发现,除了WAT和BAT,WAT中的米色脂肪细胞(beige cell)同样能够进行产热,米色脂肪细胞和棕色脂肪细胞关键区别在于,棕色脂肪细胞表达高水平UCP1,而米色脂肪细胞通常低表达UCP1[4]。BAT能通过消耗多余的脂肪、葡萄糖产热,有改善代谢、抵抗肥胖的作用,因此BAT的这一性质,可以为人类治疗肥胖、代谢综合征等病找到新出路。动物实验已经发现BAT的活性降低能够增加肥胖[16],人体研究中发现肥胖与BAT减少有关[17-18]。
单纯性肥胖是消耗低于机体内热量的摄入,导致体内聚集过多的脂肪,体重过重的症状[19]。从细胞水平看脂肪组织,脂肪细胞数目的增加和体积变大将产生肥胖[20]。本实验通过对正常组、实验组中缅树鼩的脂肪组织苏木素-伊红染色切片、免疫化学染色切片以及免疫荧光染色切片的比较,得出以下结论:1)高脂高糖食物28 d肥胖组树鼩的WAT中存在米色脂肪细胞;2)WAT中存在UCP1的表达,WAT可以增加其适应性产热;3)中缅树鼩在高脂高糖食物作用下,BAT中UCP1表达量会增加,但是随着实验时间的延长,UCP1表达量减少;4)随着实验的进行,BAT中细胞脂滴直径变大,排列更疏松,猜测其有往白色脂肪细胞发展的趋势。
在给中缅树鼩喂以高热量食物时,中缅树鼩的BAT产热能力会相应增强,这与食物诱导产热假说相一致[21]。中缅树鼩脂肪细胞在高脂高糖食物作用下会发生形态改变,小脂滴的多泡脂肪细胞大量出现,脂肪滴直径明显变大。WAT与BAT在28 d时UCP1阳性表达增强,这也说明高热量食物对产热的诱导作用。当49 d时UCP1阳性表达减少这可能是因为当动物过于肥胖时,动物的产热会减少,虽然囤积了大量脂肪,但是肥胖者机体将食物转变为热能的效率低下,因此其产热效率也降低。
[1]孙 志,张中成,刘志诚.营养性肥胖动物模型的实验研究[J].中国药理学通报, 2002,18(4):466-467.
[2]PRENTICE A M. Obesity and its potential mechanistic basis[J].British Medical Bulletin, 2001, 60:51-67.
[3]谭正怀,莫正纪. 三种肥胖动物模型研究概况[J]. 中国实验动物学志,2001,11(3):176-179.
[4]WU J, BOSTR M P, SPARKS L M, et a1. Beige adipoeytes are a distinct type of thermogenic fat cell in mouse and human[J]. Cell, 2012, 150(2):366-376.
[5]王应祥,李崇云,马世来.树鼢的分类与生态.树朐生物学[M].昆明:云南科技出版社,1991:2l-70.
[6]陈 瑾, 代解杰,孙晓梅.树鼩肝炎动物模型的研究进展 [J]. 中国比较医学杂志, 2008,18(2): 59-62.
[7]CHEN L L, SHEN P Q, LIU R W, et al. Several commonly used blood collection methods for tree shrews in experiments [J]. J Region Anat Oper Surg, 2009, 18(4): 223-224.
[8]周 显.脂肪组织制片的改良方法[J].临床与实验病理学杂志,2009,25(2):216-217.
[9]FRONTINI A, CINTI S. Distribution and development of brown adipocytes in the murine and human adipose organ[J]. Cell Metab, 2010, 11(4): 253-256.
[10]ALIMIND K, MANIERI M, SIVITZ W I, et al. Ectopic brown adipose tissue in muscle provides a mechanism for differences in risk of metabolic syndrome in mice[J]. Proc Natl Acad Sci USA, 2007, 104(7):2366-2371.
[11]ROSEN E D, SPIEGELMAN B M. Adipocytes as regulators of energy balance and glucose homeostasis[J]. Nature, 2006, 444(7121): 847-853.
[12]SPIEGELMAN B M, FLIER J S. Obesity and the regulation of energy balance[J]. Cell, 2001,104(4):531-543.
[13]CINTI S. The role of brown adipose tissue in human obesity[J]. Nutr Metab Cardiovasc Dis, 2006, 16(8): 569-574.
[14]ISHIBASHI J, SEALE P. Medicine. Beige can be slimming[J]. Science, 2010, 328(5983):1113-1114.
[15]SCHULZ T J, HUANG T L, TRAN T T, et al. Identification of inducible brown adipocyte progenitors residing in skeletal muscle and white fat[J]. Proc Natl Acad Sci U S A, 2011,108(1):143-148.
[16]CYPESS A M, KAHN C R. Brown fat as a therapy for obesity and diabetes[J].Curr Opin Endocrinol Diabetes Obes, 2010, 17(2):143-149.
[17]SACKS H, SYMONDS M E. Anatomical locations of human brown adipose tissue: functional relevance and implications in obesity and type 2 diabetes[J]. Diabetes, 2013, 62(6):1783-1790.
[18]FELDMANN H M, GOLOZOUBOVA V, CANNON B, et al. UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality[J]. Cell Metab, 2009, 9(2):203-209.
[19]孙岚云. 针剌配合耳穴按压治疗单纯性肥胖病疗效分析[J].针刺研究,2000,25(4):302-304.
[20]张 淼, 罗伟生. 肥胖形成的饮食因素及中医药治疗肥胖的研究进展[J]. 中医研究, 2003, 16(2):54-56.
[21]ROTHWELL N J. Effects of interleukin 1b in the rat[J]. Am J Physiol, 1989 (19): 111-115.
HistomorphologycomparisonofadiposetissuesinTupaiabelangeriwithhigh-glucose-fat-diet
ZUO Mu-lin1,2, BAI Chun-ling3, ZHU Wan-long1, DONG Xin-yi3, ZENG Tian-lei4, WANG Zheng-kun1
(1. Key Laboratory of Colleges and Universities on Ecosystems of Southwestern Mountain and Ecological Adaptive Evolution and Protection of Animals-plants in Yunnan Province, School of Life Sciences, Yunnan Normal University, Kunming 650500; 2. Zhen Xiong Middle School Attached to YunNan Normal University, Zhaotong 657200;3. Experiment Center for Medical Science Research, Kunming Medical University, Kunming 650500;4. First Middle School of Shuifu, Zhaotong 657800, China)
This work focused on histological study on adipose tissue inTupaiabelangeriby paraffin section, HE staining, immunohistochemistry and immunofluorescence staining. The results showed that the morphological changes of adipocytes in theTupaiabelangeriwere observed under the action of high-glucose-fat-diet, and the large number of adipocytes of small fat droplets appeared, and the diameter of fat droplets became larger. The expression of UCP1 was increased at 28 d, and decreased at 49 d after exposure to white adipose tissue and brown adipose tissue. This study showed that there was beige in white adipose tissue, high-glucose-fat-diet had an induction of heat production, too obese, and the animal′s heat will be reduced.
Tupaiabelangeri; high-glucose-fat-diet; adipose tissue; beige
2016-11-14;
2016-11-23
十二五科技支撑项目(2014BAI01B00);国家自然科学基金项目(No.31660121);云南省科技计划项目(2015GA008);云南省应用基础研究计划重点项目(No. 2016FA045)
左木林,硕士研究生,主要从事动物生理生态学研究,E-mail:83984795@qq.com;柏春玲,助理实验师,研究方向为细胞生物学;左木林和柏春玲为并列第一作者
王政昆,教授,研究方向为动物生理生态,E-mail:wangzk_123@163.com
10.3969/j.issn.2095-1736.2017.06.046
Q955
A
2095-1736(2017)06-0046-05

