塔里木马鹿胎儿性别鉴定
李超程 ,赵喜堂 ,杜迎春 ,孙丽荣 ,蒋松 ,刘明达 ,营瑞文 ,魏丽敏 ,贾斌 *
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆生产建设兵团第二师34团,新疆 库尔勒 841506;3北京市水生野生动植物救护中心,北京 102100;4通辽市农畜产品质量安全中心,内蒙古 通辽 028000)
塔里木马鹿胎儿性别鉴定
李超程1,赵喜堂2,杜迎春3,孙丽荣4,蒋松1,刘明达1,营瑞文1,魏丽敏1,贾斌1*
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆生产建设兵团第二师34团,新疆 库尔勒 841506;3北京市水生野生动植物救护中心,北京 102100;4通辽市农畜产品质量安全中心,内蒙古 通辽 028000)
为建立一种简单、准确的塔里木马鹿早期胎儿性别鉴定新方法,本研究利用妊娠马鹿血浆中胎儿游离的DNA为模板,通过常规PCR扩增牙釉蛋白特异序列,对89头妊娠12-14周龄塔里木马鹿进行胎儿性别鉴定,鉴定结果与实际产犊性别进行比较。结果表明:成功从X染色体上扩增出282 bp的片段,从Y染色体上扩增出252 bp的特异性片段;89头妊娠母鹿胎儿检测结果显示,50头为公,39头为母,与实际产仔性别比对后,鉴定准确率为91.01%。由此可知,利用胎儿游离DNA和牙釉蛋白基因对塔里木马鹿进行早期胎儿性别鉴定,方法简单且准确率高。
胎儿性别鉴定;塔里木马鹿;牙釉蛋白;PCR
由于性别在家畜经济性状中的重要影响,性别鉴定与性别控制技术的相辅相成对畜牧业生产有着重要意义[1]。马鹿作为以雄性产茸为主要经济收入的经济动物,对子代性别的要求尤为突出,所以利用妊娠马鹿血浆中胎儿游离DNA对胎儿进行性别鉴定,在生产中价值重大,因此,这对PCR技术和DNA提取技术的改进提出了更高要求。早期PCR性别鉴定实验,仅针对Y染色体短臂独有的性别决定基因(如睾丸决定因子SRY基因)设计引物[2],此类方法无内参引物参照,普遍存在假阴性问题,随后虽通过双重或多重PCR加入内参引物改进,但过程相对复杂繁琐。
牙釉蛋白(amelogenin,AMEL)是 XY染色体上 1对不同多态性的等位基因(AMEL-X/AMEL-Y)。1992年Gibson等[3]对牛AMEL基因进行克隆、测序、分析后发现,AMEL-Y基因相对于AMEL-X少21个氨基酸,同时还有13个氨基酸不同。AMEL-X与AMEL-Y基因的cDNA具有93%的同源性,而它们的第五内含子却只有45.1%的同源性。1993年Sullivan等[4]成功利用AMEL基因引物扩增进行人的性别鉴定。随后Buel等[5]、Chen 等[6]、Zeleny 等[7]、Sembon 等[8]、Hasegaw等[9]等,Pfeiffer等[10]采用 1对AMEL引物扩增对牛、猪、马和绵羊本身性别鉴定均获得成功。这些研究说明相对于单独设计Y染色体上特异性基因,AMEL基因在雌雄性别之间存在不同多态性,无需引入内参引物即可进行性别鉴定。
虽然有关AMEL基因对性别鉴定的报道最早见于1993年[4],但对妊娠母体血液中胎儿游离DNA的性别鉴定由于其浓度和纯度的原因,直到2005年才初见Zhu等[11]在孕妇身上的报道,随后由于其无创伤性特点,在不同动物中得到广泛应用。目前仅有Pfeiffer等[10]和Gurgul等[12]利用AMEL基因鉴定马鹿本身性别,而利用AMEL基因和胎儿游离DNA对妊娠马鹿进行胎儿性别鉴定的研究未见报道。据报道,妊娠母体血浆中胚胎游离DNA浓度在妊娠3个月时达到最高水平[13],且长度一般为200-300 bp小片段。
本实验选择采集妊娠12-14周龄母鹿血样,通过血浆小片段DNA提取和富集试剂盒,以获取妊娠马鹿血浆中胎儿游离的DNA,并以其为模板,采用常规PCR技术扩增AMEL基因进行了胎儿性别鉴定,旨在研究和探讨更为简单、准确的妊娠马鹿胎儿性别鉴定新方法。
1 材料与方法
1.1 材料
1.1.1 血浆
89头妊娠母鹿及青年空怀母鹿、青年公鹿阴阳性对照血样均采自新疆兵团第二师某团鹿场,颈静脉采血8-12 mL,肝素钠抗凝,4 h内,2000 r/min离心10 min,分离出血浆1.5 mL,离心管分装后4℃保存备用。
1.1.2 主要试剂
DNA提取试剂盒QIAamp DNA Mini Kit购自美国凯捷公司,PCR反应试剂2×Taq PCR Master Mix购自北京天根生化有限公司,DNA Mark I购自北京天根生化有限公司。
1.2 方法
1.2.1 DNA的提取
妊娠母鹿血浆中胎儿游离DNA浓度相对较低,降解较快,应在采样后6-8 h内提取。阴阳性对照组(青年空怀母鹿、青年公鹿)及实验组妊娠母鹿血浆DNA由QIAamp DNA Mini Kit DNA试剂盒提取,同时适当改进以提高浓度,改进内容包括:分装后1.5 mL离心管中血浆先进行低速离心,吸取离心管下层血浆用以提DNA;过吸附柱时对DNA进行富集;减少AE洗脱液用量。所提取的DNA平均浓度为 8 μg/μL。
1.2.2 马鹿AMEL基因PCR扩增
马鹿AMEL基因引物参照文献[12],由上海生工生物工程有限公司合成工合成。设置阳性对照(公鹿血浆DNA)、阴性对照(母鹿血浆DNA),空白对照(超纯水),20 μLPCR反应体系中加入:DNA模板1 μL,2×PCR Mix 10 μL,去离子水 8 μL,上游引物(5'-AGTTCCTGGCCAACACTC-3')0.5 μL(100μmol/L),下游引物(5'-GCTGGC-CAAGCTTCCAGA-3')0.5 μL(100 μmol/L);PCR 扩增条件为:95 ℃预变性5 min,94 ℃变性30 s,60 ℃退火温度,退火 30 s,72℃延伸2 min,循环数为38;72℃延伸10 min。
2 结果与分析
2.1 对照组DNA的性别鉴定结果
马鹿AMEL基因序列的扩增片段长度:雌性马鹿有282 bp的特异性扩增片段,作为阴性对照;雄性马鹿同时具有282和252 bp 2条特异性扩增片段,作阳性对照。扩增AMEL基因序列的特异性片段,经2%琼脂糖凝胶电泳,EB染色,结果见图1。

图1 马鹿血浆中DNA PCR扩增AMEL基因雌雄特异性片段结果Fig.1 The specific fragment of AMEL gene amplification in cervus elapghus plasma DNA
2.2 母鹿血浆中胎儿游离DNA的性别鉴定结果
本实验共鉴定89头妊娠母鹿胎儿,其中50头为公,39头为母,部分鉴定结果(图2)显示,泳道7、9、10、14:与阳性对照相同,有 2条特异性 AMEL引物扩增片段,表明胎儿性别为雄性,泳道 5、6、8、11、12、13、15、16:与阴性对照相同,有 1条特异性AMEL引物扩增片段,表明胎儿性别为雌性。
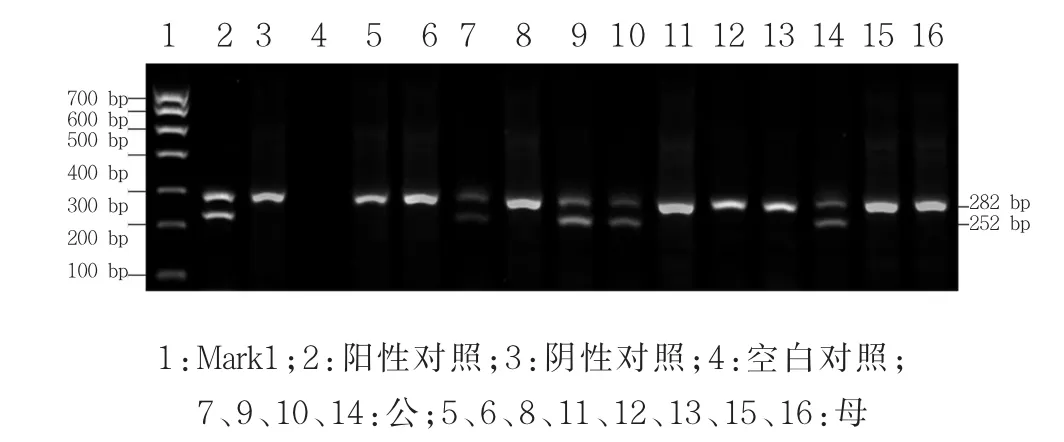
图2 血浆DNA AMEL引物扩增的特异性产物检测结果Fig.2 The specific fragment of AMEL primer amplification products in plasma DNA
2.3 鉴定结果与实际性别比对结果
89头妊娠母鹿配种时间为每年9月20日左右,采血时间为次年2月,实际产犊时间为6-7月。本实验对所采集89头份妊娠母鹿血浆进行胎儿性别鉴定后,与实际产仔性别进行比对,鉴定准确率为91.01%,结果见表1。

表1 鉴定性别与实际性别对比结果统计表Tab.1 The statistical results of detection and actual for gender
3 讨论
长期以来性别鉴定为解决只针对一种性别特异性基因(如Y染色体SRY基因)扩增而产生的假阴性问题,通常采用双重PCR、多重PCR、巢式PCR等复杂方法。本实验AMEL基因通过常规PCR扩增,雌雄个体都拥有不同的扩增产物,无需加入内参引物就能解决常用SRY基因假阴性问题,不仅简化了检测方法,同时也避免多重PCR扩增中引物、底物等的交互竞争,准确性和灵敏度都会有所提高[3]。幸宇云等[14]报道AMEL基因引物灵敏度比SRY基因高出8-10倍,本实验在选择AMEL基因在简化PCR过程的同时,也降低了对胎儿游离DNA浓度的要求。
由于妊娠母畜血浆中胎儿游离DNA的量极少,且在血浆中降解速度较快[15],依照传统方法对血浆中胎儿游离DNA提取的浓度和纯度低,导致AMEL基因胎儿性别鉴定准确率降低[16],这是常规方法长期以来无法较好应用的另一重要原因。本实验中发现,从采血后4℃保存6 h和24 h,血浆中提取的胎儿游离DNA,利用相同方法得到的琼脂糖电泳图结果不同,6 h组雄性252 bp条带清晰而24 h组模糊,此现象与席继锋等[16]在利用AMEL基因对奶牛进行早期胚胎鉴定时所获得条带模糊且不稳定的结果相似,同时李勤等[17]报道血浆中胎儿游离DNA占总DNA比重从6 h的10.3%降至36 h的3.0%,由此可以推断母体免疫系统存在促使血浆中胎儿游离细胞凋亡和胎儿DNA降解机制[18],所以提高所提取胎儿DNA浓度关键之一是血浆分离后于最短时间内提取DNA。
AMEL基因在塔里木马鹿上的成功扩增与较高浓度、纯度血浆胎儿游离DNA的提取,为鉴定妊娠塔里木马鹿胎儿性别提供了一种简单准确的新方法,但此方法仍有改进空间。本实验鉴定结果与实际结果比对后发现,虽然AMEL基因可简单有效地解决SRY基因需要复杂PCR技术才能解决的假阴性问题,但其仍未解决由于母体DNA背景造成的空胎被误测为雌性胎儿问题。因此,如果想要建立鉴定准确率更高的方法,母体背景DNA是最后的阻碍。有报道[19]称血浆中胎儿游离DNA片段长度一般小于313 bp。母体背景DNA片段长度一般大于313 bp,所以解决此问题的一个可行性方法就是特异性富集片段长度小于300 bp的DNA分子,提高血浆中胎儿游离DNA浓度,相对降低母体DNA浓度,从而间接解决背景过高造成空胎鉴定结果为阴性的问题,不过目前国际上主要通过琼脂糖凝胶电泳法富集胎儿游离DNA,但此方法操作时间长、精确度低,并且产物极易被污染,所以此类问题还有待于进一步研究。
[1]宁孟影,孙丽荣,张永生,等.猪Zfx基因RNAi载体筛选及性控效果的观察[J].石河子大学学报(自然科学版),2015,33(2):192-195.Ning M Y,Sun L R,Zhang Y S,et al.Construction of RNAi vecters of swine Zfx gene and their effects on sexual control[J].Journal of Shihezi University(Natural Science),2015,33(2):192-195.
[2]Chrenek P,Boulanger L,Heyman Y,et al.Sexing and multiple genotype analysis from a single cell of bovine embryo[J].Theriogenology,2001,55(5):1071-1081.
[3]Gibson C W,Golub E E,Abrams W R,et al.Bovine amelogenin message heterogeneity:alternative splicing and Y-chromosomal gene transcription[J].Biochemistry,1992,31(35):8384-8388.
[4]Sullivan K M,Mannucci A,Kimpton C P,et al.A rapid and quantitative DNA sex test:fluorescence-based PCR analysis ofX-Y homologousgene amelogenin[J].Biotechniques,1993,15(4):636-638,640-641.
[5]Buel E,Wang G,Schwartz M.PCR amplification of animal DNA with human X-Y amelogenin primers used in gender determination[J].J Forensic Sci,1995,40(4):641-644.
[6]Chen C,Hu C L,Wang C H,et al.Gender determination in single bovine blastomeres by polymerase chain reaction amplification of sex-specific polymorphic fragments in the amelogenin gene[J].Mol Reprod Dev,1999,54(3):209-214.
[7]Zeleny R,Bernreuther A,Schimmel H,et al.Evaluation of PCR-based beef sexing methods[J].J Agric Food Chem,2002,50(15):4169-4175.
[8]Sembon S,Suzuki S,Fuchimoto D,et al.Sex identification of pigs using polymerase chain reaction amplification of the amelogenin gene[J].Zygote,2008,16(4):327-332.
[9]Hasegaw T,Sato F,Ishida N,et al.Sex determination by simultaneous amplification of equine SRY and amelogenin genes[J].J Vet Med Sci,2000,62(10):1109-10.
[10]Pfeiffer I,Brenig B.X-and Y-chromosome specific variants of the amelogenin gene allow sex determination in sheep(Ovis aries)and European red deer(Cervus elaphus)[J].BMC Genet,2005,6(1):16.
[11]Zhu B,Sun Q W,Lu Y C,et al.Prenatal fetal sex diagnosis by detecting amelogenin gene in maternal plasma[J].Prenat Diagn,2005,25(7):577-81.
[12]Gurgul A,Radko A,Slota E.Characteristics of X-and Y-chromosome specific regions of the amelogenin gene and a PCR-based method for sex identification in red deer(Cervus elaphus)[J].Mol Biol Rep,2010,37(6):2915-2918.
[13]杨麒巍,于杉,张桂珍.孕妇外周血中游离胎儿DNA富集与分离方法及在无创性产前诊断中的应用[J].中国实验诊断学,2014,18(2):345-348.
[14]幸宇云,陈从英,黄路生,等.应用牙釉蛋白(AML)基因鉴别牛早期胎儿性别[J].农业生物技术学报,2005,13(6):759-762.Xing Y Y,Chen C Y,Huang L S,et al.Gender determination in bovine preimplantation embryosby amplification of amelogenin(AML)gene[J].Journal of Agricultural Biotechnology,2005,13(6):759-762.
[15]于韶荣,史美祺,刘宝瑞,等.全血分离时间对肠癌患者血浆游离DNA浓度的影响[J].成都医学院学报,2014,9(5):554-557.Yu S R,Shi M Q,Liu B R,et al.The influence of whole blood isolation time on plasma free DNA concentration in patients with intestinal cancer[J].Journal of Chengdu Medical College,2014,9(5):554-557.
[16]席继锋,王香祖,贾斌,等.PCR扩增妊娠奶牛牙釉蛋白基因进行胎儿性别鉴定的研究[J].中国奶牛,2011(14):1-4.Xi J F,Wang X Z,Jia B,et al.Study of embryo sex identification by PCR amplification for AML gene in pregnant dairy cows[J].China Dairy Cattle,2011(14):1-4.
[17]李勤,张毅,丁宇烽,等.孕妇血样采集后体外存放对血浆中胎儿游离DNA水平的影响[J].第二军医大学学报,2008,29(9):1042-1045.Li Q,Zhang Y,Ding Y F,et al.Influence of delay in bloodprocessing on the level of cell-free fetal DNA in maternal plasma sample[J].Academic Journal of Second Military Medical University,2008,29(9):1042-1045.
[18]蒋立斌.绵羊外周血中游离DNA应用于胎儿性别鉴定以及基因分型的初步研究[D].石河子:石河子大学,2014:5-10.
[19]Chan K C,Zhang A B,Hui N,et al.Size distributions of maternal and fetal DNA in maternal plasma[J].Clin Chem,2004,50(1):88-92.
Fetal sex identification ofCervus elaphus yarkandensis
Li Chaocheng1,Zhao Xitang2,Du Yingchun3,Sun Lirong4,Jiang Song1,Liu Mingda1,Ying Ruiwen1,Wei Limin1,Jia Bin1*
(1 College of Animal Science and Technology,Shihezi University,Shihezi,Xinjiang 832003,China;2 Farm No.34 of Agriculture Division No.2 of Xinjiang BINGTUAN,Kuerle,Xinjiang 841506,China;3 Beijing Aquatic Wildlife Rescue Center,Beijing 102100,China;4 Tongliao Agricultural and Livestock Products Quality and Safety Center,Tongliao,Inner Mongolia 028000,China)
To establish a simple and accurate method for the sex identification of theCervus elapghus yarkandensisearly fetal.The free DNA of fetal fetus as a template was used to amplify the enamel protein specific sequence by routine PCR,and then to identify the sex of 89 pregnantCervus elaphus yarkandensisfetuses with 12-14 weeks of age,finally the identification results and actual calving sex were compared in this study.The results showed that the 282 bp fragment was successfully amplified from X chromosome and 252 bp fragment was successfully amplified from Y chromosome;The fetal sex identification results of 89 pregnantCervus elapghusshowed that 50Cervus elapghuswere male and 39 were female.The identification accuracy was 91.01%,compared with the actual calving sex.Therefore,the plasma free DNA as the template,and the amelogenin gene can be used to identify the fetal sex,and the method is simple and high accuracy.
fetal sex diagnosis;Cervus elapghus yarkandensis;amelogenin;PCR
S825
A
10.13880/j.cnki.65-1174/n.2017.05.018
1007-7383(2017)05-0632-04
2017-02-25
新疆兵团动物疾病防控重点实验室开放基金课题项目(BTDJ04)
李超程(1991-),男,硕士研究生,专业方向为免疫遗传与抗病机理。
*通信作者:贾斌(1965-),男,教授,博士生导师,从事分子遗传与抗病育种研究,e-mail:jiabin@shzu.edu.cn。

