XIAP在尖锐湿疣组织中的表达及其与HPV分型的相关性
李晶,徐洪玉
(山东省交通医院 皮肤科,山东 济南 250031)
XIAP在尖锐湿疣组织中的表达及其与HPV分型的相关性
李晶,徐洪玉
(山东省交通医院 皮肤科,山东 济南 250031)
目的探讨X连锁凋亡抑制蛋白(XIAP)在尖锐湿疣组织中的表达及其与人乳头瘤病毒感染的关系。方法免疫组织化学方法分别检测尖锐湿疣和正常包皮组织中XIAP的表达,采用实时聚合酶链式反应体外扩增和反向点杂交相结合的DNA芯片技术对尖锐湿疣组织进行基因分型检测。结果正常包皮组、尖锐湿疣未复发组和复发组中XIAP的阳性表达率依次升高(分别是26.67%、53.49%和79.31%),3者之间两两比较,差异有统计学意义(P<0.05);XIAP在高危型HPV组与正常对照组的表达比较,差异有统计学意义(P<0.05),高危型HPV组高于对照组;在高危型与低危型组间、低危型与正常对照组间的表达比较,差异无统计学意义(P>0.05);XIAP在不同年龄及性别患者间的表达比较,差异无统计学意义(P>0.05);而患者不同的病程及复发次数,XIAP阳性表达率比较,差异有统计学意义(P<0.05)。结论尖锐湿疣组织中XIAP表达上调可能是其发生和复发的重要原因,XIAP在尖锐湿疣的恶性转化过程中可能起促进作用,对判断患者病情预后具有一定的参考价值。
尖锐湿疣;X连锁凋亡抑制蛋白;人乳头瘤病毒;复发;凋亡
凋亡抑制蛋白家族(inhibitor of apoptosis protein,IAP)是细胞内一类独特的抗凋亡蛋白家族,首先发现于杆状病毒,能抑制病毒感染导致的宿主细胞死亡,而X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是家族中抑制凋亡最有力的成员,可通过多种途径阻碍内源性或外源性凋亡信号传导,抑制细胞凋亡,促进肿瘤发生和发展[1]。已有研究显示XIAP在胃癌、肺癌及食管癌等多种肿瘤组织中过度表达,其表达水平与肿瘤的分化程度、临床分期及对放化疗的敏感性等密切相关[2-4]。尖锐湿疣(condyloma acuminatum,CA)是由人乳头瘤病毒(human papilloma virus,HPV)感染引起的一种慢性良性增殖性疾病,其生物学行为类似良性肿瘤。近年来,HPV(尤其是高危型HPV)的致癌性已得到证实,在与HPV感染有关的宫颈癌中XIAP表达异常[5]。而目前关于CA与XIAP的文献较少,且缺乏对XIAP与HPV感染的相关性进行研究。本研究初步探讨XIAP在CA发生、发展中的作用及其与CA的HPV分型、各临床参数之间的关系。
1 资料与方法
1.1 一般资料
选取2014年6月-2015年4月于山东省交通医院性病门诊就诊的72例患者,皮损均取自外生殖器部位,分别以石蜡包埋和液氮冰冷两种方式保存,经组织病理学确诊为CA。所有患者就诊前2周未做任何治疗,无系统性疾病史,不合并有其他感染性疾病。30例包皮标本作为对照组,取自本院泌尿外科行包皮环切术者,患者系健康男性,既往无CA等外生殖器疾病,经组织病理学检查证实为正常上皮。
1.2 分组
1.2.1 治疗后随访 分为未复发组(经彻底治疗皮损消退后,在3个月随访期内,在原皮损处或邻近部位无新发疣体)和复发组(经彻底治疗后随访3个月,无再次接触史的情况下,在原皮损处或邻近部位有新疣体者)[6]。其中,未复发组43例,男性26例,女性17例;年龄20~45岁,平均29.1岁;病程0.5~4个月,平均2.3个月。复发组29例,男性16例,女性13例;年龄22~53岁,平均31.5岁;病程0.5~5个月,平均2.8个月;复发次数1~6次,平均3.1次。
1.2.2 HPV基因分型检测 分为高危型组和低危型组,双重感染和多重感染中合并有高危型感染者归为高危型组。
1.3 试剂
兔抗人XIAP多克隆抗体、SV超敏两步法免疫组织化学试剂盒均购自武汉博士德生物工程有限公司;HPV基因分型检测试剂盒购自深圳亚能生物技术有限公司,可同时分型检测15种HPV型别,包括13种 高 危 型:16、18、31、33、35、39、45、51、52、56、58、59及 68,2种低危型 :6、11。
1.4 方法
1.4.1 免疫组织化学染色 所有标本均连续切片2张,切片厚度4 µm,1张用于免疫组织化学染色,1张行苏木精-伊红染色法染色,进行组织病理确诊。免疫组织化学操作均严格按照说明书步骤进行。用已知阳性标本做阳性对照,磷酸盐缓冲溶液代替一抗做阴性对照。
1.4.2 HPV基因分型检测 采用HPV基因分型检测试剂盒中PCR体外扩增和反向点杂交相结合的DNA芯片技术。所有操作过程严格按照说明书进行。
1.4.3 结果判定标准 XIAP阳性染色定位于细胞浆或细胞膜。细胞阳性表达强度按照以下方法进行半定量分析,①按细胞着色强度:浅黄色为1分,棕黄色为2分,棕褐色为3分;②按阳性细胞百分比:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分,两者分值的乘积即为细胞阳性表达强度,其分级方法为:0分为阴性(-),1~4分为弱阳性(+),6~8分为阳性(++),9~12分为强阳性(+++)。采用单盲法,每张切片任选2个皮片,每个皮片随机选取表皮层5个高倍(×400)视野进行评分,取其得分的平均数作为该标本分值。将(+)(+++)归为阳性表达组计算阳性率[7]。
1.5 统计学分析
数据分析采用SPSS 17.0统计软件,计数资料以率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 对照组与未复发、复发组XIAP表达比较
未复发组XIAP阳性率与对照组比较,差异有统计学意义(χ2=5.203,P=0.031);未复发组XIAP阳性率与复发组比较,差异有统计学意义(χ2=5.005,P=0.044);复发组XIAP阳性率与对照组比较,差异有统计学意义(χ2=16.389,P=0.000)。XIAP阳性着色主要位于细胞浆或细胞膜。在正常皮肤组织中,阳性细胞主要位于基底层及棘层中下部,数目较少,染色较浅,呈灶状分布;而在CA组织中,阳性细胞分布于表皮全层,以棘层为主,染色较强。见表1。
2.2 HPV基因分型结果
72例CA标本中有58例HPV-DNA阳性,检出率为80.56%。14例为阴性结果,这14例患者的临床表现和组织病理均符合CA改变,考虑可能为所检测的15种HPV型别之外的其他HPV型别感染。58例阳性标本中低危型43例(74.14%),高危型15例(25.86%)。
2.3 HPV感染组XIAP阳性率的比较
低危型组和高危型组XIAP的阳性率比较,差异无统计学意义(χ2=1.809,P=0.235);高危型组和对照组XIAP的阳性率比较,差异有统计学意义(χ2=6.667,P=0.022);低危型组和对照组XIAP的阳性率比较,差异无统计学意义(χ2=2.943,P=0.095)。见表2。
2.4 XIAP表达与CA临床特征的关系
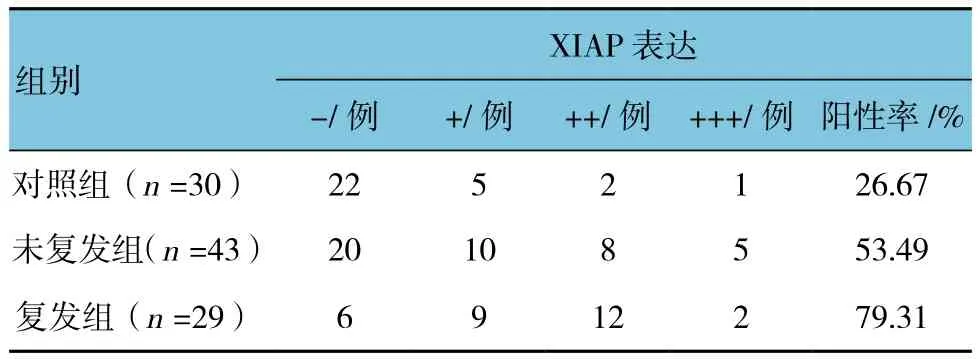
表1 对照组与未复发、复发组XIAP表达比较

表2 HPV感染组XIAP阳性率的比较
XIAP阳性表达与CA患者的发病年龄、性别比较,经χ2检验,差异无统计学意义(P>0.05);患者不同病程及复发次数、的比较,经χ2检验,差异有统计学意义(P<0.05)。见表 3。
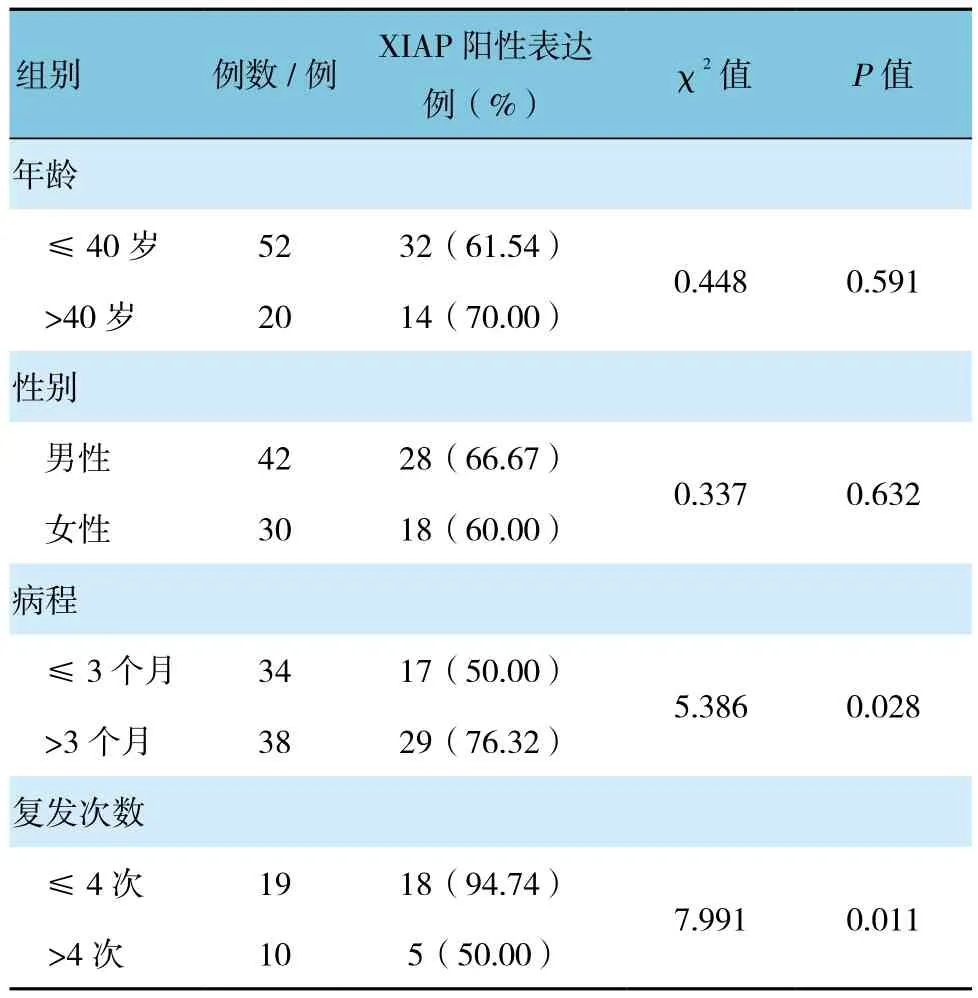
表3 XIAP表达与CA临床特征的关系
3 讨论
XIAP是IAP中唯一能同时抑制Caspase级联反应起始阶段和效应阶段的凋亡抑制蛋白,对于调节恶性细胞的程序性死亡具有决定性作用[4]。已有大量资料表明XIAP在人类多数恶性肿瘤中高表达,且可作为肿瘤标志物和预后因子之一[5,8]。笔者在临床中发现部分CA可自行缓解,部分却反复发作、迁延不愈,而巨大型CA病理可出现局部的轻度核异型性,甚至发生恶变。有关CA自行缓解或恶性转化的分子机制目前还未十分明确。YIN等[9]报道XIAP在CA组织中呈高表达,推测XIAP可能在CA的发病中起重要作用,但未做进一步深入研究。本实验检测了XIAP在不同预后(未复发和复发)CA组织中的表达,结果显示XIAP蛋白在CA中表达较正常组织上调,且复发组上调更为明显,复发组与未复发组比较有差异,提示XIAP参与了CA的发病过程,其表达上调可能干扰角质形成细胞的细胞周期、促进增殖及抑制凋亡,从而导致CA的不断发展和反复发作。本实验还发现,病程越长和复发次数越多的CA患者XIAP的阳性率越高,说明随着XIAP表达水平增高,细胞凋亡减少,有助于CA细胞的增殖甚至恶性转化;而XIAP表达水平较低的患者中,细胞增殖能力有限,可能是CA有自然缓解趋势的原因之一。由此提示XIAP对判断CA患者病情预后具有一定的参考价值。
现已证实癌基因蛋白E6和E7在HPV感染细胞的永生化和转化机制中起重要作用[10]。YUAN等[11]研究发现,在高危型HPV感染的人角质形成细胞中,E6和E7蛋白可通过上调核转录因子-kappa B的表达来间接激活XIAP转录。MITSUISHI等[5]分别检测感染低危型HPV的CA组织和感染高危型HPV鲍温样丘疹病组织中XIAP的表达水平,结论是低危型HPV癌基因蛋白不能活化XIAP表达。笔者的研究结果显示高危型HPV组的XIAP表达水平较正常组织上调,低危型HPV组较正常组虽存在一定的差别但无差异,得出的结论与上述研究一致。此结果提示感染高危型HPV的CA具有较强的抗凋亡能力,这可能是其临床上更易迁延不愈的原因之一。本研究中高危型和低危型HPV组的XIAP表达比较,由于病例尚较少,结果可能有一定的局限性,有待于在大样本中进一步研究和探讨。
综上所述,本研究分析了XIAP在不同预后CA中的表达情况,并初步探讨其与病毒感染、病情转归的关系,证实了XIAP表达上调与CA的发生、发展和复发有密切关系。已有研究报道,通过慢病毒介导的shRNA稳定抑制XIAP的表达,可减少肿瘤细胞的增长、诱导凋亡并增加肿瘤细胞对化疗和放疗的敏感性[12-13]。因此,随着分子生物学技术的进一步发展,阻断XIAP的表达可能成为治疗CA、预防复发的新靶点。
[1]张娟丽, 岳红梅. XIAP基因在肿瘤中的研究进展[J]. 现代生物医学进展, 2012, 12(25): 4973-4976.
[2]寇有为, 王强. XIAP、caspase-3在胃癌中表达及其相关性[J].中国现代医学杂志, 2011, 21(28): 3490-3494.
[3]HUANG J Q, LIANG H L, JIN T E, et al. Altered expression profile of apoptosis-related molecules correlated with clinicopathological factors in non-small-cell lung cancer[J]. Int J Clin Exp Pathol,2015, 8(9): 11278-11286.
[4]ZHOU S, YE W, SHAO Q, et al. Prognostic significance of XIAP and NF-kappaB expression in esophageal carcinoma with postoperative radiotherapy[J]. World J Surg Oncol, 2013, 11: 288.
[5]MITSUISHI T, IWABU Y, TOKUNAGA K, et al. Combined analysis of cell growth and apoptosis-regulating proteins in HPVs associated anogenital tumors[J]. BMC cancer, 2010, 10: 118.
[6]王剑磊, 位嘉, 王琪. 尖锐湿疣患者皮损中FOXP3的表达及意义[J]. 中国皮肤性病学杂志, 2014, 28(11): 1121-1123.
[7]李晶,徐洪玉,郭淑兰. Maspin蛋白在尖锐湿疣组织中的表达[J].中国麻风皮肤病杂志, 2012,28(5):324-325.
[8]TAMM I, RICHTER S, SCHOLZ F, et al. XIAP expression correlates with monocytic differentiation in adult de novo AML:impact on prognosis[J]. Hematol J, 2004, 5(6): 489-495.
[9]YIN G W, GUO Y, HUANG Y H, et al. The expression and significance of XIAP and C-jun on condyloma acuminatum[J]. Pak J Pharm Sci, 2015, 28(4 Suppl): 1551-1553.
[10]ISHIJI T. Molecular mechanism of carcinogenesis by human papillomavirus-16[J]. J Dermatol, 2000, 27(2): 73-86.
[11]YUAN H, FU F, ZHUO J, et al. Human papillomavirus type 16 E6 and E7 oncoproteins upregulate c-IAP2 gene expression and confer resistance to apoptosis[J]. Oncogene, 2005, 24(32): 5069-5078.
[12]WANG R, LI B, WANG X, et al. Inhibiting XIAP expression by RNAi to inhibit proliferation and enhance radiosensitivity in laryngeal cancer cell line[J]. Auris Nasus Larynx, 2009, 36(3):332-339.
[13]QU Y, XIA P, ZHANG S, et al. Silencing XIAP suppresses osteosarcoma cell growth, and enhances the sensitivity of osteosarcoma cells to doxorubicin and cisplatin[J]. Oncol Rep,2015, 33(3): 1177-1184.
(李科 编辑)
Expression of XIAP in condyloma acuminatum and its correlations with HPV subtypes
Jing Li, Hong-yu Xu
(Department of Dermatology, Shandong Jiaotong Hospital, Jinan, Shandong 250031, China)
ObjectiveTo investigate the roles of X-linked inhibitor of apoptosis protein (XIAP) in condyloma acuminatum and to study the relationships between XIAP andHuman Papilloma Virus(HPV)subtypes.MethodsThe immunohistochemical method was adopted to detect the expression of XIAP in condyloma acuminatum and healthy prepuce tissues. HPV genotypes were detected by PCR and gene chip in all condyloma acuminatum tissues.ResultsThe expression rate of XIAP was gradually increased from normal prepuce,nonrecurrent condyloma acuminatum to recurrent condyloma acuminatum tissues (26.67%, 53.49% and 79.31%respectively) with signi fi cant differences (P< 0.05). Futhermore, the XIAP expression level in the high-risk HPV group was higher than that in the normal prepuce (66.67% vs. 26.67%,P< 0.05); however, it was similar between the high-risk and low-risk HPV groups as well as low-risk HPV group and normal prepuce (P> 0.05). The positive expression rate of XIAP was statistically different between the patients with different disease courses and recurrent times (P< 0.05), but not between those groups with different sex and age (P> 0.05).ConclusionsElevated expression of XIAP may play an important role in the pathogenesis and recurrence of condyloma acuminatum. It may promote the malignant transformation of condyloma acuminatum, and serve as an effective and objective marker in detection and mornitoring of condyloma acuminatum.
condyloma acuminatum; X-linked inhibitor of apoptosis protein;Human Papilloma Virus;recurrence; apoptosis
R752.53
A
10.3969/j.issn.1005-8982.2017.29.024
1005-8982(2017)29-0111-04
2016-03-23

