铁冬青雌雄株在低温胁迫下的响应及抗寒性差异
柴弋霞,曾 雯,金晓玲,蔡梦颖
(中南林业科技大学 风景园林学院,湖南 长沙 410004)
铁冬青雌雄株在低温胁迫下的响应及抗寒性差异
柴弋霞,曾 雯,金晓玲,蔡梦颖
(中南林业科技大学 风景园林学院,湖南 长沙 410004)
为了明确雌雄异株植物铁冬青的抗寒机理和雌雄株抗寒性差异,对5年生铁冬青雌雄株的离体叶片进行低温胁迫处理,测定其相对电导率(REC)、丙二醛(MDA)、游离脯氨酸(Pro)、可溶性蛋白、氧化酶活性各项指标,结合Logistic方程计算出半致死温度(LT50),结合隶属函数法综合分析其抗寒能力。结果表明:随着温度的降低,铁冬青雌雄株REC和MDA含量上升,Pro、可溶性蛋白含量、POD活性表现为先上升后下降的趋势,而SOD活性则逐渐下降;雌雄株各生理指标在数值上存在显著的性别差异(P<0.05),雌株的REC和MDA含量显著高于雄株,而Pro、可溶性蛋白含量和SOD活性则显著低于雄株,POD活性无显著差异;铁冬青雌雄株最低LT50分别为-6.29 ℃和-9.37 ℃。半致死温度结合隶属函数法综合表明铁冬青抗寒性存在显著性别差异,即雄株的抗寒性强于雌株。
铁冬青;抗寒性;低温胁迫;雄株
雌雄异株植物有14 620种,广布于被子植物959个属中[1]。冬青属植物种类繁多,分布广泛,是典型雌雄异株植物的代表。铁冬青Ilex rotunda为冬青属Ilex常绿灌木或小乔木,秋冬时节,红果满树,经久不落,是优良的园林绿化树种。
近年来,随着全球气候的改变,极端低温频繁出现,低温成为限制植物生长、分布和生产力的主要因子之一。我国冬青属植物主要分布于长江流域以南,低温是限制其向北方城市引种的主要因素之一[2]。目前,有研究通过相对电导率结合Logistic方程和丙二醛、脯氨酸含量、保护酶活性等抗寒生理指标的测定[3-6],发现冬青属植物具有一定抗寒性和向北推广的潜力,而关于铁冬青抗寒性的研究少有报道,特别是针对铁冬青雌株与雄株抗寒性差异的研究还未有报道。大量研究表明:雌雄异株植物不仅在形态结构、生长发育、繁殖特性上具有差异,在抗寒能力上也表现出较大性别差异[7-8]。如:在低度胁迫下,青杨和中国沙棘雄株细胞膜受损较小,具有较强的防御能力[9-10]。因此对雌雄株抗寒性进行研究,一方面可以为雌雄株鉴别提供依据;另一方面筛选出较好的抗寒株系,有助于获得耐寒性强的新种质。本研究将通过对铁冬青雌株和雄株进行低温胁迫实验,研究其质膜透性、渗透调节物质及保护酶活性变化特征,结合雌雄株半致死温度和隶属函数值对其抗寒性进行评价,旨在研究铁冬青雌株与雄株的抗寒性差异及生理响应,为将来的良种选育及引种提供参考。
1 材料与方法
1.1 试验材料
供试材料为5年生铁冬青雌雄各3株,长势良好,种植于湖南省长沙市中南林业科技大学校园。
1.2 试验方法
于2015年1月、2月、3月取铁冬青健康枝条的倒二、倒三片成熟叶片。将叶片用去离子水洗净后均分成6份置于低温恒温槽(天恒SDC-6)中 5 ℃预冷 2 h,试验设 5、0、-5、-10、-15和-20 ℃6个温度梯度。低温处理2 h后将材料取出放入冰箱(4℃)解冻24 h,解冻后将每组平均分成3份,每份3次重复,测定各材料相对电导率。以最低温2月份的材料为代表测定其MDA、游离脯氨酸、可溶性蛋白含量和氧化酶活性等生理指标。
相对电导率(Rec)采用电导率仪法测定,拟合Logistic方程确定各植株的LT50;MDA含量采用硫代巴比妥酸比色法测定;游离脯氨酸含量采用酸性茚三酮显色法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法测定;超氧化物岐化酶(SOD)活性采用氮蓝四唑法测定,过氧化物酶(POD)活性采用愈创木酚法测定[11]。
1.3 抗寒性综合评价
采用隶属函数值法[12]综合评价铁冬青雌雄株的抗寒性,计算方法如下。
如果指标与抗寒性呈正相关:
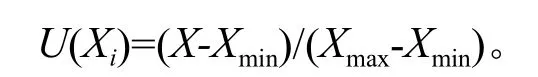
如果指标与抗寒性呈负相关:
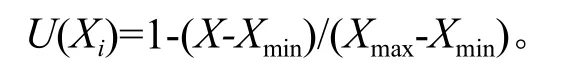
式中:U(Xi)是i样品某个指标的隶属函数值;X代表i样品某个指标均值;Xmax是所有材料中某个指标的最大值;Xmin是所有材料中某个指标的最小值。将每个树种越冬期间各指标的抗寒性隶属函数值累加起来,求其平均值,均值越大抗寒性越强。
1.4 数据处理
数据计算及图表绘制在Excel 2010中进行,利用SPSS19.0进行Logistic拟合及差异性分析。
2 结果与分析
2.1 低温胁迫对铁冬青相对电导率的影响

图1 低温胁迫对铁冬青雌雄株叶片相对电导率的影响Fig. 1 The effects on Rec under different low temperature treatments of female and male individuals of Ilex rotunda
低温胁迫下铁冬青相对电导率的变化如图1所示。由图1可知,铁冬青相对电导率随胁迫加强逐渐升高,开始增加缓慢后增加快速最后又趋于平缓,5~-20 ℃近似呈对数曲线上升,相对电导率与人工胁迫温度呈极显著负相关。0~-10 ℃处理的铁冬青相对电导率上升缓慢;-10~-15 ℃之间各植株的相对电导率迅速上升,且雌株上升幅度比雄株大,为101.25%,说明低温对其质膜造成严重伤害。雌雄株相对电导率存在显著差异(P<0.05)。
铁冬青雌雄株的相对电导率拟合的Logistic方程求出半致死温度见表1,可知拟合度在0.92~0.97之间,均达到极显著水平。随着气温的降低,铁冬青雌雄株的半致死温度均降低,与采样前平均最低气温呈正相关。整个越冬期间,铁冬青雄株半致死温度都低于雌株,说明雄株抗寒性强于雌株。
2.2 低温胁迫对铁冬青MDA含量的影响
低温胁迫下铁冬青MDA含量的变化见图2。由图2可以看出,铁冬青在低温胁迫下体内MDA含量随温度的下降而上升,5~-10 ℃时增幅较大,-20 ℃度时MDA含量达到峰值,整体与人工低温胁迫呈极显著负相关。另外,各处理阶段铁冬青雌株MDA含量极显著高于雄株(P<0.05),-20 ℃时差异最大为23.1%,且雌株的增幅显著高于雄株。

表1 铁冬青雌雄株半致死温度(LT50)†Table 1 The parameters of LT50 dynamics of male and female individuals of Ilex rotunda
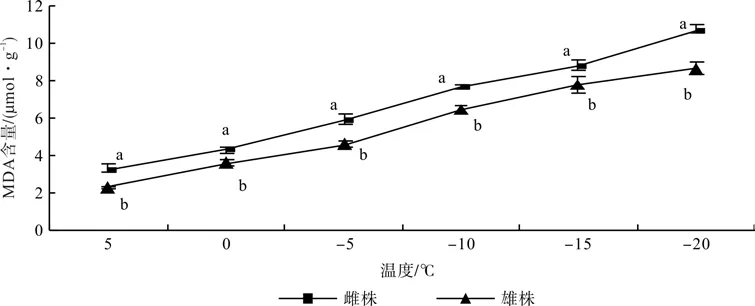
图2 低温胁迫对铁冬青雌雄株叶片MDA含量的影响Fig. 2 Effects of low temperature on the content of MDA of female and male individuals of Ilex rotunda
2.3 低温胁迫对铁冬青游离脯氨酸含量的影响
由图3可知,铁冬青游离脯氨酸含量随温度的降低先升高后降低,在5~﹣5 ℃处理下增幅较大,-10 ℃时出现了峰值,-10~-20 ℃之间均开始下降,且雌株下降幅度较大,为37.25%。从图3还可以看出,各阶段铁冬青雄株游离脯氨酸含量极显著高于雌株(P<0.05),在-20℃时差异最大,为21.5%。
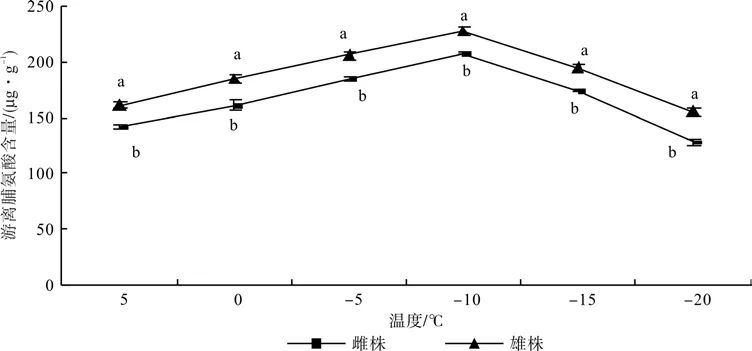
图3 低温胁迫对铁冬青雌雄株叶片游离脯氨酸含量的影响Fig. 3 Effects of low temperature on free proline content of female and male individuals of Ilex rotunda
2.4 低温胁迫对铁冬青可溶性蛋白含量的影响
低温胁迫下铁冬青可溶性蛋白含量的变化见图4。由图4 可知,铁冬青可溶性蛋白含量随温度的降低呈先升后降的趋势,0~-5 ℃时增幅最大,-10 ℃达到峰值,随后下降,整体与人工胁迫温度呈极显著正相关。铁冬青雄株的蛋白质含量在整个处理期间都显著高于雌株(P<0.05),且在-20 ℃时差异最大,雄株比雌株高29.1%。
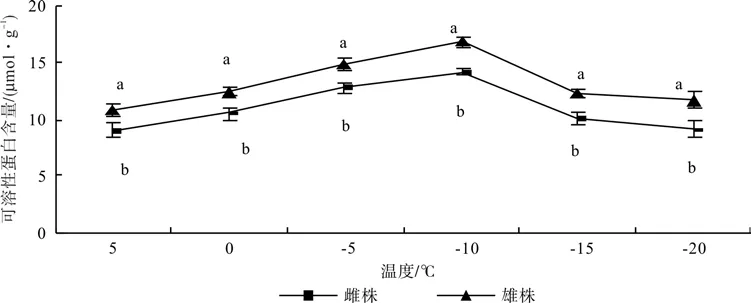
图4 低温胁迫对铁冬青雌雄株叶片可溶性蛋白含量的影响Fig. 4 Effects of low temperature on soluble protein content of female and male individuals of Ilex rotunda
2.5 低温胁迫对铁冬青保护酶活性的影响
铁冬青SOD活性的变化见图5。由图5可知,5℃铁冬青具有较高的SOD活性,随着处理温度的降低呈逐渐下降的趋势,整体与人工胁迫温度呈极显著正相关。而且,各阶段铁冬青雄株SOD活性均高于雌株,存在极显著差异(P<0.05)。其中-10℃差异最大,为52.3 μ/g。

图5 低温胁迫对铁冬青雌雄株叶片SOD活性的影响Fig. 5 Effects of low temperature on SOD activity of female and male individuals of Ilex rotunda
低温胁迫下铁冬青POD活性的变化见图6。从图6可以发现,随着处理温度的降低先呈缓慢上升后下降的趋势,但变化幅度较小。在-10℃时出现峰值,然后开始下降。从图6还可以看出,低温胁迫各个阶段中铁冬青雌雄株间的POD活性无显著差异(P<0.05)。
2.6 抗寒性综合评价
植物的抗寒机制由多种物质共同调节,仅用一种指标很难准确反映植物的抗寒性。隶属函数法可以将多个抗性指标综合起来,通过平均隶属度来评价植物抗寒性。平均隶属度越大,植物抗寒性越强。由表2可知,铁冬青雄株的平均隶属度(0.570)大于雌株(0.526),表明雄株抗寒性强于雌株,该结果与通过比较LT50大小得到的结果一致。
3 结论与讨论
大量研究表明,低温胁迫下植物细胞膜透性发生变化,膜脂过氧化产物MDA激增,引起电解质外渗,利用该原理进行相对电导率的测定,电导率升高表明低温对细胞膜的伤害增大[13]。本研究中铁冬青相对电导率和MDA含量随温度的降低而上升。与邓仁菊等[14]对火龙果抗寒性指标变化的研究结果一致。游离脯氨酸和可溶性蛋白均是重要的渗透调节物质,前者可以提高渗透压,增强保水能力,后者能防止细胞间结冰引起的原生质过度脱水,降低冰点的作用,两者均与植物的抗寒性呈正相关[15]。本试验中:随着温度的降低,铁冬青游离脯氨酸和可溶性蛋白含量先升后降,下降的原因可能是胁迫加强使细胞受损,渗透调节物质逐渐分解,这与刘芬等[16]对木麻黄的抗寒性研究结果相似。但徐传保等[17]发现竹子各品种在低温胁迫下Pro含量总体呈下降趋势,这种差异可能是由于不同植物Pro的合成对低温的影响机制不同所致。POD、SOD 广泛存在植物细胞中,能够清除活性氧等毒害物质,维持植物体内自由基的动态平衡,且与植物的抗寒性呈正相关[18]。本研究中铁冬青SOD活性随温度降低逐渐下降,说明低温对其活性产生抑制。POD活性呈现缓慢上升并在温度进一步降低时活性下降,这可能是由于适当低温促进植物抗寒性机制的响应,通过酶活性的增加来提高抗寒能力,但当温度超过植物耐寒范围,导致细胞受损,酶活性下降。这与赵明明[19]对几种冬青属植物低温胁迫下酶活性变化规律相似。但与董万鹏等[20]对西番莲的研究结果不同,这可能是不同植物抗寒性不同,表现出的变化规律也不同。

图6 低温胁迫对铁冬青雌雄株叶片POD活性的影响Fig. 6 Effects of low temperature on POD activity of female and male plant in Ilex rotunda

表2 低温胁迫下铁冬青雌雄株的隶属函数值Table 2 The membership function of male and female Ilex rotunda under low temperature treatments
迄今有关雌雄株差异性的研究主要在形态学、解剖学、生理学、逆境下受伤害程度等方面[21]。已有大量研究表明雄性植株较雌株具有更好的抗寒性:Li等[9]在对沙棘冷驯化中发现,雄株在应对低温时会更早形成抗寒机制和具有更高的抗寒性。Zhang等发现青杨雄株的叶绿体和膜结构较雌株更完整,对低温胁迫具有更高的耐冻性。高露双等[22]发现山杨雄株比雌株更能适应低温变化。本研究中,在相同的低温处理下铁冬青雄株相对电导率、MDA含量极显著低于雌株,但脯氨酸含量、可溶性蛋白含量、SOD活性显著高于雌株,雄株在低温胁迫下细胞受损程度更低,这与陶应时等[23]对连香树雌雄株抗逆性研究结果一致。因此说明铁冬青雄株比雌株更适应低温变化,抗寒性强于雌株。这可能是由于在植物体内,存在着“库-源”关系,生长期间,雌株有果实和根系两个库器官,叶片通过代谢作用向果实和根系运输,进行消耗;而雄株只有根系一个库器官,叶片积累的营养物质只需要向根部运输,消耗较少,在遇低温胁迫时,雄株叶片内积累了较多的代谢物质和养分用于抵抗环境胁迫,表现出更强的抗逆性[24]。此外,雌雄株间的POD活性无显著差异,这和王克霞[25]对芦笋雌雄株根部POD活性测定结果相同,可能是由于雌雄株体内酶活性的差异存在着时间的特异性,不同生长阶段差异不同。大量研究表明利用Logistic方程描述植物细胞膜受伤害的过程,得到半致死温度(LT50)能较直接反映植物抗寒能力,LT50越高抗寒性越差。本研究中得到雌雄株LT50分别为-6.29 ℃和-9.37 ℃,雄株抗寒性强于雌株,与隶属函数值结果一致。这是由于雌株相对于雄株在繁殖方面消耗的资源较多,而雄株有更多的能量产生来抵抗外界低温胁迫。
铁冬青雌雄株抗寒性具有显著性别差异,综合LT50、生理指标变化及隶属函数值表明,雌株对低温更敏感,雄株抗寒性强于雌株。因此推测在自然生境中雄株可能比雌株具备更好的诸如抗寒等抗逆能力。本研究只对铁冬青抗寒性的性别差异进行了研究,今后有待进一步开展其他抗逆能力的性别差异研究和分子蛋白水平的研究,为铁冬青引种和良种选育提供科学依据。
[1]Renner S S, Ricklefs R E. Dioecy and its correlates in the flowering plants[J]. American Journal of Botany, 1995, 82(5):596-606.
[2]赵明明,周余华,彭方仁,等.低温胁迫下冬青叶片内Ca2+水平及可溶性糖含量的变化[J].南京林业大学学报(自然科学版),2014, 34(5): 1-5.
[3]Sun Y P, Zhang D L. Cold hardiness ofIlex glabracultivars from field trials and laboratory tests[J]. Journal of Environmental Horticulture, 2010, 28(4): 191-196.
[4]谢晓金,郝日明.南京地区12种常绿阔叶树种冬季抗寒性动态变化[J].生态学报,2009,29(4):2149-2154.
[5]Zhang D L, Sun Y P, Jin X L,et al.Cross Compatibility ofIlex glabra(L.) A. Gray withIlex×meserveaeS. Y. Hu andIlex verticillata(L.) A. Gray[J]. Journal of Central South University of Forestry & Technology, 2011, 31(10): 1-9.
[6]夏云鹏.低温与干旱胁迫对大叶冬青叶片生理特性影响的研究[D].郑州:河南农业大学, 2010:6.
[7]尹春英,李春阳.雌雄异株植物与性别比例有关的性别差异研究现状与展望[J].应用与环境生物学报,2007,13(3):419-425.
[8]张明如,温国胜,张 瑾,等.火炬树雌雄母株克隆生长差异及其光合荧光日变化[J].生态学报,2012,32(2):0528-0537.
[9]LI C, Yang Y, Junttila O,et al.Sexual differences in cold acclimation and freezing tolerance development in sea buck thorn(Hippophae rhamnoidesL). ecotypes[J]. Plant Science, 2005,168(5): 1365-1370.
[10]Zhang S, Jiang H, Peng S M,et al.Sex-related differences in morphological, physiological, and ultrastructural responses ofPopulus cathayanato chilling[J]. Journal of Experimental Botany, 2011, 62(2): 675-686.
[11]陈建勋,王晓峰.植物生理学实验指导(第二版)[M].广州:华南理工大学出版社,2006:66-80.
[12]刘慧民,仇 茜.车代弟.18种绣线菊苗期抗寒性评价与筛选[J].园艺学报,2014,41(12):2427-2436.
[13]李 鹏,罗淑萍,田 嘉,等.低温冻害对扁桃花蕾抗寒机制的影响[J].经济林研究,2015,33(2):20- 25.
[14]邓仁菊,范建新,王永清,等.火龙果幼苗对低温胁迫的生理响应及其抗寒性综合评价[J].植物生理学报,2014,50(10):1529-1534.
[15]Guerrier G.Proline accumulation in leaves of NaCl-sensitive and NaCl-tolerant tomatoes[J]. Biologia Plantarum, 1997,40:623-628.
[16]刘 芬,姜清彬,马英姿,等.7个短枝木麻黄种源耐寒评价及综合分析[J].中南林业科技大学学报,2015,35(6):40-45.
[17]徐传保,戴庆敏.低温胁迫对竹子3 种渗透调节物质的影响[J].河南农业科学, 2011, 40(1): 127- 130.
[18]张 悦,周 琳,张会慧,等.低温胁迫对蓝莓枝条呼吸作用及生理生化指标的影响[J].经济林研究,2016,34(2):12-18.
[19]赵明明.几种冬青属植物抗寒性比较研究[D].南京:南京林业大学,2012:06.
[20]董万鹏,罗 充,李秀琴,等.低温胁迫对西番莲抗寒生理指标的影响[J].植物生理学报,2015,51(5):771-777.
[21]翟飞飞,孙振元.木本植物雌雄株生物学差异研究进展[J].林业科学,2015,51(10):110-114.
[22]高露双, 赵秀海,王晓明,等雌雄异株植物山杨的气候响应差异[J].应用生态学报,2014,25(7):1863-1869.
[23]陶应时,廖咏梅,黎云祥,等.连香树雌雄株叶片形态及生理生化指标比较[J].东北林业大学学报, 2013,41(3):18-20.
[24]王小燕.黄连木雌雄株间生物学特性的比较研究[D].河南:河南科技大学,2013:6.
[25]王克霞.芦笋雌雄株间生理化特性的差异研究[D].杭州:浙江大学,2004:6.
[本文编校:谢荣秀]
Physiological characteristics and cold hardiness between male and female plants ofIlex rotunda
CHAI Yixia, ZENG Wen, JIN Xiaoling, CAI Mengying
(College of Landscape Architecture, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
To ascertained the cold resistance mechanism and the gender difference of cold hardiness between male and female plants ofIlex rotunda, detached leaves from five years old male and female plants were collected and treated with various lower temperatures.The relative conductivity, malondialdehyde content, superoxide dismutase activity, soluble protein content and free proline content of each plant were measured in the winter. Calculated the lethal temperature by Logistic equation, and evaluated the cold-hardiness by the subordinate function. the result showed that The male plants were significantly cold hardier than that of the female plants and the LT50for male and female plants were -9.37℃ and -6.29℃ . With temperature decreasing, REC and MDA were increased and SOD activities were gradually dropped, but Pro, soluble protein content and POD were increased firstly than decreased. There were significant gender differences in physiological-biochemical indexes of male and femaleIlex rotundaplants (P<0.05). With temperature going lower, REC and MDA of female plants were higher than that of male plants and Pro content, soluble protein content and SOD activity were lower.No significantly POD activity differences were observed. The male plants ofI. rotundahad much stronger cold-resistance than that of female plants. The REC, MDA, Pro, soluble protein content and SOD could be used as physiological indices to evaluate cold hardiness of ornamental plants.
Ilex rotunda; cold-hardiness; low temperature stress; male plant
S718.45
A
1673-923X(2017)09-0093-06
10.14067/j.cnki.1673-923x.2017.09.016
2016-12-10
林业公益性行业科研专项经费资助项目(201404710);湖南省“十二五”重点学科(湘教发[2011]76号)
柴弋霞,硕士研究生
金晓玲,教授,博士生导师;E-mail:121191638@qq.com
柴弋霞,曾 雯,金晓玲,等. 铁冬青雌雄株在低温胁迫下的响应及抗寒性差异[J].中南林业科技大学学报,2017, 37(9):93-98.

