小麦农家品种‘红蚰子’苗期白粉病抗性鉴定和遗传分析*
曹燕威, 许红星, 李秀全, 安调过
小麦农家品种‘红蚰子’苗期白粉病抗性鉴定和遗传分析*
曹燕威1,3, 许红星1**, 李秀全2, 安调过1
(1. 中国科学院遗传与发育生物学研究所农业资源研究中心 石家庄 050022; 2. 中国农业科学院作物科学研究所北京 100081; 3. 中国科学院大学 北京 100049)
白粉病是小麦的重要病害之一, 优异抗病种质的鉴定和利用是控制该病害的有效措施。当前, 我国小麦生产中的多数栽培品种和品系对白粉病表现为感病, 可利用的优异抗性基因为数不多, 因此, 很有必要发掘新的有效抗源和抗性基因。我国小麦农家品种‘红蚰子’(京2350)苗期对国内38个小麦白粉病原菌菌株中的34个表现为高抗至免疫, 且成株期对石家庄地区的田间混合白粉病原菌表现为免疫或近免疫。为了进一步研究‘红蚰子’抗白粉病遗传特点, 发掘并利用其中的优异抗白粉病基因, 本研究利用白粉菌E09菌株, 分别对‘红蚰子’与感病亲本‘铭贤169’和‘辉县红’组合各自的F1、F2后代植株和F2:3株系, 进行苗期抗性鉴定和抗性遗传分析。结果表明, ‘红蚰子’与‘铭贤169’和‘辉县红’组合的所有F1均感病, 各自F2后代植株中抗病植株与感病植株的比例均符合1∶3分离比, 且各自F2:3株系中纯合抗病株系∶杂合株系∶纯合感病株系的比例均符合1∶2∶1的比例。因此, ‘红蚰子’对E09菌株的抗性由1对隐性基因控制, 暂时命名为。‘红蚰子’是我国农家品种中优异的白粉病抗源, 研究并发掘其中的抗性基因, 将为其在抗病育种中的有效利用奠定基础。
小麦; 白粉病; 农家品种; 红蚰子; 遗传分析
小麦()是我国最主要的粮食作物之一, 其产量关系到我国的粮食安全。由布氏白粉病菌(f. sp.,)引起的小麦白粉病是小麦的重要病害, 是影响小麦生产的三大主要病害之一。鉴定和利用优异的抗病种质依然是防治该病害最为经济、有效且环保的措施[1]。由于白粉菌毒性和寄主抗性之间的协同进化, 生产上大规模应用的抗病基因通常会逐渐降低或丧失抗性[2]。因此, 小麦育种工作者仍需长期致力于有效的、广谱的抗白粉病新种质或新基因的发掘和利用[3]。
迄今为止, 国内外已经在53个位点(~,与等位,=,=,=,=)正式命名了70多个小麦抗白粉病基因[4-7]。除此之外, 还报道了20多个暂时命名的抗白粉病基因。这些基因分布在小麦所有染色体上[8]。从来源上看, 它们分别来自普通小麦、小麦近缘种和远缘种。目前在我国小麦农家品种中已经鉴定出了至少8个抗白粉病基因, 包括[7]、[9]、[10]、[11]、[12]、[13]、[14]和[2], 分别来自我国的小麦农家品种‘鸟麦’、‘小红皮’、‘复壮30’、‘小白冬麦’、‘齿牙糙’、‘白葫芦’、‘D57’和‘红洋辣子’。到目前为止, 这些基因仍然对白粉病原菌保持有很好的抗性。因此, 农家品种是小麦白粉病抗源的重要基因来源之一, 也是进行小麦品种抗白粉病遗传改良的重要抗病种质资源[15]。
我国小麦农家品种‘红蚰子’(京2350)引自国家种质库, 来源于河南南阳市淅川县, 对石家庄地区的田间混合白粉病原菌表现免疫或近免疫, 前期通过白粉病抗性鉴定和筛选, 发现‘红蚰子’是一个很好的白粉病抗源材料。本研究利用国内不同地区、不同毒性的38个菌株对其进行多菌株苗期抗性鉴定, 并利用E09菌株对其与感病亲本‘辉县红’和‘铭贤169’的分离群体进行苗期抗性鉴定和遗传分析, 阐明其抗白粉病的遗传特点。
1 材料与方法
1.1 植物材料
供试小麦农家品种‘红蚰子’(京2350)来自国家种质资源库, 由前期白粉病抗性鉴定筛选而来; 感病亲本‘辉县红’和‘铭贤169’以及抗白粉病基因供体材料(共38个菌株, 分别为E03、E05、E06、E09、E11、E13、E16、E17、E18、E21、E22、E23-1、E23-2、E26、E30-2、E31、E32、E49、E50、B13、B14、B41、B15、B16、B17、B42、B43、B44、B45、B46、B47、B48、B49、B54、B55、B56、B57、B58)均保存于中国科学院遗传与发育生物学研究所农业资源研究中心小麦种质创新实验室。
1.2 苗期抗性鉴定
将用于苗期抗性鉴定的小麦材料播种于72孔(4 cm×4 cm)的穴盘中, 每孔种植6~8粒种子; 每个穴盘随机种植‘铭贤169’作为感病对照。用于抗性遗传分析的F1、F2和F2:3后代材料, 除随机设置‘铭贤169’作为感病对照外, 每个穴盘均设置抗病亲本和感病亲本对照; F1和F2后代材料每孔均种植1粒种子, 便于鉴定后移苗; 每个F2:3株系种植5孔, 每孔种植6~8粒种子, 共种植30~40粒种子。所有小麦材料播种后置于可控温度、湿度和光照的温室条件下培养, 待接种麦苗第一片叶子完全展开时, 利用白粉病菌进行充分接种。接种后的麦苗置于18 ℃黑暗条件下保湿培养24 h之后, 放在可控温室中培养, 期间每天光照14 h、白天温度为22 ℃、夜间温度为18 ℃、相对湿度为80%~90%。以‘铭贤169’作为感病对照, 接种约8~10 d后, 待‘铭贤169’充分发病, 调查记载发病情况。抗病性调查采用盛宝钦[16]提出的6级分类方法进行, 反应型(infection type, IT) 0型为免疫, 0; 型为近免疫, 1~4型分别为高抗、中抗、中感和高感。
1.3 统计分析
根据调查记载的情况, 计算杂交F2代群体的抗病单株与感病单株的比值, 并利用F2︰3家系验证推导F2单株的基因型, 经卡方测验分析分离群体的符合度。参照何家泌[17]小麦抗病基因分离理论模式, 结合F1植株的抗病性、F2群体的抗感单株分离比例, 对鉴定结果进行分析。
2 结果与分析
2.1 红蚰子的抗性鉴定
在苗期, 利用38个单孢分离的且不同毒性的小麦白粉病菌株对‘红蚰子’进行抗性鉴定, 结果表明, ‘红蚰子’对E11、E13、E16、E23-1、E23-2、E30-2、E32、B41、B42、B44和B54、B55、B56、B57、B58共15个菌株表现免疫(IT=0, 反应型为0型), 对E03、E05、E09、E17、E18、E21、E22、E26、E50、B13、B15、B16、B17、B43和B49共15个菌株表现近免疫(T=0;, 反应型为0; 型), 对E31、B14、B45和B48共4个菌株表现为高抗(IT=1, 反应型为1型), 而对E06、E49、B46和B47共4个菌株表现为高感(IT=4, 反应型为4型), 图1显示了‘红蚰子’对部分白粉菌菌株的苗期反应。‘辉县红’和‘铭贤169’作为感病对照, 均对所有38个供试菌株表现为高感。
在成株期, 利用石家庄地区的田间混合白粉病原菌进行接种, 结果表明, ‘红蚰子’对混合病原菌表现为免疫或近免疫。

图1 小麦品种‘红蚰子’对部分白粉菌菌株的苗期反应
2.2 ‘红蚰子’的抗性遗传分析
‘红蚰子’对白粉病E09菌株的反应型为0;型,感病亲本‘辉县红’和‘铭贤169’对E09的反应型均为4型, ‘红蚰子’与‘辉县红’和‘铭贤169’的F1代植株也对E09的反应型均为4型, 表明‘红蚰子’对E09的抗性由隐性基因控制。在234株‘辉县红’ב红蚰子’组合构成的F2分离群体中, 有57株表现抗病, 反应型为0型的有18株、反应型为1型的有13株、反应型为2型的有16株; 177株表现感病, 反应型为3型的有21株、反应型为4型的有156株, 抗感分离比符合1︰3(2=0.023,=0.88, 表1)。对291个‘辉县红’ב红蚰子’组合的F2︰3株系, 每个株系鉴定至少24个单株, 结果表明, 有54个纯合抗病株系, 98个杂合分离株系, 39个纯合感病株系, 纯合抗病︰杂合︰纯合感病的比例符合1︰2︰1的分离比(2=2.49,=0.29, 表1)。
同样, 在156株‘红蚰子’ב铭贤169’组合构成的F2分离群体中, 有42株表现抗病, 114株表现感病, 抗感分离比也符合1︰3(2=0.21,=0.88, 表1)。而对257个‘红蚰子’ב铭贤169’组合的F2:3株系, 有67个纯合抗病株系, 121个杂合分离株系, 69个纯合感病株系, 纯合抗病︰杂合︰纯合感病的比例也符合1︰2︰1的分离比(2=1.10,=0.58, 表1)。因此, 综合遗传分析结果表明, ‘红蚰子’对E09的抗性由1对隐性基因控制, 暂时命名为。
2.3 PmHYZ与部分已知隐性抗性基因的抗谱比较
为了区分这个隐性抗性基因与部分已报道的隐性抗性基因, 利用前面提到的38个白粉菌菌株对4个已知基因的载体品种‘CI14125’、‘Aquila’、‘复壮30’和‘小白冬麦’进行了苗期抗性鉴定和抗谱比较。结果表明,的供体材料‘CI14125’对所有供试的38个菌株均表现感病;的供体材料‘Aquila’仅对38个菌株中的5个(E30-2、E43、E50、B15和B41)表现抗病;的供体材料‘复壮30’对5个菌株(E43、E50、B13、B15和B47)表现感病, 其中对4个菌株(E50、B13、B15和B47)的反应不同于;的供体材料‘小白冬麦’仅对38个菌株中的3个(E43、B15和B47)表现为感病。因此,基因与、、和基因不同(表2)。
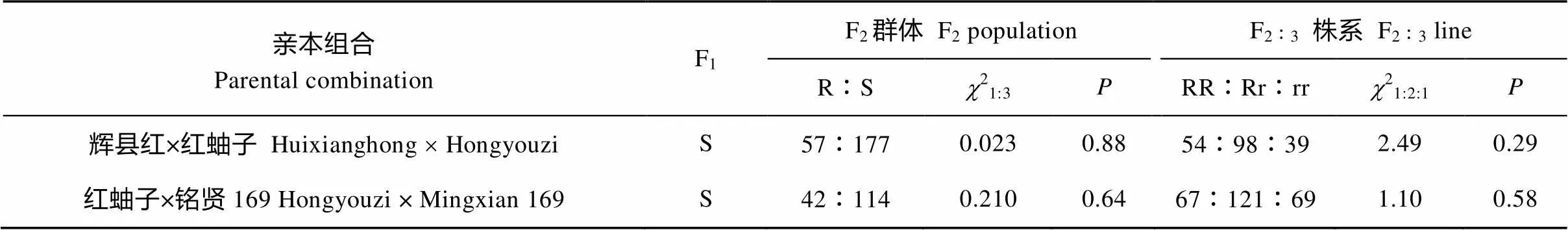
表1 小麦品种‘红蚰子’对白粉病E09菌株的抗性遗传分析
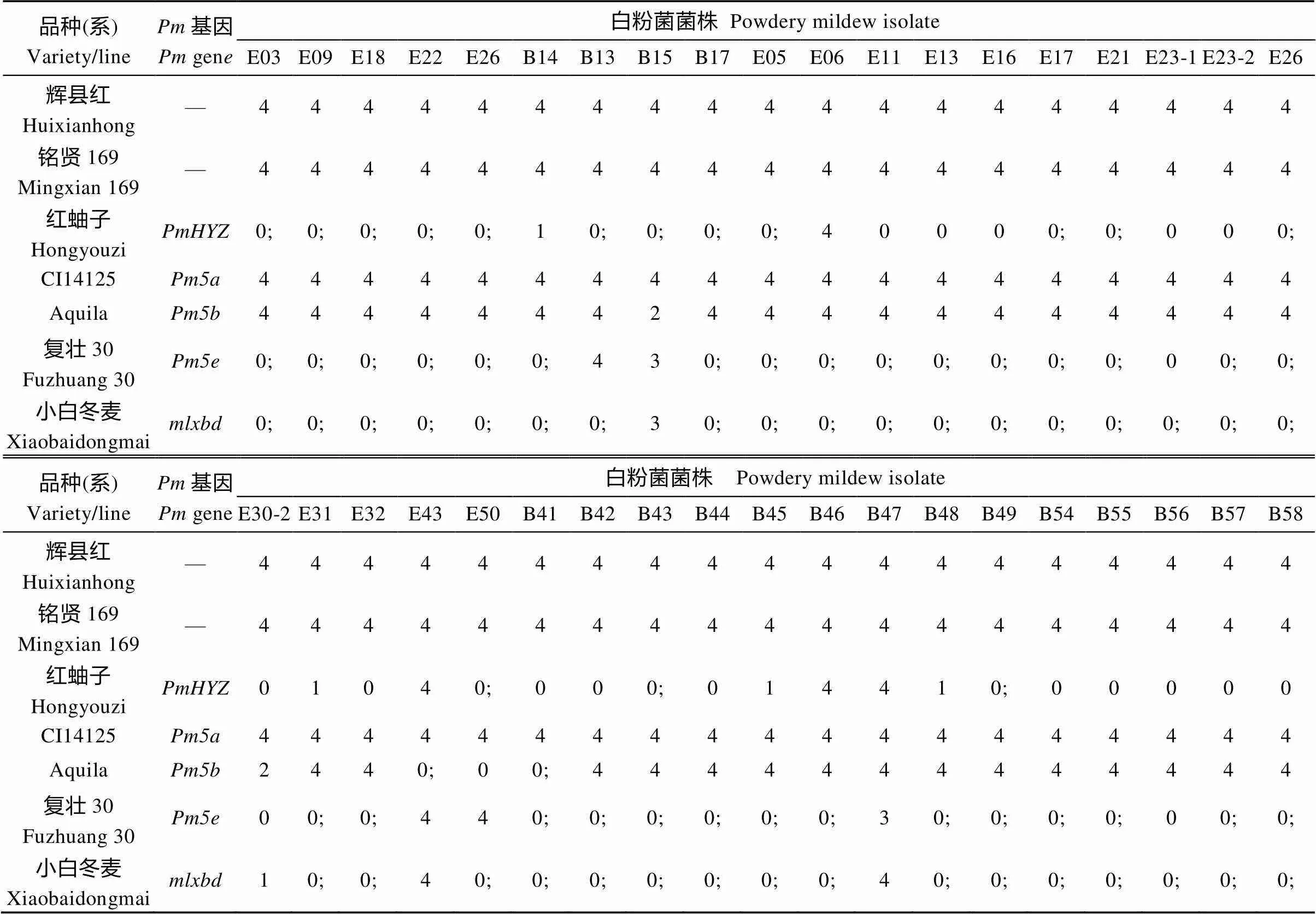
表2 红蚰子和部分抗白粉病基因供体对38个供试白粉菌菌株的反应
3 讨论
我国小麦农家品种‘红蚰子’是一个广谱的、优异的小麦白粉病抗源, 对供试的38个小麦白粉病菌株中的34个表现免疫到高抗。初步的遗传分析表明, ‘红蚰子’中携带单个隐性抗白粉病基因。进一步对该基因进行分子标记定位, 并开发育种可用的连锁标记, 将有助于该基因更好地应用于小麦抗病育种中。
农家品种具有丰富的遗传变异, 且具有很好的抗逆性和广适性, 是拓宽小麦栽培品种遗传基础和进行品种遗传改良的重要基因源[18]。我国小麦农家品种资源非常丰富, 有不少报道通过抗性遗传分析发掘其中的抗性基因。代君丽等[19]和王建超等[20]分别对农家品种‘大籽糙’和‘小红芒’的抗病性遗传分析表明这两个品种均含有1对隐性抗条锈基因; 翟雯雯等[21]对‘蚂蚱麦’、‘小白冬麦’、‘游白兰’、‘红卷芒’的抗白粉病遗传分析发现4个农家品种中均含有1对隐性抗白粉病基因。迄今为止, 在我国农家品种中也已经陆续报道了多个小麦抗白粉病基因, 如[7]、[9]、[10]、[11]、[12][13]、[14]和[2]。本研究通过多菌株抗谱鉴定和抗性遗传分析, 在我国小麦农家品种发现了1个优异的白粉病抗源‘红蚰子’, 并确定‘红蚰子’携带1对隐性抗白粉病基因, 不仅丰富了我国小麦农家品种的抗白粉病基因源, 还为该基因的进一步研究和利用奠定了基础。
目前已经报道的小麦抗白粉病基因中, 多数为显性遗传, 少数表现为隐性遗传, 包括、、、、和等[22-23]。本研究中所发现的小麦农家品种‘红蚰子’也携带隐性抗性基因。和在国内已经基本失去抗性[24],的载体品种‘Kormoran’对白粉菌E09菌株表现感病[25],的载体品种‘复壮30’对白粉病E18、E23菌株也表现感病, 然而本研究中的‘红蚰子’对白粉菌菌株E09表现抗病。本研究还区分了‘红蚰子’中抗性基因与已知抗性基因。因此‘红蚰子’所携带的白粉病抗性基因不同于、和。此外,[22]和[26]均来源于野生二粒小麦,来自一粒小麦, 而‘红蚰子’中的抗性基因来自于农家品种, 推测可能不同于、和。至于、和, 暂时还不能与‘红蚰子’中的抗性基因区分。然而, 要真正区分‘红蚰子’中的抗性基因与已报道的这些抗性基因, 还需要利用分子标记定位其中的抗性基因, 以及更系统的抗谱区分和等位性测试等。
致谢 感谢中国农业科学院的周益林和李洪杰老师提供白粉病的菌种, 感谢所有对本研究提供帮助的老师和同学。
[1] Wang Z Z, Li H W, Zhang D Y, et al. Genetic and physical mapping of powdery mildew resistance genein Chinese wheat landrace Hulutou[J]. Theoretical and Applied Genetics, 2015, 128(2): 365–373
[2] Xiao M G, Song F J, Jiao J F, et al. Identification of the geneon chromosome 7BS conferring resistance to powdery mildew in the Chinese wheat landrace Hongyanglazi[J]. Theoretical and Applied Genetics, 2013, 126(5): 1397–1403
[3] 何中虎, 兰彩霞, 陈新民, 等. 小麦条锈病和白粉病成株抗性研究进展与展望[J]. 中国农业科学, 2011, 44(11): 2193–2215 He Z H, Lan C X, Chen X M, et al. Progress and perspective in research of adult-plant resistance to stripe rust and powdery mildew in wheat[J]. Scientia Agricultura Sinica, 2011, 44(11): 2193–2215
[4] Petersen S, Lyerly J H, Worthington M L, et al. Mapping of powdery mildew resistance geneintrogressed frominto soft red winter wheat[J]. Theoretical and Applied Genetics, 2015, 128(2): 303–312
[5] Zhang R Q, Sun B X, Chen J, et al., a developmental-stage and tissue-specific powdery mildew resistance gene introgressed frominto common wheat[J]. Theoretical and Applied Genetics, 2016, 129(10): 1975–1984
[6] Li H H, Jiang B, Wang J C, et al. Mapping of novel powdery mildew resistance gene(s) fromchromosome 2P[J]. Theoretical and Applied Genetics, 2017, 130(1): 109–121
[7] Xu H X, Yi Y J, Ma P T, et al. Molecular tagging of a new broad-spectrum powdery mildew resistance allelein Chinese wheat landrace Niaomai[J]. Theoretical and Applied Genetics, 2015, 128(10): 2077–2084
[8] McIntosh R A, Dubcovsky J, Rogers W J, et al. Catalogue of gene symbols for wheat: 2017 supplement[EB/OL]. https://shigen. nig.ac.jp/wheat/komugi/genes/macgene/supplement 2017.pdf.
[9] Fu B S, Chen Y, Li N, et al.: A recessive powdery mildew resistance gene at thelocus identified in wheat landrace Xiaohongpi[J]. Theoretical and Applied Genetics, 2013, 126(4): 913–921
[10] Huang X Q, Wang L X, Xu M X, et al. Microsatellite mapping of the powdery mildew resistance genein common wheat (L.)[J]. Theoretical and Applied Genetics, 2003, 106(5): 858–865
[11] Huang X Q, Hsam S L K, Zeller F J. Chromosomal location of two novel genes for resistance to powdery mildew in Chinese landraces (L.. Thell.)[J]. Journal of Genetics and Breeding, 2000, 54: 311–317
[12] Huang X Q, Hsam S L K, Zeller F J, et al. Molecular mapping of the wheat powdery mildew resistance geneand marker validation for molecular breeding[J]. Theoretical and Applied Genetics, 2000, 101(3): 407–414
[13] Xue F, Wang C Y, Li C, et al. Molecular mapping of a powdery mildew resistance gene in common wheat landrace Baihulu and its allelism with[J]. Theoretical and Applied Genetics, 2012, 125(7): 1425–1432
[14] Ma H Q, Kong Z X, Fu B S, et al. Identification and mapping of a new powdery mildew resistance gene on chromosome 6D of common wheat[J]. Theoretical and Applied Genetics, 2011, 123(7): 1099–1106
[15] 李洪杰, 王晓鸣, 宋凤景, 等. 中国小麦品种对白粉病的抗性反应与抗病基因检测[J]. 作物学报, 2011, 37(6): 943–954 Li H J, Wang X M, Song F J, et al. Response to powdery mildew and detection of resistance genes in wheat cultivars from China[J]. Acta Agronomica Sinica, 2011, 37(6): 943–954
[16] 盛宝钦. 用反应型记载小麦苗期白粉病[J]. 植物保护, 1988, 14(1): 49 Sheng B Q. Score wheat seedlings resistance to powdery mildew by infection type[J]. Plant Protection, 1988, 14(1): 49
[17] 何家泌. 植物抗病遗传学[M]. 北京: 中国农业出版社, 1994 He J B. Plant Disease Resistance Genetics[M]. Beijing: China Agriculture Press, 1994
[18] 曹亚萍. 小麦的起源、进化与中国小麦遗传资源[J]. 小麦研究, 2008, 29(3): 1–10 Cao Y P. Origin, evolution and genetic resources of wheat in China[J]. Journal of Wheat Research, 2008, 29(3): 1–10
[19] 代君丽, 牛永春. 小麦农家品种大籽糙抗条锈性的遗传分析[J]. 遗传, 2003, 25(3): 311–313 Dai J L, Niu Y C. Inheritance of stripe rust resistance in the native wheat variety dazicao from China[J]. Hereditas, 2003, 25(3): 311–313
[20] 王建超, 冯晶, 王凤涛, 等. 我国小麦农家品种‘小红芒’成株抗条锈性遗传分析[J]. 植物保护, 2015, 41(1): 154–157 Wang J C, Feng J, Wang F T, et al. Genetic analysis on the adult plant resistance of a wheat landrace ‘Xiaohongmang’ to[J]. Plant Protection, 2015, 41(1): 154–157
[21] 翟雯雯, 段霞瑜, 周益林, 等. 我国小麦地方品种蚂蚱麦、小白冬麦、游白兰、红卷芒抗白粉病性遗传分析[J]. 植物保护, 2008, 34(1): 37–40 Zhai W W, Duan X Y, Zhou Y L, et al. Inheritance of resistance to powdery mildew in four Chinese landraces[J]. Plant Protection, 2008, 34(1): 37–40
[22] Rong J K, Millet E, Manisterski J, et al. A new powdery mildew resistance gene: Introgression from wild emmer into common wheat and RFLP-based mapping[J]. Euphytica, 2000, 115(2): 121–126
[23] Xu H X, Yao G Q, Xiong L, et al. Identification and mapping of: A recessive powdery mildew resistance gene in an einkorn (L.) accession[J]. Theoretical and Applied Genetics, 2008, 117(4): 471–477
[24] Li G Q, Fang T L, Zhang H T, et al. Molecular identification of a new powdery mildew resistance geneon chromosome 3BL derived from wild emmer (var.)[J]. Theoretical and Applied Genetics, 2009, 119(3): 531–539
[25] Nematollahi G, Mohler V, Wenzel G, et al. Microsatellite mapping of powdery mildew resistance allelefrom common wheat line IGV1–455[J]. Euphytica, 2008, 159(3): 307–313
[26] Hua W, Liu Z J, Zhu J, et al. Identification and genetic mapping of, a new recessive wheat powdery mildew resistance gene derived from wild emmer (var.)[J]. Theoretical and Applied Genetics, 2009, 119(2): 223–230
曹燕威, 许红星, 李秀全, 安调过. 小麦农家品种‘红蚰子’苗期白粉病抗性鉴定和遗传分析[J]. 中国生态农业学报, 2017, 25(12): 1842-1847
Cao Y W, Xu H X, Li X Q, An D G. Identification and genetic analysis of powdery mildew resistance at seedling stage in ‘Hongyouzi’ Chinese wheat landrace[J]. Chinese Journal of Eco-Agriculture, 2017, 25(12): 1842-1847
Identification and genetic analysis of powdery mildew resistance at seedling stage in ‘Hongyouzi’ Chinese wheat landrace*
CAO Yanwei1,3, XU Hongxing1**, LI Xiuquan2, AN Diaoguo1
(1. Center for Agricultural Resources Research, Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Shijiazhuang 050022, China; 2. Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China)
Powdery mildew, caused byf. sp.(), is a devastating foliar disease of wheat. The identification and utilization of elite resistant germplasm is an effective control measure of the disease. At present, most wheat cultivars/lines in China’s wheat production are susceptible to powdery mildew. Moreover, few powdery mildew resistance genes are used in China. Therefore, it is essential to identify more effective and elite resistance sources and genes. The ‘Hongyouzi’ Chinese wheat landrace (‘Jing 2350’) has shown immune to high resistant of 34 out of 38isolates at seedling stage and immune or nearly immune in the field to a composites ofisolates at mature stage in Shijiazhuang, China. To further study the resistance feature and identify the resistance gene (s) of ‘Hongyouzi’, genetic analysis of F1plants, F2populations and their derived F2∶3families respectively from crosses of ‘Huixianhong’ בHongyouzi’ and ‘Hongyouzi’ בMingxian169’ were conducted at seedling stage. The results showed that all F1plants derived from the combinations of ‘Huixianhong’בHongyouzi’ and ‘Hongyouzi’בMingxian169’ were susceptible toisolate E09. The ratios of resistant F2plants to susceptible plantsconformed as 1︰3 and those of homozygous resistant F2∶3lines︰heterozygous lines︰homozygous susceptible lines conformed as 1︰2︰1. These results indicated that the resistance of ‘Hongyouzi’ toisolate E09 was conferred by a single recessive resistance gene, temporarily named. ‘Hongyouzi’ was the elite powdery mildew resistance sources of Chinese wheat landraces, thus it was useful to effectively use elite resistance source and resistance gene in breeding resistant crops.
Wheat; Powdery mildew; Wheat landrace; Hongyouzi; Genetic analysis
, E-mail: hongxingxu@sjziam.ac.cn
Apr. 15, 2017;
Jun. 23, 2017
10.13930/j.cnki.cjea.170321
S332.2
A
1671-3990(2017)12-1842-06
许红星, 主要从事小麦抗性基因发掘与利用。E-mail: hongxingxu@sjziam.ac.cn
曹燕威, 主要研究方向为小麦新基因的发掘。E-mail: yanwei_2014@163.com
2017-04-15
2017-06-23
* This study was supported by Hebei Provincial Natural Science Foundation (C2016503016).
* 河北省自然科学基金项目(C2016503016)资助

