通脉方中异黄酮类成分清除DPPH自由基的活性研究△
王付荣,杨雁芳,杨秀伟
(北京大学 天然药物及仿生药物国家重点实验室,药学院 天然药物学系,北京 100191)
通脉方中异黄酮类成分清除DPPH自由基的活性研究△
王付荣,杨雁芳,杨秀伟*
(北京大学 天然药物及仿生药物国家重点实验室,药学院 天然药物学系,北京 100191)
目的通脉方是由葛根、丹参和川芎3味药按质量1∶1∶1组成的复方。本文研究通脉方中3′-羟基葛根素、3′-甲氧基葛根素、3′-甲氧基大豆苷、3′-羟基泰国野葛根素等25种异黄酮类化合物清除DPPH(2,2′-diphenyl-1-picrylhydrazyl)自由基的活性。方法通过DPPH自由基清除实验,对25个异黄酮类化合物的体外抗氧化活性进行测定。结果体外抗氧化研究表明,通脉方中的3′-羟基葛根素、3′-羟基泰国野葛根素、3′-甲氧基葛根素和3′-甲氧基大豆苷具有清除DPPH自由基的活性,呈浓度依赖性,它们的IC50值分别为(9.9±0.6)、(13.7±1.4)、(57.3±1.2)和(66.4±2.3) μmol·L-1。在同样条件下,阳性对照药丁羟甲苯和抗坏血酸的IC50值分别为(75.4±6.9)和(16.5±1.6) μmol·L-1。结论本研究结果能够预测3′-羟基葛根素、3′-羟基泰国野葛根素、3′-甲氧基葛根素和3′-甲氧基大豆苷可能是通脉方生物活性物质基础的重要组成部分。
通脉方;异黄酮;3′-羟基葛根素;3′-羟基泰国野葛根素;3′-甲氧基葛根素;3′-甲氧基大豆苷;DPPH自由基
由传统中药葛根[Puerarialobata(Willd.)Ohwi的干燥根,Puerariae Lobatae Radix,PLR]、丹参(SalviamiltiorrhizaBge.的干燥根,Salviae Miltiorrhizae Radix,SMR)、川芎(LigusticumchuanxiongHort.的干燥根茎,Chuanxiong Rhizoma,CXR)3 味中药按质量1∶1∶1组成的“通脉方”,其制剂有《中华人民共和国卫生部药品标准·中药成方制剂》第4册收载的“通脉冲剂”[1]和第20册收载的“通脉口服液”[2]等。“通脉方”3味药配伍能活血、行气、升阳,协同作用相得益彰,共奏活血通脉之功效;而且组方药味精当,易于研制为现代中药。前报报道了其水提取物的化学成分[3-4]和人肠内菌生物转化[5]研究,定量分析结果表明“通脉方”中的主要化学成分为异黄酮类化合物[6]。临床上“通脉方”用于缺血性心脑血管疾病的治疗,对动脉硬化、脑血栓、脑缺血、冠心病、心绞痛等有较好的疗效。这些疾病的发生均与体内自由基过量产生有密切关系。以葛根素为代表的异黄酮类化合物是葛根中的主要成分,具有多种心血管药理活性[7-9]。通脉颗粒在急性心肌缺血模型比格犬体内药动学研究结果表明,3′-甲氧基葛根素和3′-羟基葛根素有较高的血药浓度[10]。3′-羟基葛根素、3′-羟基泰国野葛根素、3′-甲氧基葛根素和3′-甲氧基大豆苷均来自“通脉方”组方药味的葛根[4,6]。本文报道这些异黄酮类化合物对DPPH自由基的清除活性。
1 材料
1.1 药品和试剂
受试异黄酮类化合物从通脉方中分离纯化得到,分别为大豆苷元(daidzein,1)、芒柄花素(formononetin,2)、5-羟基芒柄花苷(5-hydroxylononin,3)、芒柄花苷(ononin,4)、大豆苷(daidzin,5)、3′-甲氧基葛根素(3′-methoxypuerarin,6)、染料木苷(genistin,7)、葛根素(puerarin,8)、芒柄花素-8-C-β-D-呋喃芹糖基-(1→6)-O-β-D-吡喃葡萄糖苷[formononetin-8-C-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,9]、芒柄花素-7-O-β-D-呋喃芹糖基-(1→6)-O-β-D-吡喃葡萄糖苷[formononetin-7-O-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,10]、澳白檀苷(lanceolarin,11)、葛花宁(kakkanin,12)、大豆苷元-7,4′-二-O-β-D-吡喃葡萄糖苷(daidzein-7,4′-di-O-β-D-glucopyranoside,13)、泰国野葛根素(mirificin,14)、3′-羟基葛根素(3′-hydroxypuerarin,15)、3′-甲氧基大豆苷(3′-methoxydaidzin,16)、芒柄花素-8-C-β-D-吡喃木糖基-(1→6)-O-β-D-吡喃葡萄糖苷[formononetin-8-C-β-D-xylopyranosyl-(1→6)-O-β-D-glucopyranoside,17]、染料木素-8-C-β-D-呋喃芹糖基-(1→6)-O-β-D-吡喃葡萄糖苷[genistein-8-C-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,18]、染料木素-7-O-β-D-呋喃芹糖基-(1→6)-O-β-D-吡喃葡萄糖苷[genistein-7-O-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside;ambocin,19]、3′-羟基泰国野葛根素(3′-hydroxymirificin,20)、6″-O-β-D-木糖基葛根素(6″-O-β-D-xylosylpuerarin,21)[4]、鹰嘴豆芽素A-8-C-β-D-呋喃芹糖基-(1→6)-O-β-D-吡喃葡萄糖苷[biochanin A-8-C-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,22]、3′-甲氧基大豆苷元-7,4′-二-O-β-D-吡喃葡萄糖苷(3′-methoxydaidzein-7,4′-di-O-β-D-glucopyranoside,23)、大豆苷元-7-O-β-D-吡喃葡萄糖基-(1→4)-O-β-D-吡喃葡萄糖苷[daidzein-7-O-β-D-glucopyranosyl-(1→4)-O-β-D-glucopyranoside,24]、大豆苷元-7-O-α-D-吡喃葡萄糖基-(1→4)-O-β-D-吡喃葡萄糖苷[daidzein-7-O-α-D-glucopyranosyl-(1→4)-O-β-D-glucopyranoside,25][3],高效液相色谱-二极管阵列检测器(HPLC-DAD)面积归一化法测定纯度在98%以上,化学结构见图1。
DPPH(2,2′-diphenyl-1-picrylhydrazyl)和抗坏血酸(ascorbic acid,Vc)均购自Sigma-Aldrich Co.(St.Louis,MO,USA);丁羟甲苯(butylated hydroxytoluene,BHT)购自DIMA Technology Inc.(California,USA);96孔板购自Corning Costar公司(Cambridge,MA,USA)。
1.2 仪器
AR4120型万分之一电子天平[奥豪斯国际贸易(上海)有限公司];UVmaxKinetic Microplate Reader(Molecular Dynamics,Inc.,Sunnyvale,California,CA,USA)。
2 方法
2.1 溶液的配制
2.1.1 DPPH自由基甲醇溶液 200 μmol·L-1甲醇溶液,备用。
2.1.2 样品溶液 分别精密称取1.1项下的受试异黄酮或阳性对照药BHT、Vc,用甲醇溶解并稀释配制成不同浓度的供试品溶液,备用。
2.1.3 空白对照溶液 不加样品,按样品溶液制备方法进行配制,备用。
2.2 清除DPPH自由基活性测定
按文献报道方法[11-12],测定阳性对照药和25个异黄酮清除DPPH自由基的活性。具体操作方法主要为:分别精密吸取各供试品溶液150 μL置于96孔板上,再精密吸取50 μL浓度为200 μmol·L-1的DPPH自由基甲醇溶液置于96孔板与各样品溶液混合均匀,立即室温下避光30 min,用酶标仪测定490 nm下的吸光度值,按公式(1)计算各样品对DPPH自由基的清除率(I,%)。
I(%)=[(A0-A1)/A0]×100
(1)
式中:A0—空白对照的吸光度值;A1—样品的吸光度值。
3 结果
3.1 阳性对照药BHT和VC对DPPH自由基清除的IC50值
精密称取阳性对照药BHT用甲醇溶解并稀释配制成浓度为2.5、10、25、50、100、200、500、1000 μmol·L-1的甲醇溶液。
精密称取阳性对照药VC用甲醇溶解并稀释配制成浓度为2.5、10、20、30、50、80、100、1000 μmol·L-1的甲醇溶液。
按实验方法进行操作,测定吸光度值,按公式(1)计算清除率。
将阳性对照药浓度分别取对数值,以所得对数值lg C为横坐标,以清除率为纵坐标,用OringinPro 7.5 SR1软件做S型曲线,得出清除率为50%时阳性对照药的浓度,即为IC50值。两个阳性药BHT和VC的S型曲线图见图2,它们的IC50值分别为(75.4±6.9)、(16.5±1.6)μmol·L-1。
3.2 受试化合物对DPPH自由基的清除活性
分别精密称取各受试化合物,用甲醇溶解并稀释配制成浓度为0.01、0.1、1、10、100、1000 μmol·L-1的甲醇溶液。
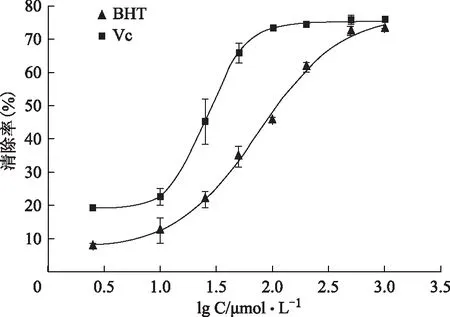
图2 阳性对照药BHT和VC的曲线图
按实验方法进行操作,测定吸光度值,按公式(1)计算清除率I(%),结果见表1。
表1 通脉方中25个异黄酮类化合物不同浓度下清除DPPH自由基的结果
由表1结果可知,受试化合物6(3′-甲氧基葛根素)、15(3′-羟基葛根素)、16(3′-甲氧基大豆苷)、20(3′-羟基泰国野葛根素)清除DPPH自由基活性呈浓度相关性。
将受试化合物6、15、16和20的浓度取对数值,以所得对数值lgC为横坐标,以清除率为纵坐标,用OringinPro 7.5 SR1软件做S型曲线(见图3),得出清除率为50%时它们的浓度,即为它们的IC50值,见表2。
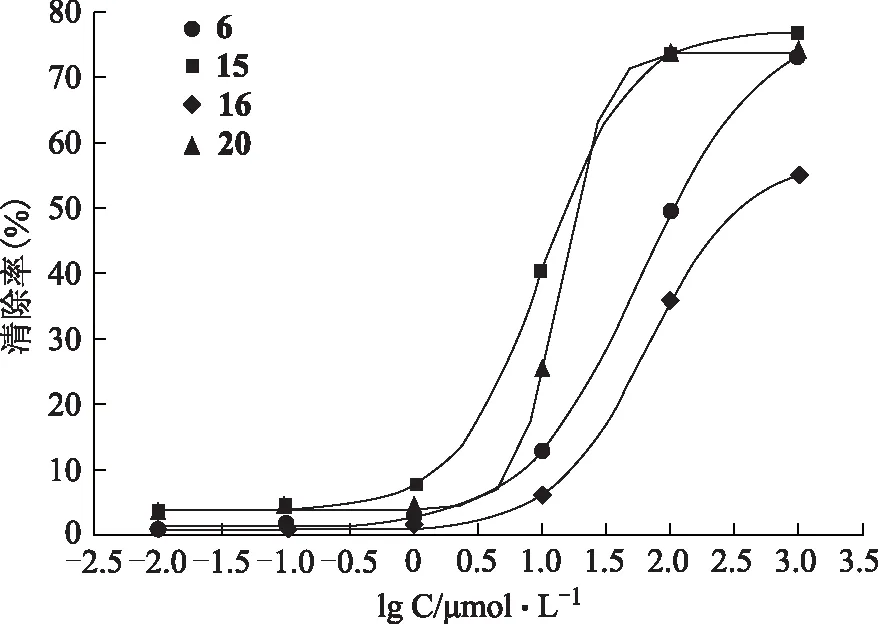
图3 4个异黄酮化合物的DPPH自由基清除率曲线图

表2 4个异黄酮化合物清除DPPH自由基的IC50值
4 讨论
自由基的产生、清除与危害是自由基生物学的主要内容,近27年来这门新兴学科已渗透或扩展到几乎全部的生命科学中。研究发现,氧化应激和抗氧化机制的平衡失调导致体内氧自由基过剩与心脑血管疾病的发生有密切关系[13-14],因此,可应用抗氧化剂对心脑血管疾病进行防治。本文对通脉方中25个异黄酮类化合物清除DPPH自由基活性的研究结果表明,3′-羟基葛根素、3′-羟基泰国野葛根素、3′-甲氧基葛根素、3′-甲氧基大豆苷清除DPPH自由基的活性良好;其中,3′-羟基葛根素和3′-羟基泰国野葛根素的活性甚至优于阳性对照药抗坏血酸(Vc),这两个异黄酮类化合物结构的共同特征是B环都具有3′-OH和4′-OH;3′-甲氧基葛根素和3′-甲氧基大豆苷的活性虽不及3′-羟基葛根素和3′-羟基泰国野葛根素,但活性均比阳性对照药丁羟甲苯(BHT)强,它们的共同特征是都具有3′-OCH3和4′-OH。
从异黄酮类化合物的结构上进行分析,发现有两个酚羟基取代在异黄酮类化合物的母核B环上的C-3′和C-4′位上,可大大增强该化合物清除DPPH自由基的活性。当C-3′位上的羟基醚化为甲氧基而仍具有4′-OH时,化合物的活性有所降低,但活性仍比阳性对照药丁羟甲苯强。
前文我们报道了通脉方提取物对大鼠具有显著的保护心肌细胞缺氧复氧损伤的作用[15],本文结果提示这些化合物在通脉方对心脑血管疾病治疗上可能会产生重要作用,它们可能是通脉方生物活性物质基础的重要组成部分之一[16],有待于深入研究。
[1] 中华人民共和国卫生部.中华人民共和国卫生部药品标准·中药成方制剂:第4册[S].1991:169.
[2] 中华人民共和国卫生部.中华人民共和国卫生部药品标准·中药成方制剂:第20册[S].1991:302.
[3] Wang F R,Yang X W,Zhang Y,et al.Three new isoflavone glycosides from Tongmai granules[J].J Asian Nat Prod Res,2011,13(4):319-329.
[4] 王付荣,葛喜珍,通脉方化学成分[J].中国实验方剂学杂志,2011,17(20):61-69.
[5] 吴帅,徐嵬,杨秀伟.人源肠内菌转化通脉方的化学研究[J].中国中药杂志,2013,38(20):3510-3519.
[6] Wang F R,Zhang Y,Yang X B,et al.Rapid determination of 30 polyphenols in Tongmai Formula,a combination of Puerariae Lobatae Radix,Salviae Miltiorrhizae Radix et Rhizoma,and Chuanxiong Rhizoma,vialiquid chromatography-tandem mass spectrometry[J].Molecules,2017,22(4):545-554.
[7] Rong H J,Stevens J F,Deinzer M L,et al.Identification of isoflavones in the roots ofPuerarialobata[J].Planta Med,1998,64(7):620-627.
[8] Sun X H,Ding J P,Li H,et al.Activation of large-conductance calcium-activated potassium channels by puerarin:the underlying mechanism of puerarin-mediated vasodilation[J].J Pharmacol Exp Ther,2007,323(1):391-397.
[9] Yan L P,Zhuang Y L,Chan S W,et al.Analysis of the mechanisms underlying the endothelium-dependent antivasoconstriction of puerarin in rat aorta[J].Naunyn-Schmiedeberg’s Arch Pharmacol,2009,379(6):587-597.
[10] 张颖,刘春旭,李磊,等.通脉颗粒在急性心肌缺血模型比格犬体内药动学研究[J].中国中药杂志,2016,41(4):737-742.
[11] Sharma O P,Bhat T K.DPPH antioxidant assay revisited[J].Food Chem,2009,113(4):1202-1205.
[12] Zheng G M,Xu L X,Wu P,et al.Polyphenols from longan seeds and their radical-scavenging activity[J].Food Chem,2009,116(2):433-436.
[13] 翟艳红.氧自由基与心血管系统疾病的关系[J].医学综述,2001,7(5):280-282.
[14] 宋玉菲.阿尔茨海默病与氧化应激[J].国际神经病学神经外科学杂志,2015,42(3):290-293.
[15] 张颖,李丹,韩笑,等.通脉颗粒活血通脉功效的指征药效成分研究[J].世界科学技术—中医药现代化,2015,17(7):1398-1404.
[16] 杨秀伟.中药物质基础研究是中药继承、发展、创新的关键科学问题[J].中国中药杂志,2015,40(17):3429-3434.
StudyonScavengingDPPHFree-radicalActivityofIsoflavonesinTongmaiFormula
WANGFurong,YANGYanfang,YANGXiuwei*
(StateKeyLaboratoryofNaturalandBiomimeticDrugs,DepartmentofNaturalMedicines,SchoolofPharmaceuticalSciences,PekingUniversity,Beijing100191,China)
Objective:Tongmai formula(TMF)is a drug combination of three components including Puerariae Lobatae Radix[roots ofPuerarialobata(Willd.)Ohwi],Salviae Miltiorrhizae Radix(roots ofSalviamiltiorrhizaBge.)and Chuanxiong Rhizoma(rhizomes ofLigusticumchuanxiongHort.)in a weight ratio of 1∶1∶1.The scavenging activity against DPPH free-radical by isoflavonoid compounds isolated from TMF were studied in this paper.The assayed isoflavonoid compounds include daidzein,formononetin,5-hydroxylononin,ononin,daidzin,3′-methoxypuerarin,genistin,puerarin,formononetin-8-C-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,formononetin-7-O-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,lanceolarin,kakkanin,daidzein-7,4′-di-O-β-D-glucopyranoside,mirificin,3′-hydroxypuerarin,3′-methoxydaidzin,formononetin-8-C-β-D-xylopyranosyl-(1→6)-O-β-D-glucopyranoside,genistein-8-C-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,genistein-7-O-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside(ambocin),3′-hydroxymirificin,6″-O-β-D-xylosylpuerarin,biochanin-A-8-C-β-D-apiofuranosyl-(1→6)-O-β-D-glucopyranoside,3′-methoxydaidzein-7,4′-di-O-β-D-glucopyranoside,daidzein-7-O-β-D-glucopyranosyl-(1→4)-O-β-D-glucopyranoside,and daidzein-7-O-α-D-glucopyranosyl-(1→4)-O-β-D-glucopyranoside.MethodsTheinvitroantioxidant potentials of above-mentioned 25 isoflavonoid compounds were evaluated by DPPH(2,2′-diphenyl-1-picrylhydrazyl)free-radical scavenging test.ResultsInvitroantioxidant studies showed that 3′-hydroxypuerarin,3′-hydroxymirificin,3′-methoxypuerarin,and 3′-methoxydaidzin in TMF possessed notable antioxidant effects on DPPH free-radical scavenging in a concentration-dependent manner and their values of IC50were(9.9±0.6),(13.7±1.4),(57.3±1.2),and(66.4±2.3)μmol·L-1,respectively.While the IC50values of butylated hydroxytoluene and ascorbic acid used as the positive control under the same condition were(75.4±6.9)and(16.5±1.6)μmol·L-1,respectively.ConclusionThe study result could predict that 3′-hydroxypuerarin,3′-hydroxymirificin,3′-methoxypuerarin,and 3′-methoxydaidzin may be an important part of the bioactive material basis of TMF.
Tongmai formula;isoflavonoid;3′-hydroxypuerarin;3′-hydroxymirificin;3′-methoxypuerarin;3′-methoxydaidzin;DPPH free-radical
国家科技重大新药创制专项(2009ZX09502-006);“十二五”国家科技支撑计划(2011BAI07B08)
*
杨秀伟,教授,研究方向:生物活性天然产物和药物的ADMET/Act.研究;Tel:(010)82801569,E-mail:xwyang@bjmu.edu.cn
10.13313/j.issn.1673-4890.2017.11.010
2017-03-23)

