秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型用于外排泵抑制剂逆转环丙沙星耐药的研究
段欣冉,姜志辉,杨相海,李 健
(1 广东药科大学,广东 广州 510000; 2 广州军区广州总医院,广东 广州 510000; 3 长沙医学院,湖南 长沙 410000)
·论著·
秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型用于外排泵抑制剂逆转环丙沙星耐药的研究
段欣冉1,2,姜志辉2,杨相海3,李 健1,2
(1 广东药科大学,广东 广州 510000; 2 广州军区广州总医院,广东 广州 510000; 3 长沙医学院,湖南 长沙 410000)
目的建立秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型,用于外排泵抑制剂(EPIs)逆转泛耐药鲍曼不动杆菌(XDR-AB)对于环丙沙星耐药的研究。方法建立秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型,选用6种EPIs(CCCP、PAβN、NMP、奥美拉唑、利血平和维拉帕米)与氟喹诺酮类药物环丙沙星联合使用,记录秀丽隐杆线虫生存率以评价体内药效,同时进行毒性试验及体外药敏试验。结果不同浓度XDR-AB对秀丽隐杆线虫的致死情况不同,选择5×106CFU/mL作为XDR-AB感染秀丽隐杆线虫浓度。秀丽隐杆线虫生存实验显示,XDR-AB感染线虫3 h后线虫组与加入多粘菌素B的对照组生存曲线比较,差异无统计学意义(χ2=3.154,P>0.05),感染线虫6、9 h,与对照组比较,差异均有统计学意义(均P<0.001),但感染6 h与9 h组的生存曲线比较,差异无统计学意义(χ2=0.669,P>0.05),最终选择6 h作为感染时长,36 h为合适的抗菌药物治疗时长。环丙沙星联合EPIs应用于感染模型实验中,低浓度的PAβN、NMP、奥美拉唑、利血平可将线虫存活率分别提高30%~40%、15%~20%、20%~30%、20%,高浓度的维拉帕米可将感染线虫的存活率提高30%左右。体外药敏试验和毒性试验结果显示,环丙沙星分别与CCCP、奥美拉唑和维拉帕米联合可降低MIC至原来的1/4,分别联合PAβN,NMP和利血平可降低MIC至原来的1/2,其中CCCP体外联合抑菌效果最佳,但毒性较大不适于体内药效研究。结论首次成功构建了秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型,得到6种EPIs逆转环丙沙星耐药性的初步研究。
鲍曼不动杆菌;秀丽隐杆线虫;外排泵抑制剂;环丙沙星
鲍曼不动杆菌(Acinetobacterbaumannii)是一类非发酵型革兰阴性杆菌,广泛存在于自然界和医院环境中,是引起医院感染最常见的条件致病菌之一[1]。 鲍曼不动杆菌可引起包括呼吸道感染、泌尿系统感染、菌血症、伤口感染、脑膜炎和呼吸机相关肺炎等多种感染性疾病。随着抗菌药物在临床中的广泛使用,该菌对常用抗菌药物产生了极大的耐药性,甚至出现了多重耐药鲍曼不动杆菌(MDR-AB)和广泛耐药鲍曼不动杆菌(extensively drug-resistantAcinetobacterbaumannii,XDR-AB),给临床治疗带来极大的挑战[2]。
鲍曼不动杆菌耐药性是通过多种耐药机制介导的,其中细菌主动外排泵的过度表达可使抗菌药物不能在细胞内蓄积达到作用浓度,是产生耐药的一个重要原因。在不动杆菌属中,耐药-结节-分化(resistance-nodulation-division,RND)家族对细菌耐药的产生有重要作用,其中AdeABC、AdeIJK、AdeFGH外排系统主要存在于鲍曼不动杆菌,可外排多种抗菌药物,如喹诺酮类、氨基糖苷类、四环素、红霉素等引起耐药[3-4]。喹诺酮类药物如环丙沙星,曾作为治疗鲍曼不动杆菌感染的一线药物,但由于鲍曼不动杆菌对其产生了广泛的耐药,导致临床已基本摒弃用环丙沙星治疗耐药鲍曼不动杆菌感染。鲍曼不动杆菌对环丙沙星的耐药机制主要是外排泵的过度表达,环丙沙星合用外排泵抑制剂(efflux pump inhibitors,EPIs)使其重新对耐药菌株发挥作用,已成为治疗鲍曼不动杆菌感染的潜在有效途径[5-6]。目前,关于EPIs的研究多局限于体外实验。不同的EPIs在体内是否能逆转鲍曼不动杆菌的耐药性达到较好的抑菌效果,是否会产生较大的毒性影响其使用,是目前EPIs应用的主要问题。秀丽隐杆线虫全身透明易于观察,培养成本低,可操控性强,具有结构简单、遗传背景清晰、生命周期短等特点。研究[7-8]发现,线虫有约40%的基因与人类疾病具有明确的同源基因,已成为现代发育生物学、遗传学、基因组学研究的重要模式生物,在病原菌中的研究也越来越广泛。通过建立秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型,将环丙沙星联合多种EPIs应用于模型中,筛选对XDR-AB有效的组合药物,为XDR-AB的治疗提供新方法和思路。
1 材料与方法
1.1 材料
1.1.1 线虫和菌种 秀丽隐杆线虫(Caenorhabditiselegansglp-4;sek-1)、大肠埃希菌(Escherichiacoli,E.coli)OP50由中山大学药学院陈缵光教授惠赠,质控菌株大肠埃希菌ATCC 25922,临床分离的XDR-AB由广州军区广州总医院检验科提供,采用法国生物梅里埃公司VITEK 2微生物全自动鉴定药敏仪鉴定。
1.1.2 药物 CCCP(carbonyl cyanide 3-chlorophenyl hydrazone)、PAβN(phenyl-arginine-β-naphthylamide)、多粘菌素B(polymyxin B)、萘啶酸(nalidixic acid)、维拉帕米(verapamil)、利血平(reserpine)、奥美拉唑(omeprazole)均购自美国Sigma化学试剂公司。NMP[1-(1-naphthylmethyl)-piperazine]、环丙沙星盐酸盐(ciprofloxacin hydrochloride monohydrate)购自阿拉丁试剂公司。荧光探针Dil(1,1-双十八烷基-3,3,3’,3’-四甲基吲哚二碳菁)购自上海麦克林生化科技有限公司。
1.1.3 培养基 LB(Luria-Bertani)固体培养基:LB粉4.2 g,琼脂粉3 g,加蒸馏水200 mL,121℃高压蒸汽灭菌15 min后4 ℃保存备用。E.coli OP50:将E.coli OP50接种至LB固体培养基上,于37 ℃二氧化碳温箱中孵育24 h。NGM(nematode growth medium)培养基:胰蛋白胨1.5 g,琼脂粉10.8 g,NaCl 1.80 g,加蒸馏水585 mL后121℃高压蒸汽灭菌15 min,待温度降低至60℃以下时,加入滤过除菌5 mg/mL的胆固醇660 μL,1 mol/L的CaCl2660 μL,1 mol/L的MgSO4660 μL,并加入磷酸缓冲液(K2HPO4和KH2PO4) 13 mL,分装至直径9 cm的培养皿中,待平板冷却凝固后,取E.coli OP50单个菌落涂布于培养基上,37℃孵育24 h后,4℃保存备用。20%BHI液体培养基(brain-heart infusion medium):4.83 g Na2HPO4·12H2O,0.96 g KH2PO4,1.60 g NaCl,0.04 g MgSO4,2.96 g BHI,10 μmol/L FeCl3,加蒸馏水至400 mL,121℃高压蒸汽灭菌15 min,待温度降低至60℃以下时,加入萘啶酸使其终浓度为5 μg/mL,于4℃保存备用。CAMHB培养基:6.6 g CAMHB,加入300 mL蒸馏水121℃高压蒸汽灭菌15 min,于4℃保存备用。
1.1.4 缓冲液及试剂 M9缓冲液:3.02 g Na2HPO4·12H2O,0.6 g KH2PO4,1 g NaCl,0.024 g MgSO4,加入蒸馏水200 mL,121℃高压蒸汽灭菌15 min 后备用;线虫裂解液:0.4 g NaOH,2 mL HClO溶液,4 mL 蒸馏水,现用现配。
1.1.5 设备 Leica DMI 4000型荧光显微镜(徕卡显微系统上海贸易有限公司),WSI-3000倒置生物显微镜(广州微域光学仪器有限公司),SW-CJ-1F型净化工作台(上海博讯实业有限公司医疗设备厂),TDZ5-WS多管架自动平衡离心机(长沙湘仪离心机仪器有限公司),DHP-9012型恒温培养箱、LRH-70生化培养箱(上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 线虫的培养和同期化处理 选用glp-4、sek-1基因缺陷型线虫,相较N2野生型线虫,其在25℃下不能产卵,且具有免疫缺陷性[9]。线虫按照文献标准程序进行培养[7]。线虫感染实验前4 d准备同步化的线虫:将线虫用M9缓冲液从NGM板上洗下收集至15 mL离心管,500 r/min离心1 min,取上清液至剩余3.5 mL的线虫液,加2.5 mL的裂解液充分振摇3 min,加M9缓冲液至15 mL,1 500 r/min离心1 min,洗涤5次,分离得到虫卵,15℃振荡16 h虫卵孵化至L1期的线虫,将其置于NGM平板的E.coli OP50菌苔上,25℃培养48 h,得到同步化的L4期线虫[8]。
1.2.2 菌悬液的制备 将冻存在-80℃的XDR-AB菌株复苏,划线培养于LB固体培养基,37℃培养24 h 备用。
1.2.3 线虫-泛耐药鲍曼不动杆菌感染模型的建立 从细菌平板上取XDR-AB单个菌落,于20%BHI中使用光度比浊仪调整菌浓度至0.5麦氏单位(约为1.5×108CFU/mL),将同步化后培养至L4期的线虫从平板上洗下,离心(500 r/min,1 min),重复2~3次,将线虫悬浮于终浓度为5×106CFU/mL的XDR-AB中感染6 h后,用BHI液体培养基清洗至少3次,将线虫分配置96孔板中,15~20条/孔加至180 μL,治疗组加20 μL的待测药物(溶于1%DMSO),阳性对照组加入2 μg/mL的多粘菌素B(PB) 20 μL(溶于1%DMSO),阴性对照组加入1%DMSO 20 μL,于25℃、湿度为85%的条件下培养30 h,在显微镜下观察线虫存活率。
1.2.4 EPIs的毒性试验 用20%BHI液体培养基将同步化培养至L4期的线虫洗至15 mL离心管中,500 r/min,1 min清洗3次,15~20条/孔分装至96孔板中至180 μL,分别加系列浓度的EPIs:CCCP、PAβN(分别为5、10、15、20、25、30、35、40 μg/mL),NMP、奥美拉唑、维拉帕米、利血平(分别为10、20、30、40、50、60、70、80 μg/mL)20 μL,于25℃湿度为85%的条件下非共培养30 h,在显微镜下观察线虫存活率,判断各EPIs对正常线虫的毒性作用。
1.2.5 抗菌药物环丙沙星及各EPIs的体外药敏试验 微量肉汤稀释法测定盐酸环丙沙星最小抑菌浓度(MIC)。以大肠埃希菌ATCC 25922,鲍曼不动杆菌ATCC 19606作为质控菌株同批进行测试。配制5 120 μg/mL的盐酸环丙沙星储备液,取13支无菌试管,用CAMHB培养基配制系列浓度的盐酸环丙沙星512、256、128、64、32、16、8、4、2、1、0.5、0.25、0.125 μg/mL,各取100 μL于96孔板中;使用光度比浊仪,取新鲜培养的细菌菌落,调整菌悬液浓度为0.5麦氏单位,取100 μL加入各孔使菌终浓度为5×106CFU/mL,各孔抗菌药物浓度为256、128、64、32、16、8、4、2、1、0.5、0.25、0.125、0.0625 μg/mL,置于35℃孵箱中孵育16~20 h,结果评定依据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)标准,单位为μg/mL。测定各EPIs的MIC值以及盐酸环丙沙星加入EPIs后的MIC值,依据毒性试验结果分别加入各EPIs,并比较加入EPIs前后菌株对抗菌药物MIC值的变化。
1.2.6 抗菌药物盐酸环丙沙星联合不同的EPIs对感染线虫的药效 将同步化的线虫按照所建立感染模型通过非共培养得到感染线虫,联合用药治疗感染线虫,药物浓度确定在安全范围内,设置高中低3组药物浓度,30 h后观察线虫的存活率,判断不同EPIs在不同药物浓度下联合盐酸环丙沙星对感染线虫的体内治疗作用。感染实验独立进行3次,同时进行阳性对照试验和阴性对照试验。
1.2.7 细菌感染路径示踪 为追踪鲍曼不动杆菌的感染路径,本试验将细菌标记上一种细胞膜红色荧光探针Dil。将细菌悬浮在2 mL的M9溶液中,添加1 μL Dil储备液,用锡纸避光,在25℃孵育3 h,清洗细菌至少3次后调整细菌浓度为5×106CFU/mL的悬浮液去感染线虫6 h。最终感染后的线虫用M9溶液清洗直至上清液完全无色为止,用荧光显微镜观察细菌的荧光强度。
1.3 统计分析 使用GraphPad Prism 5软件对全部数据进行分析,采用Kaplan-Meier方法进行生存分析,Log-rank (Mantel-Cox) Test方法对组间数据进行差异显著性分析,组间两因素方差分析用Two-way ANOVA检验分析,P≤0.05为差异有统计学意义。
2 结果
2.1 线虫-泛耐药鲍曼不动杆菌感染模型成功建立
2.1.1 不同的液体培养基中不同XDR-AB浓度对线虫感染模型的影响 采用不同浓度的XDR-AB(5×108、5×107、5×106、5×105CFU/mL,E.coli OP50对照组)在不同的液体培养基(10%BHI、20%BHI)中感染秀丽隐杆线虫,记录线虫的生存状态,确定合适的感染条件。在液体培养基中,存活线虫呈现正弦状态,或咽部肌肉不停泵动,在光线和机械刺激时可以自由活动,而XDR-AB感染死亡的线虫呈直线型僵直状态,有些身体过于肿胀而使得阴户突出,有些已被细菌侵蚀严重的线虫明显丧失身体结构(见图1),死线虫和活线虫具有明显的外观差异,方便实验定量计算。
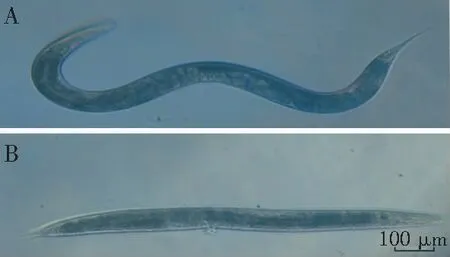
A:正常存活状态秀丽隐杆线虫;B:秀丽隐杆线虫与鲍曼不动杆菌共孵育30 h后感染致死的秀丽隐杆线虫
图1荧光显微镜下观察存活状态和死亡状态的秀丽隐杆线虫
Figure1Fluorescence microscopic observation of survival and death status ofC.elegans
为确定在液体培养基中秀丽隐杆线虫的致死是由于鲍曼不动杆菌在线虫体内的积聚,将线虫在含鲍曼不动杆菌的20%BHI-M9液体培养基中培养6 h,显微镜下观察,线虫的整个肠道明显膨胀。为进一步证实线虫肠道的膨胀是由于鲍曼不动杆菌的定植,本实验用Dil细胞膜红色荧光探针标记鲍曼不动杆菌,追踪鲍曼不动杆菌可能的感染路径。将线虫置于含荧光标记细菌的20%BHI-M9液体培养基中培养6 h,在荧光显微镜下观察,可观察到喂食了鲍曼不动杆菌的线虫整个肠道明显膨大,并充满了强烈的荧光细菌。见图2。
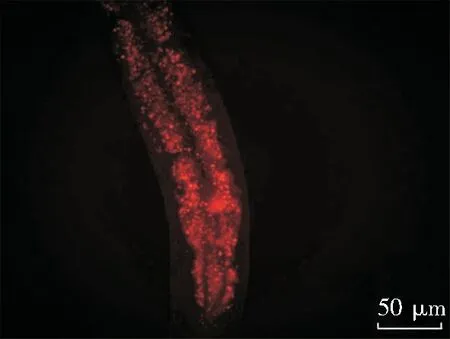
注:XDR-AB与Dil细胞膜红色荧光探针共培养3 h后感染秀丽隐杆线虫6 h,40倍荧光显微镜下观察秀丽隐杆线虫肠道充满强烈荧光细菌
图2荧光显微镜下观察Dil细胞膜红色荧光探针标记XDR-AB感染秀丽隐杆线虫
Figure2Fluorescence microscopic observation of XDR-AB-infectedC.eleganslabeled by Dil red fluorescent probe
选择10%BHI的液体培养基时,即使最高浓度的XDR-AB也无法成功感染线虫,线虫僵直一段时间后可重新蠕动;选择20%BHI液体培养基时,可观察到随着细菌浓度的降低,线虫存活时间有所延长(见图3)。线虫在不同浓度XDR-AB感染下的半数致死时长(time for half to die,LT50)明显不同,5×108CFU/mL XDR-AB感染时LT50为12 h,5×107CFU/mL XDR-AB感染时LT50为18 h,5×106CFU/mL XDR-AB感染时LT50为30 h,在5×105CFU/mL XDR-AB感染时LT50为42 h。根据不同浓度XDR-AB的致病力以及不同浓度XDR-AB对试验进度的影响,最终选取5×106CFU/mL XDR-AB作为感染浓度。
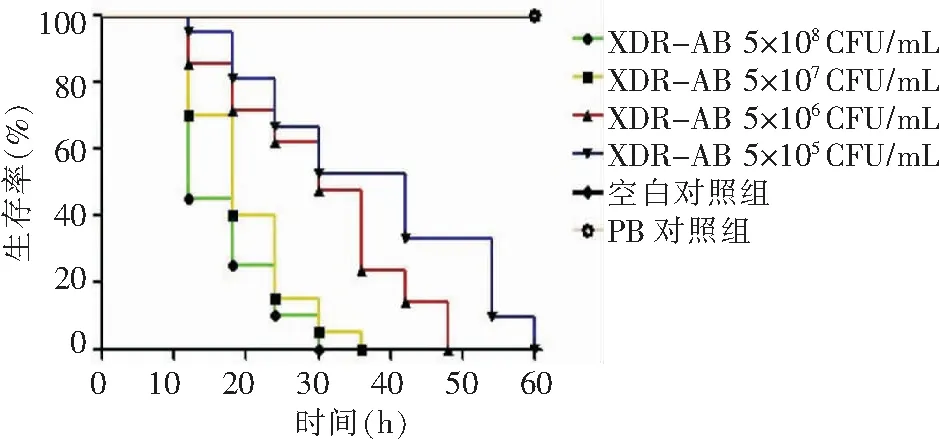
图3 不同浓度XDR-AB对感染秀丽隐杆线虫生存曲线
Figure3Survival curves ofC.elegansinfected with different concentrations of XDR-AB
2.1.2 不同感染时长及药物干预时长对线虫感染模型的影响 感染时长和加入抗菌药物的治疗时长是影响线虫生存率的关键因素,为确定最佳感染时长和治疗时长,设计线虫的感染时长分别为3、6和9 h,清洗后在阳性对照孔加入PB,观察最佳的治疗时长(见图4)。Log-rank Test显示,当感染3 h时,秀丽隐杆线虫几乎可以正常生存,没有达到较好的感染效果(χ2=3.154,P>0.05);当秀丽隐杆线虫分别被感染6、9 h时,对线虫生存率的影响差异无统计学意义(χ2=0.669,P>0.05),结合XDR-AB不同感染时长对线虫的致死能力和对实验进度的影响,最终选择6 h作为感染时长,同时选择36 h作为抗菌药物的药物干预时长,此时加入PB的阳性孔秀丽隐杆线虫生存良好,而阴性孔秀丽隐杆线虫基本已全部感染致死。
2.2 6种EPIs对秀丽隐杆线虫的毒性作用 CCCP、NMP、PAβN、奥美拉唑,维拉帕米,利血平6种EPIs对秀丽隐杆线虫的毒性作用不同,其中当CCCP的浓度>5 μg/mL、PAβN的浓度>25 μg/mL和利血平的浓度>30 μg/mL时,对秀丽隐杆线虫开始出现明显的毒性作用,秀丽隐杆线虫生存率开始下降。见图5。奥美拉唑、维拉帕米和NMP对秀丽隐杆线虫几乎都没有毒性作用,当浓度>60 μg/mL时秀丽隐杆线虫生存活跃状态下降,浓度达80 μg/mL对秀丽隐杆线虫生存率也没有影响。
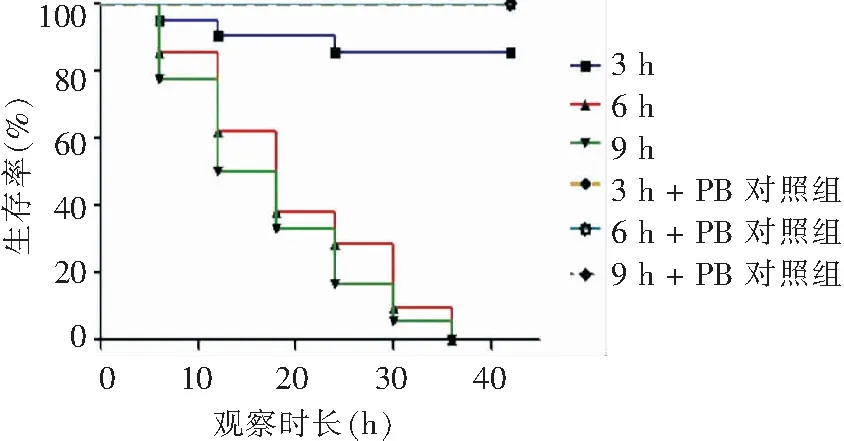
图4 XDR-AB不同感染时长与治疗时长生存曲线
Figure4Survival curves ofC.eleganswith different duration of XDR-AB infection and duration of treatment
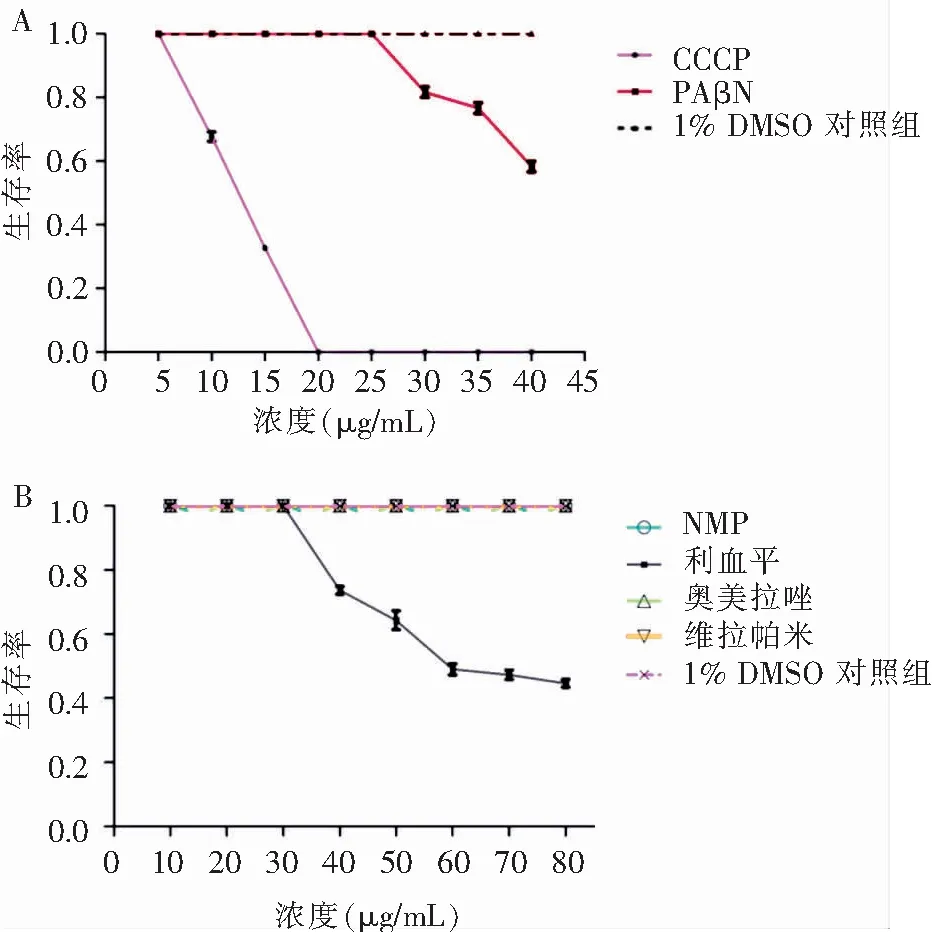
A :CCCP、PAβN对秀丽隐杆线虫的毒性试验;B: NMP、利血平、奥美拉唑和维拉帕米对秀丽隐杆线虫的毒性试验
图5不同EPIs对秀丽隐杆线虫的毒性试验
Figure5Toxicity test of different EPIs onC.elegans
2.3 联合EPI前后抗菌药物盐酸环丙沙星的MIC值变化 单独使用盐酸环丙沙星时,MIC值达256 μg/mL;单独使用CCCP、PAβN时,MIC值为15、30 μg/mL,单独使用NMP、奥美拉唑、维拉帕米和利血平时对XDR-AB没有明显的抑菌作用。加入CCCP、奥美拉唑、维拉帕米后,盐酸环丙沙星的MIC值均下降至原来的1/4(64 μg/mL);加入PAβN,NMP、利血平后,盐酸环丙沙星的MIC值均下降至原来的1/2(128 μg/mL)。
2.4 盐酸环丙沙星联合EPIs前后感染线虫的体内药效评价 加入治疗药物30 h后,不同浓度EPIs联合相应浓度的盐酸环丙沙星:除CCCP外,联合治疗效果均好于环丙沙星单用的效果。见图6。其中5、2.5、1 μg/mL的CCCP联合盐酸环丙沙星,效果均不理想,秀丽隐杆线虫存活率几乎为零。PAβN与盐酸环丙沙星联合后能提高盐酸环丙沙星在感染秀丽隐杆线虫体内的治疗作用,其中不同浓度的PAβN对联合效果差异具有统计学意义(P<0.001),PAβN较低浓度时与盐酸环丙沙星有较好的联合作用(P<0.001),比单独使用盐酸环丙沙星时感染秀丽隐杆线虫的存活率可提高30%~40%。不同浓度间的奥美拉唑联合盐酸环丙沙星对感染秀丽隐杆线虫的治疗效果差异具有统计学意义(P<0.0001),其中低浓度的奥美拉唑联合治疗效果更好(P<0.001),比单独使用盐酸环丙沙星时感染秀丽隐杆线虫的存活率可提高20%~30%。不同浓度的NMP、利血平与盐酸环丙沙星联合治疗感染秀丽隐杆线虫时,联合效果差异无统计学意义(P>0.05),为减少药物浓度与EPIs联合使用带来潜在的毒性,选择低浓度NMP(20 μg/mL)与盐酸环丙沙星联合使用,感染秀丽隐杆线虫经治疗后存活率比单一用药提高15%~20%(P<0.001);低浓度的利血平(10 μg/mL)与盐酸环丙沙星联合使用后,感染秀丽隐杆线虫经治疗后存活率比单一用药提高20%(P<0.001)。不同浓度的维拉帕米与盐酸环丙沙星联合使用时,高浓度维拉帕米的治疗作用较好(P<0.001),高浓度的维拉帕米(60 μg/mL)与盐酸环丙沙星联合使用后,感染秀丽隐杆线虫的生存率能提高30%左右。
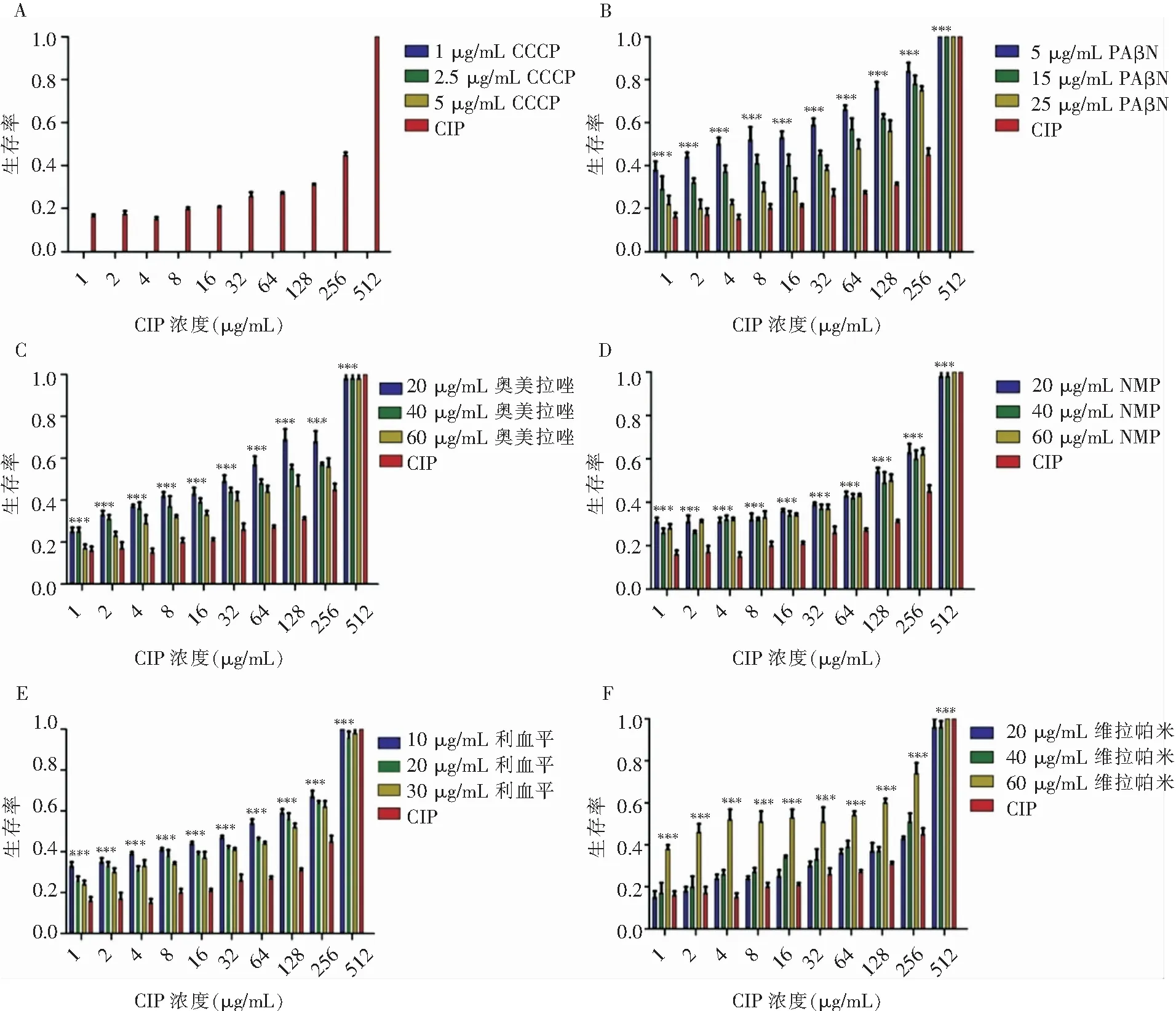
注:A—F分别为CCCP、PAβN、奥美拉唑、NMP、利血平和维拉帕米;CIP:盐酸环丙沙星; ***: 各EPI与对照组比较,P<0.001
Figure6Pharmacodynamic effect of combination of 6 different concentrations of EPIs and ciprofloxacin hydrochloride on treatment of XDR-AB infection inC.elegans
3 讨论
本研究成功建立了低成本、高效率的秀丽隐杆线虫-泛耐药鲍曼不动杆菌感染模型,用于评价抗菌药物药效的可靠性和稳定性。相比传统固体琼脂平板上的试验,极大简化了线虫在不同培养板上反复接种、清洗和转移等试验程序,探究盐酸环丙沙星与EPIs合用时在线虫模型上的治疗窗,为研究时选取安全有效的药物及药物浓度提供依据,也为之后筛选与研究其他抗菌药物提供依据。
线虫感染程度是模型成功建立的重要条件之一,本试验根据不同浓度下XDR-AB对线虫的感染致死时间及效果,最终确定5×106CFU/mL作为感染浓度, 结合鲍曼不动杆菌对线虫的致死能力和试验进度的影响,最终选择6 h作为感染时长,选择36 h作为抗菌药物的药物干预时长,初步建立XDR-AB感染秀丽隐杆线虫的感染模型。在鲍曼不动杆菌感染路径的追踪实验中,可观察到XDR-AB在肠道积聚定植,并可在肠道内扩散,使线虫整个生命过程持续感染,造成线虫感染致死。
对6种EPI进行毒性试验,体外药物敏感性试验测得所有药物的MIC值,得到环丙沙星及各EPIs对XDR-AB单独使用和联合使用时的体外抑菌效果,与体内抗菌效果形成对比,进一步研究治疗效果。CCCP是一种抑制细菌细胞膜质子转运的强解偶联剂[6, 10],CCCP在体外的抑菌效果最佳,但进行体内秀丽隐杆线虫感染试验后,CCCP与盐酸环丙沙星联合使用时秀丽隐杆线虫几乎无存活,考虑可能是因为联合使用加重了CCCP的药物毒性,加速秀丽隐杆线虫死亡。PAβN 通过结合外排泵相应位点,阻止其他底物与该位点的结合,减少药物的外排[11-12]。35 μg/mL的PAβN可将盐酸环丙沙星的MIC值降低至0.5 μg/mL,安全范围内可将盐酸环丙沙星的MIC值降低至原来的1/2,秀丽隐杆线虫体内模型筛选后,得到较低浓度PAβN(5 μg/mL)联合盐酸环丙沙星治疗后可将秀丽隐杆线虫存活率提高30%~40%,对盐酸环丙沙星的耐药性有较好的翻转效果。奥美拉唑是质子泵抑制剂(proton pump inhibitors,PPIs)的一种,临床上用于消化性溃疡的治疗,安全范围内可将盐酸环丙沙星的MIC值降低至原值的1/4,但体内治疗在低浓度(20 μg/mL)时效果更好,可将秀丽隐杆线虫生存率提高20%~30%[13-14]。NMP体内感染秀丽隐杆线虫的药效试验结果显示,不同浓度的NMP治疗效果差异无统计学意义,低浓度的NMP(20 μg/mL)可将线虫的存活率提高15%~20%[15]。利血平和维拉帕米是ATP水解驱动型EPI,在临床上有各自的适应证,利血平是一种吲哚型生物碱,临床上用于高血压的治疗,作为泵抑制剂,其本身也是某些外排泵的底物,可与抗菌药物竞争结合细菌外排泵蛋白[16]。利血平在安全范围内的体外抑菌试验中,可将盐酸环丙沙星的MIC降低至原来的1/2,用于体内感染秀丽隐杆线虫的治疗时,低浓度(10 μg/mL)时可将秀丽隐杆线虫的存活率提高20%,低浓度的EPIs发挥更好的翻转盐酸环丙沙星耐药性作用。维拉帕米属Ⅳ类抗心律失常药,安全范围内的维拉帕米可将盐酸环丙沙星的MIC降低至原来的1/4,与其他EPIs不同的是,不同浓度的维拉帕米用于体内药效试验结果,高浓度的维拉帕米(60 μg/mL)可将秀丽隐杆线虫存活率提高30%左右,高浓度的维拉帕米与盐酸环丙沙星有更好的联合治疗作用,但用于人体,仍需考虑尤其是对心脏、肝肾的毒性作用[10]。体外药敏试验较好的药物在体内或许因为较大的毒性作用而不能用于临床,且EPIs在联合用药时发挥最好疗效翻转盐酸环丙沙星耐药性的浓度也有所不同,因此,不同的EPIs体内外试验结果存在差异。
综上所述,利用临床分离的XDR-AB,成功建立秀丽隐杆线虫-鲍曼不动杆菌感染模型,用于体内治疗药物的活性筛选,可呈现出良好的量效关系,同时结合药物的毒性作用并与体外实验对比分析,探索发现新的、有效的抗菌药物,或通过翻转已有抗菌药物的耐药性,为解决细菌日益严重的耐药问题提供一个良好的思路和途径。
[1] Jayamani E, Rajamuthiah R, Larkins-Ford J, et al. Insect-derived cecropins display activity againstAcinetobacterbaumanniiin a whole-animal high-throughputCaenorhabditiselegansmodel[J]. Antimicrob Agents Chemother, 2015, 59(3): 1728-1737.
[2] Bardbari AM, Arabestani MR, Karamie M, et al. Correlation between ability of biofilm formation with their responsible genes and MDR patterns in clinical and environmentalAcinetobacterbaumanniiisolates[J]. Microb Pathog, 2017, 108: 122-128.
[3] Gholami M, Hashemi A, Hakemi-Vala M, et al. Efflux pump inhibitor phenylalanine-arginine β-naphthylamide effect on the minimum inhibitory concentration of imipenem inAcinetobacterbaumanniistrains isolated from hospitalized patients in Shahid Motahari Burn Hospital, Tehran, Iran[J]. Jundishapur J Microbiol, 2015, 8(10): e19048.
[4] Maleki MH, Jalilian FA, Khayat H, et al. Detection of highly ciprofloxacin resistanceAcinetobacterbaumanniiisolated from patients with burn wound infections in presence and absence of efflux pump inhibitor[J]. Maedica (Buchar), 2014, 9(2): 162-167.
[5] Ardebili A, Lari AR, Talebi M. Correlation of ciprofloxacin resistance with the AdeABC efflux system inAcinetobacterbaumanniiclinical isolates[J]. Ann Lab Med, 2014, 34(6): 433-438.
[6] Ardebili A, Talebi M, Azimi L, et al. Effect of efflux pump inhibitor carbonyl cyanide 3-chlorophenylhydrazone on the minimum inhibitory concentration of ciprofloxacin inAcinetobacterbaumanniiclinical isolates[J]. Jundishapur J Microbiol, 2014, 7(1): e8691.
[7] Corsi AK, Wightman B, Chalfie M. A transparent window into biology: a primer onCaenorhabditiselegans[J]. Genetics, 2015, 200(2): 387-407.
[8] Conery AL, Larkins-Ford J, Ausubel FM, et al. High-throughput screening for novel anti-infectives using aC.eleganspathogenesis model[J]. Curr Protoc Chem Biol, 2014, 6(1): 25-37.
[9] Moy TI, Ball AR, Anklesaria Z, et al. Identification of novel antimicrobials using a live-animal infection model[J]. Proc Natl Acad Sci U S A, 2006, 103(27): 10414-10419.
[10] Ni W, Li Y, Guan J, et al. Effects of efflux pump inhibitors on colistin resistance in multidrug resistant Gram-negative bacteria[J]. Antimicrob Agents Chemother, 2016, 60(5): 3215-3218.
[11] Cortez-Cordova J, Kumar A. Activity of the efflux pump inhibitor phenylalanine-arginine β-naphthylamide against the AdeFGH pump ofAcinetobacterbaumannii[J]. Int J Antimicrob Agents, 2011, 37(5): 420-424.
[12] Lamers RP, Cavallari JF, Burrows LL. The efflux inhibitor phenylalanine-arginine beta-naphthylamide (PAβN) permeabilizes the outer membrane of gram-negative bacteria[J]. PloS One, 2013, 8(3): e60666.
[13] Yang Y, Chua KL. Assessment of the effect of efflux pump inhibitors on in vitro antimicrobial susceptibility of multidrug-resistantAcinetobacterbaumannii[J]. Int J Antimicrob Agents, 2013, 42(3): 283-284.
[14] Vidaillac C, Guillon J, Arpin C, et al. Synthesis of omeprazole analogues and evaluation of these as potential inhibitors of the multidrug efflux pump NorA ofStaphylococcusaureus[J]. Antimicrob Agents Chemother, 2007, 51(3): 831-838.
[15] Aygül A. The importance of efflux systems in antibiotic resistance and efflux pump inhibitors in the management of resistance[J]. Mikrobiyol Bul, 2015, 49(2): 278-291.
[16] 周云, 凌保东. 4种外排泵抑制剂对鲍曼不动杆菌耐药性的抑制影响[J]. 中国抗生素杂志, 2013,38(6):461-466,472.
ReversalofciprofloxacinresistancebyeffluxpumpinhibitorsusingCaenorhabditiselegans-extensivelydrug-resistantAcinetobacterbaumanniiinfectionmodel
DUANXin-ran1,2,JIANGZhi-hui2,YANGXiang-hai3,LIJian1,2
(1GuangdongPharmaceuticalUniversity,Guangzhou510000,China; 2GeneralHospitalofGuangzhouMilitaryCommandofPLA,Guangzhou510000,China; 3ChangshaMedicalUniversity,Changsha410000,China)
ObjectiveTo establish an extensively drug-resistantAcinetobacterbaumannii(XDR-AB) infection model usingCaenorhabditiselegans(C.elegans), and evaluate the effect of efflux pump inhibitors(EPIs) on reversal of ciprofloxacin resistance in XDR-AB.MethodsXDR-AB infection model ofC.eleganswas established, six EPIs(CCCP, PAβN, NMP, omeprazole, reserpine, and verapamil)combined with ciprofloxacin were used to treat the infected model, the survival rate ofC.eleganswas recorded to evaluate the in vivo activities of drugs, toxicity test and in vitro drug susceptibility test were also performed.ResultsLethal effect of different concentrations of XDR-AB onC.eleganswas varied, 5×106CFU/mL of XDR-AB was selected to infectC.elegans.C.eleganssurvival test showed that survival curves ofC.elegansinfected with XDR-AB for 3 hours and curves of control group (polymixin B was added) were not significantly different (χ2=3.154,P>0.05); compared with control group, survival curves ofC.elegansinfected with XDR-AB for 6 hours or 9 hours were significantly different (bothP<0.001), but 6 hours and 9 hours were not significantly different(χ2=0.669,P>0.05),6 hours was chosen as the duration of infection, 36 hours was appropriate for the duration of antimicrobial therapy. Ciprofloxacin with EPIs for infection model revealed that low concentration of PAβN, NMP, omeprazole, and reserpine could improve the survival rate ofC.elegansby 30%-40%, 15%-20%, 20%-30%, and 20% respectively, high concentration of verapamil could improve the survival rate of infectedC.elegansby about 30%. In vitro susceptibility test and toxicity test results showed that ciprofloxacin combined respectively with CCCP, omeprazole, and verapamil could reduce minimum inhibitory concentration(MIC) to the original 1/4, combined respectively with PAβN,NMP, and reserpine could reduce MIC to the original 1/2, CCCP had the best bacterial inhibitory effect in vitro, but the toxicity was large, and was not suitable for the study of pharmacodynamics in vivo.ConclusionThe infection model ofC.elegans-XDR-AB is initially and successfully established, which is used to evaluate the efficiency of six EPIs for reversing ciprofloxacin resistance.
Acinetobacterbaumannii;Caenorhabditiselegans; efflux pump inhibitor; ciprofloxacin
[Chin J Infect Control,2017,16(12):1101-1108]
2017-08-06
国家自然科学基金项目(No.81403084);广州市科技计划项目(No.201509010012)
段欣冉(1993-),女(汉族),河南省郑州市人,硕士研究生,主要从事抗感染药物的高通量筛选研究。
李健 E-mail:2292851480@qq.com
10.3969/j.issn.1671-9638.2017.12.001
R378
A
1671-9638(2017)12-1101-08
左双燕)

