盐酸二甲双胍对海马神经干细胞增殖的影响
袁蕊,李欣昱,王潇,祝艳莎,李青云,樊红彬
·论著·
盐酸二甲双胍对海马神经干细胞增殖的影响
袁蕊1,李欣昱2,王潇1,祝艳莎1,李青云2,樊红彬2
目的:观察盐酸二甲双胍(Met)对海马神经干细胞(NSCs)增殖的影响。方法:采用体外悬浮培养法获得海马NSCs,加入不同浓度Met进行培养,通过巢蛋白(Nestin)免疫荧光法鉴定细胞、观察细胞增殖;CCK-8测定NSCs增殖。结果:体外培养NSCs高表达Nestin。Nestin与CCK-8检测结果显示,随着Met浓度从5 μmol/L增加至10 μmol/L,NSCs数量逐渐增加。当Met浓度为5 μmol/L时,细胞增殖数目最多且细胞活力最好。随着Met浓度进一步增至20 μmol/L,NSCs增殖能力逐渐下降。结论:在一定浓度范围内,Met能促进海马NSCs增殖。
盐酸二甲双胍;神经干细胞;细胞增殖;海马;大鼠
神经干细胞(neural stem cells,NSCs)具有自我更新与多向分化潜能的特点,可分化为神经元、星型胶质细胞和少突胶质细胞[1]。海马的齿状回颗粒下层(subgranular zone,SGZ)是成体脑内少数具有神经生发活动的区域之一,该区域的NSCs能分化成颗粒神经元,其树突生长入齿状回(dentate gyrus,DG)分子层,而轴突向CA3区投射并与CA3区锥体神经元的树突形成突触,参与空间学习记忆与情感相关行为的调控[2]。
盐酸二甲双胍(Metformin,Met)作为一种常规的降糖药物,被用于2型糖尿病的治疗,具有良好的降糖效果及安全性。此外,Met还具有多种生物活性和药用价值(如抗肿瘤,治疗心力衰竭和心肌肥厚等),而且它还可透过血脑屏障并能被神经细胞吸收[3]。多伦多儿童医院的Miller等[4]报道称长期服用Met的成年小鼠海马区域的神经再生和新记忆的形成速度超越对照组,并由此推测Met或与之类似的物质,可能会在一些疾病,如缺血性脑卒中、阿尔茨海默病中作为中枢神经治疗的候选药物。另有研究提示缺血前/后连续3周给予Met均能显著减小中动脉缺血模型所致小鼠脑梗死面积[5]。
本实验通过对海马NSCs给予Met药物处理,观察Met对海马NSCs增殖的影响,从而为Met用于NSCs增殖分化及相关应用研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取健康成年大鼠,体质量220~250 g,均由徐州医科大学实验动物中心提供,按雌雄比为3∶1随机配对饲养后,取24~48 h内新生大鼠,雌雄不限。
1.1.2 实验药物 Met溶解后,用DMEM/F-12(1∶1)培养液稀释为终浓度为5、10和 20 μmol/L的干细胞培养液。
1.1.3 试剂与仪器 试剂DMEM/F-12(1∶1)与B-27添加剂均购自美国Gibco公司,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮细胞生长因子(epidermal growth factor,EGF)购自美国PeproTech公司。鼠抗Nestin多克隆抗体购自美国Abcam公司。FITC和TRITC标记羊抗鼠IgG、山羊封闭血清购自北京中杉金桥公司。CCK-8试剂盒、DAPI染色液购自碧云天生物技术有限公司。多聚赖氨酸溶液购自徐州Vicmed公司。其他试剂均为国产分析纯。
1.2 方法
1.2.1 NSCs的分离与培养 参考文献[6]在无菌条件下将新生24~48 h的大鼠消毒后,于超净台内断头取脑,置于含有冰冷PBS液的经冰块预冷后的培养皿内,仔细去除血管和脑膜,分离出双侧海马组织,将其放入4℃预冷的DMEM/F12基础培养基的培养皿中,并用DMEM/F12基础培养基冲洗。将海马组织剪碎,约1 mm×1 mm×1 mm,用抛光的改良式巴氏吸管轻轻吹打成单细胞悬液,200目滤网过滤,以1 500 r/min离心5 min,弃上清,加入37℃复温的DMEF/F12完全培养基,即DMEM/F12基础培养基加入20 μg/L EGF、20 μg/L bFGF、2%B27。将单细胞悬液转移至 25 mL的培养瓶中,置于饱和湿度、温度37℃、5%CO2的培养箱中培养,定期观察,倒置相差显微镜观察细胞生长及增殖情况。培养至第3天时细胞半量换液。
1.2.2 实验分组 将原代培养干细胞悬液分别接种至24孔及96孔培养板,每组6个复孔,每孔100 μL培养液,细胞密度为 5×103个/ 孔,分为0、5、10、20 μmol/L不同浓度Met处理组进行培养。
1.2.3 NSCs鉴定 将培养3 d后的神经干细胞球,吸去完全培养液,用PBS缓冲液清洗3遍,每次5 min。用体积分数为0.04多聚甲醛室温固定15 min,PBS漂洗3次;体积分数为0.001 Triton X-100室温下破膜处理30 min后,PBS洗3次,每次5 min;用山羊血清室温封闭 1 h,吸去血清,不洗;加入一抗(Nestin 1∶100),4℃过夜;PBS漂洗3次,加入荧光标记二抗(抗体工作浓度1∶100),37 ℃避光孵育1 h;PBS漂洗 3 次,DAPI染核3~5 min;再用PBS漂洗3次,激光共聚焦显微镜观察、照相。
1.2.4 CCK-8检测不同浓度Met下海马NSCs增殖 将接种至96孔板的神经干细胞球吸去板内培养液,每孔避光加入100 μL含体积分数为0.1 CCK-8溶液的不同浓度Met NSCs完全培养液,37℃孵育4 h后终止培养。使用空白对照孔调零,在酶标仪上测定450 nm处吸光度值,结果以OD值表示。本实验重复3次,取平均值为结果。
1.2.5 免疫荧光观察海马NSCs增殖 将培养10 d后的细胞,用PBS缓冲液洗3遍,每次5 min。用体积分数为0.04多聚甲醛室温固定15 min,PBS漂洗3次;体积分数为0.001 Triton X-100室温下破膜处理 30 min后,PBS洗3次,每次5 min;用山羊血清室温封闭1 h,吸去血清,不洗;加入一抗(Nestin 1∶100),4℃过夜;PBS漂洗3次,加入荧光标记二抗(抗体工作浓度1∶100),37 ℃避光孵育1 h;PBS漂洗 3 次,DAPI染核 3~5 min;再用PBS漂洗3次,激光共聚焦显微镜观察、照相。
1.3 图像分析与统计学处理
随机选取不同浓度培养皿中的5个非重叠视野拍照(同一曝光值),计算出每个视野的Nestin阳性细胞球数。采用SPSS 13.0软件包处理数据,计量结果以(平均数±标准差)表示,多组间比较行单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 NSCs鉴定
传代细胞克隆球经Nestin间接免疫荧光染色,可见NSCs特异性标记物Nestin阳性,见图1。
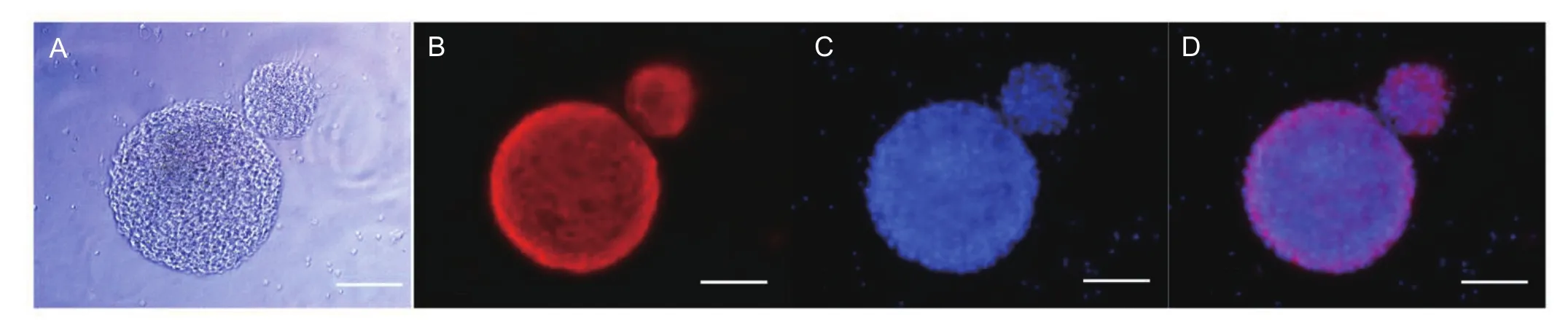
图1 海马NSCs的鉴定
2.2 NSCs增殖检测
分别加入Met药物浓度为0、5、10、20 μmol/L的干细胞培养液培养,CCK-8测定细胞增殖结果显示,0、5、10、20 μmol/L组的细胞活力分别为(0.4013±0.0580)、(0.3637±0.9800)、(0.1760±0.0520)、(0.1397±0.0349),5 μmol/L组与 10 μmol/L组的细胞活力较0 μmol/L组明显增强,差异有统计学意义(P<0.05),其中 5 μmol/L组活力最强,10 μmol/L组次之,随着Met浓度的升高,细胞的增殖呈现先上升后下降的趋势,20 μmol/L组较0 μmol/L组则活力下降,见图2。

图2 CCK8检测不同浓度Met培养细胞活性
2.3 免疫荧光观察NSCs增殖
随着Met浓度的升高,细胞的增殖表现为先上升后下降的趋势。与0 μmol/L组相比,当Met的浓度为5 μmol/L时,细胞增殖最多,差异有统计学意义(P<0.05),见图3、4。这说明Met在体外能促进海马干细胞的增殖,且5 μmol/L药物浓度较有效。

图3 Nestin表达阳性细胞球个数统计
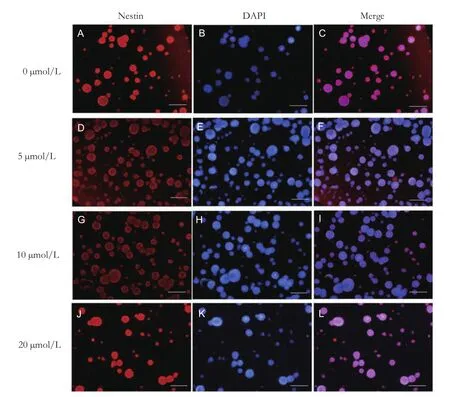
图4 Nestin标记不同浓度Met对培养10 d后的新生大鼠海马NSCs球增殖影响
3 讨论
NSCs存在于胚胎发育过程中以及包括人在内的哺乳动物大脑内。成人神经发生过程受各种生理、病理和药物刺激的动态调节作用。越来越多的证据表明,NSCs参与生理和病理条件下神经功能的定向分化。充分了解NSCs的生物学作用将为发现脑部疾病病因及主要的治疗方法提供重要的见解[7]。近年研究表明,发育中及成年哺乳动物包括室管膜、海马齿状回颗粒细胞层下区、嗅球及皮质等区域存在具有自我更新和分化潜能的NSCs,可终身存在神经发生[8],它们能够分化成新的神经元,从而发挥功能,通过外源性或内源性的NSCs疗法是中枢神经系统疾病患者中后期神经修复的重要途径[9]。研发理想的神经保护剂减少神经元损伤、促进新生神经元形成,以提高患者的生存率和生活质量具有重要的意义。成熟的神经元不具备分裂和自我更新的能力,成年神经再生主要是由NSCs分化为神经元。就目前来看,外源性干细胞移植模式存在存活率低(2%~20%)和分化率低的问题,且不能规避手术或致畸致瘤的风险,甚至涉及到伦理问题[10],因此近年来干细胞治疗脑部疾病的研究重点已经转至刺激中枢神经系统内源性NSCs的增殖和分化方向上来。
Met作为临床常用的基础降糖药物,分别通过抑制糖异生、肠壁细胞摄取葡萄糖和促进肌糖原合成三方面作用达到降糖的目的。除具有降糖作用外,大量的体内外实验均证实Met具有抗肿瘤、抗炎、促进成骨细胞生长、分化及神经保护等多种药理活性[11-13]。本实验应用不同浓度Met培养基进行新生大鼠海马NSCs体外培养,观察体外Met培养对海马NSCs增殖的影响。既往在体及离体实验数据均表明,Nestin在NSCs生存和自我更新中具有重要功能,通过支持合适的NSCs生存,可促进细胞的进一步扩增[14]。近期研究发现,Nestin通过激活MAPK和EGFR通路完成细胞的自我更新,P38-EGFR信号通路在Nestin维持的神经祖细胞自我更新和增殖中起关键作用[15]。根据CCK-8在450 nm处酶标仪测定吸光度与活细胞数量成正比原理,当细胞处于增殖阶段时,可测定NSCs增殖结果,既往有实验证实通过CCK-8测定研究发现生长素可促进NSCs增殖[16]。近期又有研究人员通过5-乙炔基-2'-脱氧尿苷(5-Ethynyl-2’-deoxyuridine,EdU)染色及CCK-8检测方法分别识别和衡量细胞的增殖,探讨高龄哺乳动物对下一代海马NSCs增殖能力影响的差异,从而证实年轻大鼠海马NSCs增殖的细胞比例高于老年大鼠海马NSCs[17]。本研究通过Nestin荧光标记染色及CCK-8方法检测不同浓度Met对海马NSCs增殖的影响,结果显示不同浓度Met处理后细胞增殖活性呈现先升高后下降趋势,具有明显差异,其中5 μmol/L Met组最明显,10 μmol/LMet组次之,而 20 μmol/L Met组对比未加药组则呈明显下降趋势;通过对Nestin标记后海马神经干细胞球计数发现, 5 μmol/L Met组干细胞球数量最多。本研究结果表明Met能促进NSCs的增殖,当浓度为5 μmol/L时增殖活性最高。
然而,本研究也发现,当Met浓度进一步增加时,海马NSCs增殖活性对比未加药组呈现下降趋势,是否随着Met浓度增高NSCs增殖出现抑制,该问题仍须进一步实验研究。本研究仅观察Met对新生大鼠海马NSCs增殖的影响,对海马NSCs的分化,以及其对进一步的NSCs的定向分化是否有影响仍须继续探讨。有研究表明BDNF对神经细胞生长具有重要作用,众多研究已经证实BDNF可以促进NSCs的增殖和向神经元定向分化并改善认知[18,19]。同时有研究表明在成骨细胞和宫颈癌细胞中发现二甲双胍可以激活AMPK调控Wnt/β-catenin这一经典信号通路[20,21]。该信号通路不仅在促进NSCs对称分裂[22]、维持神经元存活和死亡的平衡中起重要作用[23],也可以通过调控micro RNAs的表达影响脑部发育和神经再生[24,25]。二甲双胍能否通过Wnt/β-catenin通路,从转录后水平促进BDNF表达,这对了解二甲双胍促神经发生作用的机制有重要意义,这仍需要继续探讨。
致谢 本实验于徐州医科大学神经生物学研究中心完成,感谢实验期间老师们在试验期间给予的支持与帮助。
[1]Miller FD,Gauthier AS.Timing is everything:making neurons versus glia in the developing cortex[J].Neuron,2007,54:357-369.
[2]Labuzek K,Suchy D,Gabryel B,et al.Quantification of metformin by the HPLC method in brain regions,cerebrospinal fluid and plasma of rats treated with lipopolysaccharide[J].Pharmacol Rep,2010,62:956-965.
[3]Labuzek K,Suchy D,Gabryel B,et al.Quantification of metformin by the HPLC method in brain regions,cerebrospinal fluid and plasma of rats treated with lipopolysaccharide[J].Pharmacol Rep,2010,62:956-965.
[4]Wang J,Gallagher D,DeVito LM,et al.Metformin activates an atypical PKC-CBP pathway to promote neurogenesis and enhance spatial memory formation[J].Cell Stem Cell,2012,11:23-35.
[5]Li J,Benashski SE,Venna VR,et al.Effects of metformin in experimental stroke[J].Stroke,2010,41:264526-52.
[6]Kaech S,Banker G.Culturing hippocampal neurons[J].Nat Protoc,2006,1:2406-2415.
[7]Ma DK,Bonaguidi MA,Ming GL,et al.Adult neural stem cells in the mammalian central nervous system[J].Cell Res,2009,19:672-682.
[8]Cheng W,Yu P,Wang L,et al.Sonic hedgehog signaling mediates resveratrol to increase proliferation of neural stem cells after oxygen-glucose deprivation/reoxygenation injury in vitro[J].Cell Physiol Biochem,2015,35:2019-2032.
[9]Lindvall O,Kokaia Z.Stem cell research in stroke:how far from the clinic?[J].Stroke,2011,42:2369-2375.
[10]Miller RH,Bai L.Translating stem cell therapies to the clinic[J].Neurosci Lett,2012,519:87-92.
[11]Cortizo AM,Sedlinsky C,McCarthy AD,et al.Osteogenic actions of the anti-diabetic drug metformin on osteoblasts in culture[J].Eur J Pharmacol,2006,536:38-46.
[12]Kourelis TV,Siegel RD.Metformin and cancer:new applications for an old drug[J].Med Oncology,2012,29:1314-1327.
[13]Potts MB,Lim DA.An old drug for new ideas:metformin promotes adult neurogenesis and spatial memory formation[J].Cell Stem Cell,2012,11:5-6.
[14]Park D,Xiang AP,Mao FF,et al.Nestin is required for the proper selfrenewal of neural stem cells[J].Stem Cells,2010,28:2162-2171.
[15]Hu W,Lu H,Wang S,et al.Suppression of Nestin reveals a critical role for p38-EGFR pathway in neural progenitor cell proliferation[J].Oncotarget,2016,7:87052-87063.
[16]Chung H,Park S.Ghrelin regulates cell cycle-related gene expression in cultured hippocampal neural stem cells[J].J Endocrinol,2016,230:JOE-16-0126.
[17]Li B,Duan P,Han X,et al.The Effect of Advanced Motherhood on Newborn Offspring's Hippocampal Neural Stem Cell Proliferation[J].Biomed Res Int,2016,2016:1-7.
[18]Blurton-Jones M,Kitazawa M,Martinez-Coria H,et al.Neural stem cells improve cognition via BDNF in a transgenic model of Alzheimer disease[J].Proc Natl Acad Sci U S A,2009,106:13594-13599.
[19]Yang JW,Ru J,Ma W,et al.BDNF promotes the growth of human neurons through crosstalk with the Wnt/β-catenin signaling pathway via GSK-3β[J].Neuropeptides,2015,54:35-46.
[20]Takatani T,Minagawa M,Takatani R,et al.AMP-activated protein kinase attenuates Wnt/β-catenin signaling in human osteoblastic Saos-2 cells[J].Mol Cell Endocrinol,2011,339:114-119.
[21]Kwan HT,Chan DW,Cai PC,et al.AMPK activators suppress cervical cancer cell growth through inhibition of DVL3 mediated Wnt/β-catenin signaling activity[J].Plos One,2013,8:e53597.
[22]Piccin D,Morshead CM.Wnt signaling regulates symmetry of division of neural stem cells in the adult brain and in response to injury[J].Stem Cells,2011,29:528-538.
[23]Jang MH,Bonaguidi MA,Kitabatake Y,et al.Secreted frizzled-related protein 3 regulates activity-dependent adult hippocampal neurogenesis[J].Cell Stem Cell,2013,12:215-223.
[24]Baudry A,Mouillet-Richard S,Schneider B,et al.MiR-16 targets the serotonin transporter:a new facet for adaptive responses to antidepressants[J].Science,2010,329:1537-1541.
[25]Katharina M,Iwaniuk JS,Weinhold S,et al.Network-like impact of MicroRNAs on neuronal lineage differentiation of unrestricted somatic stem cells from human cord blood[J].Stem Cells Dev,2011,20:1383-1394.
Effect of Metformin on Proliferation of Rat Hippocampal Neural Stem Cells
YUAN Rui1,LI Xinyu2,WANG Xiao1,ZHU Yan-sha1,LI Qing-yun2,FAN Hong-bin2.1.Graduate School,Xuzhou Medical University,Jiangsu 221000,China;2.Department of Neurology,Affiliated Hospital of Xuzhou Medical University,Jiangsu 221000,China
Objective:To investigate the effect of Metformin(Met)on the proliferation of neural stem cells(NSCs)derived from rat hippocampus.Methods:Hippocampal NSCs were culturedin vitrowith different concentrations of Met.The proliferations of NSCs were detected by CCK-8 assay and immunofluorescence against Nestin.Results:Nestin was highly expressed in the NSCs culturedin vitro.Immunofluorescence and CCK-8 assays showed that the number of NSCs increased gradually with the increasing in Met concentration from 5 μmol/L to 10 μmol/L.Cell proliferation as well as cell viability were highest at 5 μmol/L concentration.However,the proliferation of NSCs decreased gradually with the increasing in Met concentration at 20 μmol/L.Conclusion:Metf could promote the proliferation of hippocampal NSCs in a certain concentration range.
metformin;neural stem cells;proliferation;hippocampus;rat
R741;R741.05
ADOI10.16780/j.cnki.sjssgncj.2017.06.001
1.徐州医科大学研究生学院江苏 徐州 221000 2.徐州医科大学附属医院神经内一科江苏 徐州 221000
江苏省卫生科研项目(No.H201319)
2016-11-18
樊红彬fandoc@126.com
(本文编辑:王晶)

