桑椹成熟过程中酚类物质及总黄酮含量的动态变化
黄金枝 朱敏婕 俞燕芳 邓真华 杜贤明
(江西省蚕桑茶叶研究所 330202)
桑椹成熟过程中酚类物质及总黄酮含量的动态变化
黄金枝 朱敏婕 俞燕芳 邓真华 杜贤明
(江西省蚕桑茶叶研究所 330202)
以果桑品种大十为实验材料,研究不同发育时期桑椹中总酚类物质、总黄酮及多酚单体的动态变化规律。结果表明:幼果期桑椹中含有较高的总酚类物质和总黄酮物质,随着果实的成熟,合成速率逐渐减慢,全红期又开始大量积累。多酚单体在半粉期含量最高。桑椹成熟过程中半粉期的总黄酮物质、绿原酸、芦丁、槲皮素和龙胆酸含量都是最高的,可以作为一个特殊时期深入研究。
桑椹;总酚类物质;总黄酮;多酚单体
桑椹营养价值高,含有丰富的营养成分和药用成分,具有很多保健功能,还是开发功能性食品的优质原料,国家已将其列入食药兼用品种名单[1~2]。
桑椹成熟后果实较软、皮薄、汁多,极难保存,多将其加工成桑椹原汁和浓缩果汁,用以开发饮料及果酒、果酱等[3]。本研究以大十为原料,分析鲜食用桑椹成熟过程中总酚类物质、总黄酮类物质及多酚单体类物质等活性成分的积累变化规律,以期为鲜食用果桑品种的选育和品种评价提供理论依据。
1 材料与方法
1.1 材料与设备
供试品种为大十,采自江西省蚕桑茶叶研究所果桑园,树龄、树体长势、立体条件和栽培管理水平基本一致。根据桑椹生长发育过程中的外观色泽,将桑椹果实的发育期划分为5个时期:全绿期、半粉期、粉红期、全红期和紫黑期。每个发育时期,选取大小均匀一致、着色一致、无病虫害、无挤压损伤的果实为实验材料。测定时将其研磨混匀,准确称取一定重量,重复取3次,用于成熟过程中活性成分积累量的测定。
设备:Agilent 1260高效液相色谱(美国安捷伦科技公司)、722型分光光度计(上海精密科学仪器有限公司)。
1.2 方法
1.2.1 总黄酮含量测定
称取不同发育时期的桑椹冷冻样品,置50mL离心管中,加80%乙醇30mL,超声提取3次,每次30min。10 000rpm离心5min,合并提取液,过滤并转入100mL容量瓶中,以80%乙醇定容,即得待测桑椹总黄酮和总酚的供试品。测定方法采用亚硝酸钠-硝酸铝法,以芦丁为标准曲线计算总黄酮含量[4]。
1.2.2 总酚含量测定
提取方法同1.2.1。测定方法采用福林-肖卡法[5~6],以没食子酸标准品作标准曲线计算总酚类物质的含量。
1.2.3 多酚单体含量测定
提取方法同1.2.1。色谱柱:ZORBAX SB-C18柱(4.6mm×250mm,5μm),流动相A-乙腈、B-0.4%冰醋酸,流速1.0mL/min,柱温30℃,检测波长280nm。梯度洗脱程序:B泵在0~40min时,95%降至75%;在40~45min时,由75%降至65%;在45~50min时,由65%降至50%[7]。 标准曲线制备:准确称取绿原酸、芦丁、槲皮素和龙胆酸标样各0.010 0g,用纯甲醇定容至10mL,4℃保存备测。
2 结果与分析
2.1 桑椹成熟过程中黄酮物质的总含量变化
根据实验方法制作标准曲线,回归方程式 y =1.4586x-0.0167,R2=0.999,表明芦丁质量浓度为0.1~0.6mg/mL范围内与其吸光值呈现良好的线性关系,符合朗伯比尔定律,该方程可用于桑椹总黄酮的定量测定。桑椹成熟过程中黄酮物质的总含量变化趋势见图1。黄酮物质的总含量在桑椹幼果期和果实成熟期各有一个合成高峰,其整个发育过程中半粉期桑椹中黄酮物质的总含量最高,鲜果中高达2.34mg/g,随着果实的进一步发育到全红期呈现下降趋势,紫黑期桑椹中黄酮物质的总含量较高。
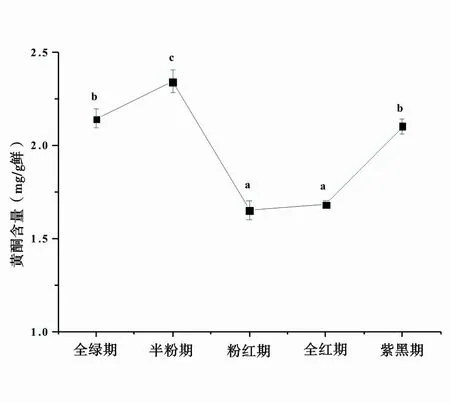
图1 桑椹成熟过程中黄酮物质总含量变化
2.2桑椹成熟过程中多酚物质的总含量变化
根据实验方法制作标准曲线,回归方程式 y =3.7434x+0.0525,R2=0.9973,表明没食子酸质量浓度为0.02~0.2mg/mL范围内与其吸光值呈现良好的线性关系,符合朗伯比尔定律,该方程可用于桑椹多酚的定量测定。桑椹成熟过程中多酚物质的总含量变化趋势见图2。由图2可知,随着果实的成熟,多酚物质的总含量呈先平衡甚至略下降,粉红期到紫黑期又大量合成的趋势。前三个时期差异不显著(pgt;0.05),后三个时期差异极显著(plt;0.01)。
2.3 桑椹成熟过程中多酚单体物质含量变化
2.3.1 液相色谱标准曲线的制备
在确定的色谱条件下测定不同质量浓度的标准
品混合液,以各梯度质量浓度为纵坐标,峰面积为横坐标,得到各类多酚单体的回归方程(表1)。各标样质量浓度与峰面积的相关性良好,相关系数(R2)在0.9994以上。
2.3.2 桑椹成熟过程中多酚单体物质色谱图
桑椹成熟过程中多酚单体色谱图如图3所示。由图3可以看出,不同成熟度的桑椹中多酚单体物质得到了较好的分离,且图谱相似,共有峰较多。
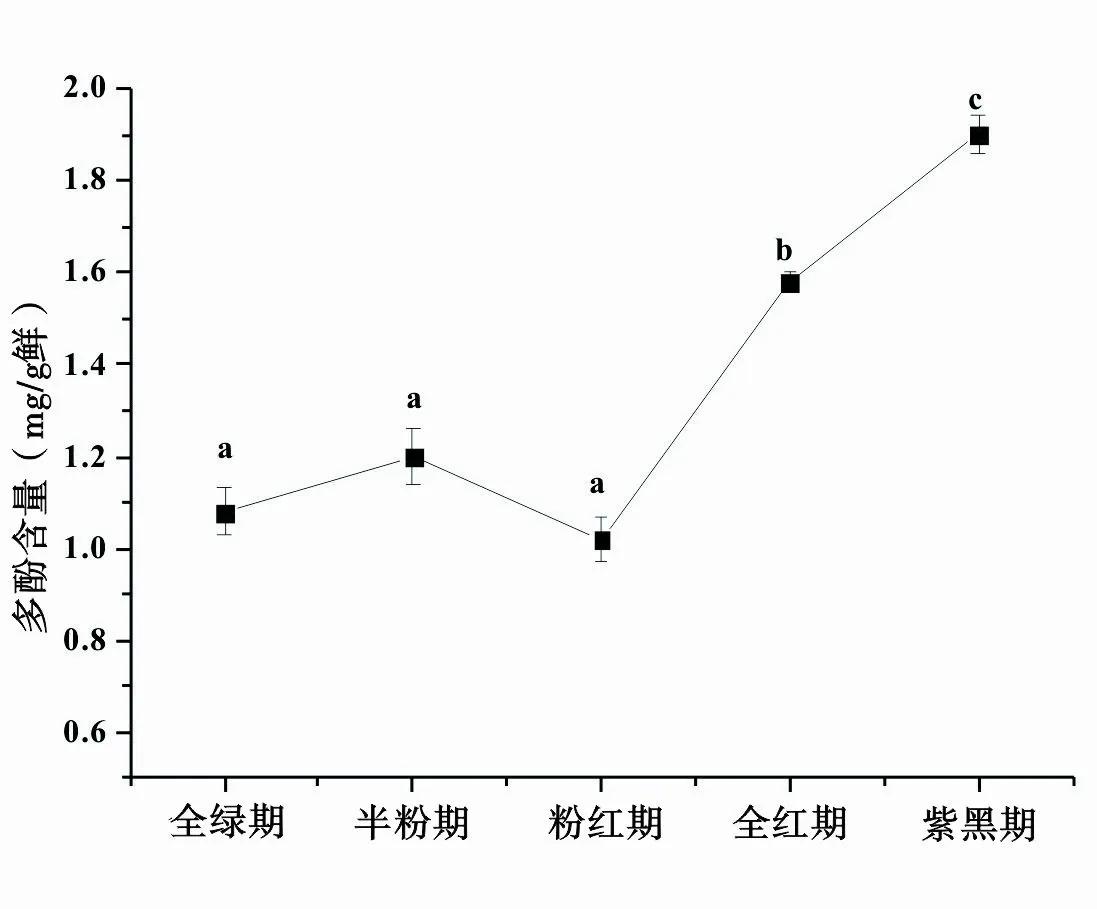

图2 桑椹成熟过程中多酚物质总含量变化

图3 桑椹成熟过程中多酚单体液相色谱图
2.3.3桑椹成熟过程中多酚单体物质含量变化
桑椹成熟过程中各种多酚单体物质含量变化趋势如表2所示。由表2可知,桑椹成熟过程中绿原酸前期缓慢增加,半粉期后又迅速下降,变化幅度很大,半粉期gt;全绿期gt;粉红期gt;全红期gt;紫黑期,鲜果中最高是最低3.35倍。桑椹成熟过程中芦丁呈先增再减再增的趋势,半粉期gt;紫黑期gt;全红期gt;粉红期=全绿期,半粉期鲜果中芦丁含量达0.23mg/g。桑椹成熟过程中槲皮素呈先增后减趋于稳定,半粉期gt;粉红期=全红期=紫黑期gt;全绿期,相差不明显。龙胆酸呈先增再减再增趋势,半粉期gt;全绿期=粉红期=紫黑期gt;全红期,但相差较小。
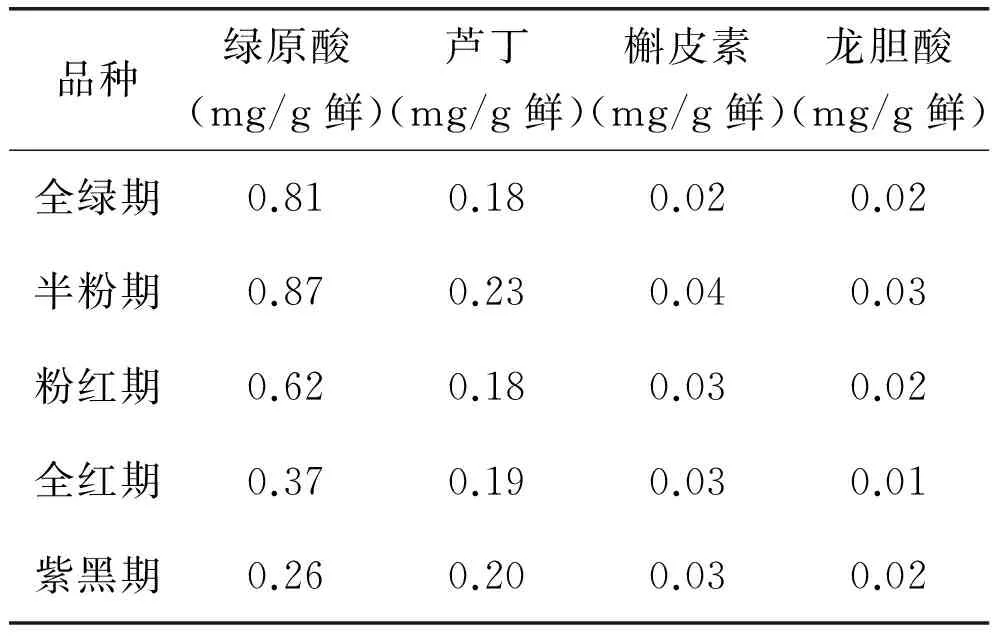
表2 桑椹成熟过程中各种多酚单体物质含量变化
3 小结与讨论
果实成熟性状的研究是果树生殖生理的重要研究内容之一,黄酮类、总酚类及多酚单体类等物质是桑椹中的重要活性成分,影响着桑椹的外观品质、风味和营养价值等内在品质。本研究结果表明,大十鲜果在半粉期的总黄酮、绿原酸、芦丁、槲皮素和龙胆酸均高于其他时期。 半粉期的桑椹中含有较高的总黄酮类物质,随着果实的发育成熟而不断转化下降,后期含量又进一步升高。桑椹中总黄酮类化合物在幼果期和成熟期各有一个合成高峰,这与在草莓和苹果中[8~9]的研究结果一致。黄酮类物质和花色苷类物质的合成都受到同一种酶UFGT的催化,在草莓等果实研究中结果表明,UFGT酶在草莓果实发育的绿熟期和全红期活性相对较高[10],果实发育前期没有花色苷的合成,其活性相对较高,因此推测,草莓果实发育前期UFGT仅催化黄酮类物质的合成,即果实发育前期会大量合成黄酮类物质[11]。
桑椹中的总酚类物质随发育时间的动态变化规律同黄酮类变化类似,半粉期的桑椹中也含有较高含量的总酚类物质,随着果实的发育成熟,合成速率减慢,后期含量又进一步升高。多种酚类化合物和花色苷具有相同的合成底物,并且几乎是同时存在而又互相制约[12]。因此推测,随着果实的发育,进入半粉期后桑椹中的花色苷开始合成,致使一些初始合成酚类物质的底物向着合成花色苷的方向发展,总酚类物质合成速率减慢。
[1] 肖更生,徐玉娟,刘学铭,等.桑椹的营养、保健功能及其加工利用[J].中药材,2001,24(1): 70~72.
[2] 王振江,肖更生,刘学铭,等.桑椹花青素的研究进展[J].蚕业科学,2006,32(1)90~94.
[3] 王振江,罗国庆,唐翠明,等.桑椹成熟过程中酚类物质、总黄酮及花色苷含量的动态变化[J].热带作物学报,2011,32(9):1 658~1 660.
[4] 石少明,袁琦.野生桑叶与药用桑叶中总黄酮的含量比较[J].柳州职业技术学院学报,2015,15(4):64~67.
[5] Aijadi A M , Kamaruddin M Y . Evaluation of the phenolics contents and antioxidant capacities of two Malaysian floral honeys [J]. Food Chemistry, 2004,85(3): 513~518.
[6] Velioulu Y S, Mazza G, Gao L, et al. Antioxidant activity and total phenolics in selected fruits,vegetables and products [J]. Journal of Agricultural and Food Chemistry, 1998, 46:4 113~4 117.
[7] 李妍,刘学铭,刘吉平,等.不同果桑品种桑椹成熟过程中非花青素酚类物质的含量变化[J].蚕业科学,2008,34(4):711~717.
[8] Lister C E, Lancaster J E. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars [J]. Journal Science of Food Agriculture, 1996, 71: 313~320.
[9] Awad M A, De Jager A.Flavonoid and chlorogenic acid changes in skin of‘Elster’and ‘Jonagold’ apples during development and ripening[J]. Scientia Horticulturae, 2001, 90: 69~831.
[10] Halbwirth H, Puhl I, Haas U, et al. Two phase flavonoid formation in developing strawberry (Fragaria × ananassa)fruit [J]. Journal of Agriculture and Food Chemistry,2006, 54:1 479~1 485.
[11] 张琼,王红清,冷平,等.草莓果实发育过程中花色苷和黄酮醇类物质的形成机制[J].园艺学报,2008,35(12): 1 735~1 741.
[12] Lancaster J E. Regulation of skin color in apples [J].Critical Reviews in Plant Sciences, 1992, 10(6): 487~502.
现代农业产业技术体系蚕桑专项(CARS-18-05B)。

