多黏菌素临床研究进展
赵 苗, 张 菁, 张婴元, 李 健
·综述·
多黏菌素临床研究进展
赵 苗1, 张 菁1, 张婴元1, 李 健2
多黏菌素; 临床药动学; 临床应用
1 前言
目前耐多药革兰阴性菌所致感染的治疗手段越来越少,新抗菌药物的紧缺导致多黏菌素类抗生素(多黏菌素E和多黏菌素B)越来越受到重视。多黏菌素类抗生素于20世纪50年代获准上市,当时药物研发的审查标准较简单,可用于指导其临床使用的信息很少。近年来,随着多黏菌素临床前研究和临床药理学研究的进展,为临床使用提供了较多信息。由于多黏菌素是一类相对较大的脂肽类分子,其口服给药后吸收较差,通常使用静脉途径给药。多黏菌素E甲磺酸钠盐(colistin methanesulphonate,CMS)注射剂是一个非活性前药,在体内转化成活性成分多黏菌素E(colistin)而发挥药效。多黏菌素B硫酸盐则为活性成分。本文旨在为多黏菌素类的合理应用提供参考。
2 剂量,用法和适应证
表1列出了具有代表性的4种多黏菌素类药品的剂量用法和适应证。CMS剂量规格因不同生产厂家而异。一种是以国际单位(International Unit,IU)为标准,另一种以mg为单位(colistin based activity,CBA)。为了合理使用多黏菌素类抗生素,欧洲药品管理局(European Medicines Agency,EMA)和美国食品药品监督管理局(Food and Drug Administration,FDA)均对CMS推荐剂量作出了调整(表2)[1]。如患者肌酐清除率>80 mL/min,多黏菌素E对病原菌的MIC>1 mg/L时,建议联合用药。
3 不同人群的药动学(PK)研究
3.1 多黏菌素E人体PK
3.1.1健康受试者 健康受试者中CMS给药剂量的70%左右是以原形(CMS)经肾排泄,colistin主要经非肾途径排泄,colistin半衰期较CMS长[2-3]。主要PK参数见表3。
3.1.2危重患者 根据早期在危重患者中的群体PK研究[4],给予CMS 3 MIU,每8小时1次时,在首次给药后colistin的血浓度较低(0.6 mg/L),至少需48 h才能达到2 mg/L,因此推荐使用负荷剂量9 MIU,24 h后给予4.5 MIU 每12小时1次的维持剂量。近期有研究将此推荐剂量应用于19例危重患者中,结果显示给予负荷剂量8 h后,colistin的血药浓度可达2.65 mg/L。另一项研究给予CMS 2 MIU后,colistin血药浓度可达到2 mg/ L[9],未采用负荷剂量,该研究中colistin的半衰期仅3.1 h[2],但其他危重患者的PK研究中,colistin半衰期为9~18 h[4,10-12],这种差异可能由于不同厂家生产的CMS在体内转化差异导致[13],此外也可能由于不同研究中危重患者的肾功能不同,当肾功能减退时,CMS排泄量减少,更多CMS转化为colistin,通过重吸收而使colistin血药浓度增加,从而使colistin半衰期延长,而且革兰阴性菌产生的内毒素诱导全身炎性反应可能影响血管内皮导致毛细血管通透性增加,使分布容积增加[15],从而导致CMS和colistin在不同患者中PK特征不同。
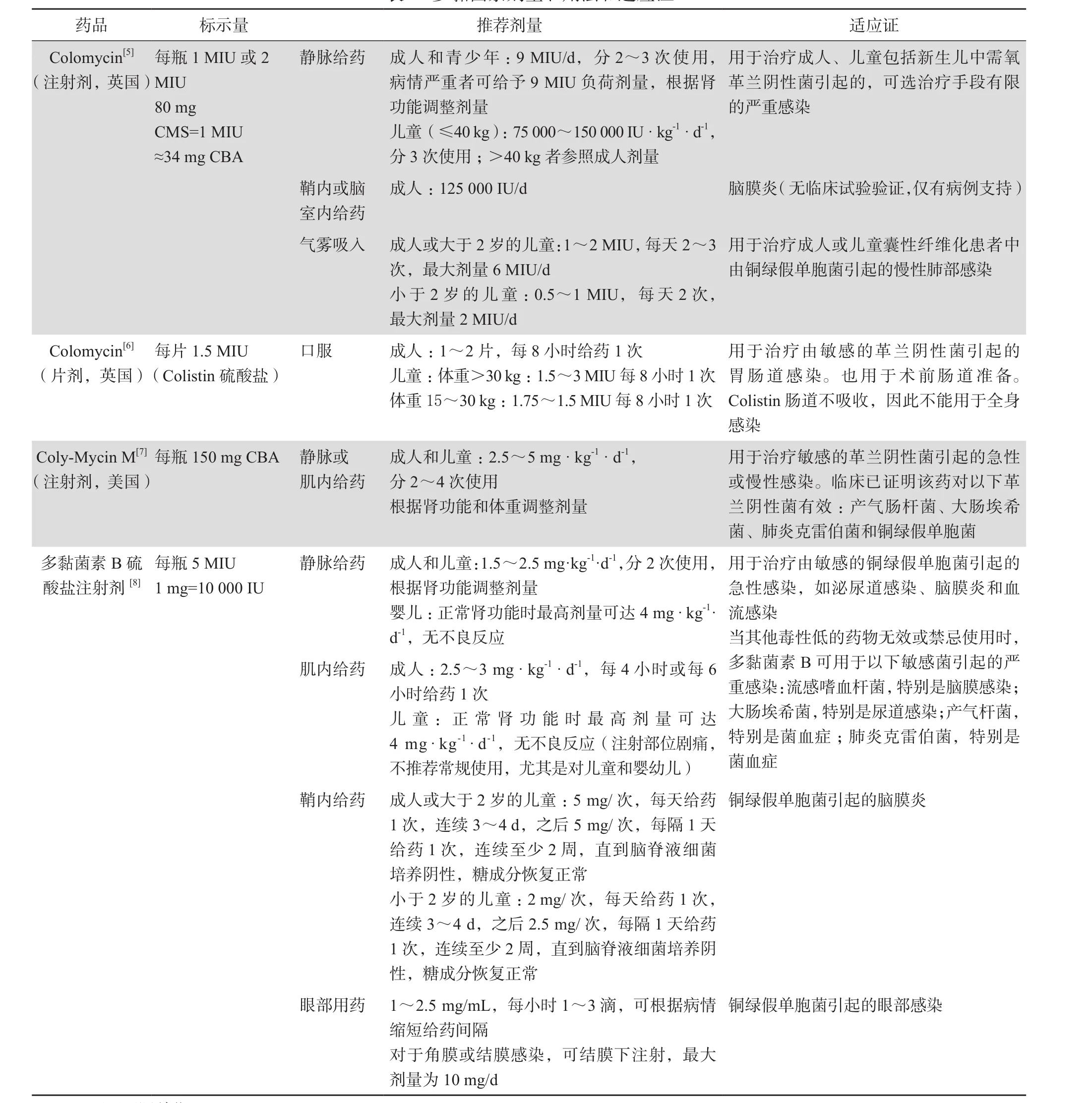
表1 多黏菌素剂量、用法和适应证
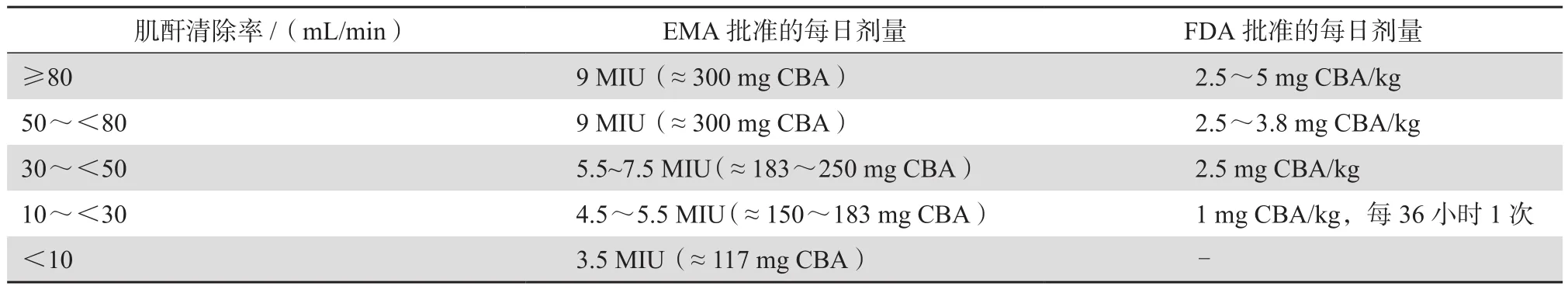
表2 EMA和FDA批准的CMS推荐剂量
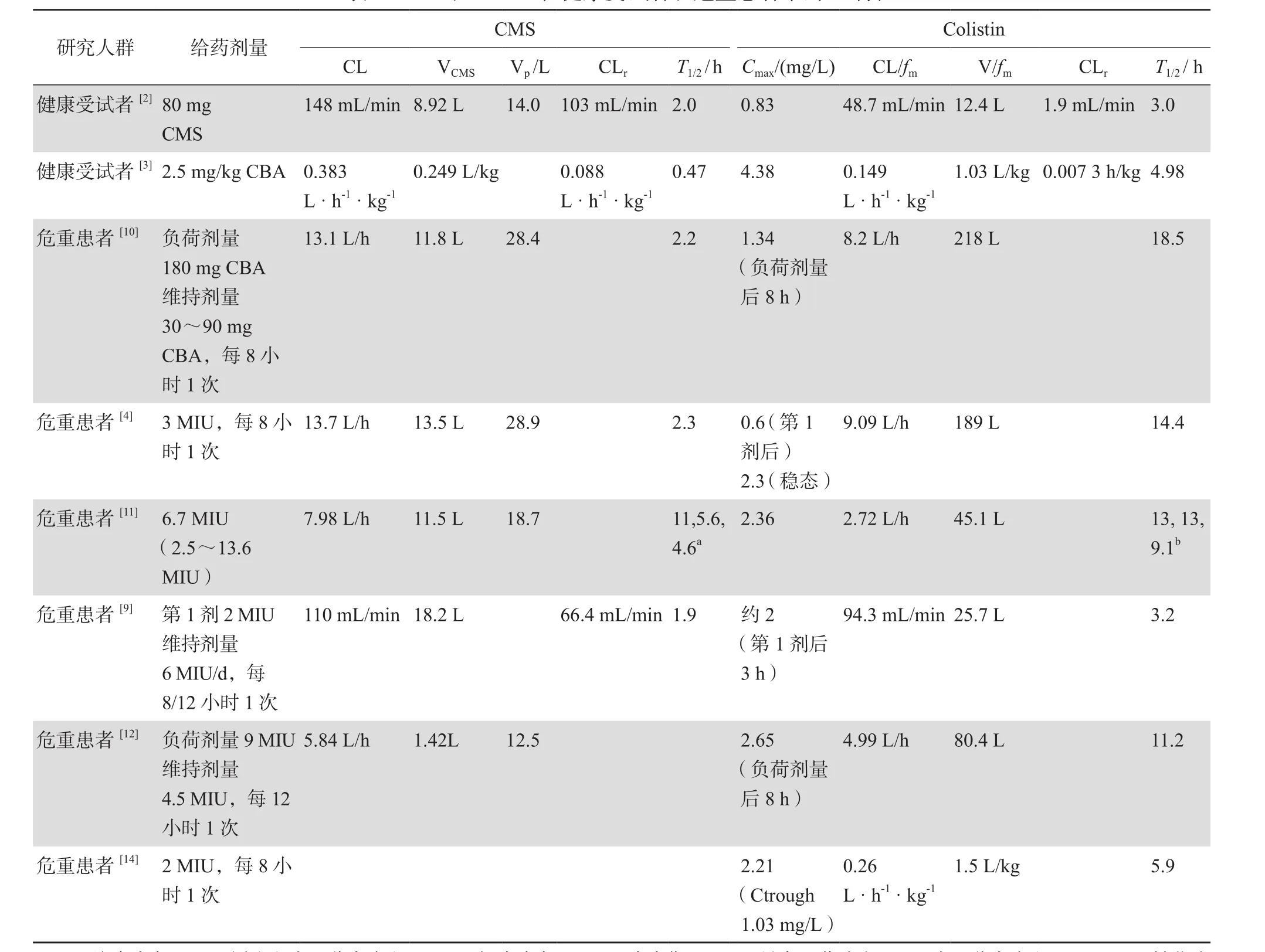
表3 CMS和Colistin在健康受试者和危重患者中的PK特征
总体来看,肾功能减退的危重患者体内colistin半衰期延长,多数研究认为需要给予负荷剂量,也有研究显示不同厂家的CMS药物,转化率不完全相同,并不一定需要负荷剂量。但对于肌酐清除率大于80 mL/min的患者,colistin血药浓度较难达到有效浓度,推荐联合用药。因此在使用CMS之前,应认真阅读该药物的药品说明书,掌握此药在人体内PK特点,合理选择药物剂量。
3.1.3肾替代治疗患者 目前的研究表明,接受肾替代治疗患者的CMS剂量差异非常大,CMS可有效地经透析排出。接受连续性静脉血液透析(continuous venovenous hemodiafiltration,CVVHDF)的患者在给予CMS后0~8 h,透析液中CMS回收率为20.3%,colistin回收率为6.88%[16]。烧伤患者进行肾替代治疗时,CMS经透析清除的量更高(51.6%)[17]。研究者建议接受CVVHDF治疗的患者不应降低CMS剂量,而应与肾功能正常的患者使用相同或更高剂量。由于CMS容易经透析排出,透析应在给药间期的后期进行,此时CMS浓度低,可以减少排出。
对于透析患者应如何调整剂量,2011年Garonzik等[11]推荐剂量为: 接受间歇性血液透析(intermittent hemodialysis,IHD)的患者,若要使colistin稳态血药浓度达到1 mg/L,非透析日的推荐剂量为CBA 30 mg,每12小时1次,在透析日应补加剂量,在透析结束前1 h,应补加50%,或在透析结束后,应补加30%;对于接受连续性肾替代治疗(continuous renal replacement,CRRT)的患者,若要使colistin稳态血药浓度达到1 mg/L,推荐剂量为每日CBA 192 mg,每8~12小时给药1次。
3.1.4腹膜透析患者 接受腹膜透析的终末期肾病患者在单次静脉注射CMS(CBA 150 mg)后,平均9.5 h(3~13 h)时可达到最大colistin血药浓度2.4 mg/L(1.2~3.4 mg/L),CMS的总清除率为1.77 L/h,腹膜透析清除率只有0.088 3 L/ h,colistin的总清除率为2.74 L/h,腹膜透析率为0.100 L/h,colistin的半衰期为13.2 h。给药后24 h内腹膜透析液中CMS的累积回收率为2.58%,colistin的累积回收率为2.61%,给药后24 h 内尿液中CMS和colistin的累积回收率分别为3.3%和2.8%。由于腹膜透析清除率远小于总体清除率,且药物在透析液中回收率很低,说明CMS和colistin经腹膜透析清除的量非常小。因此腹膜透析的患者并不需要增加剂量。蒙特卡罗模拟显示,当剂量为CBA 150 mg,给药后6 h时腹膜透析液中colistin浓度为(0.82±0.28)mg/L[18];对腹膜炎患者,给予CBA 180 mg,腹膜透析液中colistin浓度可达到2.5~3 mg/L[19]。
3.1.5儿童及新生儿 虽然多黏菌素类抗生素在儿童中的用药越来越多[20],但相关PK研究很少,目前,仅有一项研究报道colistin在儿童血和脑脊液中的浓度,研究显示,5例婴儿及儿童年龄1.5个月~14岁,接受CMS静脉注射60 000~225 000 IU·kg-1·d-1,仅有1例14岁的儿童接受225 000 IU·kg-1·d-1剂量后,colistin血药浓度超过2 mg/L,在其他儿童中为0.19~1.60 mg/L。所有儿童中脑脊液内药物浓度均非常低,无脑膜炎症时,colistin浓度为0.05~0.15 mg/L;有脑膜炎症时,colistin浓度显著增加(0.46~0.50 mg/L),占血药浓度的34%~67%[21]。新生儿中colistin PK的报道也极少,近期一项研究报道7例危重新生儿患者(平均年龄为13 d,年龄范围为5~15 d)中colistin的PK数据[22],单次给予CMS 150 000 IU/kg (相当于CBA 5 mg/kg) 后,血中colistin的Cmax为 (3.0±0.7)mg/L,达峰时间 (Tmax)为(1.3±0.9) h,半衰期(T1/2)为(9.0±6.5) h,每24小时给药1次后,colistin的稳态血浓度为(1.1±0.4)mg/L。
3.1.6烧伤患者 烧伤患者在接受CMS(CBA 150 mg,每12小时1次)治疗后,colistin的血药浓度多数低于2 mg/L,AUC0~24h为(29.2±13.5)mg·h/ L,模拟结果显示即使剂量升高至CBA 500 mg/d时,AUC0-24/MIC也仅为45 mg·h/ L(肌酐清除率≥70 mL/min)和65 mg·h/L(肌酐清除率<70 mL/min),colistinT1/2为 6.6 h。烧伤患者中colistin的T1/2和表观分布容积都较健康人高,然而清除率却相近,烧伤后的高代谢水平未显著增加colistin的清除量[23]。此外,colistin在烧伤患者体内的蛋白结合率较高(80%~90%),可能由于烧伤患者体内α-1-酸性糖蛋白水平增高[17]。
3.1.7CMS脑室内给药 在治疗中枢神经系统感染时,静脉输注CMS很难透过血脑屏障,colistin在脑脊液和血浆中的浓度比值仅为0.051~0.057[24],因此colistin难以在脑脊液中达到有效的治疗药物浓度。此时可选择CMS脑室内给药,美国感染病学会推荐剂量为CMS 10 mg/ d。然而近期研究表明[25],当CMS 剂量为5.22 mg/d时,脑脊液中colistin谷浓度即可达到2 mg/L以上(2~9.7 mg/L)。由于脑膜炎症可影响脑脊液循环,且每例患者脑脊液的引流情况不同,导致colistin浓度的波动范围也很大,当CMS剂量为5.22 mg/d时,colistin 的Cmax最高可达22.1 mg/L。考虑到colistin浓度在脑脊液中的个体间变异大,因此在使用时要格外谨慎。此研究还表明脑室内注射CMS后(3.7±0.9)h colistin可达到最大血药浓度,稳态血药浓度为3.0~12.2 mg/L,colistinT1/2为(7.8±3.2)h,在脑脊液中无蓄积现象[25]。
另一项前瞻性研究 也表明colistin在脑脊液/血清中浓度比值非常低(0.07)[26],中枢神经系统感染时,脑室内注射剂量为CMS 10 mg(1.25 MIU,CBA 3.75 mg)时,脑脊液中colistin浓度较高(1.4 mg/L,0.6~1.6 mg/L)。此外,此研究证实脑室有炎症时,colistin的血脑渗透率升高,与无炎症患者相比,colistin AUC 可高出60%左右。
3.2 多黏菌素B人体PK
目前多黏菌素B的人体PK研究相对较少,且有些研究仅测定了多黏菌素B1的浓度,本文未收集仅测定了多黏菌素B1的论文。
Zavascki等[27]首次报道多黏菌素B在危重患者中的PK特征,当给药剂量为0.5~1.5 mg/kg,每12小时1次或每48小时1次时,多黏菌素B最高血药浓度(Cmax)可达2.38~13.9 mg/L,CLtotal为0.27~0.81 mL·min-1·kg-1,表观分布容积(V)为71~194 mL/ kg,极少量(0.04%~0.86%)的多黏菌素B经尿液排出。此外,危重患者中该药的蛋白结合率(78.5%~92.4%)较健康人(55.9%±4.7%)高[27]。
另一项危重患者中多黏菌素B的群体PK研究中,给药剂量为0.45~3.38 mg·kg-1·d-1,稳态血药浓度为(2.79±0.90)mg/L(0.68~4.88 mg/ L)。CLtotal为0.0276 L·h-1·kg-1,肾清除率(CLr)为0.061 L/h,占肾小球滤过率的9.7%,说明90.3%的多黏菌素B经肾小球滤过后又被重吸收回体内。中央室V(Vc)为0.093 9 L/kg,周边室V(Vp)为0.330 L/kg。此外,蒙特卡罗模拟结果显示,目前的推荐剂量2~2.5 mg·kg-1·d-1可能只适用于MIC<1 mg/L的细菌感染,当MIC>4 mg/L时,建议采用联合用药治疗[28]。
多黏菌素B在特殊人群中的PK研究更少,为数不多的研究中病例数也极少,以下为在透析患者和肥胖患者中的研究。
在2例接受CVVHDF的患者中,1例为正常体重的年轻患者(20~30岁,50.8 kg),接受多黏菌素B治疗的剂量为75 mg,每12小时1次,另1例为老年肥胖患者(60~70岁,250 kg),剂量为250 mg,每12小时1次(2.0 mg·kg-1·d-1)。两者的最大血药浓度分别为8.62 和4.38 mg/L,总清除率(包含CVVHD清除)为2.17和6.66 L/h,其中12.2%和5.62%为CVVHD清除,CVVHD清除率为0.005 2 L·h-1·kg-1和0.001 5 L·h-1·kg-1。稳态表观分布容积为0.50 和0.34 L/kg。蛋白结合率为74.1%和48.8%。本文采用的多黏菌素B的剂量与肾功能正常患者的推荐剂量(2.0~3.0 mg·kg-1·d-1)相近,作者建议肥胖患者应按照其实际体重给药[29]。另1例白血病的青少年患者在接受血液透析时,多黏菌素B的剂量为1 mg·kg-1·d-1,透析前后的血药浓度分别为0.123 mg/L和0.117 mg/L,透析液中的多黏菌素B浓度为0,透析清除率为 8 mL/min[30]。
4 多黏菌素气雾吸入
临床研究表明直接CMS可气雾吸入作为肺炎的辅助治疗。相对于静脉输注给药,气喷雾吸入可使colistin痰液中浓度高于血浆浓度,CMS静脉给药剂量为2 MIU或4 MIU时,痰内药物浓度在给药后12 h内均低于1 mg/L,而给予相同剂量的气喷雾吸入时,药物浓度在给药后1.3~5.2 h达到峰值,分别为2.09~11.3 mg/L和4.10~21.2 mg/ L,且气喷雾吸入时,仅2%~3%的药物经尿液排出,因此有可能降低多黏菌素发生肾毒性的风险[31]。通过气雾吸入进行多黏菌素靶向给药的优势在于可最大程度提高肺黏液中药物浓度,同时降低血药浓度以降低潜在的肾毒性[32]。
5 肾毒性
肾毒性是多黏菌素类药物最主要的不良反应。患者基础肾功能[33]、年龄[33]、colistin血药谷浓度(>2.42 mg/L)[34]、colistin的剂量(≥3 mg CBA/kg)等因素在某些研究中被认为是急性肾损伤的危险因素[35]。多黏菌素诱导的肾损伤的发病机制尚未完全阐明,实验研究结果显示氧化损伤和凋亡损伤是急性肾小管坏死的关键机制[36-37],因此抗氧化剂可能起到保护作用[38-39]。在多黏菌素诱导的肾损伤大鼠模型中,给予抗坏血酸(相当于人体剂量2 g /d)7 d可预防肾小管细胞凋亡[40]。抗坏血酸的保护作用也在临床研究中得到了证实,近期有报道显示合并使用抗坏血酸3 (2~4) g / d,患者发生急性肾损伤的概率为未使用抗坏血酸时的1/4[33]。
6 目前存在的问题
6.1 缺乏多黏菌素药典标准
Colistin是由发酵产生的含有30多个成分的混合物,通过化学修饰而产生前药CMS,这个修饰过程为磺胺甲基化,可能发生在colistin的1个或所有5个主要氨基酸序列。由于不同批次CMS或药物制剂之间存在不均一性而产生的变异也会影响CMS转化为colistin的转化率,这些变异可能产生不同的药效和不良反应。因多黏菌素类的治疗窗口较窄,因此亟待新的药典标准对该类药物进行规范。
6.2 药敏试验和折点的不确定
由于CMS是无活性的前药,colistin硫酸盐应当用于colistin的体外药敏测定。由于多黏菌素类药物容易特异性的吸附在实验材料上,为减少吸附,有学者建议多黏菌素类药物的MIC测定可使用聚山梨醇酯80,但考虑到其与多黏菌素类药物潜在的协同作用,临床和实验室标准化协会(CLSI)不推荐在药敏试验中使用聚山梨醇酯80[41-42]。目前国际上认可的用于体外敏感性测试的方法是微量稀释法,即ISO 20776-1标准。CLSI推荐在测定多黏菌素类药物的抗菌活性时,应添加25 mg/L Ca2+和12.5 mg/L Mg2+。
6.3 治疗药物浓度监测
对于CMS,不同肾功能患者的稳态血浆colistin浓度存在较大差异,需要对其进行药物浓度监测(therapeutic drug monitoring,TDM)。PK和药效学研究及分析表明,colistin平均稳态血浓度为2 mg/L比较理想。如果colistin血浓度无法达到2 mg/L(可能是肾功能良好的患者)或者感染病原菌的MIC高于1 mg/L,建议采用联合治疗。在进行TDM时,血样的采集时间、血样的运送及测定过程中,都应采取相应的措施,防止CMS转化为colistin,否则所测的colistin浓度可能会高于血样采集时患者体内的浓度,从而导致误判。因CMS在体内消除快,TDM的取样时间应在下次给药前(即谷浓度),此时CMS血浓度低,对colistin浓度的影响最低。
6.4 多黏菌素的不当使用
多黏菌素有时用于治疗消化道细菌性感染。有报道称肠道细菌可对多黏菌素快速产生耐药性,因此如果需要选择性的肠道清洗,应尽可能选择其他药物。colistin曾被用作生长促进剂,用于动物疾病的预防和治疗。目前没有证据表明colistin耐药菌由动物扩散至人体,但欧洲药品管理局建议应限制使用colistin治疗已感染动物以及与它们接触的动物,同时取消所有动物预防用药的指征。在国际范围内制定相关政策以控制多黏菌素在动物感染疾病治疗中的使用,规范多黏菌素兽用非常重要。
7 总结
随着对多黏菌素类药物的关注越来越多,需要一个统一的行业标准来进行规范管理,使这一重要的最后一道防线的抗生素能得到合理有效的应用。由于colistin和多黏菌素B之间存在交叉耐药性,因此如何合理使用此抗生素以达到最佳效果,延长其临床使用寿命尤为关键。临床前研究,转化型研究和临床研究需要重点聚焦于阐明如何合理使用现有的多黏菌素,也有助于发现更好的新一代多黏菌素类抗生素。
[1]NATION RL,GARONZIK SM,LI J,et al. Updated US and European dose recommendations for intravenous colistin: how do they perform?[J]. Clin Infect Dis,2016, 62(5): 552-558.
[2]COUET W,GREGOIRE N,GOBIN P,et al.Pharmacokinetics of colistin and colistimethate sodium after a single 80-mg intravenous dose of CMS in young healthy volunteers[J]. Clin Pharmacol Ther,2011,89(6): 875-879.
[3]MIZUYACHI K,HARA K,WAKAMATSU A,et al.Safety and pharmacokinetic evaluation of intravenous colistin methanesulfonate sodium in Japanese healthy male subjects[J].Curr Med Res Opin,2011,27(12): 2261-2270.
[4]PLACHOURAS D,KARVANEN M,FRIBERG LE,et al.Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with infections caused by gram-negative bacteria[J].Antimicrob Agents Chemother,2009,53(8): 3430-3436.
[5] FOREST LABORATORIES UK. Colomycin Injection[EB/OL].[2017-02-17]. https://www. medicines. org. uk/emc/medicine/1590#companyDetails.
[6]FOREST LABORATORIES UK. Colomycin Tablets[EB/OL].[2017-02-17]. https://www. medicines. org. uk/emc/medicine/6301.
[7]FDA. COLY-MYCIN M (COLISTIMETHATE SODIUM)package Insert[EB/OL]. [2017-02-17]. http://www. accessdata.fda. gov/drugsatfda_docs/label/2013/050108s030lbl. pdf.
[8]X-GEN PHARMACEUTICALS I. Polymyxin B for Injection package Insert,USP. [2017-02-17]. http://www. x-gen. us/wpcontent/uploads/sites/21/2015/01/XGSS_TSM_POLY. 05. 15_WB. pdf.
[9]GREGOIRE N,MIMOZ O,MEGARBANE B,et al. New colistin population pharmacokinetic data in critically ill patients suggesting an alternative loading dose rationale[J]. Antimicrob Agents Chemother,2014,58(12): 7324-7330.
[10]MOHAMED AF,KARAISKOS I,PLACHOURAS D,et al. Application of a loading dose of colistin methanesulfonate in critically ill patients: population pharmacokinetics,protein binding,and prediction of bacterial kill[J]. Antimicrob Agents Chemother,2012,56(8): 4241-4249.
[11]GARONZIK SM,LI J,THAMLIKITKUL V,et al.Population pharmacokinetics of colistin methanesulfonate and formed colistin in critically ill patients from a multicenter study provide dosing suggestions for various categories of patients[J].Antimicrob Agents Chemother,2011,55(7): 3284-3294.
[12]KARAISKOS I,FRIBERG LE,PONTIKIS K,et al. Colistin population pharmacokinetics after application of a loading dose of 9 MU colistin methanesulfonate in critically ill patients[J].Antimicrob Agents Chemother,2015,59(12): 7240-7248.
[13]HE H,LI JC,NATION RL,et al. Pharmacokinetics of four different brands of colistimethate and formed colistin in rats[J]. J Antimicrob Chemother,2013,68(10): 2311-2317.
[14]IMBERTI R,CUSATO M,VILLANI P,et al. Steady-state pharmacokinetics and BAL concentration of colistin in critically Ill patients after IV colistin methanesulfonate administration[J].Chest,2010,138(6): 1333-1339.
[15]ROBERTS JA,LIPMAN J. Pharmacokinetic issues for antibiotics in the critically ill patient[J]. Crit Care Med,2009,37(3): 840-851.
[16]LI J,RAYNER CR,NATION RL,et al. Pharmacokinetics of colistin methanesulfonate and colistin in a critically ill patient receiving continuous venovenous hemodiafiltration[J].Antimicrob Agents Chemother,2005,49(11): 4814-4815.
[17]AKERS KS,ROWAN MP,NIECE KL,et al. Colistin pharmacokinetics in burn patients during continuous venovenous hemofiltration[J]. Antimicrob Agents Chemother,2015,59(1):46-52.
[18]KOOMANACHAI P,LANDERSDORFER CB,CHEN G,et al. Pharmacokinetics of colistin methanesulfonate and formed colistin in end-stage renal disease patients receiving continuous ambulatory peritoneal dialysis[J]. Antimicrob Agents Chemother,2014,58(1): 440-446.
[19]MIMOZ O,PETITPAS F,GREGOIRE N,et al. Colistin distribution in the peritoneal fluid of a patient with severe peritonitis[J]. Antimicrob Agents Chemother,2012,56(7):4035-4036.
[20]TAMMA PD,NEWLAND JG,PANNARAJ PS,et al. The use of intravenous colistin among children in the United States:results from a multicenter,case series[J]. Pediatr Infect Dis J,2013,32(1): 17-22.
[21]ANTACHOPOULOS C,KARVANEN M,IOSIFIDIS E,et al. Serum and cerebrospinal fluid levels of colistin in pediatric patients[J]. Antimicrob Agents Chemother,2010,54(9):3985-3987.
[22]NAKWAN N,USAHA S,CHOKEPHAIBULKIT K,et al. Pharmacokinetics of colistin following a single dose of intravenous colistimethate sodium in critically Ill neonates[J].Pediatr Infect Dis J,2016,35(11): 1211-1214.
[23]LEE J,HAN S,JEON S,et al. Population pharmacokinetic analysis of colistin in burn patients[J]. Antimicrob Agents Chemother,2013,57(5): 2141-2146.
[24]MARKANTONIS SL,MARKOU N,FOUSTERI M,et al.Penetration of colistin into cerebrospinal fluid[J]. Antimicrob Agents Chemother,2009,53(11): 4907-4910.
[25]IMBERTI R,CUSATO M,ACCETTA G,et al.Pharmacokinetics of colistin in cerebrospinal fluid after intraventricular administration of colistin methanesulfonate[J].Antimicrob Agents Chemother,2012,56(8): 4416-4421.
[26]ZIAKA M,MARKANTONIS SL,FOUSTERI M,et al.Combined intravenous and intraventricular administration of colistin methanesulfonate in critically ill patients with central nervous system infection[J]. Antimicrob Agents Chemother,2013,57(4): 1938-1940.
[27]ZAVASCKI AP,GOLDANI LZ,CAO G,et al.Pharmacokinetics of intravenous polymyxin B in critically ill patients[J]. Clin Infect Dis,2008,47(10): 1298-1304.
[28]SANDRI AM,LANDERSDORFER CB,JACOB J,et al.Population pharmacokinetics of intravenous polymyxin B in critically ill patients: implications for selection of dosage regimens[J]. Clin Infect Dis,2013,57(4): 524-531.
[29]SANDRI AM,LANDERSDORFER CB,JACOB J,et al.Pharmacokinetics of polymyxin B in patients on continuous venovenous haemodialysis[J]. J Antimicrob Chemother,2013,68(3): 674-677.
[30]BAIRD JS. Polymyxin B and haemofiltration in an adolescent with leukaemia[J]. J Antimicrob Chemother,2014,69(5):1434.
[31]WS YAPA S,LI J,PATEL K,et al. Pulmonary and systemic pharmacokinetics of inhaled and intravenous colistin methanesulfonate in cystic fibrosis patients: targeting advantage of inhalational administration[J]. Antimicrob Agents Chemother,2014,58(5): 2570-2579.
[32]NATION RL,LI J,CARS O,et al. Framework for optimisation of the clinical use of colistin and polymyxin B: the Prato polymyxin consensus[J]. Lancet Infect Dis,2015,15(2):225-234.
[33]DALFINO L,PUNTILLO F,ONDOK MJ,et al. Colistinassociated acute kidney injury in severely Ill patients: a step toward a better renal care? a prospective cohort study[J]. Clin Infect Dis,2015,61(12): 1771-1777.
[34]SORLI L,LUQUE S,GRAU S,et al. Trough colistin plasma level is an independent risk factor for nephrotoxicity:a prospective observational cohort study[J]. BMC Infect Dis,2013,13: 380.
[35]LEE YJ,WI YM,KWON YJ,et al. Association between colistin dose and development of nephrotoxicity[J]. Crit Care Med,2015,43(6): 1187-1193.
[36]OZYILMAZ E,EBINC FA,DERICI U,et al. Could nephrotoxicity due to colistin be ameliorated with the use of N-acetylcysteine? [J]. Intensive Care Med,2011,37(1):141-146.
[37]OZKAN G,ULUSOY S,OREM A,et al. How does colistin-induced nephropathy develop and can it be treated? [J].Antimicrob Agents Chemother,2013,57(8): 3463-3469.
[38]YOUSEF JM,CHEN G,HILL PA,et al. Melatonin attenuates colistin-induced nephrotoxicity in rats[J]. Antimicrob Agents Chemother,2011,55(9): 4044-4049.
[39]DAI C,TANG S,DENG S,et al. Lycopene attenuates colistin-induced nephrotoxicity in mice via activation of the Nrf2/HO-1 pathway[J]. Antimicrob Agents Chemother,2015,59(1): 579-585.
[40]YOUSEF JM,CHEN G,HILL PA,et al. Ascorbic acid protects against the nephrotoxicity and apoptosis caused by colistin and affects its pharmacokinetics[J]. J Antimicrob Chemother,2012,67(2): 452-459.
[41]HUMPHRIES RM. Susceptibility testing of the polymyxins:where are we now? [J]. Pharmacotherapy,2015,35(1): 22-27.
[42]European Committee on Antimicrobial Susceptibility Testing,Recommendations for MIC determination of colistin (polymyxin E). As recommended by the joint CLSI–EUCAST Polymyxin Breakpoints Working Group. EUCAST[EB/OL]. [2017-02-17].http://www. eucast. org/fileadmin/src/media/PDFs/EUCAST_files/General_documents/Recommendations_for_MIC_determination_of_colistin_March_2016. pdf.
Research update on polymyxins
ZHAO Miao, ZHANG Jing, ZHANG Yingyuan, Li Jian.
(Institute of Antibiotics, Huashan Hospital, Fudan University & Key Laboratory of Clinical Pharmacology of Antibiotics, National Population and Family Planning Commission, Shanghai200040, China)
R978.16
A
1009-7708 ( 2017 ) 06-0695-08
10.16718/j.1009-7708.2017.06.017
国家自然科学基金国际合作项目(81628015);国家自然科学基金面上项目(81373493)。
1. 复旦大学附属华山医院抗生素研究所,卫计委抗生素临床药理重点实验室,上海 200040;2. Monash Biomedicine Discovery Institute, Department of Microbiology, Monash University, Clayton, Victoria 3800, Australia.
赵苗(1989—),女,博士研究生,主要从事抗菌药物临床药理学研究。
张菁,E-mail:zhangj61@fudan.edu.cn。
2016-06-12 修回日期:2017-07-17

