阳离子阿奇霉素微类脂体体内外相关性
曾 梅,钟 萌,冯 悦,罗见春,张奇娆,张景勍
(1.重庆医科大学药学院药物高校工程研究中心,重庆 400016;2.西南医科大学附属医院药剂科,四川 泸州 646099;3. 西南医科大学附属医院核医学科,四川 泸州 646099)
阿奇霉素 (azithromycin,AM) 是新一代氮杂内酯类抗生素,临床上主要用于呼吸道、皮肤和软组织感染。但是其口服治疗往往伴有腹痛、腹泻、恶心、呕吐等胃肠道不良反应[1-2]。因此,制备的阳离子阿奇霉素微类脂体 (azithromycin cationic micron niosomes,ACMNS)是具有脂质体相似特征的泡囊结构,用于口服递送系统后可持续释放和改善AM的药代动力学过程,提高生物利用度,降低药物毒副作用,具有很高的潜在应用价值[3-4]。
Wagner-Nelson法[5-6]是用于评价一室模型药物吸收动力学的经典方法。该法简单,既不要求以静脉给药做参比,也不需要对吸收的机制与动力学模式进行限制。反卷积分法[7](Deconvolution)不需要进行房室模型拟合,直接用数学方法以真实的实验数据计算体内输入函数R。随着以缓释、控释制剂为主的给药系统的普及,Wagner-Nelson法和反卷积分法的应用较为广泛[8]。本研究同时以Wagner-Nelson法和反卷积分法分别从室模型拟合和数学模型的角度,对ACMNS的体内外相关性进行了双重研究,为ACMNS的体外释放行为预测药物体内吸收特征和变化规律提供一定的科学依据。
1 材料
1.1药品与试剂阿奇霉素(上海现代制药股份有限公司);阿奇霉素对照品(效价:952 kU·g-1,中国食品药品检定研究所);胆固醇(广州天马精细化工厂);吐温-80(上海申宇医药化工有限公司);十八胺(上海南翔试剂有限公司);甲醇、乙腈、异丙醇为色谱纯,其余试剂均为分析纯,实验用水为超纯水。
1.2仪器安捷伦1100型高效液相色谱仪(美国Agilent公司);UV-VIS3150型紫外可见分光光度仪(日本岛津公司);分析电子天秤(瑞士Mettler Toledo公司);激光粒度仪(英国Malvern公司);QL-901 型旋涡混合器(海门市其林贝尔仪器制造有限公司);TGL-16B型高速台式离心机(江苏省金坛市大地自动化仪器厂);XSP-35-1600X型生物显微镜(宜春金浩科技有限公司);Milli-Q型超纯水系统(美国Millipore公司)。
1.3动物12只健康SD大鼠,♀♂各半,体质量230~250 g,重庆医科大学实验动物中心提供。动物合格证号:SCXK(渝)2013-0001。
2 方法
2.1ACMNS的制备采用薄膜蒸发-冷冻法制备ACMNS[9]。取适量AM、胆固醇、十八胺和吐温-80于100 mL圆底烧瓶中,加入适量二氯甲烷溶解,减压蒸发至烧瓶内壁上形成一层均匀透明薄膜,加入含有5%甘露醇的磷酸缓冲溶液(PBS)和若干玻珠,继续水浴,并在常压下搅拌分散,使薄膜溶胀水合,得到混悬液。混悬液置于-20℃冰箱中冷冻过夜后,取出,于室温下完全融化,反复冻融3次可得ACMNS混悬液,于4℃冰箱中储存备用。
2.2ACMNS的粒径分布和zeta电位取适量ACMNS,用超纯水稀释一定倍数后,采用显微镜下显微计数法测定其粒径,马尔文激光粒度仪测定其zeta电位。
2.3ACMNS的体外释放采用动态膜透析法[10]测定ACMNS的体外释放度。精密量取等浓度、等体积的ACMNS和AM溶液,将含药透析袋置于盛有释放介质为pH 6.8 PBS的溶出瓶中,溶出介质体积为500 mL,满足漏槽条件。温度为(37±0.5)℃,转速为100 r·min-1,分别于0.5、1、2、4、6、8、12、24、36、48、72、96、144、192、240 h时间点取1 mL,立即补加等量同质同温的释放介质。平行操作3份。测定透析袋外液ACMNS和AM的含量,计算累积释放百分率Y,并绘制释药曲线。
2.4ACMNS的体内药代动力学
2.4.1动物给药方案及样品采集 采用交叉设计单剂量给药方案,给药剂量为每只大鼠200 mg·kg-1(以AM计)。将12只♀♂各半的SD大鼠随机分为2组,每组6只。实验前禁食12 h,全程不禁水。一组给予AM(ig),另一组给予ACMNS(ig),分别于给药0.5、1、2、4、6、8、12、24、48 h后麻醉大鼠,通过眼底取血采集血样至肝素浸润过的离心管中,6 000 r·min-1离心10 min后,取上层血浆,置于-20℃冰箱中保存待测。
2.4.2血浆样品的处理方法 精密量取血浆样品300 μL,加入10 μL内标物罗红霉素(20 mg·L-1)、 80 μL 0.2 mol·L-1的NaOH溶液和2 mL乙醚,涡旋混匀。完毕后,3 000 r·min-1离心10 min,提取乙醚层,于40℃真空干燥后,加200 μL甲醇复溶,涡旋,12 000 r·min-1离心10 min,取上清液40 μL作为供试品进样分析。
2.4.3体内分析方法的建立 色谱条件:流动相为乙腈 ∶异丙醇 ∶0.004 mol·L-1的磷酸氢二钠=60 ∶15 ∶25(V/V/V),流速1 mL·min-1,检测波长210 nm,柱温40℃。色谱柱为大连伊利特C18(250 mm×4.6 mm,5 μm)。
标准曲线的绘制:5份100 μL的空白血浆中加入不同浓度的AM标准溶液,配制成系列浓度的血浆样品,按血浆样品处理方法操作后,分别以AM和内标物的峰面积之比A对AM浓度C(mg·L-1)进行线性回归,得到标准曲线。
精密度考察:配制AM低、中、高3个质量浓度分别为5、15、25 mg·L-1的血浆样品,各浓度平行配制3份,按血浆样品的处理方法,1 d内连续进样检测5次,连续5 d,考察其日内和日间精密度。
回收率考察:配制AM低、中、高3个质量浓度为5、15、25 mg·L-1的血浆样品,各浓度平行配制3份,按血浆样品的处理方法,同时直接测定相应浓度AM对照品溶液和内标溶液,计算绝对回收率和萃取回收率。
2.5Wagner-Nelson法评价体内外相关性将血药浓度数据用DAS 2.1.1软件进行拟合,并以AIC、R2的大小判断ACMNS在大鼠体内药动学房室模型。采用Wagner-Nelson法[6,11-12]计算各时间点体内药物吸收百分数,并与相应时间点体外药物累积释放百分数进行线性回归,考察其体内外相关性,计算公式如下:

(1)
其中,Fa为t时药物吸收百分数,XA为体内吸收的药物总量,Ct是t时体内血药浓度,k是药物消除的一级速率常数。
2.6反卷积分法评价体内外相关性
(2)
公式中AUC为相邻时间间隔内ACMNS药-时曲线下面积,C(ti)为ACMNS各时间点的血药浓度,将各点数据代入即可求得相邻时间间隔内ACMNS的输入函数R[7,11]。以输入函数R对相对应时间点的体外累积释放度进行线性回归,考察ACMNS的体内外相关性。
3 结果
3.1ACMNS的粒径分布和zeta电位经显微计数法测定其粒径为(5.87±1.17)μm,马尔文激光粒度仪测定其zeta电位为+(12.5±0.02)mV。
3.2ACMNS的体外释放ACMNS和AM的释放曲线如Fig 1所示,二者在相同的释放介质(pH 6.8 PBS)中比较,ACMNS比原料药AM释放的慢,在前0.5 h释放了约24%,前2 h释放了约38%,8 h释放了约62%,36 h释放了约77%,240 h基本释放完全,ACMNS的释放行为得以改善,具有明显的缓释作用。
3.3ACMNS的体内药代动力学AM体内血浆样品的标准曲线方程为:A=19.26C-52.69,r=0.9991,n=3,AM的浓度在1.0~50.0 mg·L-1范围内和内标物罗红霉素的峰面积比有良好的线性关系。高、中、低3个浓度的溶液中,AM的日内精密度RSD分别为4.32%、2.13%、0.94%,日间精密度RSD分别为3.14%、1.56%、1.12%,日内和日间精密度均良好,符合生物样品分析方法学要求。高、中、低3个浓度的溶液中,AM的绝对回收率分别为97.80%、99.51%、98.43%,萃取回收率分别为82.31%、88.49%、90.24%,回收率较高,说明采用该方法处理AM血浆样品合适。
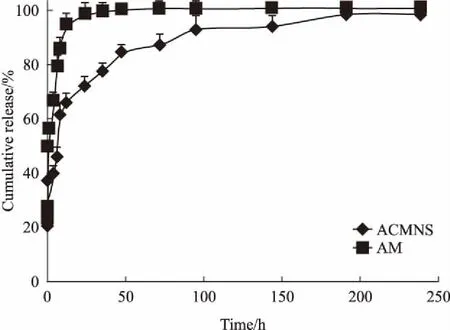
Fig 1 The release cure of ACMNS and AM in vitro
ACMNS和AM在大鼠体内血药浓度与时间绘制成的药-时曲线如Fig 2所示,ACMNS的达峰时间Tmax为4 h。大鼠体内的血药浓度时间数据用DAS 2.1.1药动学软件进行处理,得到ACMNS的房室模拟,见Tab 1。根据R2最大,AIC最小的原则[13]选取ACMNS的最佳药代动力学模型为一室模型。
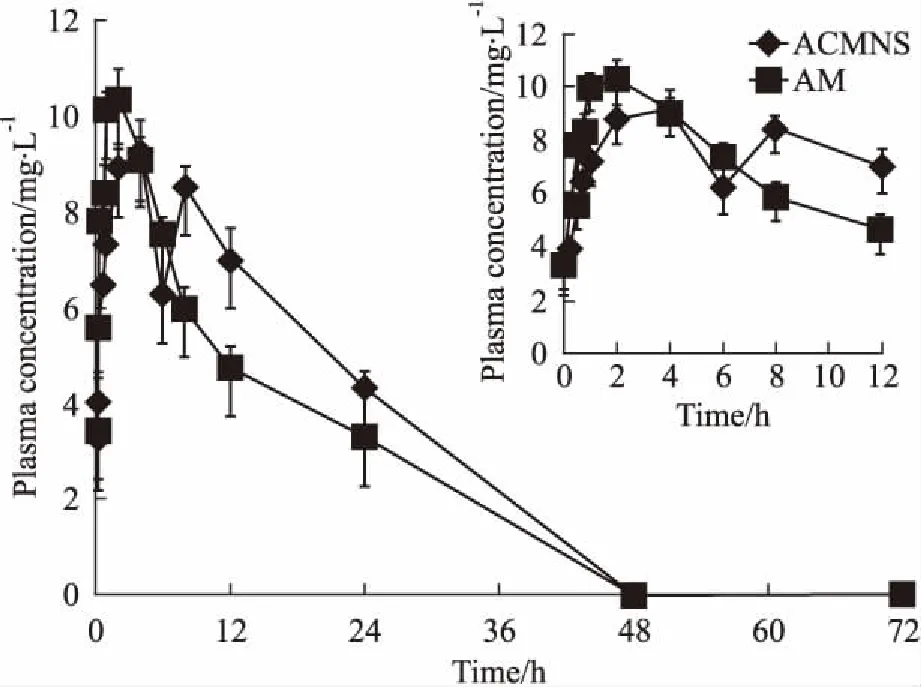
Fig 2 Pharmacokinetic profiles of ACMNS and AM after intragastric administration
3.4Wagner-Nelson法评价体内外相关性由Fig 2可知,单剂量灌胃ACMNS后,4 h后达最大血药浓度,根据公式(1)计算0.5、1、2、4 h时ACMNS的体内吸收分数Fa,见Tab 2。以0.5~4 h体外累积释放百分率为自变量X,体内吸收百分数为因变量Fa,得线性回归方程Fa=3.0524Y-5.7709,r=0.8976,根据相关系数临界表r(2,0.05)=0.9500,r小于相关系数临界值,结果表明ACMNS体外累计释放百分数与体内吸收百分数间没有相关性。
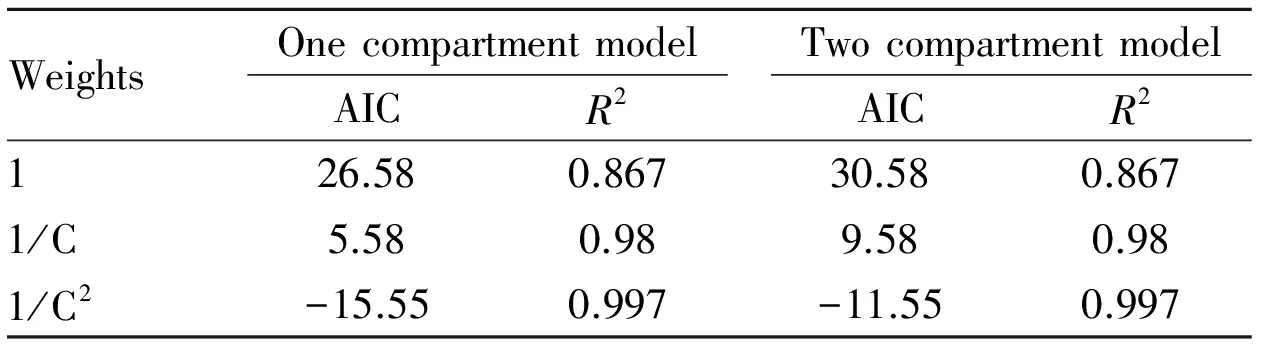
Tab 1 ACMNS compartment pharmacokinetic model fitting
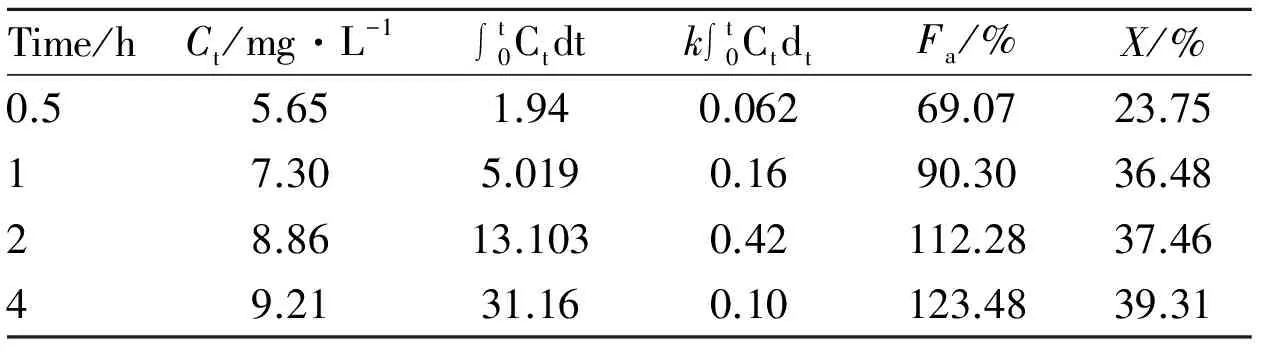
Tab 2 The Wagner-Nelson parameters about ACMNS
3.5反卷积分法评价体内外相关性根据公式(2)计算ACMNS反卷积分中的输入函数R,得到各时间点为0.5、1、2、4 h时的输入函数R值,见Tab 3。以体外累积释放率X作为自变量,输入函数R为因变量,得回归方程R=2.3413X-58.687,r=0.5217,临界值r(2, 0. 05)=0.9500,r小于相关系数临界值,结果表明,ACMNS无体内外相关性。此结果与Wagner-Nelson法评价体内外相关性的结果一致。

Tab 3 The deconvolution parameters about ACMNS
4 讨论
AM为脂溶性药物,口服后引起的胃肠道不良反应可通过改变其剂型而减轻。因此,将其制备成ACMNS后,类脂体泡囊结构包裹的药物需通过一定时间的溶解、扩散以及囊材的溶蚀而被体内吸收。同时,有效地减缓了药物的释放速率,延长了药物在体内有效浓度的时间。
体内外相关性研究的方法较多,最常用的是利用模型参数k求算出体内吸收分数。以吸收分数与相同时间点的体外累积释放率的相关系数的大小来判断体内外的相关性。2015版《中华人民共和国药典》规定,对于在体内吸收呈一室模型的药物,可根据Wagner-Nelson法计算其吸收百分数。本研究通过该法进行ACMNS体内外分析,结果表明ACMNS无体内外相关性。但是室模型拟合法的不足也在于吸收分数的计算引入了消除速率常数k。由于缓控释制剂在体内滞留时间较长,药物从制剂中释放速度较慢,尾段数据常混杂有吸收相,对尾段数据分析易产生较大误差。反卷积分法不需使用模型而是直接根据实验数据就可以得到关于药物体内动态的情况[14]。但反卷积分法所需数据量大,对实验时间点的设置也有要求,否则只能根据原始数据通过外推法或者内插法计算某些时间点的血药浓度,因此本文中反卷积分法的相关性系数稍低,但与Wagner-Nelson法评价体内外相关性的结果仍一致。两种不同类型的方法分别从室模型拟合及数学模型的角度双重验证了ACMNS的体外释放与体内吸收之间没有相关性。
[1] Nirmala M J, Mukherjee A, Chandrasekaran N. Design and formulation technique of a novel drug delivery system for azithromycin and its anti-bacterial activity against Staphylococcus aureus[J].AAPSPharmSciTech, 2013,14(3): 1045-54.
[2] 胡守伟.阿奇霉素的不良反应探析[J]. 中国现代药物应用,2010,4(8):152.
[2] Hu S W. Analysis of adverse reactions of azithromycin[J].ChinJModDrugAppl,2010,4(8):152.
[3] Zhong M,Feng Y,Liao H,et al. Azithromycin cationic non-lecithoid nano/microparticles improve bioavailability and targeting efficiency[J].PharmRes,2014,31(10):2857-67.
[4] Mohsen A M,AbouSamra M M,ElShebiney S A. Enhanced oral bioavailability and sustained delivery of glimepiride via niosomal encapsulation:in-vitrocharacterization andin-vivoevaluation[J].DrugDevIndPharm,2017,6:1-11.
[5] Wagner J G,Nelson E. Kinetic analysis of blood levels and urinary excretion in the absorptive phase after single doses of drug[J].JPharmSci,1964,53:1392-403.
[6] Tang M,Hu P,Huang S,et al. Development of an extended-release formulation for apremilast and a level ainvitro-invivocorrelation study in beagle dogs[J].ChemPharmBull,2016,64(11):1607-15.
[7] 蒋秋冬,吴叶鸣,张 会,等. 中药挥发油透皮促渗布洛芬的药动学及体内外相关性研究[J]. 中国中药杂志,2016,41(23):4362-7.
[7] Jiang Q D,Wu Y M,Zhang H,et al. Evaluation of pharmacokinetics andinvitro/invivocorrelation of ibuprofen with essential oils as penetration enhancer following transdermal administration[J].ChinJChinMasterMed,2016,41(23):4362-7.
[8] 罗 文,谭群友,熊华蓉,等. 普鲁斯的明缓释片体外释放与体内吸收的相关性研究[J]. 四川大学学报(医学版),2013,44(1):80-3.
[8] Luo W,Tan Q Y,Xiong H R,et al. Correlation between in vitro and in vivo absorption of sustained-releasing tablets of neostigmine bromide[J].JSichuanUniv(MedSciEd),2013,44(1):80-3.
[9] Balakrishnan P,Shanmugam S,Lee W S,et al. Formulation andinvitroassessment of minoxidil niosomes for enhanced skin delivery[J].IntJPharm,2009,377(1-2):1-8.
[10] 袁誉铭,陈学梁,陈 静,等. 溴吡斯的明新型纳米乳体外释放和大鼠在体胃肠吸收[J]. 中国药理学通报,2017,33(2):276-9.
[10] Yuan Y M,Chen X L,Chen J,et al. In virtro release and gastrointestinal absorption of novel pyridostigmine bromide nanoemulsion[J].ChinPharmacolBull,2017,33(2):276-9.
[11] Sanaka M,Yamamoto T,Osaki Y,et al. Assessment of the gastric emptying velocity by the 13C-octanoate breath test: deconvolution versus a Wagner-Nelson analysis[J].JGastroenterol,2006,41(7):638-46.
[12] 吴锡凤. 瑞替加滨胃漂浮缓释片的药代动力学及体内外相关性研究[D]. 合肥:安徽中医药大学,2015.
[12] Wu X F. Pharmacokinetics and in vitro/in vivo correlation of retigabine dihydrochloride stomach floating sustained-release tablets[D]. Hefei: Anhui University of Chinese Medicine,2015.
[13] 刘建平. 生物药剂学与药物动力学[M]. 第4版. 北京:人民卫生出版社,2011: 233-4.
[13] Liu J P.BiopharmaceuticalsandPharmacokinetics[M]. Fourth edition. Beijing:People′s Medical Publishing House,2011: 233-4.
[14] 岳 鹏. 卷积法在体内外相关性研究中的应用[J]. 药学学报,2009,44(1):19-24.
[14] Yue P. Application of numerical convolutioninvivo/invitrocorrelation research[J].ActaPharmSin,2009,44(1):19-24.

