微量中药成分的起效机制研究不容忽视
——“遗传协同致死”模式有助于发现并阐释中药显效物质基础及起效机制*
韦忠红,余苏云,陈文星,王爱云,陆 茵,3**
(1.南京中医药大学药学院 南京 210023;2.江苏省中药药效与安全性评价重点实验室 南京 210023;3.江苏省中医药防治肿瘤协同创新中心 南京 210023)
微量中药成分的起效机制研究不容忽视
——“遗传协同致死”模式有助于发现并阐释中药显效物质基础及起效机制*
韦忠红1,2,余苏云1,2,陈文星1,2,王爱云1,2,陆 茵1,2,3**
(1.南京中医药大学药学院 南京 210023;2.江苏省中药药效与安全性评价重点实验室 南京 210023;3.江苏省中医药防治肿瘤协同创新中心 南京 210023)
中药作用机制及显效物质的阐明是制约中药现代化进程的主要障碍。当前研究的对象大都为中药的丰度成分,研究思路多归为正向药理学模式,这种模式往往忽略对中药微量成分的研究。“遗传协同致死”是一种基因之间的互作关系,可使得共同调控生物效应呈现级数放大(大于1 000倍)。鉴于,遗传协同研究模式在抗肿瘤药物研发中取得喜人成绩。(包括PARP抑制剂的发现,化疗药物增效减毒组合的临床使用等)。同时,中药在对抗环境胁迫所产生的多种次生代谢产物,为契合遗传协同靶点提供多成分基础。那么,是否可以将这一研究模式用于阐明微量活性成分的研究?从“靶点-成分-效应”的逆向思维出发,在明确遗传协同靶点的基础上,对中药微量弱效成分起效机制展开研究,并进一步发现潜力的协同成分组合。
微量中药成分 遗传协同致死 环境胁迫 逆向药理学 显效物质基础
中药现代化的发展进程中,对药物作用机制的探讨始终备受重视,创新的中药药理学研究思维成为中药现代研究的关键任务,也是探索中药治疗策略和中药作用模式的基础。当前主流的中药药理学研究思维是一种“成分-靶点-效应”的正向药理学研究思路,包括中药复方“霰弹靶点理论”、多成分多靶点思想,网络药理学等等。以上研究思路有着从分析向综合、从局部向整体的发展趋势,都从不同的侧面表述了中药作用的特点。上述研究的方法和思路围绕中药及中药复方中的丰度成分及常量成分,往往忽略中药组分中种类众多的微量成分,而这些微量成分在中药整合药效中扮演着不可或缺的重要角色。这些微量的活性成分(如鸦胆子中的苦木内酯[1],莪术中的β-榄香烯[2],红花中的羟基红花黄色素[3])在整个中药材中的含量不高,且多数有效成分代谢动力学特征不理想,进入特定组织或细胞的有效成分浓度低;此外,与西药的靶向制剂相比,大多中药中的有效靶点与受体的亲和力较弱[4,5],中药的微量弱效的活性成分是如何起效的呢?
施以逆向思维,从生物网络靶标之间的协同关系研究中药微量弱效成分之间的协同倍增效应,或许可以进一步探索中药多成分之间,除了存在多成分单靶点的叠加和多成分各个靶点的协同以外,是否还存在某种更为重要的靶点与靶点之间协同作用机制,从而使得低亲和力、微量中药多成分组合的效应级数倍增?
近二十年来,“遗传协同致死”模式被成功地应用于抗癌药物的研发中,为靶向抗肿瘤药物的发现[6]及联合使用[7]提供了高效的研究策略。那么,是否可以从“遗传协同致死”的角度来诠释中药微量弱效成分起效的机制,完成将中药活性成分的研究从常量化学成分向微量化学成分的转变。这或许是中药发挥药效重要起效机制的一种补充,成为中药药理学研究新的突破点。
1 遗传协同致死——靶与靶之间的协同效应倍增
遗传协同致死(synthetic lethality)是因两个非致死性基因同时发生突变或干预(如药物干扰,RNA干扰等),从而产生致死效应,属于一种基因层面的相互作用而产生的特定生物现象[8,9]。遗传协同致死不是两个基因之间孤立的相互作用关系,而是这两个基因所在的基因组背景下,在功能上的互作关系。互为遗传协同致死的基因具有某些重要功能上的互补性,当某一个基因功能异常时,另外一个基因会对其进行补偿以维持功能正常。当两基因中任一基因发生突变或干预,对生物事件影响甚微,但若两个基因同时发生突变,或同时进行干预,或在一个基因突变的情况下对另一个基因进行干预,则会使这两个基因共同影响的生物事件发生致死效应[10,11]。(如图1所示)
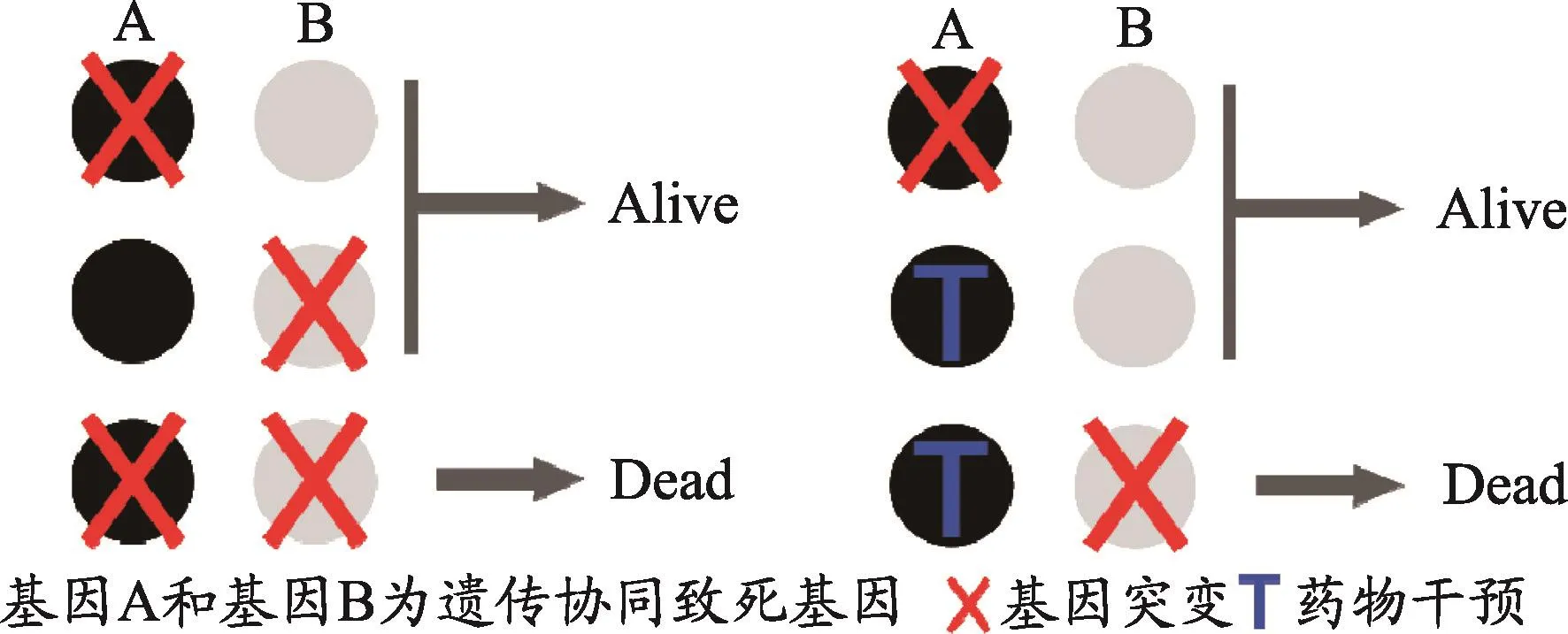
图1 基因A与基因B互为遗传协同致死关系
1.1 遗传协同致死关系互作网络
遗传协同致死在低等模式生物(酵母、果蝇、秀丽隐杆线虫等)[12-14]上是一种普遍的基因互作方式。模式生物酵母除了10%的关键基因(单基因缺失即可致死),其余约80%的基因都是遗传协同致死基因,且大多数基因都和多个基因间存在遗传协同致死关系[15,16]。如调控DNA复制的基因和DNA损伤修复基因就存在遗传协同致死关系;负责细胞有丝分裂检查点的基因也和DNA修复基因产生遗传协同致死效应[7,17]。
鉴于人和酵母等模式生物在多种基本生物学过程以及功能上的保守性,从而激发对肿瘤遗传协同致死基因发现的研究[18,19]。2009年Peter C.Fong发表在New England Journal of Medicine文章提供了肿瘤发生发展过程中存在遗传学“协同致死”现象的最早临床证据[10]。更加令人兴奋的是,Livnat Jerby-Arnon在2014年Cell上阐述了一种基于“遗传协同致死”进行抗肿瘤靶点筛选的数学模型[20]。2017年,Tim Wang等进一步利用基因组CRISPR筛选技术,成功绘制出急性髓系白血病上癌基因Ras的遗传协同致死互作基因网络[21]。这种“共犯关系”的确定揭示了已知的互作基因群体,也发现了一些基因之间以前不知道的或未被研究过的新联系[21,22]。
令人欣喜的是,基于遗传协同致死研究模式开展抗肿瘤药物的研发策略也获得了可喜的成果,体现了协同致死关系在肿瘤治疗中的巨大潜力。
1.2 基于特殊遗传缺陷的遗传协同致死基因的抗肿瘤药物开发
PARP抑制剂就是第一种成功利用遗传协同致死研究模式开发并获批临床使用的抗癌药物[6,23,24]。已上市的PARP1抑制剂(奥拉帕尼[25],尼拉帕尼[26,27]等)可特异性治疗BRCA突变所致DNA修复缺陷的肿瘤,如乳腺腺癌及卵巢癌等[24,25]。正常情况下,BRCA与PARP共同协作,保证DNA被完整修复,但是在BRCA发生突变的肿瘤细胞上只剩下一条途径修复单链断裂,细胞的存活就更加依赖于PARP1的修复功能。故而,抑制PARP1的功能就可以选择性地杀伤BRCA突变的肿瘤细胞,而对正常细胞影响甚微。
诚然PARP抑制剂是基于BRCA遗传协同致死关系开发出来的,但是PARP的“协同致死伴侣”绝不仅仅只有BRCA。2017年美国癌症研究协会(AACR)年会上,指出PARP抑制剂处理携带IDH基因突变的癌细胞,则可进一步破坏DNA修复机制,从而有效杀伤癌细胞。奥拉帕尼对复发性胶质母细胞瘤患者疗效的临床试验中,初步证据表明,奥拉帕尼可以进入某些胶质母细胞瘤[28]。该项研究在确定PARP与IDH遗传协同致死关系的同时,也从DNA修复角度诠释了IDH突变对胶质母细胞瘤所赋予的新的基因功能。
1.3 利用遗传协同致死关系开展化疗药物协同增效药物筛选
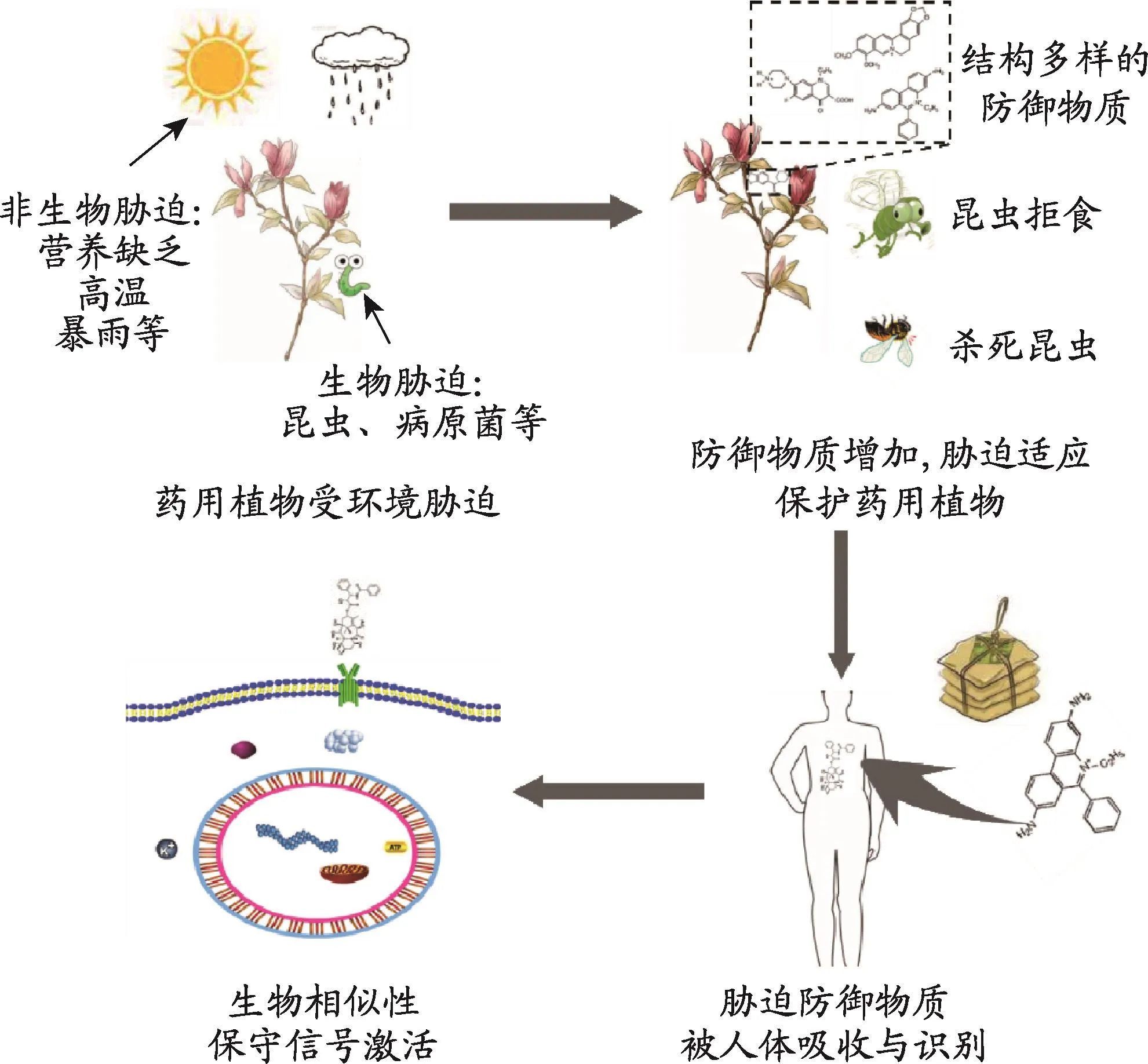
图2 受环境胁迫产生的多成分防御物质是中药发挥遗传协同致死效应的基础
除了对具有某一基因突变的肿瘤进行高特异性靶向药物的开发以外,遗传协同致死模式也用于细胞毒类药物耐药协同增效基因及药物的发现。早在2007年,Whitehurst等就已经利用RNA干扰文库对紫杉醇协同增效基因进行了全基因组筛选,发现多个基因的敲除能够使肺癌细胞系对紫杉醇的敏感性显著增加,其中一些基因的敲除可以使得紫杉醇的敏感性提高超过1 000倍[29]。另有研究发现,与PARP抑制剂联用能够使成胶质细胞瘤细胞对化疗药物替莫唑胺的敏感性增加。而蛋白激酶B、BCL/XL、岩藻糖激酶FUK和酰基辅酶A硫酯酶ACOT11等多个基因的敲除能够使成胶质细胞瘤细胞对长春碱的敏感性增加[30,31]。基于遗传协同致死模式对细胞毒类药物增敏基因的筛选为临床实施靶向药物与细胞毒类药物联合应用提供了依据[32]。如,硼替佐米(蛋白酶体抑制剂)与紫杉醇联合使用已应用于临床中,并取得喜人的成效[33]。
2 中药的多成分是环境胁迫的进化产物,为契合遗传协同靶点提供物质准备
“若无进化之光,生物学将毫无意义”,新达尔文主义(综合学说)的创建人杜布蓝斯基的这一观点有助于诠释中药的药效物质基础的来源。中药(尤以植物源性中药)结构种类多样的成分(群、族)是为了适应环境胁迫而不断进化的结果。中药为了应对微生物、昆虫等生物胁迫,分泌特殊物质(即功能性小分子物质)构成化学防御,这种外源性化学兴奋效应可以使得微生物或昆虫的胁迫耐受性增加;同时,为了抵御干旱、缺氧、强紫外线、重金属等非生物胁迫,中药体内产生大量的结构多样的次生代谢产物[34,35]。
即使是在面对某一种环境胁迫时,植物形成的相互影响自我更新的适应性进化产物也并非是单一成分,而是调控此胁迫多环节过程的结构多样性成分。迄今为止,已发现有几百种植物次生代谢产物具有抗真菌、细菌、病毒等作用。例如,Deavours等研究指出,苜蓿叶为了抵御茎点霉(一种真菌病原体),苜蓿叶片中的芒柄花素苷和苜蓿素的含量会同时增加[36,37];另外,当植物受到昆虫啃食这一生物胁迫是,组织被破坏,释放出自身的或感受到植食性昆虫口腔分泌物中的诱导因子时,能迅速作出反应,合成毒性次生代谢产物,构成直接化学防御或合成挥发性次生代谢产物吸引植食性昆虫的天敌形成间接化学防御,以避免遭受过度啃食。如树胡椒[38]在应对昆虫胁迫时,一方面产生会异松油烯导致昆虫拒食,另一方面产生黄樟素直接杀死昆虫。
虽然人对植物胁迫性进化的贡献较小,但鉴于物种适应性进化的保守性和趋同性,使得包括人类在内的动物与植物具有很高的生物相似性。除了合成和降解蛋白质、核酸、糖与脂质基本细胞生理过程一致外,一系列相互关联的信号通路在植物与动物体内中亦都有及其相似保留[35]。例如,细胞色素CYP450酶系[39]广泛进化保守性地存在于所有生物体,参与了化合物的生物合成、解毒、代谢等诸多过程之中;人体的AMPK蛋白[40]与植物中的SnRK1[41]为同源物,这一同源的蛋白质激酶都能够通过感受细胞能量状态来维持真核细胞的ATP生成和消耗的平衡,来实现能量代谢的稳态;此外,人体内Nrf-2作为一个核转录因子参与基因的ARE调控元件的核心TGACG序列相结合,转录调控机体一系列抗氧化应激损伤,抗炎等保护基因的表达[42]。而在植物体内具有与ARE启动子调控元件序列及功能极其类似的As-1顺式作用元件,并具有与Nrf2结合域序列中等程度的相似的TGA转录子与之相结合[43]。
药用植物在应对环境胁迫所产生的防御物质,除了改善自身适应非生物性胁迫和对抗生物胁迫外,可以与人体产生优秀的生物相容性,用于人类疾病的治疗(如图2)。这些防御物质(包括次生代谢产物)多为中药活性成分,而应对环境胁迫的中药活性成分可能就是靶向人体遗传协同致死靶点,实现药效协同倍增的药物组合来源。
3 基于遗传协同致死模式发现并阐明中药微量弱效活性成分起效机制
3.1 从同一环境胁迫的防御物质中发现协同效应倍增的中药活性成分组合
植物在面对一种环境胁迫时,产生多种防御成分来对抗,那么同时产生的防御成分往往可对一种胁迫产生协同作用。2000年Frank R.Stermitz等[44]就指出了一组出色的天然组合——小檗碱和5’-MHC的协同抗菌作用使小檗属植物几乎不会受到病源菌等微生物的生物胁迫。5’-MHC是专一的微生物多药耐药泵(MDR)抑制剂,可强效抑制微生物将小檗碱排出。但是5’-MHC是没有直接杀菌作用的,5’-MHC与小檗碱联合使用时,可以将小檗碱的最低抑菌浓度提高500倍以上。
又如,银杏在应对光照胁迫时,银杏叶片中的黄酮和内酯含量会发生一致性改变,在42%的自然光照强度条件下,黄酮含量和内酯含量最高[45]。而银杏黄酮和银杏内酯[46]在心血管疾病上的应用都表现出优秀的药效,且共同参与调节抗血小板聚集、抗缺血再灌注损伤、保护血管内皮细胞、抗炎、抗动脉粥样硬化及抗心律失常等心血管疾病的多个方面。更有甚者,银杏酮酯以作为中药银杏制剂应用于临床。欧洲将银杏酮酯EGb761(Ginkgo biloba extract30,GBE30)即银杏黄酮不得低于24%,银杏内酯不得低于6%作为银杏制剂的国际标准制品。我国自主研发、具有独立知识产权的类似EGb761的新型银杏制剂—银杏酮酯GBE50[47],其银杏总黄酮含量达44%以上,银杏内酯达6%以上,临床用于治疗冠心病、心绞痛和脑动脉硬化、眩晕等心脑血管疾病,具有较好的临床疗效。
据此可见,对抗同一种环境胁迫的防御成分中发现产生遗传协同致死效应的中药活性成分是成分发现效应倍增协同药物组合的有效途径。如,莪术块根中的莪术油成分为了抵御光照不足而蓄积[48],丹参中的芳香酸类成分为了应对UV-B辐射和干旱的胁迫而增加[49],其中莪术油中的莪术醇、莪术二酮,榄香烯等和丹参芳香酸类成分中的迷迭香酸,阿魏酸,丹参素等成分研究均证实可以调控不同信号来发挥抗肿瘤药效;那么从这些成分入手,筛选协同组合使得抗肿瘤效应倍增不失为一个有希望的突破口。
3.2 基于遗传协同致死原理以逆向思维发现中药效应倍增活性成分组合
从逆向药理学思维出发,根据不同疾病的生物网络调控过程中靶蛋白之间存在协同作用,探究中药微量成分效应倍增的机制,并发现主要显效物质组合。提出“遗传协同靶点验证→中药显效成分筛选→成分组合药效评价”的研究思路。
随着各种组学数据的迅速扩增以及合适药靶的不断发现,在不同疾病中基于遗传协同靶点的组合药物研发逐渐受到重视,其中不乏用于中药防治疾病的研究。例如,基于遗传协同靶点网络的构建,进行了中药防治阿尔兹海默(AD)的研究,筛选出了包括32个基因的拟用于防治AD药物筛选的候选基因群,并发现针对于这些基因的药物组合[50]。又如,Wnt信号激活的肿瘤细胞对表皮生长因子受体ErbB 3和血管内皮生长因子受体VEGFR1等信号分子的依赖性增加[51],Wnt+ErbB 3、Wnt+VEGFR1即可作为抗肿瘤中药发现的组合靶点,作用于Wnt信号的水溶性成分丹参素[52]与作用于ErbB 2的丹参酮IIA[53]及作用于VEGFR1的隐丹参酮[54]都是丹参抗肿瘤效应倍增活性成分潜在组合。
将经典的遗传协同致死模式用以探讨中药有效成分量低,与靶点的亲和力弱,但是可以显效的作用特点。不仅从新的角度诠释了中药的作用机制,也为未来天然活性成分发现提供了一种全新的研究思维模式。
1 Liu JH,Zhao N,Zhang GJ,et al.Bioactive quassinoids from the seeds of Bruceajavanica.JNat Prod,2012,75(4):683-688.
2 詹琼,周鑫莉,黄若凡,等.β-榄香烯血药浓度测定方法的建立及其药动学研究.中国药房,2017,28(2):173-177.
3 康东健,谭勇,阚萌萌,等.不同海拔梯度新疆红花品质分析研究.中药材,2017,40(1):127-130.
4 王广基.中药药代动力学研究的新探索.中国药学大会暨中国药师周,2012.
5 郝海平,郑超湳,王广基.多组分、多靶点中药整体药代动力学研究的思考与探索.药学学报,2009,44(3):270-275.
6 Yap T A,Sandhu SK,Carden CP,et al.Poly(ADP-ribose)polymerase(PARP)inhibitors:Exploiting a synthetic lethal strategy in the clinic.Ca Cancer JClin,2011,61(1):31-49.
7 McLornan D P,List A,Mufti G J.Applying synthetic lethality for the selectivetargetingof cancer.NEngl JMed,2014,371(18):1725-1735.
8 Hartwell L H,Szankasi P,Roberts CJ,et al.Integrating genetic approaches into the discovery of anticancer drugs.Science,1997,278(5340):1064-1068.
9 Kaelin WG.The concept of synthetic lethality in the context of anticancer therapy.Nat Rev Cancer,2005,5(9):689-698.
10 Iglehart JD,Silver DP.Synthetic lethality--a new direction in cancerdrugdevelopment.NEngl JMed,2009,361(2):189-191.
11 Kachroo A H,Laurent JM,Yellman C M,et al.Evolution.Systematic humanization of yeast genes reveals conserved functions and genetic modularity.Science,2015,348(6237):921-925.
12 Reid R J,Du X,Sunjevaric I,et al.A Synthetic Dosage Lethal Genetic Interaction Between CKS1B and PLK1 Is Conserved in Yeast and Human Cancer Cells.Genetics,2016,204(2):807-819.
13 Piskur J,GojkovićZ,Bahn E.A synthetic combination of mutations,including fs(1)pyrSu(b),rSu(b)and b,causes female sterility and reduces embryonic viability in Drosophila melanogaster.Mol Gen Genet,1999,261(3):553-557.
14 Winzeler E A,Shoemaker D D,Astromoff A,et al.Functional characterization of the S.cerevisiae genome by gene deletion and parallel analysis.Science,1999,285(5429):901-906.
15 Fromont-Racine M,Rain JC,Legrain P.Toward a functional analysis of the yeast genome through exhaustive two-hybrid screens.Nat Genet,1997,16(3):277-282.
16 Pan X,Ye P,Yuan D S,et al.A DNA integrity network in the yeast Saccharomycescerevisiae.Cell,2006,124(5):1069-1081.
17 Kwok M,Davies N,Agathanggelou A,et al.Synthetic lethality in chronic lymphocytic leukaemia with DNA damage response defects by targeting the ATRpathway.Lancet,2015,385 Suppl 1:S58.
18 Chan D A,Giaccia A J.Harnessing synthetic lethal interactions in anticancer drugdiscovery.Nat Rev Drug Discov,2011,10(5):351-364.
19 Han K,Jeng E E,Hess G T,et al.Synergistic drug combinations for cancer identified in a CRISPR screen for pairwise genetic interactions.Nat Biotechnol,2017,35(5):463-474.
20 Jerby-Arnon L,Pfetzer N,Waldman Y Y,et al.Predicting cancerspecific vulnerability via data-driven detection of synthetic lethality.Cell,2014,158(5):1199-1209.
21 Wang T,Yu H,Hughes N W,et al.Gene Essentiality Profiling Reveals Gene Networks and Synthetic Lethal Interactions with Oncogenic Ras.Cell,2017,168(5):890-903.e15.
22 Cox A D,Fesik SW,Kimmelman A C,et al.Drugging the undruggable RAS:Mission possible.Nat Rev Drug Discov,2014,13(11):828-851.
23 Li S.Inhibition of poly(ADP-ribose)polymerase in BRCA mutation carriers.NEngl JMed,2009,361(17):1707;author reply 1707-1708.
24 Fong P C,Boss D S,Yap T A,et al.Inhibition of poly(ADP-ribose)polymerase in tumors from BRCA mutation carriers.N Engl J Med,2009,361(2):123-134.
25 Chan S L,Mok T.PARP inhibition in BRCA-mutated breast and ovarian cancers.Lancet,2010,376(9737):211-213.
26 Scott L J.Niraparib:First Global Approval.Drugs,2017,77(9):1029-1034.
27 Schram A M,Aghajanian C A,Hyman D M.Niraparib in Recurrent Ovarian Cancer.NEngl JMed,2017,376(8):801.
28 Sulkowski P L,Corso C D,Robinson N D,et al.2-Hydroxyglutarate produced by neomorphic IDH mutations suppresses homologous recombination and induces PARP inhibitor sensitivity.Sci Transl Med,2017,9(375).
29 Whitehurst A W,Bodemann B O,Cardenas J,et al.Synthetic lethal screen identification of chemosensitizer loci in cancer cells.Nature,2007,446(7137):815-819.
30 Curtin N J,Szabo C.Therapeutic applications of PARP inhibitors:anticancer therapy and beyond.Mol Aspects Med,2013,34(6):1217-1256.
31 Svilar D,Dyavaiah M,Brown A R,et al.Alkylation sensitivity screens reveal a conserved cross-species functionome.Mol Cancer Res,2012,10(12):1580-1596.
32 Kitchens C A,McDonald P R,Shun T Y,et al.Identification of chemosensitivity nodes for vinblastine through small interfering RNA high-throughput screens.JPharmacol Exp Ther,2011,339(3):851-858.
33 Tan T T,Degenhardt K,Nelson D A,et al.Key roles of BIM-driven apoptosis in epithelial tumors and rational chemotherapy.Cancer Cell,2005,7(3):227-238.
34 Menendez JA,Joven J,Aragonès G,et al.Xenohormetic and anti-aging activity of secoiridoid polyphenols present in extra virgin olive oil:a new family of gerosuppressant agents.Cell Cycle,2013,12(4):555-578.
35 Howitz K T,Sinclair D A.Xenohormesis:sensing the chemical cues of other species.Cell,2008,133(3):387-391.
36 Deavours B E,Dixon R A.Metabolic engineering of isoflavonoid biosynthesisin alfalfa.Plant Physiol,2005,138(4):2245-2259.
37 Li P,Dong Q,Ge S,et al.Metabolic engineering of proanthocyanidin production by repressing the isoflavone pathways and redirecting anthocyanidin precursor flux in legume.Plant Biotechnol J,2016,14(7):1604-1618.
38 Andrés M F,Rossa G E,Cassel E,et al.Biocidal effects of Piper hispidinervum(Piperaceae)essential oil and synergism among its main components.Food Chem Toxicol,2017.
39 Scott JG,Liu N,Wen Z.Insect cytochromes P450:diversity,insecticide resistance and tolerance to plant toxins.Comp Biochem Physiol C Pharmacol Toxicol Endocrinol,1998,121(1-3):147-155.
40 Hardie D G,Ross F A,Hawley S A.AMPK:a nutrient and energy sensor that maintains energy homeostasis.Nat Rev Mol Cell Biol,2012,13(4):251-262.
41 Hulsmans S,Rodriguez M,De Coninck B,et al.The SnRK1 Energy Sensor in Plant Biotic Interactions.Trends Plant Sci,2016,21(8):648-661.
42 Crunkhorn S.Deal watch:Abbott boosts investment in NRF2 activators for reducingoxidativestress.Nat Rev Drug Discov,2012,11(2):96.
43 Wu L,Zhang Z,Zhang H,et al.Transcriptional modulation of ethylene response factor protein JERF3 in the oxidative stress response enhances tolerance of tobacco seedlings to salt,drought,and freezing.Plant Physiol,2008,148(4):1953-1963.
44 Stermitz F R,Lorenz P,Tawara JN,et al.Synergy in a medicinal plant:antimicrobial action of berberine potentiated by 5'-methoxyhydnocarpin,a multidrug pump inhibitor.Proc Natl Acad Sci U S A,2000,97(4):1433-1437.
45王华田,姜岳忠.光照强度对银杏叶片发育及黄酮和内酯含量的影响.江西农业大学学报(自然科学),2002,24(5):617-622.
46 Nakanishi K.Terpene trilactones from Gingko biloba:from ancient timestothe 21st century.Bioorg Med Chem,2005,13(17):4987-5000.
47谢德隆,黄新生.中国银杏药品质量标准体系的建立及规范的实践.世界科学技术-中医药现代化,2002,4(1):61-62+74.
48蒋妮,覃柳燕,李力,等.环境胁迫对药用植物次生代谢产物的影响.湖北农业科学,2012,51(08):1528-1532.
49刘景玲,齐志鸿,郝文芳,等.UV-B辐射和干旱对丹参生长和叶片中酚酸类成分的影响.生态学报,2015,35(14):4642-4650.
50 Roses A D.Pharmacogenetics in drug discovery and development:a translational perspective.Nat Rev Drug Discov,2008,7(10):807-817.
51 Naik S,Dothager R S,Marasa J,et al.Vascular Endothelial Growth Factor Receptor-1 Is Synthetic Lethal to Aberrant{beta}-Catenin Activation in Colon Cancer.Clin Cancer Res,2009,15(24):7529-7537.
52 Yang Y,Su Y,Wang D,et al.
53 Su CC,Lin Y H.Tanshinone IIA down-regulates the protein expression of ErbB-2 and up-regulates TNF-alpha in colon cancer cells in vitro and in vivo.Int JMol Med,2008,22(6):847-851.
54 Jian W,Yu S,Tang M,et al.A combination of the main constituents of Fufang Xueshuantong Capsules shows protective effects against streptozotocin-induced retinal lesions in rats.J Ethnopharmacol,2016,182(9):50-56.
The Mechanism Study of Micro-substance of Chinese Medicine——The Discovery and Elucidation of Effective Substance and Mechanism of Chinese Medicine via the Theory of Synthetic Lethality
Wei Zhonghong1,2,Yu Suyun1,2,Chen Wenxing1,2,Wang Aiyun1,2,Lu Yin1,2,3*
(1.School of pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Jiangsu Key Laboratory for Pharmacology and Safety Evaluation of Chinese Materia Medicine,Nanjing 210023,China;3.Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine(TCM)Prevention and Treatment of Tumor,Nanjing 210023,China)
The elaboration of the mechanism and pharmacodynamic substance are the main obstacles to the modernization of Chinese medicine.The rich ingredient of Chinese medicine is almost attention,with a research strategy of forward pharmacology.This strategy often neglects the study of trace components of Chinese medicine.Synthetic lethality,a extremely complex gene interactions,is to magnify the effects of the co-regulation of biological effects(>1 000 times).The theory of synthetic lethality has achieved good results in the development of anti-tumor drugs,including the discovery of PARP inhibitors,the clinical use of chemotherapy drug addition and attenuation combination.In view of this,this research model may be used to elucidate trace effective substance.Based on the reverse thinking of"targetcomponent-effect"and clear synergistic targets,the mechanism of traces and weak-potency substance of traditional Chinese medicinewasstudied,and the synergistic combination of potential wasfound.
micro-substance of Chinese medicine,synthetic lethality,environment stresses,reverse pharmacology,effective substance
10.11842/wst.2017.09.003
R286
A
2017-08-09
修回日期:2017-09-11
* 国家自然科学基金委面上项目(81673725):利用“遗传协同致死”模式研究丹参微量弱效多成分的效应倍增机制,负责人:陆茵;江苏省研究生创新基金项目(KYCX17_1315):基于肿瘤血管芽生的遗传协同靶点研究丹参异类协同机制,负责人:韦忠红;江苏高校优秀科技创新团队:活血化瘀中药对肿瘤转移的调控及机制研究,负责人:陆茵
** 通讯作者:陆茵,教授,博士生导师,主要研究方向:活血化瘀中药对肿瘤转移的影响。
(责任编辑:张 静,责任译审:王 晶)

