拟南芥细胞分裂素受体AHK3亚细胞定位信号的研究
吴 委,王作伟,粟永英,甘 爽,杜世平,蔡 易,郭晋雅
(1 四川农业大学 生命科学学院,四川 雅安 625014; 2 四川农业大学 理学院,四川 雅安 625014)
拟南芥细胞分裂素受体AHK3亚细胞定位信号的研究
吴 委1,王作伟1,粟永英1,甘 爽1,杜世平2,蔡 易1,郭晋雅1
(1 四川农业大学 生命科学学院,四川 雅安 625014; 2 四川农业大学 理学院,四川 雅安 625014)
【目的】研究细胞分裂素受体在细胞内定位分布的具体信号及其机制。【方法】构建拟南芥细胞分裂素受体蛋白——组氨酸蛋白激酶3(Arabidopsis histidine kinase 3, AHK3)的一系列亚细胞定位相关表达载体,转化到拟南芥原生质体细胞中进行瞬时表达后,采用激光共聚焦显微镜观察研究AHK3的亚细胞定位信号。【结果】AHK3定位于内质网(Endoplasmic reticulum, ER);AHK3的N端和C端均含有ER定位序列。【结论】AHK3在ER中实现对细胞分裂素的感知及受体蛋白之间的相互应答,并进行下游的信号转导;AHK3含有多段ER驻留信号。
拟南芥;细胞分裂素;AHK3;亚细胞定位;内质网
植物激素是由植物自身代谢所产生的一类有机分子,是一类在极低浓度下就能产生明显生理效应的微量物质。它们可以从产生部位移动到作用部位,参与植物发育和抗逆的生理过程,在组织与器官分化、开花与结实、成熟与衰老、休眠与萌发等发育过程中发挥重要的调控作用;同时,在逆境环境下参与调控植物的生理状态以获得更好的适应性[1]。细胞分裂素(Cytokinin,CTK)作为重要的植物激素之一,于20世纪50年代被发现,其在促进植物分生组织分化、调控顶端优势、微管组织分化、叶绿体分化、叶片衰老、生物和非生物胁迫反应等许多生理过程中行使功能[2]。CTK功能的实现,有赖于相关信号受体的作用。因此,CTK信号受体的种类、结构、功能及其信号传递的分子机制是目前CTK信号转导研究的重点之一[2-3]。
拟南芥 Arabidopsis thaliana作为一种模式植物,是研究CTK信号转导分子机制的理想材料。拟南芥属于十字花科拟南芥属植物,具有个体小、生长周期短、自花授粉、基因组小等优点,被广泛应用于植物遗传学、发育生物学、细胞生物学和分子生物学的研究[4]。对拟南芥中CTK信号通路的研究发现,植物体内细胞分裂素的信号传导机制是一种类似于细菌和真菌中双元组分系统的磷酸接力反应[5]。通过细胞分裂素受体蛋白——拟南芥组氨酸蛋白激酶 2(Arabidopsis histidine kinase 2,AHK2)、拟南芥组氨酸蛋白激酶3(Arabidopsis histidine kinase 3,AHK3)和拟南芥组氨酸蛋白激酶4(Arabidopsis histidine kinase 4,AHK4)的细胞分裂素接受域(Cyclases/histidine kinases associated sensory extracellular, CHASE)结合细胞分裂素后发生自体磷酸化,并将磷酸基团由激酶区保守的组氨酸残基转移至信号接收区保守的天冬氨酸残基上;随后,天冬氨酸上的磷酸基团被传递到胞质中的磷酸转运蛋白( Arabidopsis histidine phosphotransfer proteins,AHPs) 上;磷酸化的AHPs进入细胞核并将磷酸基团转移到一系列反应调节因子( Arabidopsis response regulators,ARRs)上,从而调节下游的细胞分裂素反应,产生一系列生理生化效应,最终实现对植物生长发育的调控[6-8]。
近几年,细胞分裂素受体蛋白激酶的结构功能、生化特性、亚细胞定位和信号转导模式的研究报道较多。早期的研究工作表明细胞分裂素受体定位在细胞质膜,Kim等[9]使用绿色荧光蛋白(Green fluorescent protein, GFP)标记AHK3转化原生质体后,发现AHK3 定位在细胞质膜上,但Dortay等[10]进一步研究发现细胞分裂素受体在植物细胞内有更多的分布位置,Caesar等[11]通过农杆菌介导的烟草叶片细胞的瞬时转化,发现拟南芥AHK3定位于内质网 (Endoplasmic reticulum, ER),并且与AHK4存在相互作用;之后,Wulfetange等[12]在玉米的研究中也发现细胞分裂素受体主要定位在内质网中,然而该定位不能解释外源添加的细胞分裂素如何调控植物的生理状态。此外,前人研究还发现与细胞分裂素受体同为组氨酸激酶家族的AHK1蛋白定位于细胞质膜[13]。那么,决定细胞分裂素受体蛋白分布于内质网中的具体定位信号是什么?细胞分裂素受体蛋白在内质网发挥功能的原因是什么?这些问题尚不清楚。
本文通过构建AHK3基因部分结构缺失的表达载体,并转化到拟南芥原生质体细胞中观察AHK3蛋白的亚细胞定位情况,从而探究AHK3定位信号的分布特征,可为进一步进行AHK3精确定位信号的分析以及AHK3参与细胞分裂素信号传导途径分子机制的研究奠定基础。
1 材料与方法
1.1 材料与试剂
以拟南芥Col-0野生型为试验材料,种子购自ABRC(Arabidopsis biological resource center)。材料培养条件如下:温度22 ℃,湿度60%,光照度6 000 lx,培养基质为Jiffy泥炭土、珍珠岩和蛭石(体积比为 1∶1∶1)。
相关分子生物学试剂均购于NEB公司,Trizol购于Invitrogen公司,重组酶和重组构建试剂盒购于南京诺唯赞生物科技有限公司,质粒小提试剂盒和胶回收试剂盒购于天根生物科技有限公司,反转录试剂盒购自TaKaRa公司,试验中所用其他试剂均为分析纯。
水稻分泌载体膜蛋白1(Secretory carrier membrane protein1,SCAMP1)是一个具有多个跨膜域、定位于质膜的蛋白[14-17];在烟草细胞中,SCAMP1通过内质网–高尔基体(Golgi)–反面高尔基体(TGN)–质膜(PM)运输途径到达质膜[18]。而钙联接蛋白(Calnexin,CNX)是一个高度保守的、定位于内质网的蛋白[19]。ARA7则是一个定位到内囊体的蛋白[20]。因此,本研究利用上述不同细胞器标记蛋白,构建其与红色荧光蛋白(Red fluorescent protein,RFP)融合的瞬时表达载体,用于亚细胞定位分析。质膜标记蛋白载体SCAMP1-RFP、内质网标记蛋白载体CNX-RFP、内囊体标记蛋白载体ARA7-RFP,均在前期构建保存[21]。
1.2 基因克隆
选取1周龄拟南芥幼苗,通过Trizol处理及苯酚–氯仿法提取组织总RNA,并采用反转录试剂盒PrimeScript®RT reagent kit with gDNA Eraser将其反转录成cDNA。以cDNA为模板PCR扩增获得AHK1、AHK3基因及相关结构域的序列,反应体系和反应程序参照NEB公司Q5聚合酶说明书,所用引物见表1。

表1 引物信息表Tab. 1 Primer information
1.3 载体构建
以HBT95::GFP载体为骨架,使用ClonExpress II One Step Cloning Kit重组构建试剂盒,进行AHK3亚细胞定位相关GFP融合瞬时超表达载体的构建。通过SMART软件(http://smart.embl-heidelberg.de/smart)和TMHMM Server 2.0软件(http://www.cbs.dtu.dk/services/TMHMM)预测AHK1和AHK3的蛋白质结构域(图1)。根据上述预测的结构域,设计AHK3亚细胞定位相关GFP融合瞬时表达载体的构建策略(图2)。通过Primer primier 5.0设计AHK1、AHK3和SCAMP1基因及相关结构域序列的引物,引物信息及序列如表1所示。
1.4 原生质体瞬时表达及亚细胞定位观察
采用氯化铯密度梯度离心的方法[22]提取上述质粒。从4周龄的拟南芥叶片中提取原生质体,通过PEG介导的方法[23],将制备好的质粒转化到原生质体细胞中瞬时表达,培养12 h后,参照文献[24]的方法使用激光共聚焦显微镜观察AHK3相关融合蛋白的亚细胞定位分布。
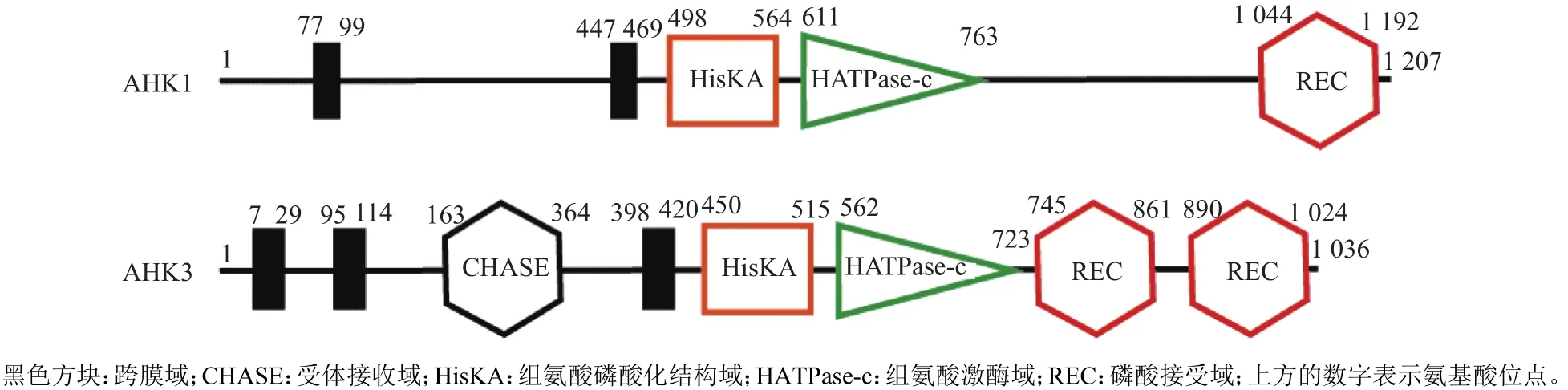
图1 AHK1与AHK3的结构Fig. 1 Structures of AHK1 and AHK3
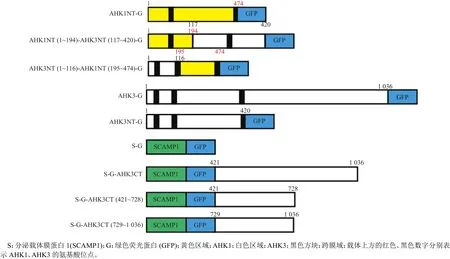
图2 载体构建模式图Fig. 2 Pattern of vector construction
1.5 数据处理
使用Photoshop CS4进行图片处理和Adobe Illustrator CS6进行绘图。
2 结果与分析
2.1 AHK3定位于内质网
为确定AHK3的亚细胞定位情况,本研究构建了AHK3-GFP融合蛋白表达载体HBT95::AHK3-GFP,并将不同细胞器标记蛋白(SCAMP1、CNX、ARA7)与红色荧光蛋白(RFP)融合的表达载体CNX-RFP、SCAMP1-RFP、ARA7-RFP分别与AHK3-GFP一起共转化到拟南芥原生质体细胞中瞬时表达,通过激光共聚焦显微镜观察绿色荧光信号(指示AHK3-GFP融合蛋白所在位置)和红色荧光信号(指示不同细胞器标记蛋白-RFP融合蛋白所在位置)在细胞内的分布情况,分析AHK3的亚细胞定位特征。研究发现,AHK3-GFP和ER标记蛋白CNX-RFP的信号能够完全重叠(图3A),而AHK3-GFP与质膜标记蛋白SCAMP1-RFP及液泡标记蛋白ARA7-RFP的信号不能完全重叠(图3B、3C);值得注意的是,当荧光信号较弱的时候,由于提高了激光强度和传感器的灵敏度,拍摄GFP或RFP的荧光信号时,会受到叶绿体自发荧光的干扰,因此我们单独采集了叶绿体的荧光信号作为参考。如图3B所示,SCAMP1-GFP正常是定位在细胞质膜,但是由于在叶肉原生质体中的表达较弱,采集SCAMP1-RFP信号时同时采集到了叶绿体的自发荧光。上述结果证明,AHK3定位于ER中。
2.2 AHK3NT和AHK3CT均含有ER定位序列
明确了AHK3定位于ER,但其定位相关机理仍然未知,因此, 对AHK3的定位序列进行了进一步研究:通过分别构建AHK3 N端(AHK3NT)与C端(AHK3CT)缺失的GFP融合瞬时表达载体,在原生质体中瞬时表达后,观察其亚细胞定位情况,探索AHK3中的ER定位信号。首先,我们构建了AHK3NT-GFP表达载体,通过与CNX-RFP共定位分析,发现GFP与RFP信号重叠(图4A),说明AHK3的N端含有ER定位信号。之后,构建了SCAMP1-GFP表达载体,通过与SCAMP1-RFP共定位分析,发现SCAMP1-GFP定位于质膜(图4B);而在SCAMP1-GFP之后融合AHK3CT进一步构建成SCAMP1-GFP-AHK3CT表达载体,并与CNX-RFP进行共定位分析后,发现GFP和位于ER的RFP信号完全重叠(图4C),不能与定位于质膜的RFP信号重叠(图4D), 说明AHK3CT中的定位信号改变了原来定位于质膜的SCAMP1-GFP信号,AHK3CT将GFP信号驻留在了ER中,上述结果表明AHK3的C端也含有较强的ER驻留信号。
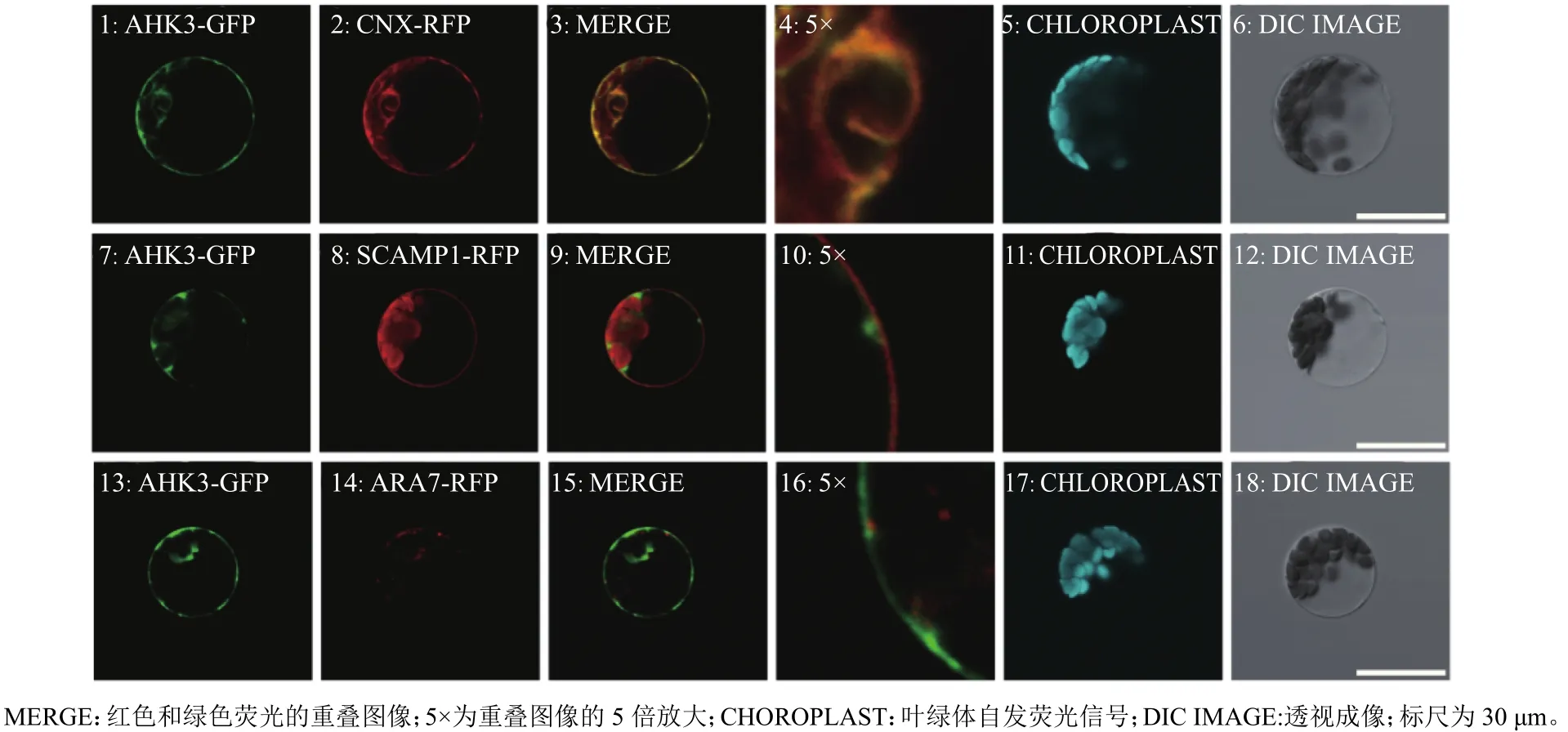
图3 AHK3的亚细胞定位Fig. 3 The subcellular localization of AHK3
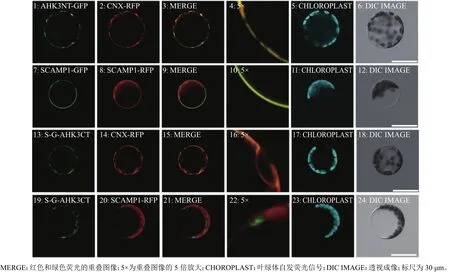
图4 AHK3的N端和C端的亚细胞定位Fig. 4 The subcellular localizations of N and C terminals of AHK3
2.3 AHK3NT的ER定位信号可能位于跨膜域中
为了进一步分析AHK3 N端的内质网定位信号的具体位置,本研究根据AHK3NT中前2个跨膜域所在的位置将AHK3NT拆分为2段,并且与已知定位于质膜的AHK1NT的前后2段结构域进行融合,构建 AHK1NT(1~194)-AHK3NT(117~420)-GFP 和 AHK3NT (1~116)-AHK1NT(195~474)-GFP嵌合表达载体,同时构建了AHK1NT-GFP表达载体。通过亚细胞定位分析,发现AHK1-GFP部分定位于质膜(图5A),而分别嵌合了AHK3NT前后2段跨膜域的融合蛋白都定位于内质网(图5B、5C)。上述结果说明:AHK3NT前后2段结构区域中均含有ER定位信号,使得原来分布于质膜的AHK1NT被定位在ER中;而AHK3NT中的ER定位信号可能位于跨膜域中。
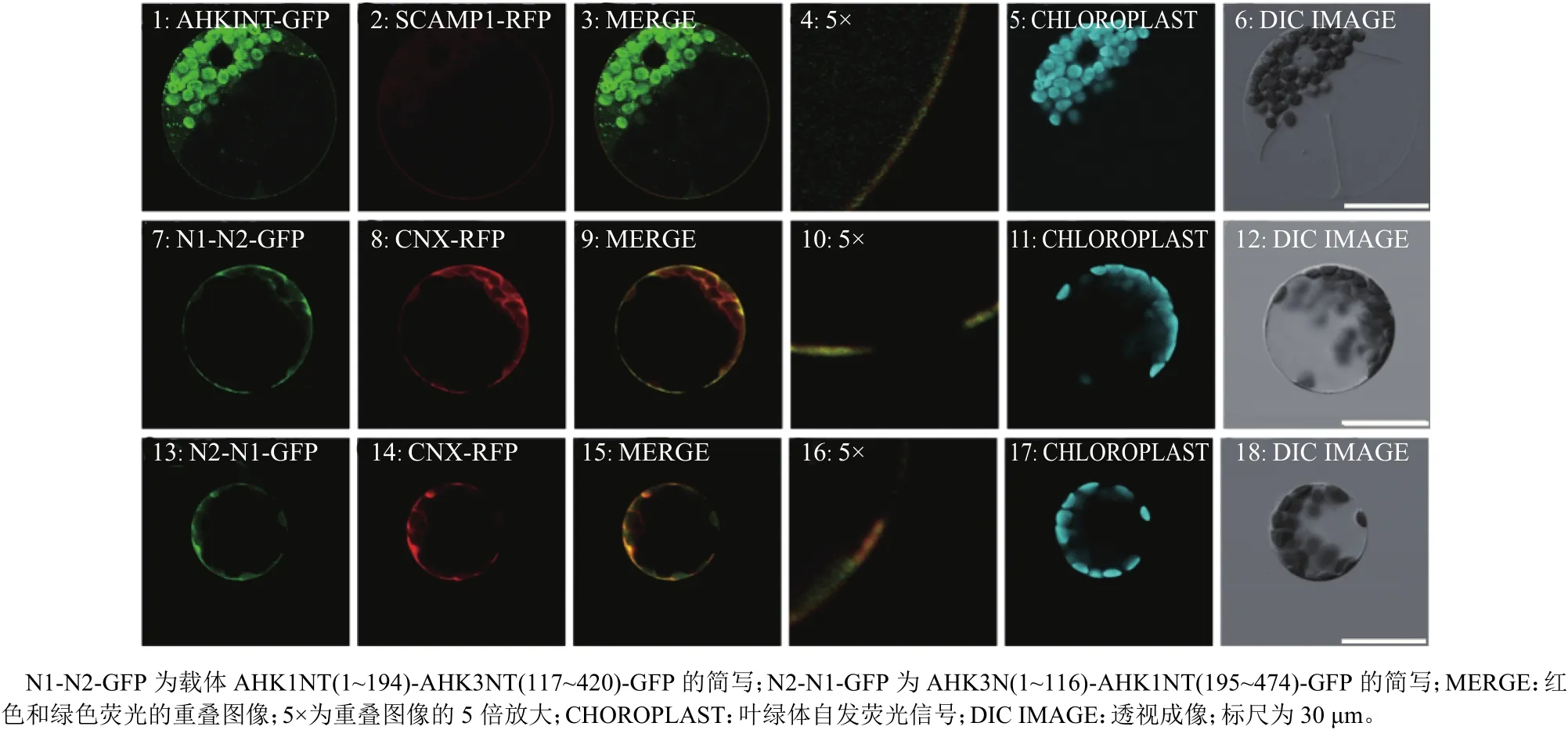
图5 AHK3 的N端亚细胞定位信号分析Fig. 5 The subcellular localization signals of N terminal of AHK3
2.4 AHK3CT有多段ER定位信号
为了进一步分析AHK3CT中的ER定位信号,我们根据AHK3CT的结构,将AHK3CT也分成2段,前段为AHK3CT第421~728位氨基酸,后段为AHK3CT第729~1 036位氨基酸,分别与已知定位于质膜的SCAMP1-GFP融合,构建了S-GAHK3CT(421~728)和 S-G-AHK3CT (729~1 036)嵌合表达载体,经过亚细胞定位分析,发现S-G-AHK3CT(421~728)和 S-G-AHK3CT(729~1 036)嵌合蛋白都定位于ER(图6A、6B)。上述结果说明:AHK3CT前后2段序列中均含有ER定位信号。
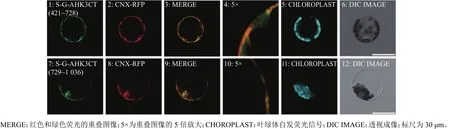
图6 AHK3 的C端亚细胞定位信号分析Fig. 6 The subcellular localization signals of C terminal of AHK3
3 讨论与结论
在Caesar等[11]发现AHK3定位于内质网的试验中,其通过农杆菌注射烟草叶片瞬时表达,将AHK3的GFP融合蛋白载体与细胞器标记蛋白载体共转化,观察AHK3的定位,证明了AHK3定位于内质网,但是未对AHK3的定位机理进行进一步的分析。经过本研究对AHK3亚细胞定位的研究,再次证明了AHK3定位于内质网,并且初步探索了AHK3的具体定位信号。
在细胞中,蛋白空间位置的分布主要通过其定位序列来实现,按照组成蛋白的氨基酸顺序来分,定位序列可能在N端,也可能在C端;按照空间分布位置来分,定位序列可能在膜外、膜内或跨膜域中。例如:BP-80是一种蛋白相对分子质量为80 000,定位于液泡的I型蛋白,它的跨膜域和C端对其液泡定位具有非常重要的作用[25-26];而内膜蛋白(EMP12)的C端中有ER输出信号和高尔基定位信号[27]。因此,本研究根据AHK3的结构域特征对AHK3全序列进行了拆分,并分别与已知定位于质膜的SCAMP1和AHK1NT进行融合共定位分析,发现AHK3蛋白序列使原本定位于质膜的SCAMP1和AHK1NT发生了改变,定位到了ER,说明AHK3中含有多段可将其定位到内质网中信号区域,并且,AHK3的N端和C端都含有直接定位于ER的信号序列;在对AHK3 N端定位序列进一步的探索中,发现其中的跨膜域可能是其ER定位信号。在前人的报道中,蛋白质C端ER定位序列的研究比较清楚,如内质网腔定位信号HDEL或者KDEL[28],内质网膜定位信号KKXX(K为赖氨酸,X为任意氨基酸)[29],作用原理如下:KKXX序列通过与COPI作用使蛋白从高尔基体回流到ER,从而使蛋白定位于ER中[30-32]。本文将AHK3CT分段与SCAMP1-GFP融合进行定位研究试验,结果发现AHK3CT的前后2段序列都有ER定位信号。因此,我们对AHK3的蛋白序列进行了分析,发现在AHK3的C端含有多个KKXX信号序列,其分布于AHK3CT的前后两端, 该定位序列可能决定了AHK3CT的ER定位,该推断还需以后进一步的研究来证明。
在AHK3的结构域中,感知细胞分裂素的CHASE结构域不能在细胞质中发挥作用,只能在ER基质中发挥功能[3],而C端则是在细胞质中发挥信号转导的作用。本研究证明AHK3中含有多段ER定位信号序列,其可以确保AHK3在ER中行使功能,有利于细胞分裂素受体信号接收和传递功能的顺利实现。因此,定位于ER的AHK3受体可能在细胞分裂素的感知、下游的信号转导及受体蛋白的互作应答中具有重要的功能。
通过本研究发现,AHK3定位于ER,并且AHK3中含有多个ER定位信号,ER定位序列可能位于AHK3 N端前后2段跨膜域和C端中;该研究结果为进一步对AHK3进行精细定位信号分析以及AHK3在细胞分裂素信号传导途径中的功能研究奠定了基础。
[1]李合生. 现代植物生理学[M]. 北京: 高等教育出版社,2012: 217.
[2]KIEBER J J, SCHALLER G E. The perception of cytokinin: A story 50 years in the making[J]. Plant Physiol,2010, 154(2): 487-492.
[3]SHI X, RASHOTTEA M. Advances in upstream players of cytokininphosphorelay: Receptors and histidine phosphotransfer proteins[J]. Plant Cell Rep, 2012, 31(5): 789-799.
[4]翟中和, 王喜忠, 丁孝明. 细胞生物学[M]. 北京: 高等教育出版社, 2011: 50.
[5]INOUE T, HIGUCHI M, HASHIMOTO Y, et al. Identification of CRE1 as a cytokinin receptor from Arabidopsis[J]. Nature, 2001, 409(6823): 1060-1063.
[6]SUZUKI T, MIWA K, ISHIKAWA K, et al. The Arabidopsis sensor His-kinase, AHK4, can respond to cytokinins[J]. Plant Cell Physiol, 2001, 42(2): 107-113.
[7]UEGUCHI C, KOIZUMI H, SUZUKI T, et al. Novel family of sensor histidine kinase genes in Arabidopsis thaliana[J]. Plant Cell Physiol, 2001, 42(2): 231-235.
[8]WERNER T, SCHMÜLLING T. Cytokinin action in plant development[J]. Curr Opin Plant Biol, 2009, 12(5):527-538.
[9]KIM H J, RYU H, HONG S H, et al. Cytokinin-mediated control of leaf longevity by AHK3 through phosphorylation of ARR2 in Arabidopsis[J]. P Natl Acad Sci USA, 2006, 103(3): 814-819.
[10]DORTAY H, GRUHN N, PFEIFER A, et al. Toward an interaction map of the two-component signaling pathway of Arabidopsis thaliana[J]. J Proteome Res, 2008, 7(9):3649-3660.
[11]CAESAR K, THAMM A M, WITTHÖFT J, et al. Evidence for the localization of the Arabidopsis cytokinin receptors AHK3 and AHK4 in the endoplasmic reticulum[J]. J Exp Bot, 2011, 62(15): 5571-5580.
[12]WULFETANGE K, LOMIN S N, ROMANOV G A, et al. The cytokinin receptors of Arabidopsis are located mainly to the endoplasmic reticulum[J]. Plant Physiol,2011, 156(4): 1808-1818.
[13]MÜLLER B, SHEEN J. Advances in cytokinin signaling[J]. Science, 2007, 318(5847): 68-69.
[14]LAM S K, CAI Y, HILLMER S, et al. SCAMPs highlight the developing cell plate during cytokinesis in tobacco BY-2 cells[J]. Plant Physiol, 2008, 147(4): 1637-1645.
[15]LAM S K, CAI Y, TSE Y C, et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells[J]. Plant J,2009, 60(5): 865-881.
[16]LAM S K, SIU C L, HILLMER S, et al. Rice SCAMP1 defines clathrin-coated, trans-Golgi-located tubular-vesicular structures as an early endosome in tobacco BY-2 cells[J]. Plant Cell, 2007, 19(1): 296-319.
[17]LAM S K, TSE Y C, ROBINSON D G, et al. Tracking down the elusive early endosome[J]. Trends Plant Sci,2007, 12(11): 497-505.
[18]LIU D Y T, SMITH P M C, BARTON D A, et al. Characterisation of Arabidopsis calnexin 1 and calnexin 2 in the endoplasmic reticulum and at plasmodesmata[J]. Protoplasma, 2017, 254(1): 125-136.
[19]GELDNER N, DÉNERVAUD-TENDON V, HYMAN D L, et al. Rapid, combinatorial analysis of membrane com-partments in intact plants with a multicolor marker set[J].Plant J, 2009, 59(1): 169-178.
[20]JIANG L, ROGERS J C. Integral membrane protein sorting to vacuoles in plant cells: Evidence for two pathways[J]. J Cell Biol, 1998, 143(5): 1183-1199.
[21]CAI Y, JIA T, LAM S K, et al. Multiple cytosolic and transmembrane determinants are required for the trafficking of SCAMP1 via an ER-Golgi-TGN-PM pathway[J].Plant J, 2011, 65(6): 882-896.
[22]DURANTE M, COVI A, BARSANTI L. Heterogeneity of HeLa cell DNA as evidenced by CsCl density gradient centrifugation[J]. Cmls-Cell Mol Life S, 1977, 33(9):1158-1159.
[23]YOO S D, CHO Y H, SHEEN J. Arabidopsis mesophyll protoplasts: A versatile cell system for transient gene expression analysis[J]. Nat Protoc, 2007, 2(7): 1565-1572.
[24]ELGASS K, CAESAR K, SCHLEIFENBAUM F, et al.Novel application of fluorescence lifetime and fluorescence microscopy enables quantitative access to subcellular dynamics in plant cells[J]. PLoS One, 2009, 4(5):2095-2118.
[25]TSE Y C, LO S W, HILLMER S, et al. Dynamic response of prevacuolar compartments to Brefeldin A in plant cells[J]. Plant Physiol, 2007, 142(4): 1442-1459.
[26]ROBINSON D G, JIANG L, SCHUMACHER K. The endosomal system of plants: Charting new and familiar territories[J]. Plant Physiol, 2008, 147(4): 1482-1492.
[27]GAO C, YU C K, QU S, et al. The Golgi-localized Arabidopsis endomembrane protein12 contains both endoplasmic reticulum export and Golgi retention signals at its C terminus[J]. Plant Cell, 2012, 24(5): 2086-2104.
[28]WANG H, SHAO Y, ZHANG W, et al. Molecular characterization of two novel molecular chaperones in bacterial-challenged Apostichopus japonicus[J]. Gene, 2015,570(1): 141-149.
[29]COSSON P, LETOURNEUR F. Coatomer interaction with di-lysine endoplasmic reticulum retention motifs[J].Science, 1994, 263(5153): 1629-1631.
[30]SCHRÖDER S, SCHIMMÖLLER F, SINGER-KRÜGER B, et al. The Golgi-localization of yeast Emp47p depends on its di-lysine motif but is not affected by the ret1-1 mutation in alpha-COP[J]. J Cell Biol, 1995, 131(4): 310-315.
[31]HARTER C, WIELAND F T. A single binding site for dilysine retrieval motifs and p23 within the gamma subunit of coatomer[J]. P Natl Acad Sci USA, 1998, 95(20):11649-11654.
[32]GOMEZ M, SCALES S J, KREIS T E, et al. Membrane recruitment of coatomer and binding to dilysine signals are separate events[J]. J Biol Chem, 2000, 275(37):29162-29169.
Analysis of subcellular localization signals of Arabidopsis cytokinin receptor protein AHK3
WU Wei1, WANG Zuowei1, SU Yongying1, GAN Shuang1, DU Shiping2, CAI Yi1, GUO Jinya1
(1 College of Life Science, Sichuan Agricultural University, Ya’an 625014, China;2 College of Science, Sichuan Agricultural University, Ya’an 625014, China)
【Objective】To study the subcellular localization signals of cytokinin receptors and related mechanisms.【Method】A series of expression vectors for subcellular localization of Arabidopsis histidine protein kinase 3 (AHK3), one of cytokinin receptor proteins in Arabidopsis, were constructed and transformed into Arabidopsis protoplast cells for transient expression. Laser confocal microscope was used to observe the subcellular localization of AHK3 protein.【Result】AHK3 is localized in endoplasmic reticulum(ER). Both N and C terminals contain ER localization sequences.【Conclusion】AHK3 carry out its functions in ER, such as perception of cytokinin, downstream signal transduction and interactions with other receptor proteins, and AHK3 contains multiple ER localization signals.
Arabidopsis thaliana; cytokinin; AHK3; subcellular localization; endoplasmic reticulum
Q943.2
A
1001-411X(2017)06-0064-08
吴委, 王作伟, 粟永英, 等. 拟南芥细胞分裂素受体AHK3亚细胞定位信号的研究[J]. 华南农业大学学报, 2017, 38(6): 64-71.
2017-02-10 优先出版时间:2017-11-06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.S.20171106.1412.022.html
吴 委 (1991—),男,硕士研究生,E-mail: 891712599@qq.com; 通信作者: 郭晋雅 (1983—),女,讲师,博士,E-mail:jyguo@foxmail.com
四川省教育厅重点项目(15ZA0001)
【责任编辑 庄 延】
——疾病防治的新靶标

