药用植物大戟组培快繁体系优化研究
, , , 坤华, 林轩,
(广西壮族自治区药用植物园a.广西药用资源保护与遗传改良重点实验室;b.药用植物保育实验室, 南宁 530023)
·应用技术·
药用植物大戟组培快繁体系优化研究
李翠,韦莹,缪剑华,韦坤华,李林轩,张占江
(广西壮族自治区药用植物园a.广西药用资源保护与遗传改良重点实验室;b.药用植物保育实验室, 南宁 530023)
[目的]采用组织培养快繁技术解决大戟种苗短缺和种质资源可持续开发利用问题,为人工种植提供技术支持。[方法]对消毒剂和消毒时间进行筛选,以大戟带侧芽茎段为外植体,以MS、B 5、N 6为基本培养基,采用正交试验比较植物生长调节剂 (6-BA、2,4-D、KT、NAA、IAA、IBA 、AC)对大戟愈伤组织诱导、不定芽分化、繁殖系数和诱导生根的影响。[结果]外植体经15 d诱导培养,形成愈伤组织,其诱导的最佳培养基为B 5+2,4-D 1.5 mg/L+6-BA 0.5 mg/L,愈伤组织诱导率达到80%;不定芽分化的最佳培养基为MS+ 6-BA 1.0 mg/L+ IAA 0.6 mg/L;最利于增殖的培养基为MS+KT 0.5+ 6-BA 1.5 mg/L+IAA 1.0 mg/L,增殖倍数6~10;最佳的生根培养基为MS+IBA 2.0 mg/L+IAA 1.0 mg/L,生根率93.1%。[结论]此途径繁殖速度快、再生率高,有望为栽培大戟提供大量种苗,为大戟深入开发利用研究提供依据。
药用植物; 大戟; 组培快繁; 生根率
大戟属(EuphorbiaLinn.)是大戟科(Euphorbiaceae)中最大的属,《中国植物志》及《Flora of China)记载其约2 000 种,几乎遍布全球,是特大属之一,中国约有77种,大戟科植物大戟(EuphorbiapekinensisRupr.),为多年生常绿草本,根圆柱状,长20~30 cm,花期5—8月,果期6—9月,广布于全国(除台湾、云南、西藏和新疆),北方尤为普遍;生于山坡、灌丛、路旁、荒地、草丛、林缘和疏林内,根入药,具有较高的药用价值(约100元/kg),具有逐水通便,消肿散结,主治水肿,并有通经之效,用于治疗慢性肾炎,晚期血吸虫病腹水或其他肝硬变腹水等症。大戟对生长环境要求苛刻,近年来,大戟资源遭到了严重破坏,随着市场需求量的不断增加,野生大戟资源濒临枯竭,价格从几元一公斤到现在的上百元一公斤,且常常有价无市,由于种子细小,生产上难以实现大面积栽培。采用生物技术组织培养技术,可以有效快速地提高大戟种苗的繁殖速度和质量,实现大戟优质种苗的工厂化育苗,以满足生产上的需要。本研究通过诱导愈伤组织获得丛生芽,得到的种苗健壮、成活率高,可在短期内提供大量大戟的优质种苗,有效解决了大戟的规模化育苗问题。>
表1 不同培养基对大戟愈伤组织诱导的影响
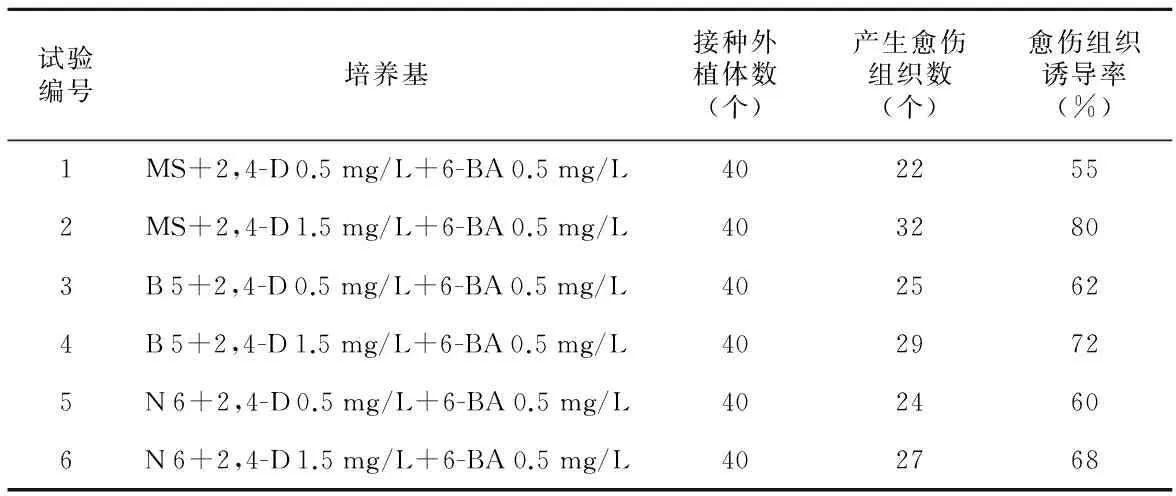
试验编号培养基接种外植体数(个)产生愈伤组织数(个)愈伤组织诱导率(%)1MS+2,4-D0.5mg/L+6-BA0.5mg/L4022552MS+2,4-D1.5mg/L+6-BA0.5mg/L4032803B5+2,4-D0.5mg/L+6-BA0.5mg/L4025624B5+2,4-D1.5mg/L+6-BA0.5mg/L4029725N6+2,4-D0.5mg/L+6-BA0.5mg/L4024606N6+2,4-D1.5mg/L+6-BA0.5mg/L402768
1 实验材料
2015年5月采集自广西药用植物园引种繁育圃,经吕惠珍副主任技师鉴定该品种为京大戟,经筛选后选择无病虫害的优良大戟植株为实验材料,选取其带侧芽茎段作为外植体。
2 外植体处理及培养条件
2.1 外植体处理
将带侧芽茎段表面洗净去污,于超净工作台内采用浓度为75%的酒精灭菌30~45 s,无菌水冲洗1~3次,放入0.1% HgCl2灭菌剂灭菌,并充分震荡,再用无菌水冲洗2~5次,用无菌滤纸将茎段表层的水分吸干,剪去与灭菌剂接触部分,然后按自然顺序接种到诱导培养基上。
2.2 培养条件
各个培养阶段附加不同浓度的植物生长调节剂,蔗糖 3%,琼脂0.6%,pH值5.8~6,培养室平均光照强度2 000 lx左右,光照时间12 h/d,温度(24±2)℃。
3 试 验
3.1 大戟愈伤组织的分化
基于MS、B 5、N 6培养基,添加不同浓度的2,4-D(0.5,1.0,1.5 mg/L)、6-BA(1.0,1.5,2.0 mg/L),进行大戟愈伤组织诱导实验,每组接种10瓶,每瓶接种3个外植体,培养20 d后统计外植体的愈伤组织诱导率等结果。
3.2丛生芽再生诱导
基于MS、B 5、N 6培养基,添加NAA、IAA、6-BA 3种不同类型激素,并开展正交设计NAA(0.5,1.0,1.5 mg/L)、KT (0.1,0.2,0.4 mg/L)、6-BA(1.0,1.5,2.0 mg/L)进行大戟不定芽诱导实验,每个处理10瓶,每瓶4块愈伤组织,培养20 d后统计丛生芽诱导率等结果。
3.3 丛生芽繁殖培养
在MS为基本培养基的基础上以6-BA、IAA为生长调节激素考察大戟丛生芽繁殖情况。6-BA(0.5,1.0,1.5 mg/L)、IAA (0.2,0.4,0.6 mg/L)2种激素设计6组试验对大戟丛生芽繁殖效果比较研究,每个处理10瓶,每瓶3个单芽,30 d统计丛生芽增殖结果。
芽增殖倍数=(20 d后芽数-接种时芽数)/接种时芽数。
3.4 生根培养
为了寻找大戟无菌苗生根壮苗的最适合培养基,设置以下不同处理(表3),以MS为基本培养基,IBA(1.0,2.0 mg/L)、AC(0.5,1.0,1.5 mg/L)2种添加物进行试验,对大戟的繁殖培养基进行优化,将生长健壮,高2~3 cm的无根苗接种于4种不同处理的生根培养基上,每组试验接种10瓶,每瓶6个单芽,培养30 d后统计生根数平均值和生根率等结果。
4 结果与分析
4.1 愈伤组织诱导情况
基于MS、B 5、N 6培养基,添加2,4-D(0.5,1.0,1.5 mg/L)、6-BA(1.0,1.5,2.0 mg/L),进行大戟不定芽诱导实验,每组接种10瓶,每瓶接种4个外植体,培养20 d后统计外植体的愈伤组织诱导率等结果(图1)。
愈伤组织诱导率(%)=产生愈伤组织的外植体数/接种外植体总数×100%;
生根率(%)=产生不定根的丛苗数/接种丛苗总数×100%;
生根数平均值=总生根数/接种总数。

图1 大戟愈伤组织
4.2 丛生芽再生诱导
将得到的试管苗丛生芽置于愈伤组织分化出芽培养基中,MS培养基,添加IAA、6-BA 2种不同类型激素,并添加IAA(0.2,0.4,0.6 mg/L)、6-BA(0.5,1.0,1.5 mg/L)进行对大戟不定芽诱导实验,每组试验接种10瓶,每瓶4块愈伤组织,培养20 d后统计丛生芽诱导率等结果(图2)。
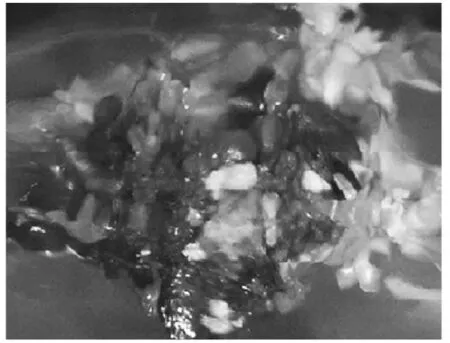
图2 愈伤组织诱导出芽
20~30 g/L蔗糖和3.8~4.8 g/L的琼脂,培养基pH=5.8,观察发现,培养基中添加1.0 mg/L的6-BA和0.6 mg/L的IAA壮苗效果最好,株高达5.37 cm。
4.3 丛生芽繁殖培养
将外植体接种到MS培养基中,在培养温度为23~26 ℃,光照强度1 400~2 000 lx,光照时间为10~12 h/d的条件下培养30 d,侧芽分化后获得丛生芽,其中MS培养基中含0.1~0.4 mg/L的KT、1.0~2.0 mg/L的6-BA、1.0~2.0 mg/L的NAA、20~30 g/L蔗糖和3.8~4.8 g/L的琼脂,培养基的pH值为5.8,观察发现,培养基中6-BA和NAA浓度增加,大戟丛生芽数均增加;在培养基中添加0.2 mg/L的KT、2.0 mg/L的6-BA和1.5 mg/L的NAA,丛生芽效果最好(图3)。
4.4 生根培养
将健壮植株置于MS生根培养基中,在培养温度23~26 ℃,光照强度1 400~2 000 lx,光照时间为10~12 h/d的条件下,培养40 d得到带根的完整植株,其中MS生根培养基中含0.5~1.5 mg/L的IAA、1.0~2.0 mg/L的IBA、25~30 g/L蔗糖和3.8~4.8 g/L的琼脂,培养基的pH值为5.8,观察发现,培养基中IAA浓度增加,组培苗的生根率也增加;培养基中添加2.0 mg/L的IBA和1.0 mg/L的IAA生根效果最好,生根率达93.1%,平均根长达到4.49 cm;

图3 大戟丛生芽繁殖

图4 大戟组培苗
表2 不同激素水平对大戟丛生芽壮苗效果的影响
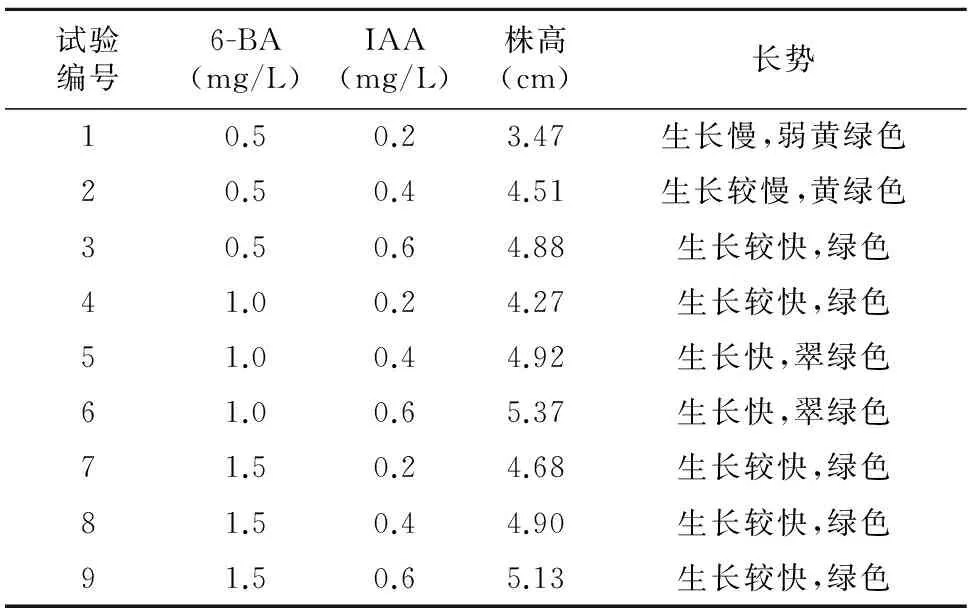
试验编号6-BA(mg/L)IAA(mg/L)株高(cm)长势10.50.23.47生长慢,弱黄绿色20.50.44.51生长较慢,黄绿色30.50.64.88生长较快,绿色41.00.24.27生长较快,绿色51.00.44.92生长快,翠绿色61.00.65.37生长快,翠绿色71.50.24.68生长较快,绿色81.50.44.90生长较快,绿色91.50.65.13生长较快,绿色
5 讨 论
大戟属植物(EuphorbiaL.)为大戟科植物中最大的属。大部分为一年或多年生草本植物,全球有2 000余种,广泛分布于世界各地,尤以非洲和南美洲最多,大戟属植物在中国有80余种。作为一种具有悠久用药历史的传统药物,大戟属植物在我国民间有着广泛的应用基础。在藏药系统中主要用于治疗水肿、结核、疥疮、无名肿毒等疾患。大戟属植物良好的药物活性,吸引了众多的药物化学家的关注。
表3 不同激素对大戟组织培养快速繁殖效果的影响
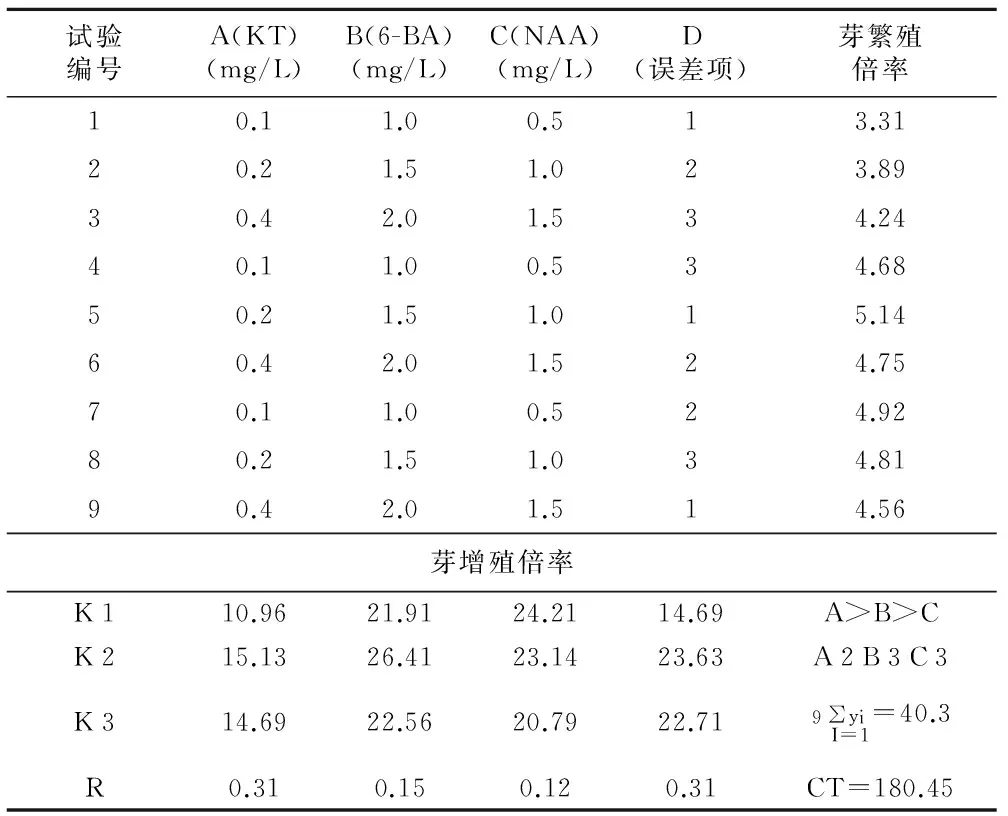
试验编号A(KT)(mg/L)B(6-BA)(mg/L)C(NAA)(mg/L)D(误差项)芽繁殖倍率10.11.00.513.3120.21.51.023.8930.42.01.534.2440.11.00.534.6850.21.51.015.1460.42.01.524.7570.11.00.524.9280.21.51.034.8190.42.01.514.56芽增殖倍率K110.9621.9124.2114.69A>B>CK215.1326.4123.1423.63A2B3C3K314.6922.5620.7922.719∑yi I=1=40.3R0.310.150.120.31CT=180.45
注:芽增殖倍数=(30 d后芽数-接种时芽数)/接种时芽数。
表4 不同激素水平对大戟组培苗生根效果的影响
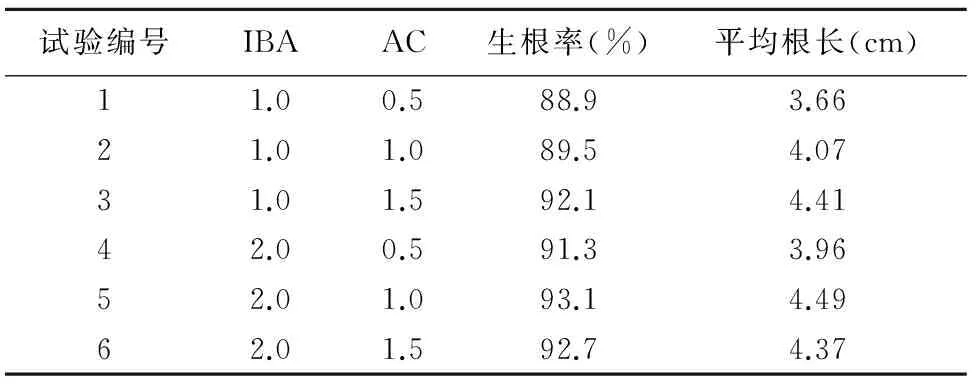
试验编号IBAAC生根率(%)平均根长(cm)11.00.588.93.6621.01.089.54.0731.01.592.14.4142.00.591.33.9652.01.093.14.4962.01.592.74.37

图5 大戟组培苗生根情况
植物生长调节剂是培养基中的关键物质,能以极微小的量影响到植物的细胞分化、分裂和发育,对组织培养起着重要的调节作用[9]。当细胞分裂素/生长素的比值合适时,能诱导芽的形成和促进芽的生长。6-BA是组织培养研究中最常用的细胞分裂素,能促进细胞分裂、侧芽和植株的生长等,萘乙酸NAA是一种广谱型植物生长调节剂,能促进细胞分裂与扩大,诱导形成不定根、增加坐果,防止落果等作用,吲哚乙酸IAA广谱多用途,但因它在植物体内外易降解而未成常用商品植物生长素,能诱导形成不定根[10-11]。多种激素组合能更有效的促进植物的相互作用的生长,属于协同效应。因此在MS基本培养基内同时加入6-BA、IAA对大戟生长的具有较大的效果。
本研究中,大戟外植体经15 d诱导培养,形成愈伤组织,其诱导的最佳培养基为B 5+2,4-D 1.5 mg/L+6-BA 0.5 mg/L,愈伤组织诱导率达到80%;试验中得出大戟丛生芽繁殖的最优培养基为MS+ KT 1.5+6-BA 1.5 mg/L+NAA 1.0 mg/L,大戟丛生芽的增殖率一般可达到6.5,且芽苗翠绿粗壮。试验中MS培养基中添加2.0 mg/L的IBA和1.0 mg/L的IAA生根效果最好,生根率达93.1%,平均根长达到4.49 cm,该研究方法生产的大戟种苗既可满足人们对大戟的用途需求,又可保护珍稀濒危种质资源,同时还为丰富我国园林植物种类提供保障。本研究结果为大戟的保护和可持续开发利用开辟了一条新的途径,为同属其他物种的组织培养研究提供借鉴和参考。
[1]中国科学院中国植物志编辑委员会.中国植物志(第四十四卷,第三分册)[M].北京:科学出版社,1997:89-90.
[2]WU Z Y,RAVEN P H,HONG D Y,et al.Flora of China(V01.¨)[M].Beijing:Science Press,and St.Louis:Missoufi Botanical Garden Press,2008:305.
[3]勇应辉,戴传超,杨启银,等.内生真菌和培养基对大戟组培苗生长和炼苗的影响[J].安徽农业科学,2008,36(2):505-507.
[4]戴传超,余伯阳,董晨,等.药用植物大戟的快速繁殖研究[J].广西植物,2005,25(2):152-155.
[5]张蓓蓓.三种大戟属植物的化学成分及抗肿瘤活性研究[D].东南大学,博士学位论文,2013.
[6]黄衡宇,王美蓉.紫背金盘愈伤组织诱导与再生体系的建立[J].中草药,2014(9):1 313-1 318.
[7]张占江,李翠,吕惠珍,等.条叶唇柱苣苔组织培养研究[J].种子,2013,32(9):19-22.
[8]韦范,李翠,韦坤华,等.岩黄连的高频再生体系建立与优化[J].江苏农业科学,2014,42(11):68-71.
[9]李林轩,凌征柱,李翠,等.珐菲亚组织培养条件的优化研究[J].中草药,2013,44(10):33-35.
[10]杨冉,黄萍,祁珊珊,等.柳枝稷种子组培快繁技术[J].江苏农业科学,2014,42(2):46-48.
[11]于红梅,赵密珍,钱亚明,等.海沃德猕猴桃带芽茎段的组织培养快繁技术[J].江苏农业科学,2014,42(11):78-79.
(本栏目责任编辑:申 晓)
Optimization Study of Tissue Culture Regeneration of Medicinal PlantsEuphorbiapekinensisRupr.
LICui,WEIYing,MIAOJianhua,WEIKunhua,LILinxuan,ZHANGZhanjiang
2016-10-20
广西青年基金项目(2015 GXNSFBA 139104);广西中医药民族医药项目(GZBZ 14-15);广西壮药质量标准研究项目(MZY 2013052)。
李 翠(1982—),女,黑龙江省依安县人;硕士,助理研究员,主要从事药用植物繁育与保存研究;E-mail:licuicui941@aliyun.com
张占江,副研究员,研究方向:药用资源保护与开发利用;E-mail:zzj1811@163.com。
10.16590/j.cnki.1001-4705.2017.04.131
S 567.23+9
A
1001-4705(2017)04-0131-04

