奶牛溶菌酶基因多态性与乳房炎的关联分析
李云龙 高峰 张海涛 顾开朗 (徐州生物工程职业技术学院 江苏徐州 221006)
奶牛溶菌酶基因多态性与乳房炎的关联分析
李云龙 高峰 张海涛 顾开朗 (徐州生物工程职业技术学院 江苏徐州 221006)
通过研究奶牛溶菌酶基因(Bos taurus 1ysozyme,LYZ)的多态性与乳房炎的相关性,为奶牛的抗病育种提供新的分子遗传标记。利用PCR-SSCP技术对420头中国荷斯坦牛LYZ基因进行多态性检测,并对LYZ基因的多态位点与SCS(somatic cell score)和泌乳性状进行相关分析。结果表明:LYZ基因的外显子1上存在115(T>G)突变位点,使精氨酸变为亮氨酸;发现了3种基因型GG,TG和TT,频率分别为0.20、0.48和0.32;GG基因型个体的SCS最小二乘均值极显著低于TT基因型个体(P<0.01),显著低于TG基因型个体(P<0.05);GG基因型个体的305d产奶量最小二乘均值极显著高于TT基因型个体(P<0.01),显著高于TG基因型个体(P<0.05)。LYZ基因该位点的突变对奶牛的SCS和305d产奶量有较大的遗传效应,可作为分子标记应用于奶牛乳房炎抗性和产奶量的筛选。
LYZ基因 PCR-SSCP 多态性 SCS
奶牛乳房炎是奶牛多发病,在世界范围内造成了巨大的经济损失,据调查我国奶牛乳房炎发病率普遍高于国外。如果能通过奶牛的抗病育种来减少奶牛乳房炎发病率,减少经济损失具有极其重要的意义。溶菌酶(Lysozyme)全称1,4-β-N-溶菌酶,又称粘肽N-乙酰基胞壁酰水解酶,能够特异水解细菌细胞壁中肽聚糖N-乙酰胞壁酸和N-乙酰葡糖胺之间的β-1,4-糖苷键,是一种具有抗菌、溶菌活性的固有免疫效应分子[1]。目前已知在高等反刍动物(如牛、羊和鹿等)基因组中存在大概10种溶菌酶相似基因[2]。然而研究发现,反刍动物虽然有众多溶菌酶基因,但相对于其他动物机体缺乏溶菌酶[3]此外,不同组织溶菌酶表达差异巨大,牛肾、血液、泪液、乳汁中溶菌酶表达水平低于大多数动物[4],牛溶菌酶在乳腺中水平较低,仅为0.05~0.13mg/L,相比之下,人乳腺溶菌酶表达量可比其高2000~4000倍[5]。溶菌酶作为哺乳动物机体防御因子的重要成员,因为其具有抗菌、消炎、组织修复以及提高免疫力等多方面活性,同时又是一种天然、无毒的蛋白质,只作用于细菌细胞壁,而对动物机体无害。本研究采用 PCR-SSCP 技术对奶牛乳腺表达的溶菌酶基因进行多态性检测,并与奶牛体细胞评分(Somatic Cell Score, SCS)和泌乳性状进行关联分析,旨在探索溶菌酶基因突变与奶牛乳房炎易感性是否存在关联,为标记辅助育种、提高奶牛对病原微生物抵抗力、降低奶牛乳房炎发病率提供理论依据。
1 材料与方法
1.1 样本采集
420头中国荷斯坦牛血样采自徐州张集镇某奶牛场,产奶性能记录由该场提供。该场每月进行一次DHI(Dairy Herd Improvement)测定。
1.2 试验方法
1.2.1 基因组DNA提取 采用常规的苯酚-氯仿抽提法[6]。
1.2.2 引物设计 根据GenBank公布的牛LYZ基因序列(NC-007303),用Primer5.0软件对LYZ基因的4个外显子分别设计4对引物。引物由上海生物工程技术有限公司合成(表1)。

表1 LYZ基因引物 (℃)
1.2.3 PCR扩增扩增体系:10×buffer2.0μl、25mmol/ LMg2+1.5μl、dNTP0.5μl、TaqDNA聚合酶0.3μl、上下游引物各(10pmol/μl)1.0μl、DNA模板1.0μl、ddH2O12.7μl。扩增程序:94℃预变性5min;94℃变性40s,复性40s(具体退火温度见表1),72℃延伸10min,30个循环;最后72℃延伸10min,4℃保存。PCR扩增产物经1%琼脂糖凝胶电泳后,EB染色并拍照。
1.2.4 SSCP分析 将2µl PCR产物和8µl变性上样缓冲液加入离心管中并混匀,98℃变性10min,冰浴5min。采用交联度为29:1的聚丙烯酰胺凝胶,150V电泳过夜,电泳结束后银染显色。根据PCR~SSCP检测结果,选取不同基因型的PCR产物用试剂盒纯化回收后,送至上海生工生物工程技术服务有限公司进行序列测定。
1.3 数据分析
计算基因频率、基因型频率、有效等位基因数和多态信息含量,运用卡方检验器软件计算卡方值,运用SPSS16.0进行最小二乘分析。在进行统计分析时,先将乳中体细胞数(Somatic Cell Counts,SCC)用如下公式转换为体细胞评分(SCS):SCS=log(SCC/100)+3,并保留小数点后2位有效数字。
2 结果与分析
2.1 PCR-SSCP检测结果
4对引物的PCR扩增产物经琼脂糖凝胶电泳检测,得到了预期的产物(图1)。对PCR扩增产物进行SSCP检测,引物P1中共检测出3种基因型,分别命名为GG、TG和TT型(图2)。根据测序结果(图3)表明:LYZ基因第一外显子的115(T>G)位点发生突变,此突变使密码子Arg转变为Leu。引物P2、P3和P4在所有个体的SSCP检测中均没有发现多态。
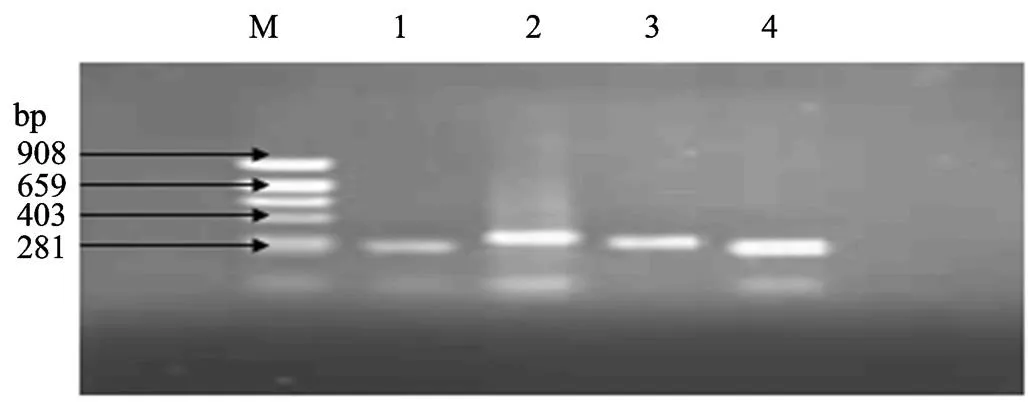
图1 引物P1-4的PCR产物
M:Marker pBR322;1-4:引物P1-4的PCR产物
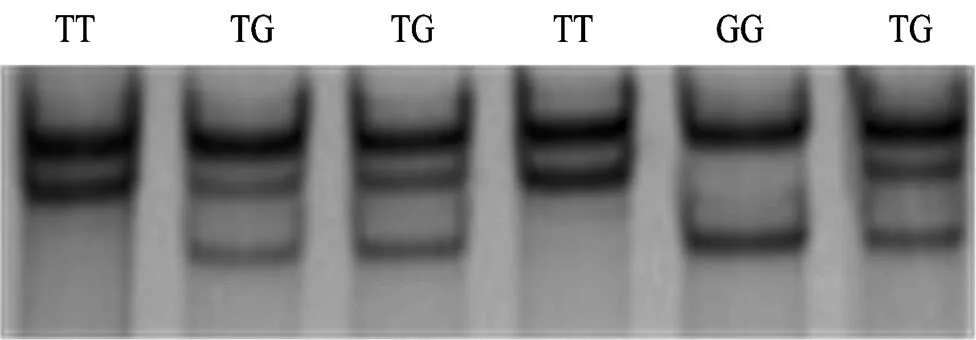
图2 中国荷斯坦牛LYZ基因第1外显子SSCP分析
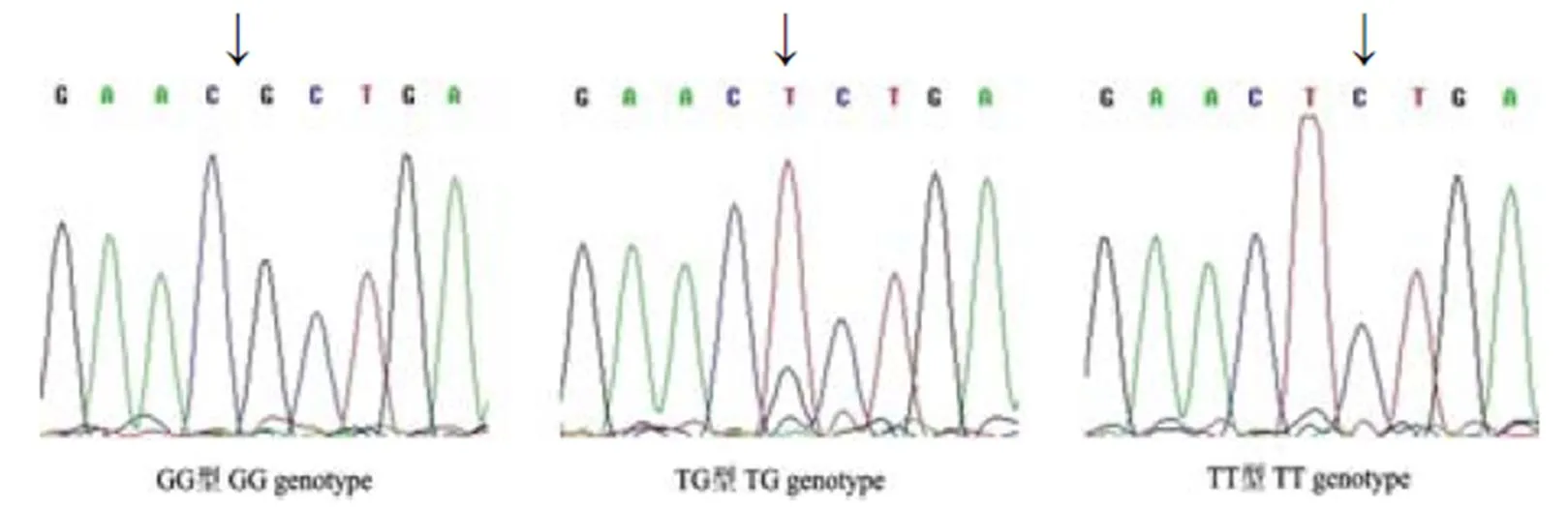
图3 115(T>G)位点的测序
2.2 基因型频率、等位基因频率及遗传特性
LYZ基因115(T>G)位点的等位基因频率和基因型频率结果如表2所示:基因型TT、TG和GG的频率分别为0.32、0.48和0.20,等位基因T和G的频率分别为0.56和0.44。T为优势等位基因,杂合子TG为优势基因型。LYZ基因115(T>G)位点的多态信息含量(PIC)大于0.50,表明该位点处于高度多态,变异程度较大。
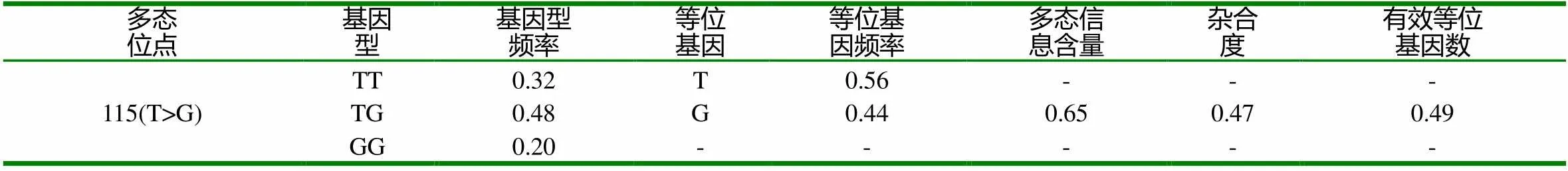
表2 LYZ基因115位点基因型频率和等位基因频率及遗传特性
2.3 LYZ基因多态性与奶牛泌乳性状的相关性
对LYZ基因多态位点进行最小二乘分析结果表明:115(T>G)位点对SCS和305d产奶量有显著影响。TT基因型个体的SCS极显著高于GG基因型个体(P<0.01),显著高于TG基因型个体(P<0.05);TT基因型个体的305d产奶量极显著低于GG基因个体(P<0.01),显著低于TG基因型个体(P<0.05)。
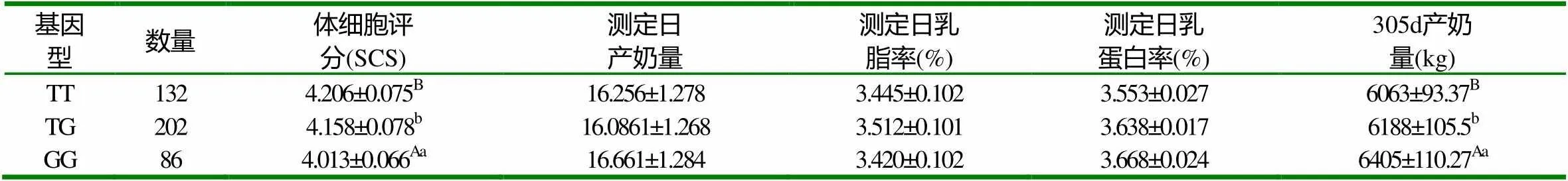
表3 LYZ基因115(T>G)位点对泌乳性状的效应 (kg、%)
注:同列大写字母不同表示差异极显著(P<0.01);同列小写字母不同表示差异显著(P<0.05)。
3 讨论
(1)SCC是指每毫升牛奶中体细胞的含量,乳中体细胞含量的多少是衡量乳房健康状况及乳卫生质量的标志之一。SCC作为乳房炎的常规检测方法有两大优点:(1)随着大量牧场DHI的实施,SCC已成为日常记录的一部分,可以通过仪器测定。(2)SCC的遗传力高于乳房炎的遗传力。乳房炎遗传力约为0.02~0.06[7],但为了提高SCC反映乳房炎的客观性、准确性和便于统计,在关联分析中往往将SCC转化为SCS,SCS的遗传力在0.1-0.2之间[8],而SCS与乳房炎之间存在遗传相关,相关系数在0.60-0.80之间[9]。本研究中LYZ基因的三种基因型对SCS的影响存在显著差异,GG基因型个体的SCS极显著低于TT基因型个体(P<0.01),显著低于TG基因型个体(P<0.05),对于乳房炎而言GG是最有利基因型,TT是最不利基因型。因此,在奶牛的乳房炎抗性育种中,该位点可以作为标记辅助育种,降低奶牛乳房炎的发病率。(2)LYZ基因的研究多集中在转基因和疾病防治上,很多学者尝试将具有较高活性的人溶菌酶基因转入到奶牛[10]和奶山羊[11],使牛、羊乳腺分泌表达人溶菌酶,从而提高对乳房炎的抵抗力。杨睿[12]等用不同来源的四种溶菌酶对引起奶牛乳房炎的葡萄球菌做抑菌实验,并从中筛选出抑菌效果最好的样品。孙怀昌[13]等将两种自行构建的表达人溶菌酶基因的重组质粒注射到患病奶牛的乳腺,经CMT试验证明对临床型和隐性乳房炎具有治疗作用。而目前对牛的LYZ基因多态性与奶牛乳房炎关联分析的研究较少,最近有研究发现,在水牛LYZ基因外显子3上存在多态位点[14],并研究得出血清中溶菌酶AA基因型个体活性高于其它基因型个体,而AA基因型个体奶中的体细胞数低于其它基因型个体。本试验通过PCR-SSCP技术检测奶牛的LYZ基因3个外显子多态性,在第一外显子的115位点发现了T→G的突变,与陈仁金等[15]的检测结果一致,该位点进行相关性分析表明:其显著影响305d产奶量,GG基因型个体极显著高于TT基因型个体(P<0.01),显著高于TG基因型个体(P<0.05)。由于G等位基因不是优势等位基因,该位点多态信息含量(PIC)大于0.50,表明该位点处于高度多态,变异程度较大,存在较大的选择潜力,对该位点的选择有望获得更多的遗传进展。所以应逐步固定优势等位基因,以提高奶牛生产和抗病性能。
4 结论
本研究结果表明:LYZ基因对中国荷斯坦牛305d产奶量和SCS评分有较大的遗传效应,可用于中国荷斯坦牛的分子标记辅助选择。
[1] Prager E M, Wilson A C, Arnheim N.Wide spread distribution of lysozyme g in egg white of birds[J].Biol Chem, 1974, 249(22): 7295-7297.
[2] Irwin D M, Sidow A, White R T,et al.Multiple genes for ruminant lysozymes.The immune response to structurally defined proteins,Smith-Gill S J, Sercarz.E, Schenectady, YN: Adenine Press, 1989, 73-85.
[3] Prieur D J.Tissue specific deficiency of lysozyme in ruminants[J]. Comp Biochem Physiol B, 1986, 85(2): 349-353.
[4] Dobson D E, Prager E M, Wilson A C.Stomach lysozymes of ruminants. I. Distribution and catalytic properties[J].Biol Chem, 1984, 259(18): 11607-11616.
[5] Benkerroum N. Antimicrobial activity of lysozyme with special relevance to milk[J]. African Journal of Biotechnology, 2008, 7(25): 4856-4867.
[6] Sambrook J, Russell D W. Huang P T(Translate). Molecular Cloning: A Laboratory Manual. Beijing: Science Press,2002.
[7] Shook G E, and Schutz M M. Selection on somatic cell score to improve resistance to mastitis in the United States [J]. J Dairy Sci, 1994, 77: 648-658.
[8] Banos G E, Shook G E. Genotype by environment interaction and genetic correlations among paritie for somatic cell count and milk yield[J]. J Dairy Sci, 1990, 73: 2563-2571.
[9] Young C W, Legates J E, Leece J G. Genetic and phenotypic relationships between clinical mastitis, laboratory criteria, and udder height[J].J Dairy Sci.1960,43:54-62.
[10] Yang B, Wang J, Tang B, et al. Characterization of bioactive recombinant human lysozyme expressed in milk of cloned transgenic cattle[J]. PLoS One, 2011, 6(3): 17593.
[11] Maga E A, Cullor J S, Smith W, et al. Human lysozyme expressed in the mammary gland of transgenic dairy goats can inhibit the growth of bacteria that cause mastitis and the cold-spoilage of milk[J]. Foodborne Pathog Dis, 2006, 3(4): 384-392.
[12] 杨睿, 黄伟, 付利芝等. 4种不同来源溶菌酶对引起奶牛乳房炎葡萄球菌的抑制作用[J]. 中国兽医科学, 2014(4): 24-27.
[13] 孙怀昌, 于锋, 苏建华等. 人溶菌酶基因治疗奶牛乳腺炎的初步研究[J]. 畜牧兽医学报, 2004(2): 15-17.
[14] Sahoo N R, Kumar1 P, Bhushan1 B, Bhattacharya T K, Sharma1 A, Dayal S, Pankaj P K, Sahoo M. PCR-SSCP of serum lysozyme gene (Exon-III) in riverine buffalo and its association with lysozyme activity and somatic cell count[J]. Asian-Aust. J. Anim. Sci. 2010,23(8): 993-999.
[15] 陈仁金, 杨章平, 毛永江. 中国荷斯坦牛LYZ基因多态性及其与乳房炎的关联分析[J]. 中国农业科学, 2010, 43(23): 4936-4941.
(2017–07–26)
徐州市科技计划项目(KC15N0012)
S852.4+2
A
1007-1733(2017)11-0001-03

