甜菜夜蛾卵黄原蛋白多克隆抗体制备及其在不同发育时期蛋白表达
赵静,孙洋,谭永安,肖留斌,姜义平,柏立新
甜菜夜蛾卵黄原蛋白多克隆抗体制备及其在不同发育时期蛋白表达
赵静,孙洋,谭永安,肖留斌,姜义平,柏立新
(江苏省农业科学院植物保护研究所/江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,南京 210014)
制备甜菜夜蛾()卵黄原蛋白(vitellogenin,Vg)多克隆抗体,并检测甜菜夜蛾不同发育时期血淋巴中的Vg蛋白表达量变化,为进一步研究Vg转运与利用机制以及生物学功能打下基础。以羽化24 h的甜菜夜蛾雌成虫cDNA为模板,通过PCR扩增得到甜菜夜蛾基因片段,其包含vitellogenin-N结构功能区。将目的片段连入pMD-19T载体后进行测序,利用DNAMAN软件分析该基因序列的准确性及编码蛋白的特性。将测序正确的基因片段通过I和I限制性内切酶连接到原核表达载体pCzn1。将重组表达载体pCzn1-转入大肠杆菌ArcticExpress,离心收集诱导表达的菌液,超声波破碎菌体沉淀,取上清液与沉淀进行SDS-PAGE检测,分析Vg重组蛋白的可溶性。在不同温度、不同浓度IPTG条件下诱导表达Vg重组蛋白,筛选最优表达条件。经Ni-NTA琼脂糖凝胶亲和层析柱纯化得到了Vg重组蛋白,将该蛋白免疫新西兰白兔,制备兔抗Vg血清抗体。采用间接ELISA方法检测血清抗体的效价,并通过Western blot法检测甜菜夜蛾雌虫不同发育阶段血淋巴中Vg蛋白的表达差异。扩增所得基因片段为2 091 bp,编码697个氨基酸, 预测蛋白分子量为80.88 kD。通过大肠杆菌表达出的Vg重组蛋白相对分子量为80 kD,其大小与预期的Vg重组蛋白带大小相符合。其主要以包涵体形式表达,而在上清中表达量不明显。不同温度、不同浓度IPTG条件下诱导表达Vg重组蛋白的结果显示温度为25℃,IPTG浓度为0.6 mmol·L-1时,Vg重组蛋白表达量最高。继续提高温度和IPTG浓度,对提高Vg重组蛋白的表达量无明显作用,且杂蛋白增多。新西兰白兔经4次免疫后,间接ELISA法检测表明,制备的兔抗Vg抗体具有较好的灵敏度,效价达到 1﹕512 000。Western blot检测Vg蛋白在甜菜夜蛾不同发育阶段血淋巴中的表达,其杂交出的单一条带在180 kD左右。Vg蛋白在甜菜夜蛾雌蛹末期开始微弱表达。雌成虫羽化后血淋巴中Vg蛋白表达量先升高后降低,呈动态变化,到羽化48 h表达量最高,随后降低。纯化获得了Vg重组蛋白,并明确了最优表达条件(温度为25℃,IPTG浓度为0.6 mmol·L-1);制备了高效价的甜菜夜蛾Vg多克隆抗体,明确了甜菜夜蛾Vg蛋白的表达规律。
甜菜夜蛾;卵黄原蛋白基因;原核表达;抗体制备;表达模式
0 引言
【研究意义】甜菜夜蛾()属鳞翅目(Lepidoptera)夜蛾科(Noctuidae),是一种世界性分布的多食性重要害虫,可严重危害多种重要经济作物[1-2]。近年来,由于蔬菜、Bt棉等适生性虫源寄主种植面积的扩大等因素,中国暴发频度呈上升趋势。其暴发的主要原因是繁殖能力强及较高的抗药性[3-4]。目前,国内关于甜菜夜蛾的生殖生理研究还很薄弱,仅在生殖系统结构与发育分级方面有部分报道[5-6]。卵黄原蛋白(vitellogenin,Vg)的合成与卵黄的沉积是卵形成的关键因素,其含量直接影响雌成虫产卵潜力。通过开展甜菜夜蛾卵黄发生的研究,可充分揭示甜菜夜蛾成虫大量产卵的内在规律,对该虫害种群测报与防治具有重要意义。【前人研究进展】在大部分昆虫中,Vg是卵黄蛋白的前体,它由雌性脂肪体在激素的调控下合成,分泌到血淋巴,被卵母细胞通过卵黄原蛋白受体(vitellogenin receptor,VgR)调节的内吞作用所摄取,经修饰、切除、加工后以晶体形式沉积为卵黄磷蛋白(vtellin,Vt)。迄今,有关昆虫的分子特性、功能、卵黄发生的时间动态以及卵黄发生的内分泌调控机理等已有许多研究,涉及的昆虫包括11目80余种[7-15]。不同昆虫类群或同一昆虫类群不同种类的个体,Vg合成与摄取的时间并不相同,这一性质决定了昆虫卵黄发生的时间差异。在鳞翅目中,对于成虫不取食的蛾类,Vg合成启动在末龄幼虫、预蛹或蛹初期,如舞毒蛾()始于末龄幼虫[16];天蚕()始于结茧的预蛹期[17];而对于成虫取食的蛾类,Vg合成和启动在蛹末期或成虫期,如斜纹夜蛾()[15]和美洲棉铃虫()[17]。随着RNA干扰技术的发展,已有研究表明Vg不仅为胚胎发生提供营养物质,它在生物体内还具有气候适应、激活卵巢、生殖竞争、行为构建、延长寿命、转化食物、抗氧化、传播病毒等其他的功能[18-20]。【本研究切入点】昆虫Vg的功能为人们利用或抑制昆虫提供了新思路,在前期研究中甜菜夜蛾序列已克隆得到,但甜菜夜蛾Vg蛋白的合成、转运与吸收机制以及生物学功能尚不明确。目前,研究Vg含量的动态变化主要采用免疫印迹方法,因此制备Vg抗体是研究的关键。【拟解决的关键问题】在前期获得卵黄原蛋白全长序列的基础上,通过分离纯化特异性肽链,制备其多克隆抗体,并通过Western blot分析甜菜夜蛾不同发育时期Vg含量的动态变化,揭示其卵黄发生规律,为在蛋白水平上进一步研究甜菜夜蛾Vg转运与吸收机制以及生物学功能打下基础。
1 材料与方法
试验于2016年在江苏省农业科学院植物保护研究所完成。
1.1 材料
供试甜菜夜蛾虫源来自江苏省农业科学院植物保护研究所作物虫害研究室。甜菜夜蛾饲养条件为温度(26.5±1)℃,相对湿度(65±5)%,光周期 L﹕D=14 h﹕10 h,成虫期补充10%蜂蜜水。
1.2 方法
1.2.1 Vg表达引物设计与序列扩增 根据笔者实验室前期已发表的甜菜夜蛾的全长序列[21](GenBank登录号:KT599434),设计含有I和I酶切位点的特异性引物。用于扩增的特异性片段,包含 Vitellogenin-N 结构区。引物由上海生工合成。正向引物序列为:5′-GGGTTTCATATGTG GCAAACTGGCAAACT-3′,反向引物序列:5′-CTCTA GAAATTCCACTCTTGATAGC-3′。采用Trizol reagent(Invitrogen)提取羽化24 h的甜菜夜蛾雌成虫(从破蛹而出开始计算羽化时间)总RNA,用M-MLV酶(Promega)反转录获得cDNA。以此cDNA为模板用特异性引物扩增特异性片段。PCR反应程序为94℃预变性 3 min,然后按照 94℃ 45 s,55℃ 30 s,72℃ 120 s,进行 30 次循环反应,最后于 72℃延伸 10 min。PCR 产物经琼脂糖凝胶电泳分离,并通过胶回收试剂盒(Axygen)纯化回收目的DNA片段。目的片段与pMD-19T 载体(TaKaRa)连接,经PCR筛选阳性克隆后,送上海生工测序。利用DNAMAN软件分析该基因序列的准确性及预测编码蛋白的大小。重组载体命名为 pMD19T-。
1.2.2 Vg原核表达载体的构建 用限制性内切酶I和I酶(TaKaRa)双酶切回收的PCR产物和空pCzn1载体(江苏省农业科学院昆虫实验室保存),回收目的片段及表达载体,经T4 DNA连接酶(TaKaRa)连接,16℃过夜后转化大肠杆菌ArcticExpress(北京华越洋),在含有氨苄青霉素(Amp)的平板上抗性筛选培养,通过酶切及PCR扩增筛选阳性克隆,并将确认为阳性克隆的质粒送上海生工测序,分析是否为目的片段序列,将鉴定正确的重组质粒命名为 pCzn1-。
1.2.3Vg重组蛋白的可溶性分析及表达条件的优化 接种鉴定正确的重组子于含有50 μg·ml-1Amp的 3 ml LB 液体培养基中,37℃振荡培养过夜。次日,1﹕100转接于30 ml LB(含Amp)液体培养基中培养,至 OD600值为0.5时,加入IPTG分别调至终浓度为0.2、0.4、0.6、0.8、1.0 mmol·L-1,于37℃、200 r/min进行诱导融合蛋白表达。诱导4 h后收集1 ml菌液,6 000 r/min离心10 min,弃上清,用PBS重悬菌体沉淀;超声波破碎菌体沉淀并离心,取上清液与沉淀进行12% SDS-PAGE检测分析Vg 重组蛋白的可溶性及最适的 IPTG 浓度。在最适的IPTG终浓度进行温度优化,将诱导温度分别调整至 20、25、30和 35℃,根据Vg重组蛋白表达量检测结果确定诱导最佳温度。
1.2.4 Vg包涵体蛋白的制备和纯化 在最适 IPTG 浓度和温度条件下进行 Vg目的蛋白大规模的诱导表达。将诱导表达后的培养菌液在低温4℃条件下,60 000 r/min离心10 min,菌体沉淀与20 ml裂解buffer(包含20 mmol·L-1Tris-HCl、1 mmol·L-1PMSF和细菌蛋白酶抑制剂cocktail混合液,pH 8.0)重悬,重悬液进行超声破碎(功率 400 W,工作 4 s,间歇8 s,共20 min);将超声破碎的细胞裂解液4℃10 000×离心20 min,收集沉淀;使用包涵体洗涤液(20 mmol·L-1Tris,1 mmol·L-1EDTA,2 mol·L-1尿素,1 mol·L-1NaCl,1% Triton X-100,pH 8.0)洗涤包涵体3次;用溶解缓冲液(20 mmol·L-1Tris,5 mmol·L-1DTT,8 mol·L-1尿素pH 8.0),按一定比例溶解包涵体,4℃放置过夜。利用低压层析系统,包涵体溶液以0.5 ml·min-1流速上样至Ni-IDA亲和层析柱(Novagen),用Ni-IDA缓冲液洗脱目的蛋白,收集洗脱液。将洗脱液装入透析袋,于4℃经0.01 mol·L-1PBST 溶液(pH 8.0)透析过夜后获得 Vg纯化蛋白。采用 12% SDS-PAGE检测Vg重组蛋白的纯度。
1.2.5 Vg多克隆抗体的制备 取纯化的Vg重组蛋白进行BCA蛋白浓度测定,免疫2只新西兰白兔(2—2.5 kg)(江苏省农业科学院兽医研究所提供),进行皮下注射,每次免疫量为 400 µg,2—3周免疫一次,共免疫 4 次。第4次免疫后在大白兔颈动脉采血,8 000 r/min 离心8 min所得上清制备抗血清并准备纯化抗体。将Vg蛋白与琼脂糖介质偶联制备成抗原亲和纯化层析柱,将PBS与所得抗血清等量混合后缓慢上样,待抗体抗原结合后用甘氨酸洗脱缓冲液洗脱得到所需纯化抗体,并在PBS缓冲液中进行4℃透析过夜,隔日进行效价测定。
1.2.6 效价测定 用间接ELISA法对抗体进行最终的效价测定。以纯化的Vg蛋白(5 μg·mL-1)包被ELISA 板,混匀后加入板条中,每孔加入100 μL,4℃过夜。用PBST(0.2 g KCl,0.2 g KH2PO4,2.9 g Na HPO4·12H2O,8 g NaCl,0.05% Tween-20,pH 7.4)洗涤3次,每次5 min后,加入封闭液(含5%牛血清白蛋白的PBST)于37℃封闭2 h。取出酶标板,弃去内液,用PBST洗板3次,加入用PBST连续倍比稀释(500×20—500×210)的Vg多克隆抗体和阴性血清(免疫前健康兔血清)每孔100 μl,37℃恒温箱1 h。同上洗涤后,加入100 μl的用PBST以1﹕5 000稀释的二抗HRP-IgG,37℃放置 1 h。用PBST洗板3次,每次5 min,最后加 100 μl TMB 底物液显色,37℃显色15 min,待终止反应后,酶标仪测定 A450值。
1.2.7 多克隆抗体检测甜菜夜蛾不同发育阶段血淋巴Vg含量 采用背血管取血淋巴法[15,22],用定量玻璃毛细管直接插入甜菜夜蛾胸部背血管,收集甜菜夜蛾不同发育时期(化蛹1—7 d的雌蛹,羽化0、12、24、48、60、72 h的雌成虫)血淋巴样品。甜菜夜蛾不同发育时期的血淋巴样品设置3个重复,每个重复取自5头试虫,每头试虫定量吸取1 μl血淋巴,共5 μl。每个样品用PBS溶液稀释100 倍,上样 10 μl,进行SDS-PAGE电泳,电转印至 PVDF 膜上。转印 PVDF 膜后,取下膜先用 PBST 洗涤 4 次,每次5 min,然后将膜用含5%脱脂奶粉的PBST封闭液置于37℃封闭 1 h,加入用 PBST 以1﹕5 000稀释比例的一抗(上述制备的Vg多克隆抗体),膜在一抗稀释液中4℃过夜。次日将膜取出后,用PBST洗膜4次,每次5 min。用PBST以1﹕5 000的比例稀释二抗HRP-IgG(上海生工),膜在二抗中37℃反应 1 h。反应完毕后,把膜取出置于干净的盒子中用PBST洗膜 4次,ECL显影,曝光。
2 结果
2.1 甜菜夜蛾Vg片段的扩增和克隆
以羽化24 h的甜菜夜蛾成虫cDNA为模板,用加酶切位点的特异性引物进行扩增, PCR扩增产物经琼脂糖凝胶电泳分离后,呈现一条大小与预期相吻合的目的DNA条带,约为2 091 bp(图 1)。将此特异性条带切胶回收,连接到pMD-19T载体,并挑斑鉴定。同时,测序克隆载体也验证了序列的正确性。序列长度 2 091 bp,编码 697 个氨基酸,预测蛋白分子量为 80.88 kD。

1:PCR 产物PCR product;M:DL2000 DNA Marker
2.2 Vg原核表达载体的构建
经I和I双酶切的基因片段,亚克隆到pCzn1载体上,转化至大肠杆菌ArcticExpress,挑选平板上单一的菌落抽提质粒并进行酶切鉴定。如图2所示,正确的重组质粒酶切后呈现两条清晰的条带,一条带为 2 091 bp的片段,另一条带为约4 400 bp的pCzn1载体。此外采用DNAMAN软件分析该重组质粒测序所得序列,结果显示基因序列无突变缺失,表明pCzn1-载体构建成功。
2.3 重组蛋白表达的鉴定
经IPTG诱导后,重组克隆菌的表达产物经SDS-PAGE分析表明在80 kD处出现了一条新蛋白带,其大小与预期的Vg重组蛋白带大小相符合,其在沉淀中表达量较高而在上清中表达量不明显(图3)。
2.4 表达条件的优化
2.4.1 IPTG浓度 以未诱导的菌体作为对照,用0.2、0.4、0.6、0.8和1.0 mmol·L-1的IPTG浓度诱导,随着 IPTG 加入量的增加,Vg蛋白表达量也明显增加(图4)。当IPTG 浓度为0.6 mmol·L-1时,Vg蛋白表达量呈现最大化,而继续提高 IPTG 的浓度对提高蛋白的表达量无明显作用。
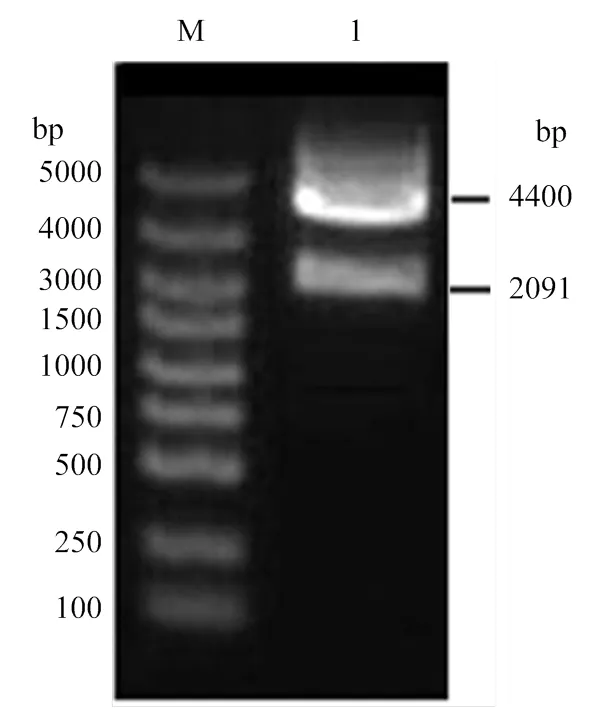
M:DL5000 DNA Marker;1:pCzn1-Vg质粒双酶切pCzn1-Vg ingested by Nde I/Xba I
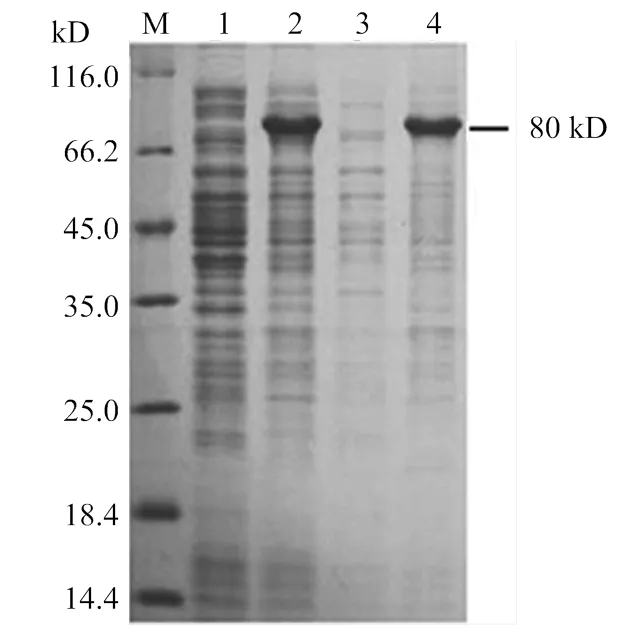
M:蛋白marker Protein marker;1:未经诱导 pCzn1-Vg表达产物The expression product of pCzn1-Vg without inducing;2:pCzn1-Vg 诱导后表达产物induced expression product of pCzn1-Vg;3:诱导表达产物上清液the precipitate induced by IPTG;4:诱导表达产物沉淀The supernatant induced by IPTG
2.4.2 诱导温度 在0.6 mmol·L-1的最适IPTG 浓度下,随着诱导温度的升高,沉淀蛋白的表达量在25℃时有明显提高(图5)。25℃以后,随着温度升高,蛋白表达量无明显变化,且杂蛋白量增多。
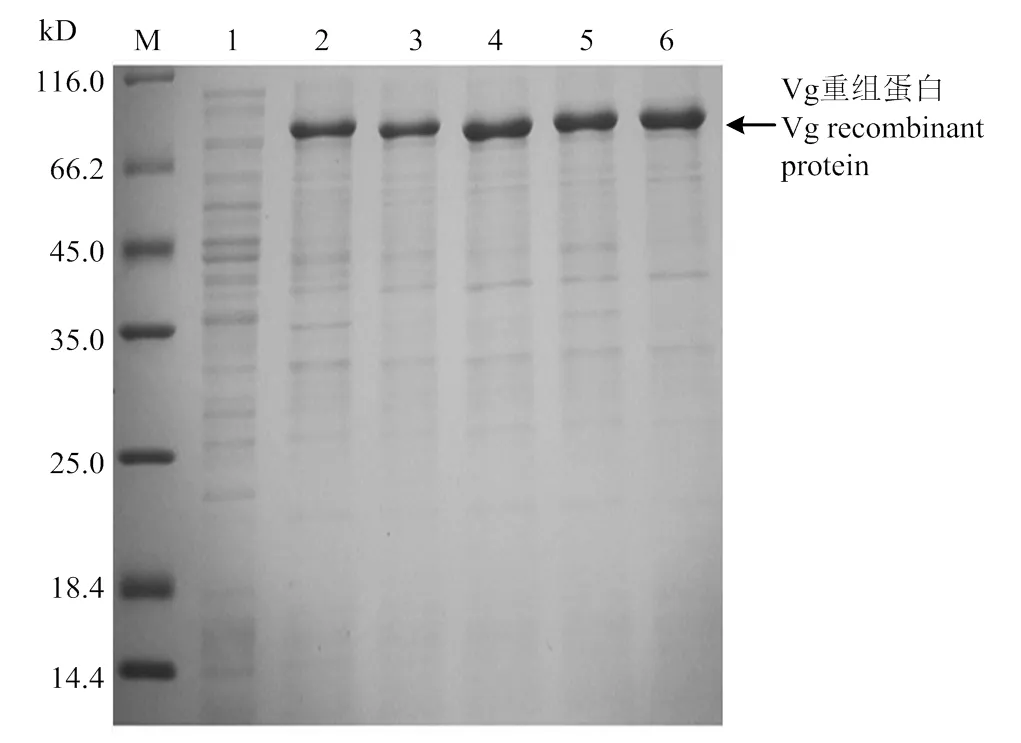
M:蛋白Marker Protein Marker;1—6:IPTG 浓度分别为0、0.2、0.4、0.6、0.8 和1.0 mmol·L-1时,pCzn1-Vg 转化菌诱导后破菌沉淀Precipitates of pCzn1-Vg induced by IPTG at the concentration of 0, 0.2, 0.4, 0.6, 0.8 and 1.0 mmol·L-1, respectively
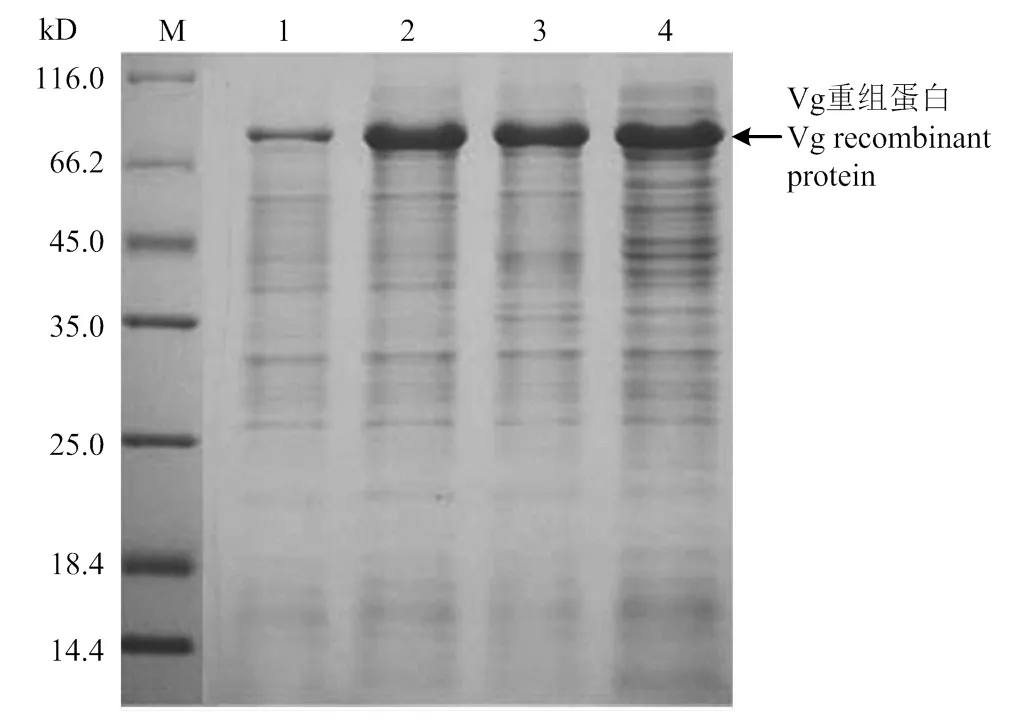
M:蛋白Marker Protein Marker;1—4:加入 0.6 mmol·L-1 IPTG分别在20、25、30和35℃时诱导,pCzn1-Vg转化菌诱导后破菌沉淀Precipitate of pCzn1-Vg by induction with 0.6 mmol·L-1 IPTG at 20, 25, 30, and 35℃
2.5 Vg重组蛋白的纯化检测
Vg包涵体蛋白经过变复性的方式,重溶目标蛋白,通过Ni柱树脂亲和纯化获得目标蛋白,进行12% SDS-PAGE 分析,用Ni-IDA缓冲液洗脱,可获得一条约为 80 kD 的清晰的特异性蛋白条带(图6)。
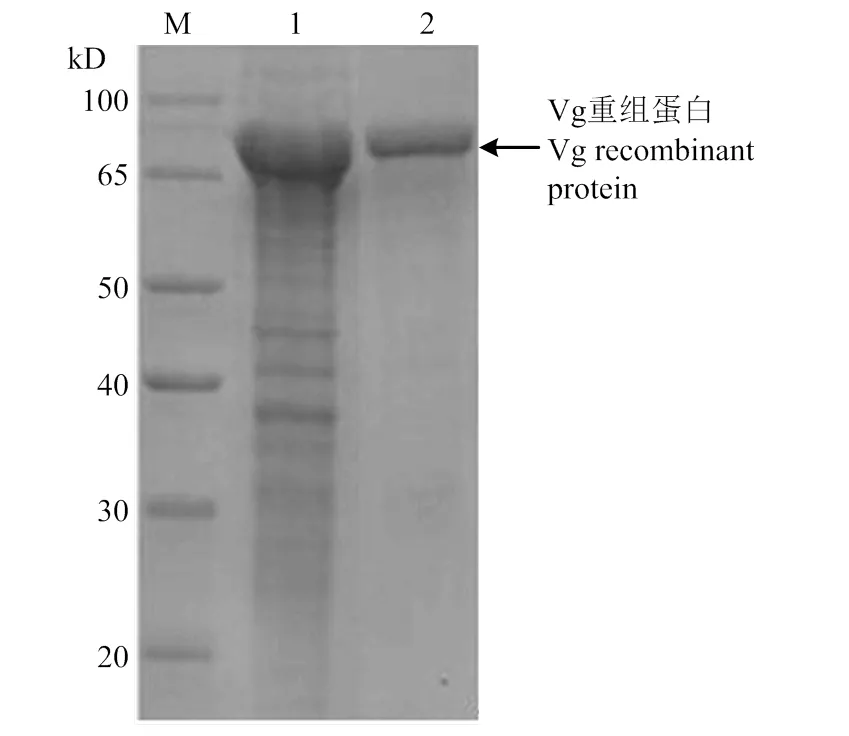
M:蛋白Marker Protein Marker;1:Vg包涵体蛋白Precipitate from pCzn1-Vg;2:纯化后的 Vg 重组蛋白Purified Vg recombinant protein
2.6 Vg多克隆抗体效价的测定
新西兰白兔经4次免疫后,用间接ELISA法检测Vg多克隆抗体的效价。Vg多克隆抗体和阴性血清(免疫前健康兔血清)按 500×20(500)至 500×210(512 000)连续倍比稀释,结果表明,当Vg抗体稀释512 000 倍时,OD阳性/OD阴性>2.0,其终效价可达 1﹕512 000。
2.7 多克隆抗体检测甜菜夜蛾不同发育阶段血淋巴中Vg的含量
分别取化蛹 1—6 d的雌蛹以及刚羽化,羽化 12、24、48、60、72 h的甜菜夜蛾成虫血淋巴样品,用Western blot检测Vg蛋白在甜菜夜蛾不同发育阶段血淋巴中的表达差异(图7)。其杂交出的单一条带在180 kD左右。Western blot检测结果显示Vg仅在甜菜夜蛾雌虫中表达,从蛹末期开始微弱表达。成虫羽化后血淋巴中Vg表达量先升高后降低,呈动态变化,到羽化 48 h表达量最高,随后降低。
3 讨论
昆虫Vg是由 6—7 kb的mRNA编码,首先形成分子量约为200 kD的前体蛋白,然后卵裂位点将其分裂成 40—60和140—190 kD大小两种亚基,亚基经聚合、修饰后形成Vg[23]。在前期研究中,通过对甜菜夜蛾序列的分析,总长5 694 bp,编码1 761个氨基酸,总分子量为200 kD左右,预测蛋白水解酶在卵裂位点RTLR将其分解成大小两个亚基(141和58 kD)。本研究用于原核表达的肽链vitellogenin-N区是一个脂蛋白结构域,主要用于运输脂质[24],表达的Vg重组蛋白为80 kD左右,其包含卵裂位点RTLR。理论上用Vg重组蛋白免疫家兔制备的多克隆抗体对Vg大小亚基都有免疫反应,但Western blot结果显示在雌虫血淋巴中,只检测出Vg的一个大亚基(180 kD左右)。有研究表明,在同属夜蛾科的斜纹夜蛾中,通过分离卵提取物卵黄蛋白制备Vg多克隆抗体对卵与雌性血淋巴进行Western blot分析,也只能检测出Vg的一个大亚基[14]。因此笔者推测,像一些高等膜翅目昆虫如日本瘤姬蜂()[25]一样,甜菜夜蛾中只有编码大亚基的部分才有转录活性,而编码小亚基单位的部分缺失或不表达。
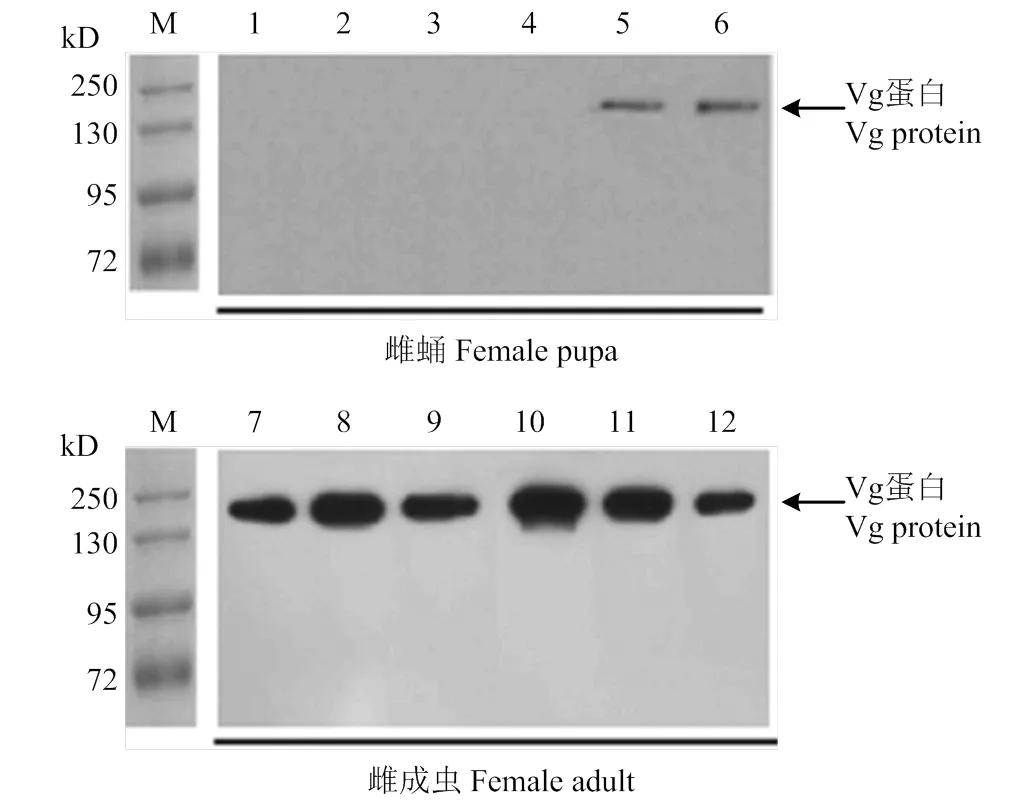
M:蛋白marker Protein Marker;1—6:化蛹1-6 d的雌蛹Female pupae from 1st to 6th day;7—12:刚羽化雌成虫、羽化12、24、48、60、72 h雌成虫0-, 12-, 24-, 48-, 60-, 72-h-old adults
昆虫Vg在体内合成具有性别、发育时期和组织的特异性。在大多数昆虫中,脂肪体是Vg合成的唯一场所,然后分泌到血淋巴,被卵母细胞通过卵黄原蛋白受体吸收[7]。在前期的研究中,笔者克隆得到甜菜夜蛾序列,同时明确了仅在雌虫脂肪体表达,而在中肠、马氏管、卵巢等组织中不表达。鳞翅目昆虫Vg合成启动时间根据成虫是否取食的特性在不同类群中存在差异性。本研究测定的甜菜夜蛾Vg蛋白表达动态结果显示 Vg在甜菜夜蛾雌虫蛹末期开始微弱表达,成虫羽化后Vg表达量先升高后降低,呈动态变化,到羽化48 h表达量最高,随后降低。甜菜夜蛾Vg合成和启动在蛹末期,这与大多数属于成虫补充营养型的蛾类Vg合成和启动时间一致,如烟草天蛾()[17]和斜纹夜蛾[15]。而对于成虫不取食型的蛾类,如同属于鳞翅目的舞毒蛾[16],Vg在末龄幼虫就开始表达。不同蛾类Vg合成启动时间不同,这可能是由个体内在特有的内分泌系统调控决定的。
在害虫预测预报中,通过剖解昆虫的卵巢发育进度可以预测其田间产卵量。而昆虫Vg蛋白表达量的变化与卵巢发育进度紧密相关,这在很多昆虫如美洲蜚蠊()[11]、猛蚁()[26]、草地贪夜蛾()[27]、斜纹夜蛾[14]中已得到证实。根据甜菜夜蛾雌蛾的卵巢形态和结构变化,将其卵巢发育进度分为5级,即乳白透明期、卵黄沉积期、成熟待产期、产卵盛期、产卵末期[6]。通过对室内甜菜夜蛾种群不同日龄的卵巢组织进行解剖,结果显示在甜菜夜蛾蛹末期(羽化前2 d)是乳白透明期,卵巢处于萌芽阶段,脂肪体量多而饱满。这一阶段本研究测定的Vg蛋白表达动态结果显示Vg表达开始启动,但表达量较弱,与观察到的卵黄沉积较少,卵巢管基本处于透明状的现象基本相符。从蛹体发黑即将要羽化至羽化48 h是卵黄沉积期,这一时期卵巢管伸长,管内卵量急速增加,未成熟的卵粒较多,卵巢发育所需求的营养物质急剧增加。因此,Vg表达量在蛋白水平上进入快速增长期。羽化48 h之后甜菜夜蛾卵巢进入成熟待产期,进入待产期后,脂肪体明显变少,卵巢管内有大量成熟的卵存在,而此刻未成熟的卵粒较少,所需求的营养物质减少,Vg蛋白表达量也开始降低。本研究血淋巴中Vg蛋白表达量的趋势变化与笔者前期对甜菜夜蛾脂肪体组织中表达量的测定结果[21]基本一致。因此,综合Vg表达动态及卵巢发育进度的结果,笔者认为在甜菜夜蛾进入产卵盛期(羽化3—4 d)前,已基本完成了卵黄沉积的主要过程。
甜菜夜蛾寄主范围广,食性杂,并具有繁殖能力强、易产生抗药性、迁飞扩散能力强等特点[28-30],因而极易猖獗发生、暴发成灾,现已列入世界性极难治理的重大害虫范围。Vg是胚胎发育营养的主要来源,在昆虫生殖过程中起重要作用,也是害虫种群增殖的关键因子。用于制备甜菜夜蛾Vg多克隆抗体的抗原有两种,一种是表达蛋白,另一种为甜菜夜蛾卵提取物即卵黄蛋白。Moon等[14]曾利用甜菜夜蛾的卵提取物制备了Vg抗体,但其特异性效果不好,在目标蛋白附近220 kD的位置有交互免疫性,不利于对Vg的表达动态进行准确测定。本研究通过原核表达的vitellogenin-N结构区,制备了高效价,高纯度,特异性强的多克隆抗体,并测定了血淋巴中Vg的动态变化。研究结果一方面可揭示甜菜夜蛾卵黄发生规律与卵巢发育进度及产卵动态的内在联系,对于甜菜夜蛾的监测防治具有重要意义;另一方面也可为进一步研究甜菜夜蛾Vg吸收与转运机制以及生物学功能打下基础。
4 结论
克隆了甜菜夜蛾的功能区片段,该基因片段序列长度 2 091 bp,编码697个氨基酸。同时获得了原核表达的Vg纯化蛋白,明确了蛋白最优表达条件(温度为25℃,IPTG浓度为0.6 mmol·L-1);制备了甜菜夜蛾Vg多克隆抗体,通过Western blot明确了甜菜夜蛾 Vg 蛋白的表达规律。
[1] FARAHANI S, NASERI B, TALEBI A A. Comparative life table parameters of the beet armyworm,(Hübner) (Lepidoptera: Noctuidae) on five host plants., 2011, 13(1): 91-101.
[2] AZIDAH A A, SOFIAN-AZIRUN M. Life history of(Lepidoptera: Noctuidae) on various host plants., 2006, 96: 613-618.
[3] 戴瀚洋, 孙洋, 柏立新, 赵静, 肖留斌, 谭永安. 亚致死浓度甲维盐胁迫对甜菜夜蛾幼虫解毒酶系活力及其相关基因表达量的影响. 棉花学报, 2015, 27(2): 149-158.
DAI H Y, SUN Y, BAI L X, ZHAO J, XIAO L B, TAN Y A. Activities of detoxification enzymes and expressions of related genes inlarvae treated with sublethal concentrations of emamectin benzoate., 2015, 27(2): 149-158. (in Chinese)
[4] 文礼章, 张友军. 我国甜菜夜蛾大尺度暴发频度与广域温度和广域降雨量关系的预测模型. 昆虫学报, 2010, 53(12): 1367-1381.
WEN L Z, ZHANG Y J. Modelling of the relationship between the frequency of large-scale outbreak of the beet armyworm,(Lepidoptera: Noctuidae) and the wide-area temperature and rainfall trends in China., 2010, 53(12): 1367-1381. (in Chinese)
[5] 王宪辉, 徐洪富, 许永玉, 刘勇, 周真. 甜菜夜蛾雌性生殖系统结构、发育分级及在测报上的应用. 植物保护学报, 2003, 30(3): 261-266.
WANG X H, XU H F, XU Y Y, LIU Y, ZHOU Z. The structures and developmental progress of reproductive system of beet armyworm,(Hübner), and their use in forecast., 2003, 30(3): 261-266. (in Chinese)
[6] 韩兰芝, 翟保平, 戴率善, 张孝羲, 刘培磊. 江苏丰县甜菜夜蛾田间种群虫源性质分析. 生态学报, 2004, 24(7): 1388-1398.
HAN L Z, ZHAI B P, DAI S S, ZHANG X Y, LIU P L. Analysis on the population status of the beet armyworm,(Hübner) in Fengxian, Jiangsu Province, China., 2004, 24(7): 1388-1398. (in Chinese)
[7] 戈林泉, 吴进才. 昆虫卵黄蛋白及其激素调控的研究进展. 昆虫知识, 2010, 47(2): 236-246.
GE L Q, WU J C. Research progress in insect vitellin and its hormone regulation., 2010, 47(2): 236-246. (in Chinese)
[8] 叶恭银, 吕慧平, 蒋彩英. 昆虫卵黄蛋白分子的多样性与进化关系//李典谟. 走向二十一世纪的中国昆虫学. 北京: 中国科学技术出版社, 2001: 178-189.
YE G Y, LÜ H P, JIANG C Y. Diversity and phylogeny of yolk proteins in insects//Li D M.. Beijing: Chinese Science and Technology Press, 2001: 178-189. (in Chinese)
[9] 董胜张, 高秀云, 程正贤, 胡萃, 叶恭银. 蝶蛹金小蜂卵黄蛋白单克隆抗体的制备及其应用方法的建立. 昆虫学报, 2007, 50(9): 871-877.
DONG S Z, GAO X Y, CHENG Z X, HU C, YE G Y. Development of monoclonal antibodies to the vitellin in an endoparasitoid,(Hymenoptera: Pteromalidae) and its application methods., 2007, 50(9): 871-877. (in Chinese)
[10] TUFAIL M, LEE J M, HATAKEYAMA M, OISHI K, TAKEDA M. Cloning of vitellogenin cDNA of the American cockroach,(Dietyoptera) and its structural and expression analyses., 2000, 45(1): 37-46.
[11] TUFAIL M, TAKEDA M. Molecular characteristics of insect vitellogenins., 2008, 54(12): 1447-1458.
[12] TUFAIL M, NAEEMULLAH M, ELMOGY M, SHARMA P, TAKEDA M, NAKAMURA C. Molecular cloning, transcriptional regulation, and differential expression profiling of vitellogenin in two wing-morphs of the brown planthopper,Stål (Hemiptera: Delphacidae)., 2010, 19(6): 787-798.
[13] TUFAIL M, NAGABA Y, ELGENDY A M, TAKEDA M. Regulation of vitellogenin genes in insects., 2014, 17(3): 269-282.
[14] MOON J, KIM Y. Purification and characterization of vitellin and vitellogenin of the beet armyworm,, (Noctuidae: Lepidoptera)., 2003, 6(1): 37-43.
[15] SHU Y H, ZHOU J L, TANG W C, LU K, ZHOU Q, ZHANG G. Molecular characterization and expression pattern of(Lepidoptera: Noctuidae) vitellogenin, and its response to lead stress., 2009, 55(7): 608-616.
[16] LAMISON C D, BALLARINO J, MA M. Temporal events of gypsy moth vitellogenesis and ovarian development., 1991, 16(2): 201-209.
[17] 叶恭银, 胡萃, 洪健, 龚和. 天蚕卵黄原蛋白的合成、运转与沉积. 昆虫学报, 1999, 42(3): 225-233.
YE G Y, Hu C, HONG J, GONG H. Synthesis, transport and accumulation of vitellogenin in the Japanese oak silkworm,(Lepidoptera: Saturiidae)., 1999, 42(3): 225-233. (in Chinese)
[18] SEEHUUS S C, NORBERG K, GIMSA U, AMDAM G V. Reproductive protein protects sterile honey bee workers from oxidative stress., 2006, 103(4): 962-967.
[19] LI Z, ZHANG S, LIU Q. Vitellogenin functions as a multivalent pattern recognition receptor with an opsonic activity., 2008, 3(4): e1940.
[20] HUO Y, LIU W, ZHANG F, CHEN X, LI L, LIU Q, ZHOU Y, WEI T, FANG R, WANG X. Transovarial transmission of a plant virus is mediated by vitellogenin of its insect vector., 2014, 10(3): e1003949.
[21] ZHAO J, SUN Y, XIAO L B, TAN Y A, BAI L X. Molecular characterization and expression of vitellogenin gene fromexposed to cadmium stress., 2016, 593(1): 179-184.
[22] 王岩, 马纪, 刘小宁. 昆虫血淋巴的收集技术与方法. 应用昆虫学报, 2009, 46(1): 147-151.
WANG Y, MA J, LIU X N. Techniques and methods for collecting insect haemolymph., 2009, 46(1): 147-151. (in Chinese)
[23] 马卓, 刘廷辉, 陈洁, 梁超, 曹美琳, 何运转. 异色瓢虫卵黄蛋白单克隆抗体的制备及鉴定. 昆虫学报, 2015, 58(11): 1186-1193.
MA Z, LIU T H, CHEN J, LIANG C, CAO M L, HE Y Z. Preparation and identification of monoclonal antibodies to the vitellin in(Coleoptera: Coccinellidae)., 2015, 58(11): 1186-1193. (in Chinese)
[24] SMOLENAARS M M W, MADSEN O, RODENBURG K W, VAN DER HORST D J. Molecular diversity and evolution of the large lipid transfer protein superfamily., 2007, 48: 489-502.
[25] NOSE Y, LEE J M, VENO T, HATAKEYAMA M, OISHI K. Cloning of cDNA for vitellogenin of the parasitoid wasp,: vitellogenin primary structure and evolution considerations., 1997, 27(9): 1047-1056.
[26] AZEVEDO D O, ZANUNCIO J C, DELABIE J H C, SERRÃO J E. Temporal variation of vitellogenin synthesis in, (Formicidae: Ectatomminae) workers., 2011, 57(7): 972-977.
[27] SORGE D, NAUEN R, RANGE S, HOFFMANN K H. Regulation of vitellogenesis in the fall armyworm,(Lepidoptera: Noctuidae)., 2000, 46(6): 969-976.
[28] ZHANG B, LIU H, HELEN H S, WANG J J. Effect of host plants on development, fecundity and enzyme activity of, (Hübner) (Lepidoptera: Noctuidae)., 2011, 10(8): 1232-1240.
[29] 司升云, 周利琳, 王少丽, 江幸福, 许再福, 慕卫, 王冬升, 王小平, 陈浩涛, 杨亦桦, 吉训聪. 甜菜夜蛾防控技术研究与示范—公益性行业(农业)科研专项 “甜菜夜蛾防控技术研究与示范” 研究进展. 应用昆虫学报, 2012, 49(6): 1432-1438.
SI S Y, ZHOU L L, WANG S L, JIANG X F, XU Z F, MU W, WANG D S, WANG X P, CHEN H T, YANG Y H, JI X C. Progress in research on prevention and control of beet armyworm,in China., 2012, 49(6): 1432-1438. (in Chinese)
[30] SU J, SUN X X. High level of metaflumizone resistance and multiple insecticide resistance in field populations of, (Lepidoptera: Noctuidae) in Guangdong Province, China., 2014, 61(3): 58-63.
(责任编辑 岳梅)
Polyclonal antibody preparation ofvitellogeninand its protein expression at different Developmental stages
ZHAO Jing, SUN Yang, TAN YongAn, XIAO LiuBin, JIANG YiPing, BAI LiXin
(Institute of Plant Protection/Key Lab of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base, Jiangsu Academy of Agricultural Sciences, Nanjing 210014)
The objective of this study is to prepare the polyclonal antibody ofvitellogenin(Vg), investigate the expression pattern of Vgprotein in female hemolymph ofat different developmental stages, and to provide a basis for studying the function and mechanism of synthesis, transportation and utilization.The fragment ofwas amplified from the cDNA of 24-h-old female adults ofby PCR which included the vitellogenin-N region. The fragment ofwas then inserted into the pMD-19T for sequencing. The nucleic acid sequence and the amino acids encoded by this gene fragment were analyzed by DNAMAN software. The sequencedfragment was inserted into the expression vector pCzn1 byI andI digestion. The recombinant vector pCzn1-Vg was then inserted intoArcticExpress. TheArcticExpress expressing the Vg recombinant protein was collected and crushed by ultrasonic. The supernatant and the precipitate were collected, respectively, and SDS-PAGE was used to analyze the expression of the recombinant protein. The recombinant Vg protein was expressed at different temperatures and concentrations of IPTG and the optimized expression condition was achieved. The recombinant protein was purified by Ni-NTA agarose. The purified recombinant protein was used to produce polyclonal antibody via immunizing rabbit. The titer of rabbit anti-Vg antiserum was evaluated by indirect ELISA. The content of Vg in female hemolymph ofat different developmental stages was detected by Western blot.The length of the fragment ofis 2 091 bp, encoding 697 amino acids. The predicted molecular weight of Vg recombinant protein is 80.88 kD. The molecular weight of Vg recombinant protein expressed inis 80 kD, which is consistent with the predicted molecular weight. It was mainly expressed in inclusion body rather than the supernatant. The results of Vg recombinant protein content expressed at different temperatures and concentrations of IPTG showed that it was highly expressed at inducing temperature of 25℃ with 0.6 mmol·L-1IPTG. It had no obvious effect on boosting the Vg recombinant protein level and other protein content increased by raising temperature and the concentration of IPTG. After immunizing New Zealand white rabbits with four times, the ELISA assay showed that the rabbit anti-Vg antiserum had a good sensitivity with the titer 1﹕512 000.The Vg content in female hemolymph ofat different developmental stages was detected by Western blot. A single Vg band of approximately 180 kD was detected. Vg was first expressed at late stage of female pupa and showed a low expression level. After female adult eclosion, Vg expression was in a dynamic balance which peaked in 48-h-old female adults, then decreased.The Vg recombinant protein was successfully purified and the optimized expression condition (temperature of 25℃ with 0.6 mmol·L-1IPTG) is clearly defined. The polyclonal antibody of Vg protein with high titer was obtained and the expression pattern of Vg inis explicit.
; vitellogenin gene; prokaryotic expression; polyclonal antibody; expression pattern
2017-06-06;
国家重点研发计划(6111661)、国家现代农业产业技术体系(CARS-18-16)、江苏省农业科学院院基金计划(6111612)、国家公益性行业(农业)科研专项(201303028)、江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地自主研究课题(3201632)
接受日期:2017-09-01
联系方式:赵静,E-mail:jingzhao0126@126.com。通信作者肖留斌,E-mail:xlbwll@sohu.com

