E盒结合锌指蛋白2对非小细胞肺癌预后的意义及其介导的多药耐药机制
刘志波,刘春玲
(1.青海大学附属医院 肿瘤内科,青海 西宁 810001;2.河北省秦皇岛市海港医院肿瘤科,河北 秦皇岛 066000)
E盒结合锌指蛋白2对非小细胞肺癌预后的意义及其介导的多药耐药机制
刘志波1,刘春玲2
(1.青海大学附属医院 肿瘤内科,青海 西宁 810001;2.河北省秦皇岛市海港医院肿瘤科,河北 秦皇岛 066000)
目的探讨E盒结合锌指蛋白2(ZEB2)对非小细胞肺癌(NSCLC)预后的意义及介导的多药耐药机制。方法选取72例NSCLC患者癌组织及癌旁组织,免疫组织化学染色检测组织ZEB2的表达,分析ZEB2表达与NSCLC患者临床资料及生存预后的关系。按照转染类型将细胞分为3组:ZEB2-siRNA组、ZEB2-NC组和空白对照组(Mock)。采用小干扰RNA(siRNA)技术降低A549细胞ZEB2表达,分别采用不同浓度顺铂、紫杉醇处理A549细胞,CCK-8法检测细胞对化疗药物的敏感性,流式细胞术检测细胞周期和凋亡率,Western blot检测细胞耐药蛋白P-糖蛋白(P-gp)、肺耐药相关蛋白(LRP)表达。结果ZEB2蛋白在癌组织阳性表达率为77.8%(56/72),癌旁组织阳性表达率为23.6%(17/72),ZEB2蛋白在癌组织阳性表达率高于癌旁组织(P<0.01)。肿瘤直径≥5 cm组ZEB2阳性表达率高于肿瘤直径<5 cm组,Ⅲ、Ⅳ期组ZEB2阳性表达率高于Ⅰ、Ⅱ组,淋巴结转移组ZEB2阳性表达率高于无淋巴结转移组,中低分化组ZEB2阳性表达率高于高分化组,各组间比较差异有统计学意义(P<0.05)。ZEB2阳性组总生存率和无病生存期低于阴性组(P<0.05)。Mock组、ZEB2-NC组和ZEB2-siRNA组细胞存活率均随化疗药物浓度增加而降低,其中ZEB2-siRNA组细胞存活率低于ZEB2-NC组(P=0.000)。经Cisplatin、Paclitaxel处理后,与Mock组、ZEB2-NC组比较,ZEB2-siRNA组细胞凋亡率增加,G0/G1期所占百分率降低,S期所占百分率升高,组间比较差异有统计学意义(P=0.000)。ZEB2-siRNA组P-gp、LRP蛋白表达水平低于Mock组和ZEB2-NC组(P=0.000),ZEB2-NC、Mock组P-gp、LRP蛋白表达比较差异无统计学意义(P>0.05)。结论NSCLC组织ZEB2表达上调,抑制ZEB2可以降低耐药蛋白P-gp、LRP表达,并逆转肺癌的多药耐药特性。
E盒结合锌指蛋白2;非小细胞肺癌;预后;多药耐药;P-糖蛋白;肺耐药相关蛋白
肺癌是世界范围内发病率和死亡率最高的恶性肿瘤,据我国最新的调查显示[1],中国肺癌发病率居各种恶性肿瘤的首位。非小细胞肺癌[2](non-small cell lung cancer,NSCLC)是肺癌最常见的分型,在肺癌中所占的比例约为85%。全身化疗是NSCLC治疗的主要措施,尽管初治NSCLC对多数化疗药物敏感性较高,但是极易出现耐药性,使肿瘤细胞发生多药耐药(multidrug resistance,MDR)而导致化疗失败。E盒结合锌指蛋白2(zinc finger E-box-binding homeobox 2,ZEB2)属于锌指转录因子家族成员之一[3],通过与 E- 钙黏附蛋白(epithelia-cadherin,E-cadherin)启动子区E-box结合,抑制E-cadherin表达,促进细胞上皮间质转化(EMT),导致肿瘤细胞发生MDR。P-糖蛋白(P-glycoprotein,P-gp)是存在于细胞膜表面的耐药糖蛋白,P-gp能够起到类似能量依赖性“药物泵”作用[4],将药物从细胞内泵出细胞外,减弱药物对肿瘤细胞的杀灭作用而诱导耐药。肺耐药相关蛋白(lung resistance-related protein,LRP)是存在于细胞核内的一种耐药蛋白[5],其将进入细胞核内的药物通过小囊泡的形式排出细胞外,使细胞核避免受到化疗药物的损伤而产生耐药。本研究以ZEB2作为研究目标,通过耐药蛋白P-gp、LRP角度探讨ZEB2诱导NSCLC多药耐药的作用机制,旨在为逆转MDR治疗NSCLC提供理论基础。
1 资料与方法
1.1 一般资料
选取2012年1月-2016年12月在青海大学附属医院行手术治疗的72例NSCLC患者作为研究对象。其中,腺癌33例,鳞癌39例;术中切除癌组织和癌旁组织(距癌组织切缘>5 cm),立即置于液氮中保存待检。本研究经本院伦理委员会批准,患者自愿捐献样本组织供研究使用,并签署知情同意书。术前未进行放疗、化疗等抗癌治疗,术后样本组织经病理检查确诊。
1.2 实验试剂
肺癌细胞系A549(购自美国菌种保藏中心),通用型SP检测试剂盒(购自北京中杉金桥生物科技公司),鼠抗人ZEB2抗体、鼠抗人P-gp抗体、鼠抗人LRP抗体(购自美国Sigma公司),鼠抗人GAPDH抗体(购自Santa Cruz公司),Trizol试剂(购自美国Invitrogen公司),Prime Script RT reagent Kit(购自TaKaRa公司),ZEB2干扰RNA序列(由上海吉玛制药技术有限公司设计合成),ZEB2-siRNA序列:5'-GUAAUGACUAGGGCUAUUA-3',阴性对照(ZEB2-NC)序列:5'-CGUAUGCGCGUACUCUAAUTT-3'。脂质体LipofectamineTM2000(购自美国Invitrogen公司)。DMEM培养基(购自Gibco公司),CCK-8试剂盒、Annexin-Ⅴ FITC凋亡检测试剂盒、Annexin-Ⅴ PE凋亡检测试剂盒及碘化丙啶PE(购自碧云天生物技术研究所)。顺铂(Cisplatin)(购自江苏豪森药业集团有限公司),紫杉醇(Paclitaxel)(购自海口市制药有限公司),流式细胞仪(购自美国BD公司),PVDF膜、ECL化学发光试剂盒(购自Millipore公司)。
1.3 方法
1.3.1 免疫组织化学染色检测组织ZEB2表达 取癌组织和癌旁组织切片,以PBS代替一抗作为阴性对照,按照免疫SP检测试剂盒说明书进行操作,实验简述如下:切片常规脱蜡至水,加热修复抗原,再滴加3%过氧化氢消除内源性过氧化物。滴加100μl ZEB2抗体,4℃孵育过夜;第2天用PBS缓冲液冲洗3次,再滴加2滴二抗,室温继续孵育30 min。加入DAB染液后苏木精复染,自来水冲洗,脱水透明后中性树胶封固,显微镜下观察,以细胞质上出现黄色或棕黄色颗粒作为阳性染色。随机选择5个视野进行阳性细胞计数,阳性结果判定参考以下标准,染色强度:0分:无染色;1分:淡黄色;2分:黄色或棕黄色;3分:棕褐色。阳性细胞比例:0分:<5%,1分:5%~25%;2分:26%~50%;3分:51%~75%;4分:>75%。免疫染色评分(immunoreactive score,IRS)以染色强度和阳性细胞比例综合判定,两者相乘,IRS评分0~12分,其中≤4分为阴性,>4分为阳性。
1.3.2 随访 术后对患者以电话或门诊复查方式规律随访,本研究随访截止时间为2017年3月20日。定义无病生存期(disease-free survival,DFS):从术后第2天开始至疾病复发、远处转移或因非小细胞肺癌死亡的时间;总生存期(overall survival,OS):从术后第2天开始至因任何原因引起死亡的时间。
1.3.3 细胞培养及分组处理 A549细胞均接种于DMEM培养基(含10%胎牛血清、100 u/ml青霉素和100u/ml链霉素),在培养箱中37℃、5%二氧化碳CO2培养。每隔2天更换1次培养基。A549细胞待融合达80%~90%时进行瞬时转染,转染前将ZEB2-siRNA或ZEB2-NC用150 μl PBS溶解,使之终浓度为20 μmol/L。按照转染类型将细胞分为3组:ZEB2-siRNA组、ZEB2-NC组和空白对照组(Mock),ZEB2-siRNA组:将 1 μl LipofectamineTM2000与1.5μl ZEB2-siRNA混匀,静置5min,再加入400 μl细胞悬液,37℃、5%CO2继续培养6 h,更换培养基,再培养48 h进行转染后其他检测操作。ZEB2-NC组加入1.5 μl ZEB2-NC,其余操作同ZEB2-siRNA组。Mock组仅加入1 μl LipofectamineTM2000脂质体,其余操作同ZEB2-siRNA组。
1.3.4 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测ZEB2 mRNA表达 取生长旺盛期MRC-5细胞及转染后A549细胞,加入1ml Trizol试剂提取总RNA。取1μl总RNA进行PCR扩增,PCR反应体系10μl:dNTP 0.5 μl,RNase inhibitor 1 μl,M-MLV 逆转录酶 0.5 μl,1×buffer 3 μl,加入ddH2O 补充至 10 μl;反应条件:95℃预变性 30 s,95℃变性 5 s,60℃退火30 s,72℃延伸2 min,总计40个循环。ZEB2正向:5'-CGCATTTCCCCCTGCTACT-3',反向:5'-TGGTCG TAGCCCAGGAATACTG-3';GAPDH 正向:5'-GAGT CAACGGATTTGGTCGT-3',反向:5'-CATGGGTGGA ATCATATTGGA-3'。定量分析结果以Ct值表示,以GAPDH作为内参,2-△△Ct作为目的基因相对表达量。
1.3.5 CCK-8法检测细胞对化疗药物的敏感性将细胞铺于96孔板中(5×103个/孔),孵育24 h后,分别加入浓度为25、50、100及200 μg/ml的顺铂和25、50、100 及 200 μg/ml的紫杉醇,37℃、5%CO2培养24 h,再向每孔中加入预先配置好的CCK-8试剂(10 μl/孔),37℃继续孵育,于450 nm处检测吸光度值。
1.3.6 流式细胞术检测细胞周期 细胞接种于96孔板中(1×106个/孔),培养24 h后加入抑制率最高浓度的顺铂、紫杉醇。继续培养24 h,收集贴壁细胞,加入70%乙醇于-20℃固定12 h,第2天弃去固定液,加入RNA酶反应30 min,再加入5 μl PI染液染色30 min,上机检测,每次实验平行操作3次。
1.3.7 流式细胞术检测细胞凋亡率 细胞接种于96孔板中(1×106个/孔),培养24 h后加入抑制率最高浓度的顺铂、紫杉醇。继续培养24 h,收集贴壁细胞,依次加入400 μl Annexin V和5 μl Annexin V-FITC染液,避光孵育15min,上机检测,每次实验平行操作3次。
1.3.8 Western blot检测细胞P-gp、LRP蛋白表达细胞接种于96孔板,培养24 h后加入抑制率最高浓度的顺铂、紫杉醇。继续培养24 h,取对数生长期细胞,弃去培养液,PBS冲洗,加入离心管中,再加入1ml RIPA裂解液置于冰浴上裂解30 min,4℃条件下离心15 min,BCA蛋白浓度试剂盒检测蛋白纯度。将20μg蛋白提取液置于10%SDS-PAGE电泳分离,常规湿法转膜,加入5%脱脂牛奶孵育封闭2 h。分别加入P-gp、LRP抗体,4℃孵育24 h。再滴加二抗37℃孵育2 h。PBS冲洗3次,按照ECL化学发光显影试剂盒显影,以β-actin作为内参照,分析目的条带相对表达量。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示。先进行正态性分布和方差齐性检验。对符合正态性分布的计量资料,多组间比较用单因素方差分析(one-way ANOVA)。方差齐时多组间比较用Bonferroni法,方差不齐时用Welch近似F检验。计数资料比较用配对设计的四格表χ2检验。生存分析用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结果
2.1 ZEB2蛋白在癌组织和癌旁组织中的表达
ZEB2阳性主要表达于细胞质,以出现黄色或棕黄色颗粒沉淀为阳性细胞(见图1)。ZEB2蛋白在癌组织阳性表达率为77.8%(56/72),癌旁组织阳性表达率为23.6%(17/72),ZEB2蛋白在癌组织阳性表达率高于癌旁组织,两组间比较差异有统计学意义(χ2=42.258,P=0.000)。

图1 ZEB2蛋白在癌组织和癌旁组织中的表达 (×200)
2.2 ZEB2表达与NSCLC患者临床资料及预后的关系
ZEB2表达与肿瘤直径、TNM分期、淋巴结转移、分化程度有关,肿瘤直径≥5 cm组ZEB2表达阳性率高于肿瘤直径<5 cm组,Ⅲ、Ⅳ期组ZEB2表达阳性率高于Ⅰ、Ⅱ组,淋巴结转移组ZEB2表达阳性率高于无淋巴结转移组,中低分化组ZEB2表达阳性率高于高分化组,各组间比较差异有统计学意义(P<0.05),见附表。72例非小细胞肺癌患者共有68例获得完整随访,中位随访时间53.8个月,其中阴性组随访15例,阳性组随访53例。生存分析显示,ZEB2阳性组总生存率和无病生存期低于阴性组(P<0.05)。见图2。
2.3 抑制ZEB2表达对顺铂、紫杉醇作用后A549细胞生存率的影响
qRT-PCR和Western blot检测结果显示,ZEB2-siRNA组ZEB2 mRNA和蛋白表达水平低于ZEB2-NC组(P<0.01),ZEB2-NC和Mock组ZEB2 mRNA和蛋白表达水平比较差异无统计学意义(P>0.05),见图3A、B。提示转染ZEB2 siRNA能够抑制A549细胞ZEB2的表达。Mock组、ZEB2-NC组和ZEB2-siRNA组细胞存活率均随顺铂、紫杉醇的浓度增加而降低,其中ZEB2-siRNA组细胞存活率低于ZEB2-NC组(P<0.01),ZEB2-NC和Mock组细胞存活率比较差异无统计学意义(P>0.05)。见图3C、D。
2.4 抑制ZEB2表达对顺铂、紫杉醇作用后A549细胞凋亡率的影响
经顺铂、紫杉醇处理后,ZEB2-siRNA组细胞凋亡率高于Mock组和ZEB2-NC组(P<0.01),ZEB2-NC、Mock组细胞凋亡率比较差异无统计学意义(P>0.05)。见图 4A、B。

附表 ZEB2表达与NSCLC临床资料的关系

图2 ZEB2表达与NSCLC患者预后的关系
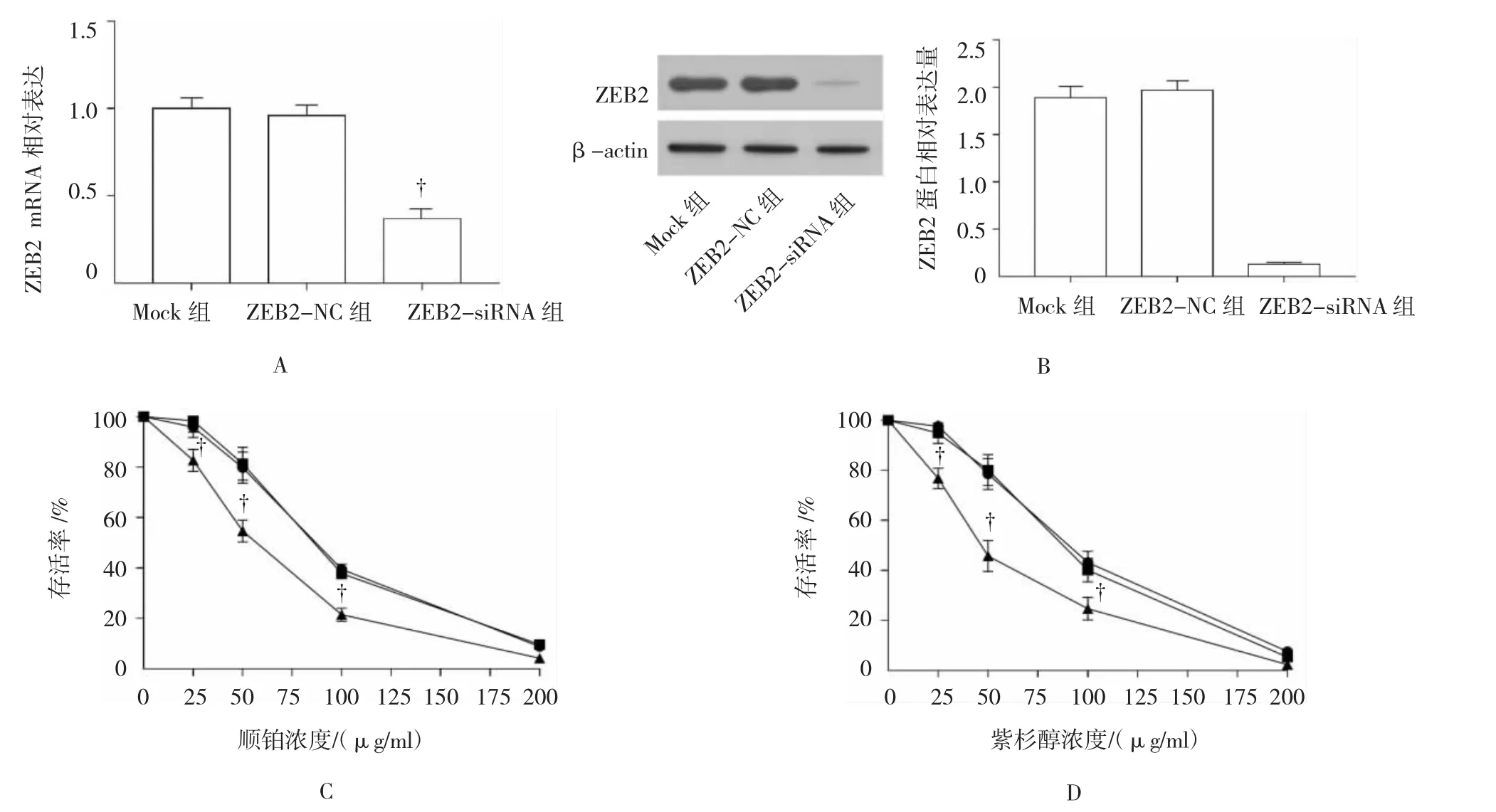
图3 不同浓度顺铂、紫杉醇作用后A549细胞生存率比较
2.5 抑制ZEB2表达对顺铂、紫杉醇作用后A549细胞周期分布的影响
经顺铂、紫杉醇处理后,与Mock组、ZEB2-NC组比较,ZEB2-siRNA组G0/G1期百分率降低,S期百分率升高,组间比较差异有统计学意义(P<0.01),ZEB2-NC和Mock组细胞周期率比较差异无统计学意义(P>0.05)。见图 5。


图4 顺铂、紫杉醇处理后A549细胞凋亡率变化
2.6 抑制ZEB2表达对顺铂、紫杉醇作用后A549细胞P-gp、LRP蛋白表达的影响
Western blot结果显示,与Mock组、ZEB2-NC组比较,ZEB2-siRNA组P-gp、LRP蛋白表达水平降低(P<0.01),ZEB2-NC 和 Mock组 P-gp、LRP蛋白表达比较差异无统计学意义(P>0.05)。见图6。
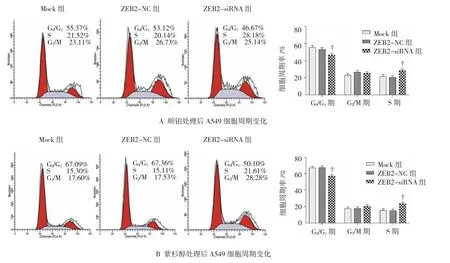
图5 顺铂、紫杉醇处理后A549细胞周期变化

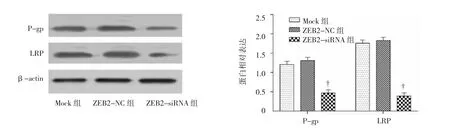
图6 顺铂、紫杉醇处理后A549细胞周期变化
3 讨论
ZEB2是snail家族重要的转录抑制因子,通过BMP和TGF-β信号途径调控下游转录因子表达,发挥相应的生物学功能。有研究[6]显示,ZEB2通过上皮-间质转化(EMT)调控肿瘤的发生、进展和转移。SI等[7]报道称乳腺癌组织ZEB2呈高表达,且ZEB2蛋白表达水平与乳腺癌分化程度、TNM分期和淋巴结转移有关。REN等[8]证实,ZEB2促进EMT的发生,导致细胞之间的黏附作用减弱,进而诱导小细胞肺癌侵袭和转移。本研究分别对NSCLC组织和癌旁组织ZEB2表达进行分析,结果显示ZEB2蛋白在癌组织阳性率高于癌旁组织,且ZEB2表达与肿瘤大小、TNM分期、淋巴结转移及分化程度有关,说明ZEB2具有NSCLC诊断和病情评估的潜在价值。有报道[9]称,ZEB2高表达能够抑制周期蛋白(cyclin),促进抑癌蛋白磷酸化,导致细胞增殖、侵袭和转移。XIA等[10]报道称ZEB2表达上调的肝癌患者生存时间明显高于ZEB2低表达者,ZEB2对恶性肿瘤的预后评估具有重要指导作用。本研究对NSCLC患者进行长期随访,结果显示ZEB2阳性组总生存期和无病生存率低于阴性组,提示癌组织ZEB表达水平可以作为NSCLC预后的重要评估指标。
手术联合全身化疗是治疗NSCLC的主要手段。目前NSCLC细胞对多数化疗药物敏感,然而重复使用化疗药物极易出现抗药性,导致发生MDR现象而使化疗失败,这亦是NSCLC远期生存率低的原因之一[11]。MADER等[12]也指出,NSCLC初期对化疗药物敏感,但很快发生耐药而导致化疗失败,患者预后差,且极易复发,5年生存率低。肿瘤细胞MDR现象成为临床亟待解决的问题。EMT是导致恶性肿瘤发生MDR的主要原因,有报道[13]显示,乳腺癌细胞ZEB2表达上调,诱导EMT转化,导致对5-FU耐药。王庆海等[14]也认为,ZEB2与卵巢癌的顺铂耐药密切相关。本研究显示抑制ZEB2表达后,顺铂、紫杉醇处理使A549细胞存活率降低,提示降低ZEB2表达可能提高A549细胞对化疗药物的敏感性。GAO等[15]采用CCK-8法分析显示,转染ZEB2-642的小细胞肺癌耐药指数降低,降低ZEB2表达可降低小细胞肺癌的耐药性。本研究利用流式细胞术分析发现,经顺铂、紫杉醇处理后,ZEB2-siRNA组细胞凋亡率高于Mock组和ZEB2-NC组,化疗药物诱导凋亡率增加也说明细胞对化疗药物的耐药性降低。国外有报道称[16],ZEB2调控的靶基因可能参与肿瘤细胞周期调节,进而诱导耐药。本研究进一步对各组细胞的周期分布进行分析,结果发现经顺铂、紫杉醇处理后,ZEB2-siRNA组G0/G1期所占百分率降低,S期所占百分率升高,说明抑制ZEB2表达促进化疗药物对A549细胞在S期的阻滞,使化疗药物对细胞的杀伤作用增加,耐药性降低。
MDR的发生机制非常复杂,耐药蛋白的表达在该过程中发挥着关键作用。P-gp和LRP是两种重要的耐药蛋白,P-gp通过将细胞内的药物泵出细胞外,导致细胞内有效药物浓度降低而诱导耐药。刘俊等[17]报道,胰腺癌细胞P-gp高表达,可以选择性的将依托泊苷、5-FU、长春新碱等化疗药物泵出细胞,使细胞发生MDR。LRP能够将进入细胞核内的化疗药物重新转运至小囊泡内排出细胞外,使细胞核DNA免受化疗药物的损伤而产生耐药。梁梦等[18]报道,化疗耐药型卵巢癌患者LRP阳性率高于高于化疗敏感型,LRP也是预测卵巢癌化疗敏感的独立预后因素。但是在非小细胞肺癌中,关于ZEB2和P-gp、LRP关系的研究尚未见报道。本研究显示,经过顺铂、紫杉醇处理后,ZEB2-siRNA组P-gp、LRP蛋白表达水平降低,提示ZEB2可能通过P-gp和LRP蛋白介导A549细胞发生MDR。但是ZEB2与P-gp、LRP之间并不是孤立事件,很可能通过某种信号通路进行转导而诱导耐药,限于研究的篇幅,本研究暂未探讨ZEB2与P-gp、LRP之间的信号转导通路,这也是笔者后续研究的重点。
综上所述,NSCLC组织ZEB2表达上调,抑制ZEB2可以降低耐药蛋白P-gp、LRP表达,并逆转肺癌的多药耐药特性。
[1]昌盛,代敏,任建松,等.中国2008年肺癌发病、死亡和患病情况的估计及预测[J].中华流行病学杂志,2012,33(4):391-394.
[2]HEUSCH P, KÖHLER J, WITTSACK H J, et al. Hybrid [18F]-FDG PET/MRI including non-Gaussian diffusion-weighted imaging(DWI): Preliminary results in non-small cell lung cancer(NSCLC)[J]. Eur J Radiol, 2013, 82(11): 2055-2060.
[3]KUMAR P A, KOTLYAREVSKA K, DEJKHMARON P, et al.Growth hormone (GH) -dependent expression of a natural antisense transcript induces zinc finger E-box-binding homeobox 2(ZEB2) in the glomerular podocyte: a novel action of gh with implications for the pathogenesis of diabetic nephropathy[J]. J Biol Chem, 2010, 285(41): 31148-31156.
[4]邓镇,罗淼珊,赵元淑,等.GluN2A抑制剂对癫痫持续状态大鼠脑内P-糖蛋白表达的影响[J].华中科技大学学报(医学版),2014,13(2):168-172.
[5]MATSUNAGA T, YAMAJI Y, TOMOKUNI T, et al. Nitric oxide confers cisplatin resistance in human lung cancer cells through upregulation of aldo-keto reductase 1B10 and proteasome[J]. Free Radic Res, 2014, 48(11): 1371-1385.
[6]曹永梅,吕毅,刘玉静,等.miR-200及其靶基因ZEB1/2在急性肺损伤后早期肺纤维化中上皮-间质转化(EMT)过程[J].昆明医科大学学报,2016,37(12):1-7.
[7]SI W, HUANG W, ZHENG Y, et al. Dysfunction of the Reciprocal Feedback Loop between GATA3-and ZEB2-Nucleated Repression Programs Contributes to Breast Cancer Metastasis [J].Cancer Cell, 2015, 27(6): 822-836.
[8]REN D, WANG M, GUO W, et al. Double-negative feedback loop between ZEB2 and miR-145 regulates epithelial-mesenchymal transition and stem cell properties in prostate cancer cells[J].Cell Tissue Res, 2014, 358(3): 763-778.
[9]TECHASEN A, NAMWAT N, LOILOME W, et al. Tumor necrosis factor-α modulates epithelial mesenchymal transition mediators ZEB2 and S100A4 to promote cholangiocarcinoma progression[J]. J Hepatobiliary Pancreat Sci, 2014, 21(9): 703-711.
[10]XIA L, HUANG W, TIAN D, et al. Forkhead box Q1 promotes hepatocellular carcinoma metastasis by transactivating ZEB2 and VersicanV1 expression[J]. Hepatology, 2014, 59(3): 958-973.
[11GHOSH G, YAN X, LEE A G, et al. Quantifying the sensitivities of EGF receptor (EGFR) tyrosine kinase inhibitors in drug resistant non-small cell lung cancer (NSCLC) cells using hydrogel-based peptide array[J]. Biosens Bioelectron, 2010, 26(2):424-431.
[12]MADER R M, FOERSTER S, SARIN N, et al. NSCLC cells adapted to EGFR inhibition accumulate EGFR interacting proteins and down-regulate microRNA related to epithelial-mesenchymal transition[J]. Int J Clin Pharmacol Ther, 2014, 52(1):92-94.
[13]AHMAD A, ABOUKAMEEL A, KONG D, et al. Phosphoglucose isomerase/autocrine motility factor mediates epithelial-mesenchymal transition regulated by miR-200 in breast cancer cells [J].Cancer Res, 2011, 71(9): 3400-3409.
[14]王庆海,蒋惠萍,邓晓洁,等.上皮性卵巢癌中ZEB2和C-myc蛋白的表达及临床意义[J].南方医科大学学报,2015,14(12):1765-1769.
[15]GAO Y, ZHANG W, HAN X, et al. YAP inhibits squamous transdifferentiation of Lkb1-deficient lung adenocarcinoma through ZEB2-dependent DNp63 repression[J]. Nat Commun, 2014, 5(14):4629.
[16]CHU P Y, HU F W, YU C C, et al. Epithelial-mesenchymal transition transcription factor ZEB1/ZEB2 co-expression predicts poor prognosis and maintains tumor-initiating properties in head and neck cancer[J]. Oral Oncol, 2013, 49(1): 34-41.
[17]刘俊,黄陈,孙晶,等.HIF-1α、P-gp在胰腺癌中的表达及其临床病理学的意义[J].中华肝胆外科杂志,2011,17(1):36-38.
[18]梁梦,周英琼,郭芳,等.GST-π、ERCC1、MRP和LRP在卵巢癌组织中的表达及意义[J].中国现代医学杂志,2012,22(5):10-14.
(王荣兵 编辑)
Prognostic value of Zinc finger E-box-binding homeobox 2 in non-small cell lung cancer and its role in multidrug resistance
Zhi-bo Liu1,Chun-ling Liu2
(1.Department of Oncology,Affiliated Hospital of Qinghai University,Xining,Qinghai 810001,China;2.Department of Oncology,Qinhuangdao Haigang Hospital,Qinhuangdao,Hebei 066000,China)
ObjectiveTo investigate the prognostic value of Zinc finger E-box-binding homeobox 2(ZEB2)in non-small cell lung cancer (NSCLC)and its role in multidrug resistance.MethodsInin vivostudy,a total of 72 patients diagnosed with NSCLC were included in this study,and tumor tissue and adjacent normal tissue samples of them were collected. Expression of ZEB2 was measured by Immunohistochemical staining.Potential relationship between ZEB2 and clinic survival data was analyzed.Inin vitrostudy,genetic knockdown models of ZEB2 in A549 cells line were established by siRNA.Cells were divided into 3 groups:ZEB siRNA group,sequence control group,and negative control (Mock)group.Drug cytotoxicity was measured by CCK-8 assays after co-incubation with Cisplatin or Paclitaxel.Cell cycle and apoptosis rate was measured by flow cytometry.Expression levels of p-glycoprotein (P-gp)and LRP was determined by Western blot.ResultsZEB2 positive cells in cancer tissue was significantly increased when compared with normal tissue (77.8%vs 23.6%,P=0.000).ZEB2 positive cells in group with tumor diameter larger than 5 cm,Ⅲ~Ⅳ phase,lymphatic metastasis,and poor and middle differentiation were dramatically increased when compared with those in group with tumor diameter<5 cm,Ⅰ~Ⅱ phase,metastasis-free,and well differentiation (P<0.05),respectively.Overall survival and cancer-free survival in ZEB2 positive group was significantly lower than those in ZEB2 negative group (P<0.05).Cellular survival of A549 cell line in Mock group,ZEB2-NC group and ZEB2-siRNA group was significantly decreased with treatment of Cisplatin or Paclitaxel in a dose-dependent manner.Cellular survival of A549 cell line in ZEB2-siRNA group was significantly lower than that of Mock group and ZEB2-NC group (P=0.000).Flow Cytometry data suggested that,after treatment with Cisplatin and Paclitaxel,cell apoptosis and S phase ratio increased while G0/G1phase ratio decreased significantly compared with those in Mock group and ZEB2-NC group (P=0.000).Expression levels of P-gp,LRP in ZEB2-siRNA group were significantly downregulated compared with Mock group and ZEB2-NC group (P=0.000)while no significant difference of P-gp,LRP protein between Mock group and ZEB2-NC group (P>0.05).ConclusionZEB2 are up-regulated in NSCLC tissue,and inhibition of ZEB2 reverses the P-gp-and LRP-dependent multidrug resistance of NSCLC.
zinc finger e-box-binding homeobox;non-small cell lung cancer;prognosis;multidrug resistance;p-glycoprotein;lung resistance-related protein
R734.2
A
10.3969/j.issn.1005-8982.2017.27.008
1005-8982(2017)27-0037-08
2017-05-17

