改性凹凸棒石对水溶液中Pb(II)吸附性能研究
张 婕, 蔡 丽, 王景涛, 陈卫航
(郑州大学 化工与能源学院,河南 郑州 450001)
改性凹凸棒石对水溶液中Pb(II)吸附性能研究
张 婕, 蔡 丽, 王景涛, 陈卫航
(郑州大学 化工与能源学院,河南 郑州 450001)
以3-氨丙基乙氧基硅烷(APTES)为改性剂,成功地合成改性凹凸棒石(ATP),并研究了其对水溶液中Pb(II)的吸附性能.主要采取SEM、XRD、BET、FTIR和TGA对改性前后ATP的物理结构和化学组成进行测试分析;通过单因素静态实验,探讨了吸附时间、吸附剂用量、温度、Pb(II)初始浓度等因素对改性ATP吸附Pb(II)性能的影响.结果表明吸附时间80 min,吸附剂用量0.35 mg·L-1,温度35 ℃,pH为6,初始浓度100 mg·L-1时平衡吸附量为241.4 mg·g-1.
凹凸棒石; 表面改性; 吸附性能; Pb(II)
0 引言
冶金、电镀、化工、石油精炼等工业废水中含有铅、镉、汞多种有害重金属离子.其中铅主要经消化道及呼吸道被人体吸收,对造血系统、神经系统、消化系统造成损害.治理废水污染的传统方法虽有很多,但吸附法因其高效、简便、易操作而被广泛采用.
凹凸棒石(ATP)是一种含有晶质水合镁、铝酸盐的粘土矿物[1].ATP比表面积大、来源广、成本低、储量丰富,尤其在我国江苏盱眙县储量为8.9亿吨.ATP在重金属离子吸附、有机污染物吸附等废水处理领域得到越来越广泛的研究和重视.天然ATP是一种常见、廉价的吸附材料,但含有蒙脱土、石英、白英石及碳酸盐矿物等杂质,对Pb(II)的吸附量较低.笔者选用ATP,除对其常规提纯处理;还首次在表面接枝APTES,对Pb(II)的吸附效果显著.此改性过程为一步改性,过程简单,影响因素较少.
1 实验原理及方法
1.1实验试剂及仪器
凹凸棒石(工业级,江苏省淮源矿业有限公司);盐酸(分析纯,烟台市双双化工有限公司);3-氨丙基乙氧基硅烷APTES(分析纯,南京道宁化工有限公司);硝酸(分析纯,洛阳市化学试剂厂);硝酸铅(分析纯,天津市科密欧化学试剂有限公司).
TAS-986F原子吸收光谱仪(北京普析通用仪器公司).
1.2ATP的提纯
取适量ATP经溶解,高温煅烧[2],1 mol/L盐酸,80 ℃活化约180 min后,用蒸馏水洗涤至pH值约为6,30 ℃真空干燥,用粒径为φ178 mm的分子筛进行筛分.
1.3ATP的改性
在50 mL环己烷中加入提纯ATP,该悬浮液在常温下超声10 min后,在快速搅拌的条件下按m(APTES)∶m(ATP)=1∶1的比例加入APTES,60 ℃回流20 h,静置后用无水乙醇离心洗涤,60 ℃真空干燥.
1.4样品的表征
SEM采用日本电子株式会社生产的JSM-7500F型扫描电子显微镜.
XRD采用日本理学公司的D/MAX-RA型X射线粉末衍射分析仪.
比表面积测试(BET)采用GS-100型气相层析仪,孔分布测定采用经典N2吸附-脱附等温线,测试条件:350 ℃, 4 h, 133.3×10- 5Pa.
红外光谱(FTIR)采用Thermo Nicolet IR200型傅立叶红外光谱仪对ATP进行红外光谱分析.
热重分析(TGA)采用TG-DTA对改性前后ATP进行热重分析,升温速率为10 ℃/min.
1.5吸附实验
取20 ml的Pb(II)溶液,加入吸附剂,恒温振荡离心,取上层清液用原子吸收分光光度计测Pb(II)浓度.ATP对Pb(II)的单位吸附量和去除率可按公式(1)和(2)计算.

(1)

(2)
式中:C0为初始浓度mg·L-1;Ce为平衡浓度,mg·L-1;V为溶液的体积,L;m为吸附剂的质量,g;qe为平衡吸附量,mg·g-1;R为去除率,%.
对吸附剂用量考察时,取浓度均为100 mg·L-1的Pb(II)溶液,pH值为3.5,吸附剂用量在0.25~1.5 mg·L-1,25 ℃恒温振荡180 min.对平衡浓度和吸附温度考察时,初始浓度为10 ~500 mg·L-1,pH值为3.5,吸附剂用量为0.35 mg·L-1,在25、35、45 ℃振荡180 min.对pH值考察时,初始浓度为100 mg·L-1,pH值为1~6,吸附剂用量0.35 mg·L-1,25 ℃恒温振荡180 min.对吸附时间考察时,初始浓度100 mg·L-1,pH值为3.5,吸附剂用量0.35 mg·L-1,25 ℃下振荡0~300 min.
2 结果与讨论
2.1ATP提纯
2.1.1 SEM分析
提纯前后ATP扫描电镜(SEM)分析如图1所示.从图1可以看出,天然ATP表面杂乱无章且相互聚集,块状结构较多,针棒状较少.提纯后ATP整体分布变得疏松,晶体间矿物的连接物明显减少,针棒状较多.这表明高温煅烧和酸处理能够去除ATP表面杂质,去除碳酸盐,ATP中八面体阳离子和少量四面体溶解,可导致ATP孔道疏通和孔径变大,比表面积增大,活性位点增加[3].
2.1.2 BET分析
对提纯ATP进行BET测试,由图2看出,N2吸附-脱附等温线在低压(P/P0lt;0.45)时,N2的吸附量缓慢增加,说明是单分子层吸附[2-3];当压力相当高时(P/P0gt;0.9)吸附量又急剧增加,出现毛细凝结现象,形成滞留回环,这发生在中孔吸附剂[4].天然ATP比表面积约9.6~36 m2·g-1,通过提纯ATP比表面积增大为170.58 m2·g-1,说明提纯处理使其比表面积得到大幅度的增加,能提高ATP的吸附性能.

图1 天然ATP (a)和提纯ATP (b)的扫描电镜Fig.1 SEM imagine of raw ATP (a) and purified ATP (b)

图2 提纯ATP的N2吸附-脱附等温线Fig.2 N2 adsorption-desorption isotherm of purified ATP
2.1.3 XRD分析
天然ATP和提纯ATP进行XRD分析如图2所示,ATP主要特征衍射峰的位置(2θ=8.34°、27.5°和35.22°)在提纯前后没有明显变化.提纯ATP的石英(2θ=19.8°、26.58°和40.1°),白英石(2θ=29.06°)和蒙脱土(2θ=16.02°)[4]特征衍射峰消失,并且衍射峰(2θ=13.56°和20.69°)强度增强,这是因为天然ATP表面杂质太多,使其表面特征衍射峰被掩盖,通过提纯处理可使其显露出来.
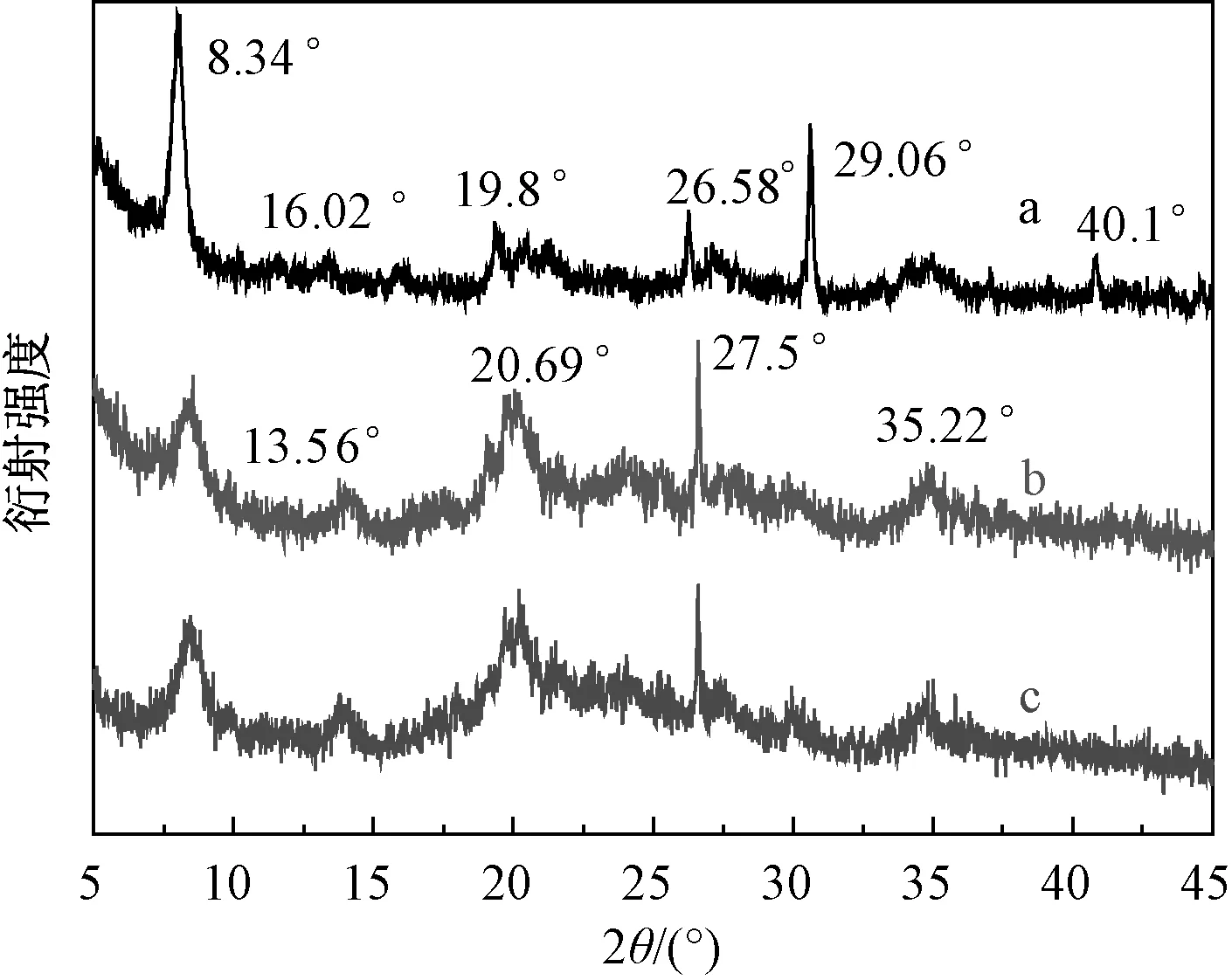
图3 天然ATP(a),提纯ATP(b)和改性ATP(c)的XRD谱图Fig.3 XRD patterns of raw ATP(a), purified of ATP(b) and modified of ATP(c)
2.2ATP的改性
2.2.1 FT-IR分析
提纯ATP和改性ATP红外光谱分析如图4所示, 与提纯ATP红外谱图相比,改性ATP红外谱图在3 442.7 cm-1、1 640.35 cm-1处的吸收峰强度明显减弱,这说明APTES与ATP表面的结合水接触,发生脱水缩合,形成Si—O—Si,实现接枝.在2 923.46 cm-1出现新的吸收峰[5],这是APTES上—CH2—的不对称伸缩振动峰,说明ATP上的—OH基团成功地与APTES发生了反应.
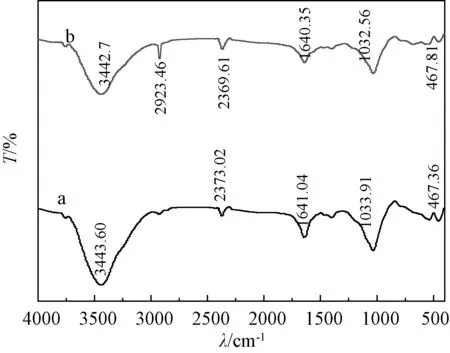
图4 提纯ATP(a)和改性ATP(b)的红外光谱Fig.4 FT-IR patterns of purified ATP (a) and modified ATP(b)
2.2.2 TGA分析
对提纯ATP和改性ATP进行热失重分析,结果如图5所示.在热重分析前,样品都经过了高温400 ℃煅烧,所以提纯ATP的失重率很低,在700 ℃达到失重平衡,失重率仅为4.564 5%.但是改性ATP失重现象非常明显,这是因为改性ATP表面接枝高分子量APTES,在高温下有机物分解[6],失重率增大,在达到失重平衡时,失重率达23.17%,说明APTES成功地接枝ATP表面.
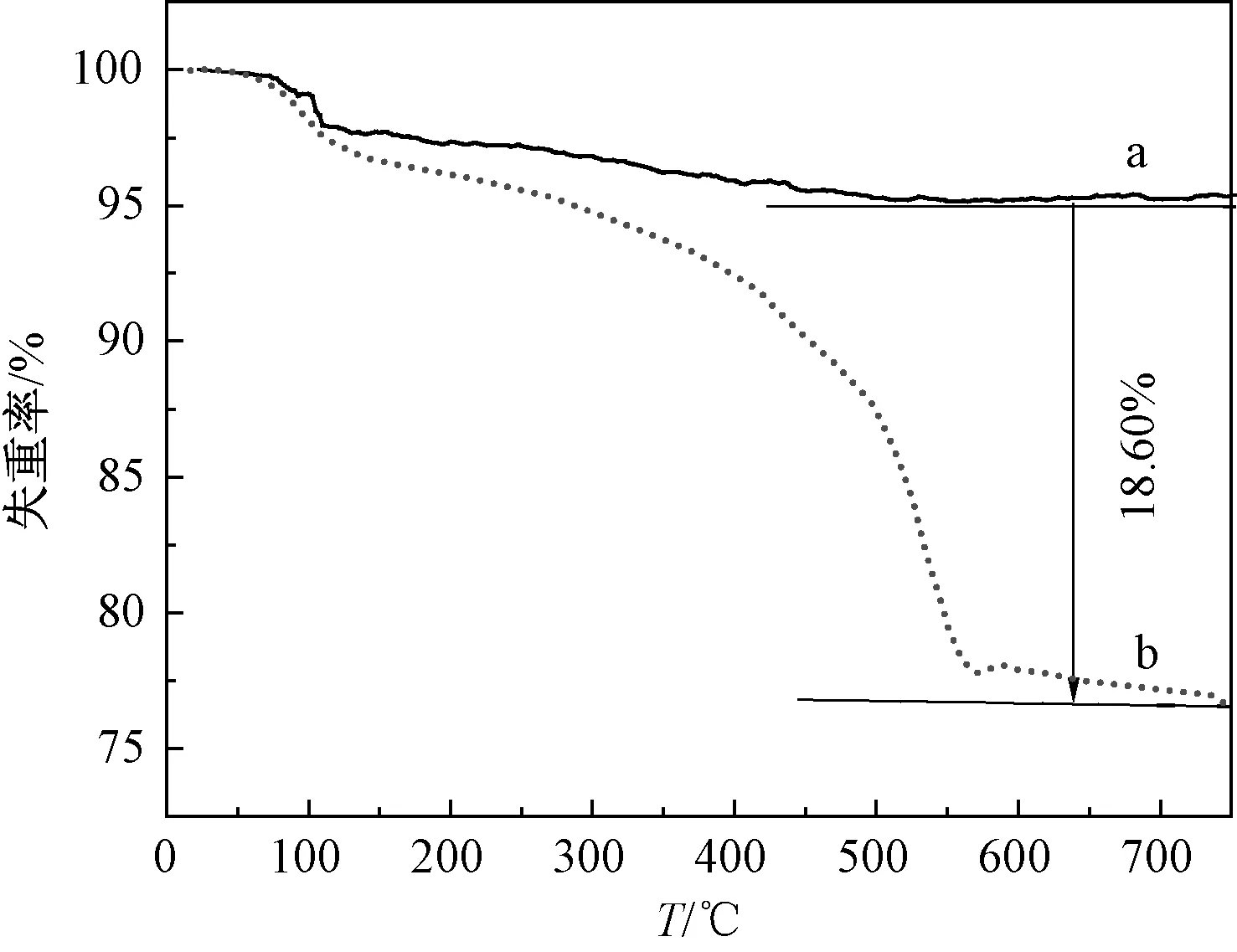
图5 提纯ATP(a)和改性ATP(b)的热失重谱图Fig.5 TGA patterns of purified ATP(a) and modified ATP(b)
2.3改性ATP对Pb(II)吸附性能测试
在适宜的同等条件下比较改性前后的吸附量如表1所示.由表1可以看出,改性ATP吸附量是未改性ATP吸附量的3.8倍,这说明改性效果较为明显,同时也可以应用于其他离子的吸附.从表2可以看出,改性ATP吸附性能明显优于其他传统吸附剂,这对废水处理有很好的发展前景.
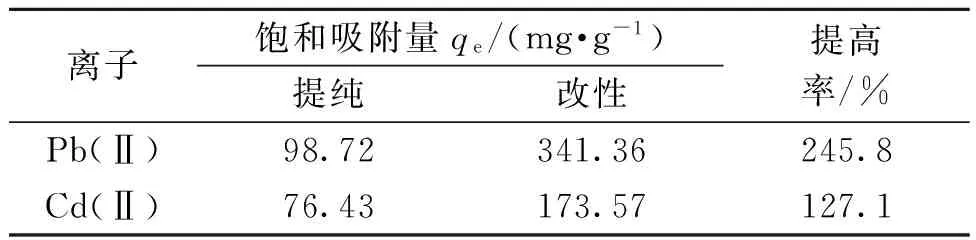
表1 改性前后吸附性能对比
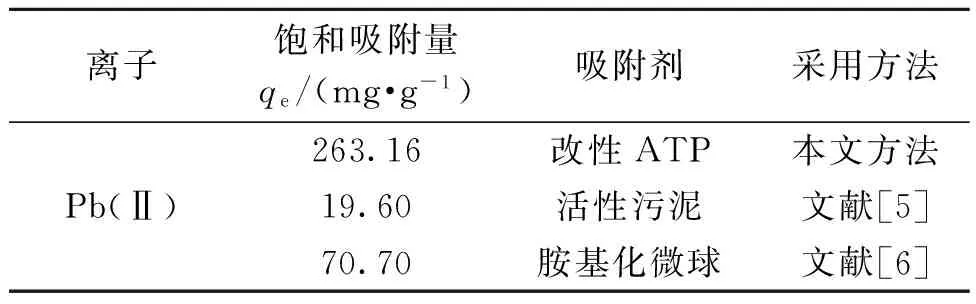
表2 改性凹凸棒与其他传统吸附剂吸附性能对比Tab.2 Comparison of adsorption capacities of modifiedATP and other adsorbents
2.3.1 吸附剂用量的影响
吸附剂用量对吸附Pb(II)的影响如图6所示.可以看出,随着改性ATP用量增加,吸附量逐渐减小,去除率却逐渐增加.这是因为溶液中的Pb(II)浓度一定,改性ATP的用量较小,单位质量ATP就会被周围较多的Pb(II)包围,因此吸附量大.但吸附剂的用量过小,改性ATP表面的氨基官能团数目有限,与Pb(II)螯合作用的机会少,所以Pb(II)去除率较低.但是当改性ATP用量增加,可以提供更多的吸附位点,其表面可以与Pb(II)结合的官能团数目增多,但是溶液中Pb(II)浓度是一定的,因此吸附量降低,去除率增大,溶液中Pb(II)去除率最终达到平衡.为了保证实验吸附量和去除率都达到一定的水平,取0.35 g·L-1吸附剂,此时吸附量为200 mg·g-1,去除率R为85%.
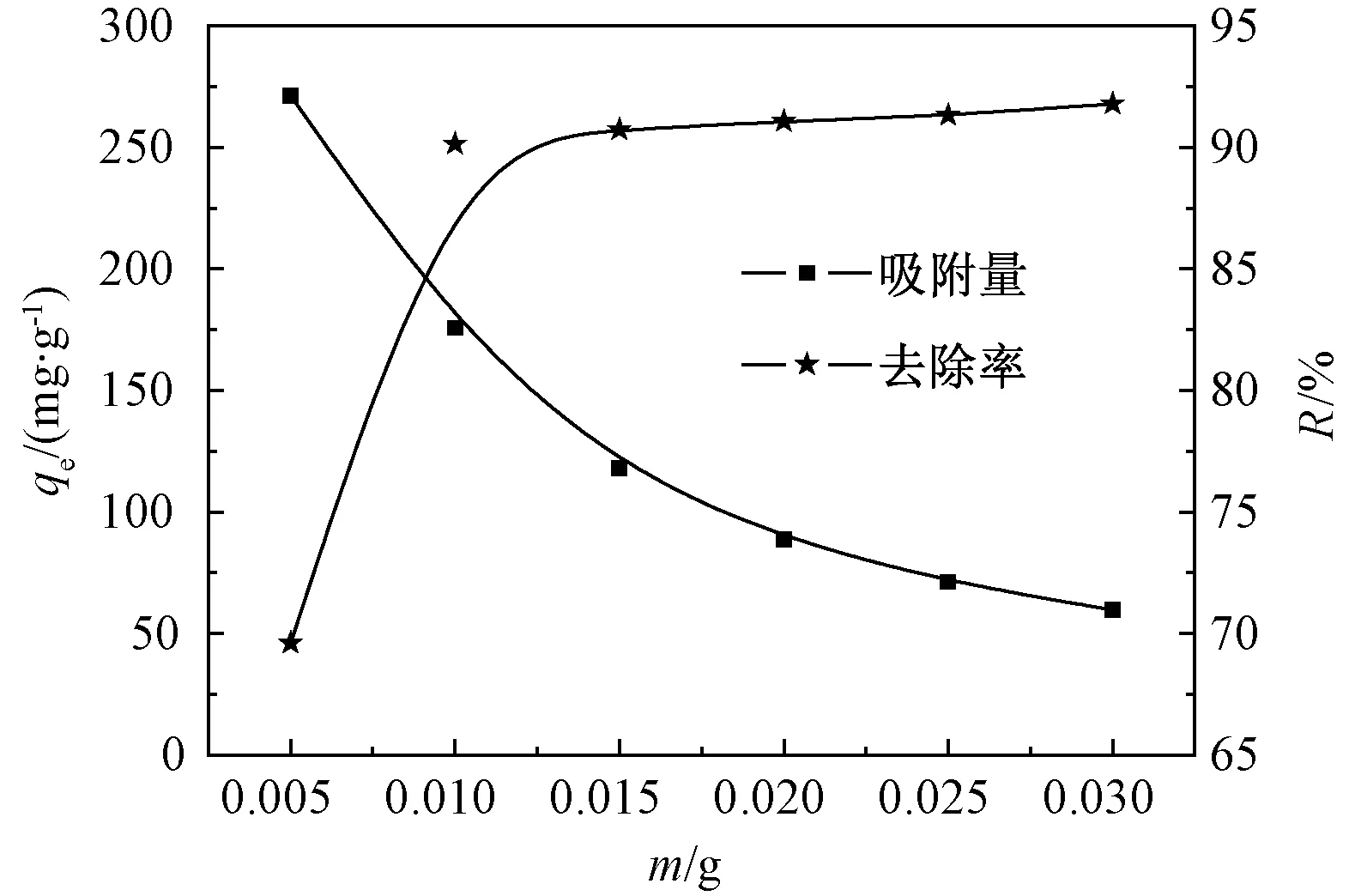
图6 改性ATP用量的影响Fig.6 Effect of modified ATP dosage on adsorption
2.3.2 吸附时间的影响
吸附时间对改性ATP吸附的影响如图7所示.可以看出,改性ATP对Pb(II)吸附初期是快速吸附过程,50 min之后吸附速率明显减慢,直至80 min趋于吸附平衡.这是因为初始阶段溶液浓度大,传质推动力就大,吸附剂表面的空闲活性位点多,与Pb(II)接触的机率就大,所以吸附速率就快.随后改性ATP表面的空闲活性位点减少,使得吸附速率下降.
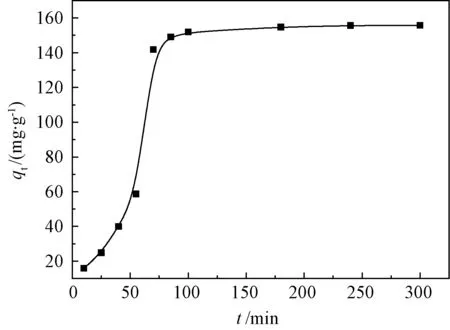
图7 吸附时间的影响Fig.7 Effect of contact time on adsorption
2.3.3 初始浓度和温度的影响
初始浓度和温度对吸附Pb(II)的影响如图8所示.可以看出,在同一温度下,改性ATP吸附量随着溶液中Pb(II)初始浓度增大而增大,这是因为ATP用量一定时,溶液中Pb(II)初始浓度越大,其与吸附剂的碰撞机会大,吸附量增大.当溶液中的Pb(II)的初始浓度增大到一定值时,吸附量趋于平缓,这是因为改性ATP表面的氨基与Pb(II)发生螯合作用趋于饱和状态.此外,改性ATP对Pb(II)的吸附量随着吸附温度的升高而增大,这说明该吸附过程是吸热过程,升高温度有利于吸附过程.

图8 初始浓度和温度对吸附的影响Fig.8 Effect of initial concentration and temperature on adsorption
2.3.4 溶液pH值的影响
溶液pH值能够改变溶液中Pb(II)的存在状态和数量,故选用pH值范围为1~6.从图9看出:随着pH值的增大,吸附量逐渐增大,在pH值为6时达到最大吸附量329.57 mg·g-1;在pH值为1时,吸附量较低.这是因为当溶液的pH值过低,改性ATP表面接枝的氨基基团上的氮原子被高度质子化,无法再与Pb(II)发生螯合作用,使吸附量偏低.
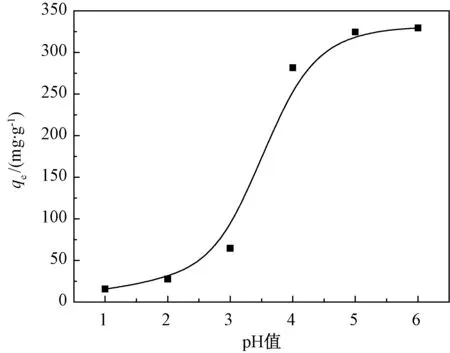
图9 溶液pH的影响Fig.9 Effect of pH on adsorption
3 结论
笔者主要研究了ATP的提纯、改性和吸附性能三部分内容.主要由XRD、SEM、BET、FTIR、TGA对天然ATP,提纯ATP和改性ATP进行表征.结果表明,提纯ATP的杂质明显减少,比表面积增大,成功地在ATP表面接枝上大量的氨基,对Pb(II)具有良好的吸附性能,吸附能力明显高于未改性ATP.
[1] 张彦灼,任珺,陶玲,等.凹凸棒石粘土的物化性质研究进展[J].中国非金属矿工业导刊, 2013(1): 24-26.
[2] 王秀芳,田勇,张会平.高比表面积煤质活性炭的制备与活化机理[J].化工学报,2009, 60(3): 733-737.
[3] 何余生.李忠.奚红霞,等.气固吸附等温线的研究进展[J].离子交换与吸附,2004, 20(4): 376-384.
[4] MANGUN C L,DEBARR J A,ECONOM Y J.Adsorption of sulfur dioxide on ammonia-treated activated carbon fiber[J].Carbon, 2001, 39(11): 1689-1696.
[5] MIRZABE G H,KESHTKAR A R. Selective sorption of U(VI) from aqueous so-lutions using a novel aminated Fe3O4/SiO2/PVA nanofiber adsorbent prepared by electro-spinning method[J].J Radioanal Nucl Chem,2015, 303(1): 561-576.
[6] 张婕,尚成江,陈卫航,等.胺基化杂化微球对溶液中Cu和Pb(Ⅱ)的吸附[J].郑州大学学报(工学版), 2015, 36(5): 1-5.
StudyonAbsorptionofPb(II)fromAqueousSolutionbyModifiedATP
ZHANG Jie, CAI Li, WANG Jingtao, CHEN Weihang
(School of Chemical Engineering and Energy,Zhengzhou University,Zhengzhou 450001,China)
With APTES as a modifier, the modified ATP was successfully prepared. And the adsorption of Pb(II) from aqueous solution by modified ATP was studied. The physical structure and chemical composition of raw ATP, purified ATP and modified ATP were characterized by SEM、XRD、BET、FTIR and TGA, respectively. The effects of contact time、the dosage of adsorbent、temperature and initial concentration on the adsorption property for Pb(II) were investigated through single factor static experiments. The results showed that the equilibrium adsorption capacity of Pb(II) was 241.4 mg·g-1under the following conditions: contact time 80 min、the dosage of adsorbent 0.35 g·L-1、temperature 35℃、pH 6 and initial concentration 100 mg·L-1.
attapulgite(ATP); modified; adsorption; Pb(II)
2017-06-16;
2017-08-27
国家自然科学基金资助项目(21206151)
张婕(1970— ),女,河南郑州人,郑州大学副教授,博士,主要从事化学分离工程研究,E-mail: zhanglianbi@zzu.edu.cn.
1671-6833(2017)06-0083-05
O647.3
A
10.13705/j.issn.1671-6833.2017.06.012

