盐酸贝那普利咀嚼片在犬体内的生物等效性研究
刘 欣,魏丽娟,宋婷婷*,瞿红颖,贾 兴,耿智霞,魏占勇,邹 明,陈 杰
(1.河北远征药业有限公司,石家庄 050041;2.河北省兽药工程技术研究中心,石家庄 050041;3. 青岛农业大学,山东青岛 266000;4. 浙江省余桃市梨洲街道办事处,浙江余桃 315400)
盐酸贝那普利咀嚼片在犬体内的生物等效性研究
刘 欣1,2,魏丽娟1,2,宋婷婷1,2*,瞿红颖1,2,贾 兴1,2,
耿智霞1,2,魏占勇1,2,邹 明3,陈 杰4
(1.河北远征药业有限公司,石家庄 050041;2.河北省兽药工程技术研究中心,石家庄 050041;
3. 青岛农业大学,山东青岛 266000;4. 浙江省余桃市梨洲街道办事处,浙江余桃 315400)
为研究国产和进口盐酸贝那普利片在犬体内的药代动力学和生物等效性,将20只健康比格犬随机分成2组,采用双周期交叉试验设计,按0.5 mg/kg体重分别单剂量口服受试产品和参比产品。采用UPLC-MS/MS法测定血浆中盐酸贝那普利及贝那普利拉的浓度,利用WinNonlin5.2.1软件计算主要药动学参数,并评价两种产品的生物等效性。结果显示,受试产品和参比产品中盐酸贝那普利Tmax分别为0.85±0.36和0.98±0.40 h;Cmax分别为65.85±31.14和52.02±25.79 ng/mL;AUC0-t分别为46.98±29.77和40.54±20.76 h·ng·mL-1;AUC0-∞分别为48.28±30.05和41.54±20.85 h·ng·mL-1;受试产品和参比产品的贝那普利拉Tmax分别为1.78±0.55和1.90±0.72 h;Cmax分别为63.05±28.44和55.29±36.01 ng/mL;AUC0-t分别为249.09±87.90和212.50±90.03 h·ng·mL-1;AUC0-∞分别为274.15±93.86和264.42±161.86 h·ng·mL-1。受试产品和参比产品的Tmax、Cmax、AUC0-t和AUC0-∞均无显著性差异(Pgt;0.05)。双单侧t检验及90%置信区间结果均提示两种制剂生物等效,临床上可相互替代。该试验可为兽医临床安全使用该药提供科学依据。
盐酸贝那普利;贝那普利拉;生物等效性;超高效液相色谱串联质谱
盐酸贝那普利(Benazepril hydrochloride)是一种不含巯基的长效血管紧张素转化酶抑制剂,是目前治疗高血压的较新首选药物,疗效确切,副作用小,肝肾功能不全的患病动物使用安全,同时对心脏病、糖尿病、肾脏疾病亦有疗效。该药口服吸收迅速,在体内水解后形成二羧酸的活性代谢产物贝那普利拉(Benazeprilate)而起作用,其活性约是盐酸贝那普利的1000倍[1]。因此,盐酸贝那普利在兽医临床上有着良好的应用前景。
在研究盐酸贝那普利和贝那普利拉的临床药动学时,由于给药剂量小,生物利用度低等特点,导致血药浓度低,需要建立一种快速灵敏的测定方法。早期采用GC-MS法虽然比较灵敏[2],但因需要衍生化前处理,现在很少应用。近年随着质谱技术应用的普及,目前多采用HPLC-MS/MS法分析检测生物样品中的盐酸贝那普利和贝那普利拉的含量,但在面对药动学研究的大批量样品时,HPLC-MS/MS仍然比较费时[3-6]。本试验建立的UPLC-MS/MS法[7]同时检测盐酸贝那普利和贝那普利拉,5 min即可分析一个样品,而且具有分离良好,峰形对称,分析准确快捷等特点。通过对国产盐酸贝那普利咀嚼片在健康犬体内的药代动力学特征研究,与诺华公司生产的盐酸贝那普利风味片进行比较及生物等效性分析,为兽医临床安全使用该药提供科学的依据。
1 材 料
1.1 仪器 超高效液相色谱-串联四级杆质谱仪:Waters UPLC Xevo TQ-S,美国Waters公司,配Masslynx V4.1软件;保护柱:AQUITY UPLC BEH HILIC( 2.1 mm×5 mm,1.7 μm) waters公司;色谱柱:AQUITY UPLC BEH C18 ( 2.1 mm×50 mm,1.7 μm),waters公司;CT15RT型台式高速冷冻离心机:德国Beckman公司;IKA MS.3涡旋混合器:德国IKA公司。电子分析天平:BSA224S型,赛多利斯科学仪器(北京)有限公司;数控超声波清洗器:KQ-400KKDE型,昆山市超声仪器有限公司;塑料离心管:1.5 mL、2 mL、5 mL和10 mL,德国普兰德公司;微孔滤膜:有机相针式尼龙66微孔滤膜,孔径0.22 μm,杉羽(天津)科技有限公司。
1.2 药品与试剂 受试品:盐酸贝那普利咀嚼片,批号:20150401,每片含盐酸贝那普利5 mg,河北远征禾木药业有限公司提供。参比品:盐酸贝那普利风味片,批号:24537,每片含盐酸贝那普利5 mg,诺华公司提供。盐酸贝那普利标准品:含量:99.8%,批号:100768-201403;贝那普利拉标准品:含量:95.9%,批号:100771-201001;马来酸依那普利标准品:含量:99.8%,批号:100705-201203,均购买自中国食品药品检定研究院。乙腈、甲醇,均为色谱纯,美国Sigma-aldrich公司;甲酸为色谱纯,天津市科密欧化学试剂有限公司;超纯水。
1.3 试液的配制
1.3.1 盐酸贝那普利储备液配制 精密称取盐酸贝那普利对照品5.01 mg(相当于盐酸贝那普利5.00 mg),置于50 mL量瓶中,用甲醇溶解并定容至刻度,摇匀,配成浓度为100 μg/mL的盐酸贝那普利储备液,-20 ℃保存,有效期6个月。
1.3.2 贝那普利拉储备液的配制 精密称取贝那普利拉对照品5.21 mg( 相当于贝那普利拉5.00 mg),置于50 mL量瓶中,用甲醇溶解并定容至刻度,摇匀。配成浓度约100 μg/mL的贝那普利拉储备液,-20 ℃保存,有效期6个月。
1.3.3 盐酸贝那普利和贝那普利拉混合工作液的配制 准确吸取盐酸贝那普利和贝那普利拉储备液各100 μL于2 mL EP管中,加入800 μL甲醇稀释成浓度为10 μg/mL的混合工作液,再依次稀释浓度为5、2、1、0.5、0.2、0.1、0.05、0.02、0.01 μg/mL的混合标准工作液。现用现配。
1.3.4 马来酸依那普利(内标)储备液的配制 精密称取马来酸依那普利对照品5.01mg (相当于马来酸依那普利5.00 mg),置于50 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀。配成浓度约100 μg/mL的马来酸依那普利储备液,-20 ℃保存,有效期6个月;100 ng/mL马来酸依那普利:取100 μL马来酸依那普利储备液于100 mL容量瓶中,加入乙腈定容至刻度。
2 方 法
2.1 试验动物 20只成年健康比格犬,均为雄犬,选取青岛博隆实验动物有限公司,平均体重为9.99±2.22 kg。按常规饲养,自由饮水和采食,饲料为全价日粮,不含抗菌药物。试验前观察1周,动物饮食、行为和体温等临床表现正常,有异常的犬只,应剔除试验。
2.2 试验设计与试验方案 20只受试犬随机分成A、B两组,每组10只,禁食12 h后,口服试验药品,采用随机自身交叉实验设计。第一阶段A组口服给药参比品,B组口服给药受试品,给药剂量按盐酸贝那普利0.5 mg/kg。受试犬在试验期间自由饮水,给药3 h后给予少量食物。第二阶段A组口服给药受试品,B组口服给药参比品。两阶段给药间隔为10 d。
2.3 样品采集 犬只进行全抱式保定,进行前肢外侧静脉采血。给药前采空白血,记为0 min。口服给药后分别于5、10、15、30、45 min和1、1.5、2、3、4、6、8、10、12、16、24 h采集血液样品约3 mL,将血样置于肝素钠抗凝管中,4000 r/min离心10 min,分离血浆后于-20 ℃保存备用。
2.4 色谱条件 保护柱:AQUITY UPLC BEH HILIC(2.1 mm×5 mm,1.7 μm),waters公司;色谱柱:AQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm),waters公司公司;梯度洗脱;流速:0.3 mL/min;柱温:35 ℃;进样量:2 μL;流动相:A相为0.1%甲酸水溶液,B相为乙腈,梯度洗脱程序见表1。
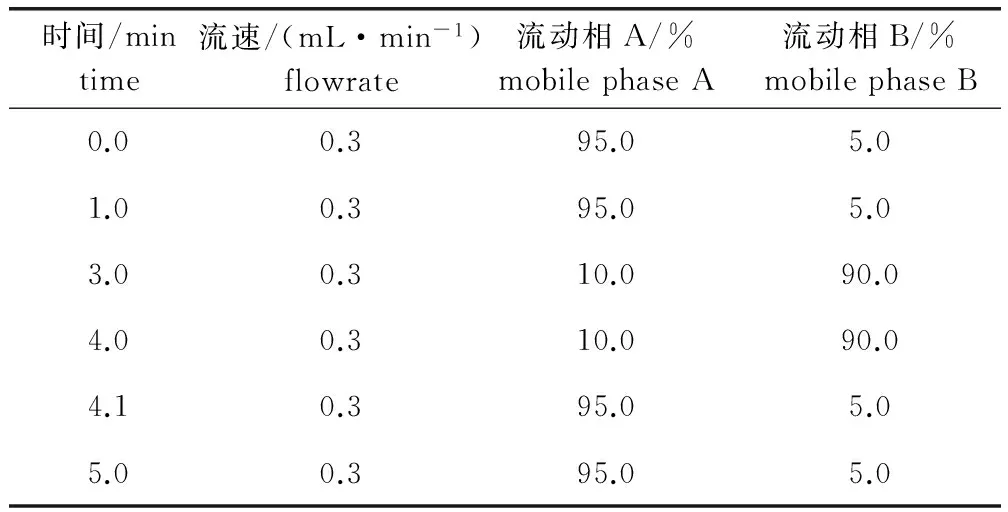
表1 梯度洗脱程序Tab 1 Gradient elution procedure
2.5 质谱条件 采用多反应监测(MRM)扫描模式;电喷雾离子源(ESI):正离子扫描;毛细管电压:3000 V;锥孔电压:40 V;驻留时间:0.061;雾化气流速 (L/h):850;锥孔气流速 (L/h):150;雾化温度:400 ℃;离子源温度:150 ℃;盐酸贝那普利、贝那普利拉以及依那普利MRM质谱检测参数见表2。
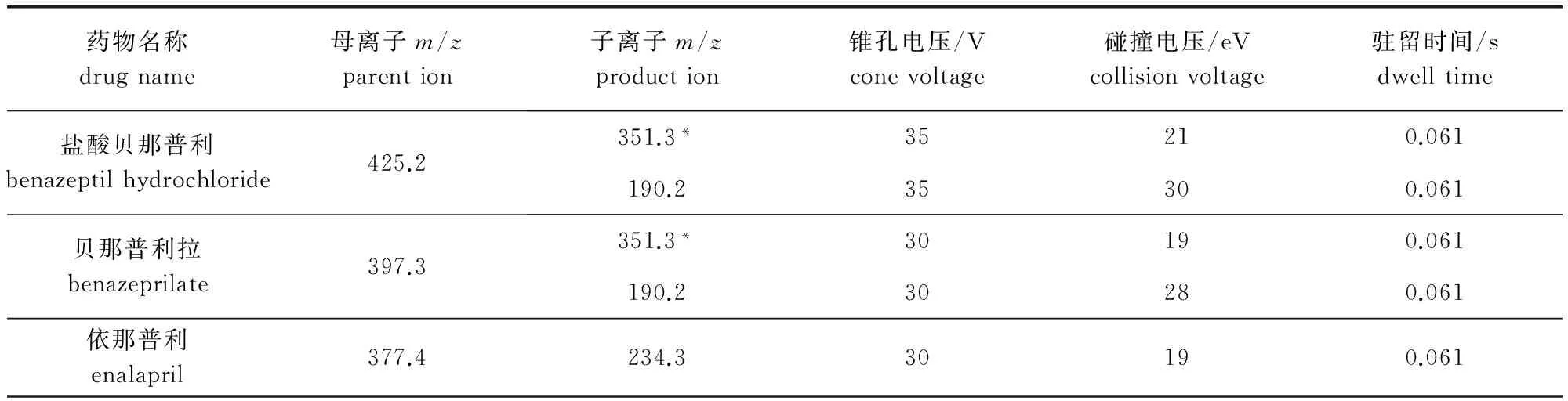
表2 各离子检测情况表Tab 2 Ions for monitoring
带*的离子对是用来进行定量分析的离子对
2.6 方法学验证 对盐酸贝那普利、贝那普利拉标准品进行精密度、回收率和稳定性试验,考察方法的合理性。
2.7 血浆样品的处理 从冰箱中取出犬血浆,常温解冻,摇匀后精密移取0.5 mL血浆于2 mL离心管中,加入1 mL乙腈(含浓度为100 ng/mL的内标),涡旋1 min,使用高速冷冻离心机在4 ℃条件下15000 r/min,离心10 min。取上清液0.3 mL加入到2 mL离心管中,再加入0.7 mL超纯水,整个过程样品进行了10倍稀释,涡旋1 min,在4 ℃条件下15000 r/min,离心10 min。取上清液过有机滤膜(0.22 μm),待UPLC-MS/MS分析。
3 结 果
3.1 方法学试验结果
3.1.1 灵敏度 经试验测定,本方法最低检测限(LOD)为0.05 ng/mL,最低定量限(LOQ)为0.1 ng/mL,满足生物等效性研究要求。
3.1.2 标准曲线和线性范围 盐酸贝那普利和贝那普利拉的血药浓度在1~200 ng/mL范围内线性关系良好,各相关系数r≥0.999,见表3。

表3 盐酸贝那普利的回归方程和相关系数Tab 3 Regression equation and correlation coefficient of benazeptil hydrochloride
Y:药物色谱峰面积与内标面积比值;X:所对应的药物浓度
3.1.3 回收率与变异系数 对添加不同浓度盐酸贝那普利和贝那普利拉的血浆样品重复测定6次,共4个批次,其测定结果及计算所得的回收率与变异系数见表4和表5。由表中数据可知:盐酸贝那普利和贝那普利拉在1、10、100 ng/mL三个添加水平上的回收率均在85%以上,回收率稳定,批内变异系数CV≤5%,批间变异系数CV≤10%,精密度良好。
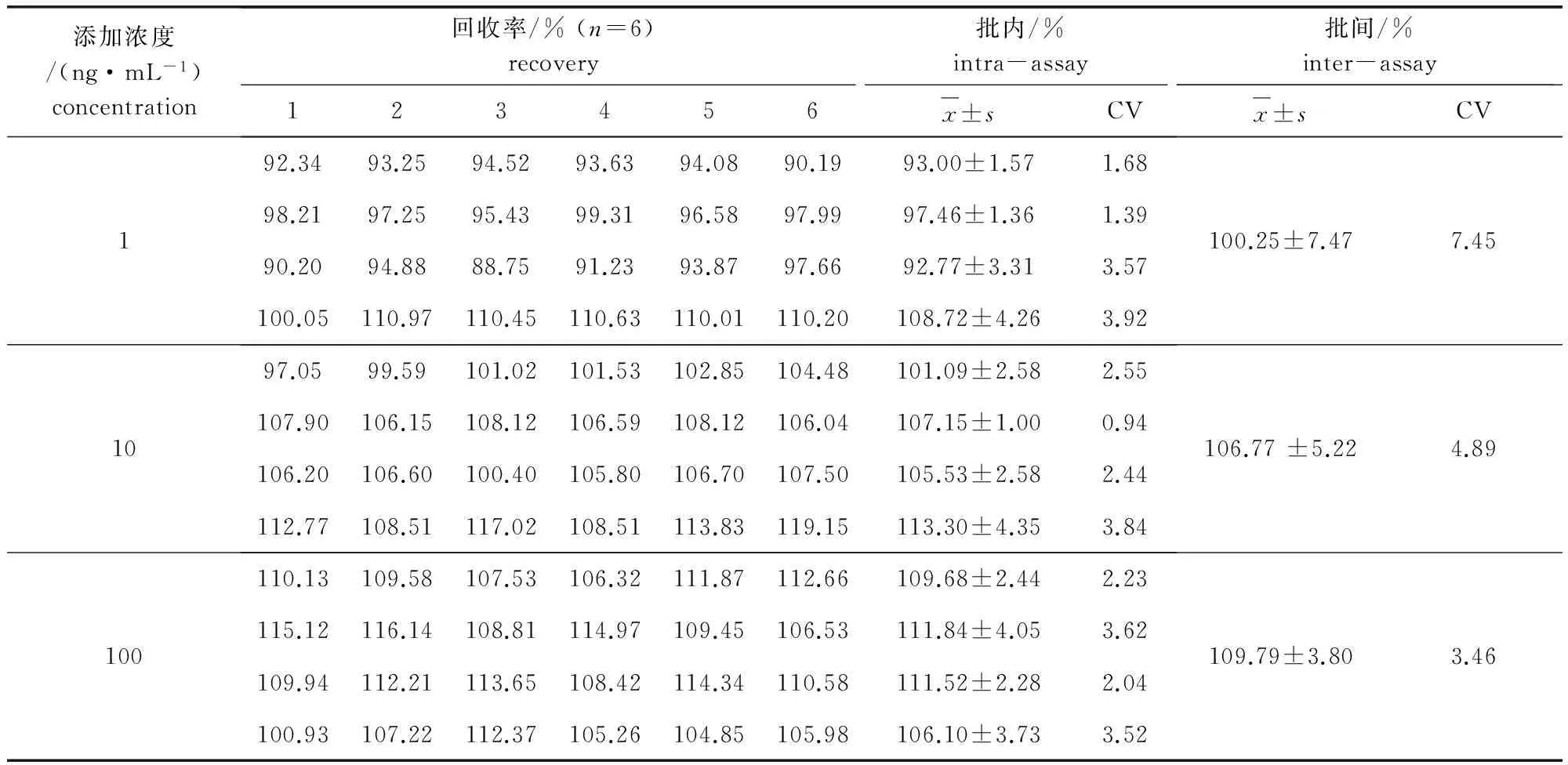
表4 盐酸贝那普利在犬空白血浆中的加样回收率与变异系数Tab 4 Recovery and variable coefficient of benazeptil hydrochloride in plasma
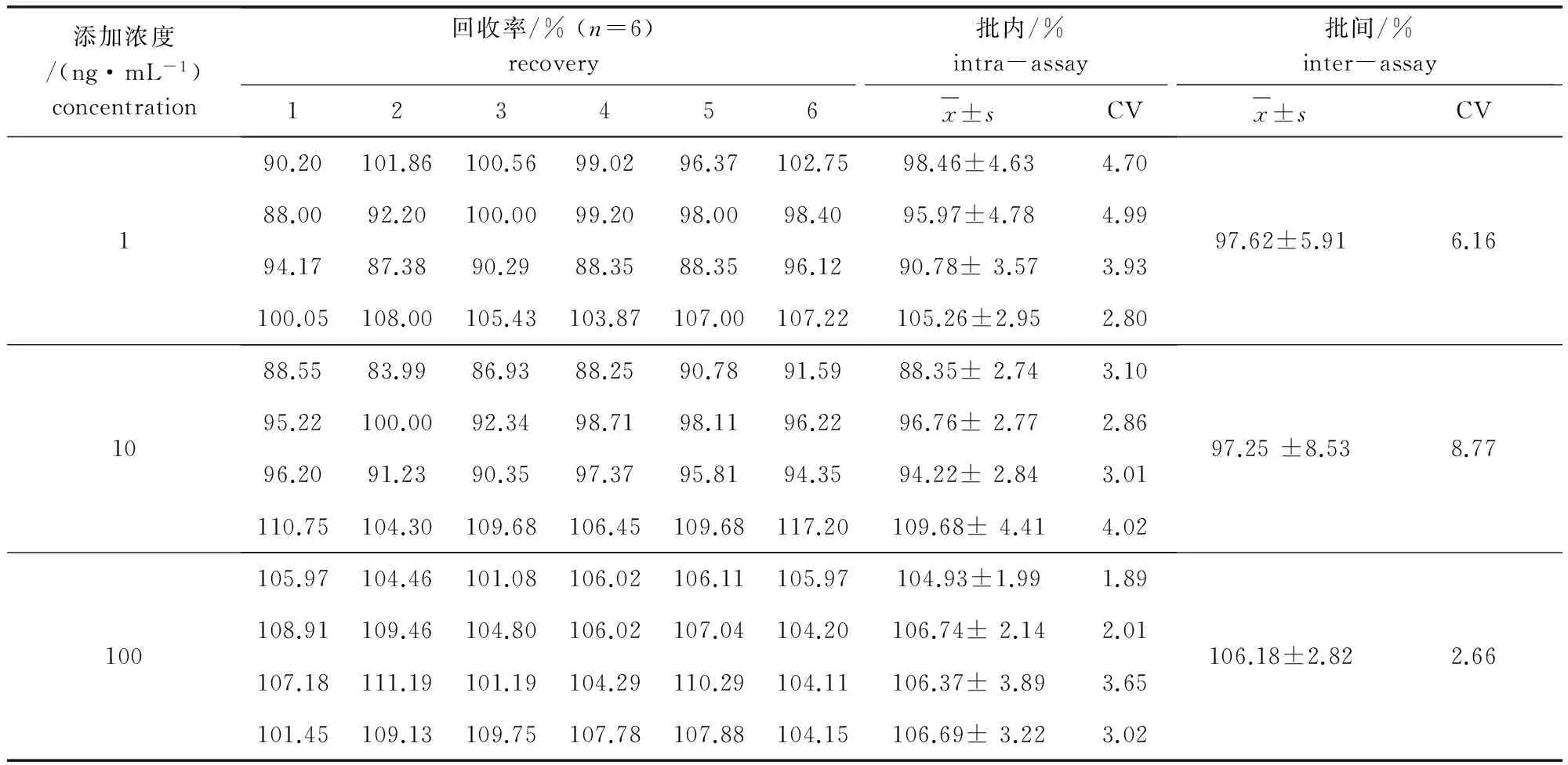
表5 贝那普利拉在犬空白血浆中的加样回收率与变异系数Tab 5 Recovery and variable coefficient of benazeprilate in plasma
3.1.4 稳定性 盐酸贝那普利、贝那普利拉以及内标依那普利在样品预处理后,室温放置11 h后仍稳定,色谱峰面积几乎未变化。但为保证结果的准确性,建议样品处理后及时上机检测。样品反复冻融3次后含量有所减少,不利于样品的稳定性,所以在检测样品时,应避免反复冻融。
3.1.5 基质效应 经过试验测定,盐酸贝那普利在低(1 ng/mL)、中(10 ng/mL)、高(100 ng/mL)三个浓度均有基质增强的作用,其中低浓度的基质效应尤其明显,为122.5%,中浓度为114.1%,高浓度为110.9%。贝那普利拉在低 (1 ng/mL)、中(10 ng/mL)、高(100 ng/mL)三个浓度亦有基质效应的存在,但有区别于盐酸贝那普利,在低浓度时呈现基质增强作用,为114.1%。在中浓度时呈现为基质减弱作用,减弱至95.9%。在高浓度时亦呈现为基质减弱作用减弱至87.9%。
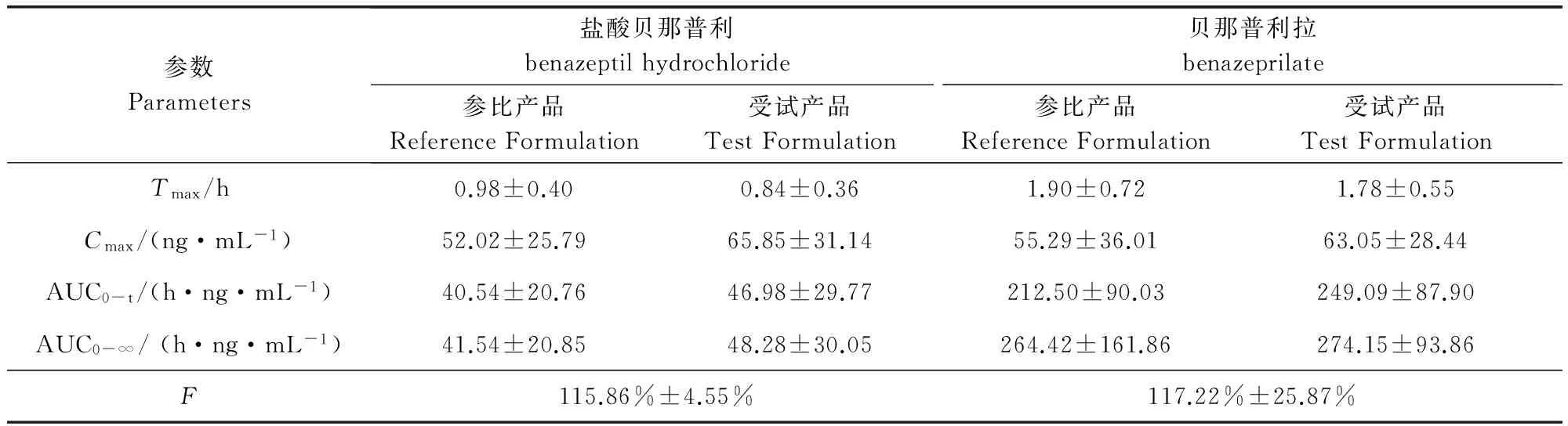
3.2 犬单剂量口服盐酸贝那普利片受试品和参比品的实测血药浓度及药动学特征 犬单剂量(0.5 mg/kg)口服盐酸贝那普利片后,不同时间测得的受试品和参比品对应的平均血药浓度-时间曲线见图1。血药浓度时间数据采用WinNonlin5.2.1 版药代参数计算软件进行非房室模型分析计算主要药动学参数,见表6。由图1可以看出,口服参比品和受试品后,盐酸贝那普利在犬体内具有吸收迅速、消除较快等特点。贝那普利拉具有峰浓度高,消除缓慢等特点。
3.3 生物等效性试验结果 采用SPSS 19.0统计学软件对参数Cmax、AUC0-t与AUC0-∞(已进行对数处理)进行多因素方差分析,每个参数在产品间、周期间以及个体间的差异均不显著(Pgt;0.05),无统计学意义;Tmax(未进行对数处理)应用非参数检验后,结果显示两组数据差异不显著(Pgt;0.05),说明两种产品在比格犬体内的达峰时间存在生物等效。
采用winnonlin bioequivalence model进行生物等效性检验,结果见表7。

图1 犬单剂量口服(0.5 mg/kg)盐酸贝那普利片后,盐酸贝那普利和贝那普利拉的平均药时曲线图Fig 1 The mean concentration-time curves of benazeptil hydrochloride and benazeprilate in dogs after single oral administration of benazeptil hydrochloride at the dose of 0.5mg / kg body weight
参数Parameters盐酸贝那普利benazeptilhydrochloride贝那普利拉benazeprilate参比产品ReferenceFormulation受试产品TestFormulation参比产品ReferenceFormulation受试产品TestFormulationTmax/h0.98±0.400.84±0.361.90±0.721.78±0.55Cmax/(ng·mL-1)52.02±25.7965.85±31.1455.29±36.0163.05±28.44AUC0-t/(h·ng·mL-1)40.54±20.7646.98±29.77212.50±90.03249.09±87.90AUC0-∞/(h·ng·mL-1)41.54±20.8548.28±30.05264.42±161.86274.15±93.86F115.86%±4.55%117.22%±25.87%

表7 犬单剂量口服(0.5 mg/kg)盐酸贝那普利片后盐酸贝那普利和贝那普利拉的生物等效性分析Tab 7 Analysis of bioequivalence in dogs administered a single oral of benazeptil hydrochlorideat the dose of 0.5mg/kg body weight
对参数Cmax、AUC0-t、AUC0-∞、Tmax进行的生物等效性分析及检验结果表明,河北远征禾木药业有限公司生产的盐酸贝那普利咀嚼片与诺华公司生产的盐酸贝那普利风味片具有生物等效性。
4 讨 论
比格犬单剂量口服盐酸贝那普利片后,盐酸贝那普利吸收迅速,给药后1 h之前Cmax达到最高血药浓度,然后血药浓度迅速下降,给药6 h的血药浓度基本在1 ng/mL以下。贝那普利拉达峰时间比原药晚,药物峰浓度Cmax出现在给药后1~2 h。贝那普利拉可长期抑制犬血浆内的ACE,给药后24 h在血浆中仍可检测到贝那普利拉,表明服用单剂量盐酸贝那普利片后至少可持续保持明显抑制作用24 h。
参比片盐酸贝那普利的Tmax为0.98±0.40 h,Cmax为52.02±25.79 ng/mL,贝那普利拉的Tmax为1.90±0.72 h,Cmax为55.29±36.01 ng/mL。这与郑经成[1]报道的盐酸贝那普利Tmax为0.54±0.10 h,Cmax为565.32±148.33 ng/mL,贝那普利拉Tmax为1.17±0.41 h,Cmax为124.68±25.67 ng/mL的差异较大。M Qian等[8]评价了一种盐酸贝那普利与原研制剂(FORTEKOR)在犬体内的生物等效性,所得盐酸贝那普利与贝那普利拉在犬体内的药动学参数与本试验较为一致。J N King 等[9]在8只健康比格犬中对盐酸贝那普利及贝那普利拉的药代动力学研究发现,比格犬按0.5 mg/kg单次口服盐酸贝那普利后,0.5 h达血药浓度,而后迅速被水解为贝那普利拉,贝那普利拉在1.25 h后也达到最大峰浓度。上述不同试验研究结果的差异可能是由于犬的品种、体重(按体重给药和按片剂给药)、性别(公母各半)、年龄以及数量等的不同引起,也有可能是由于给药后受试犬没有给予充足的水而引起的Tmax延长。
此外,在生物等效性的试验设计中,给药后按照16个采血点进行采血,受试组和参比组在24 h的贝那普利拉血药浓度均值分别是1.61±0.21和2.49±0.19 ng/mL,都小于各组的1/20Cmax,受试品的相对生物利用度F为117.22%±25.87%,大于80%,因此本试验设计的采样点与农业部规定的兽药生物等效性的要求相符。
本试验根据生物等效性分析标准,采用双单侧t检验和90%置信区间统计分析法评价两种制剂的生物等效性,结果符合国内仿制药生物等效的要求。试验中两种制剂表现出相似的生物利用度和相同的药效,在临床上可以相互替代,为兽医临床治疗的有效性和安全性提供了科学的参考依据。
[1] 郑经成,周连根,瞿 颖,等. 贝那普利片及其代谢物贝那普利拉在家猫体内的药代动力学及生物利用度研究[J]. 畜牧兽医学报, 2014, 45(12):1437-1442.
Zheng J C, Zhou L G, Qu Y,etal. Pharmacokinetics and bioavailability of benazepril and its metabolite benazeprilat in cats[J].Chinese Journal of Animal and Veterinary Sciences, 2014, 45(12): 1437-1442.
[2] Pommier F, Boschet F, Gosset G. Quantitative determination of benazepril and benazeprilat in human plasma by gas chromatography-mass spectrometry using automated 96-well disk plate solid-phase extraction for sample preparation[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2003, 783(1):199-205.
[3] Pilli N R, Inamadugu J K, Mullangi R,etal. Simultaneous determination of atorvastatin, amLodipine, ramipril and benazepril in human plasma by LC-MS/MS and its application to a human pharmacokinetic study[J]. Biomedical Chromatography, 2011, 25(4):439-449.
[4] Xiao W T, Chen B, Yao S Z,etal. Simultaneous determination of benazepril hydrochloride and benazeprilat in plasma by high-performance liquid chromatography/electrospray-mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2005, 814(2):303-308.
[5] Hu X L, Zheng Y T, Sun J G,etal. Simultaneous quantification of benazepril, gliclazide and valsartan in human plasma by LC-MS-MS and application for rapidly measuring protein binding interaction between rhein and these three drugs[J]. Chromatographia, 2009, 69(9):843-852.
[6] 张国刚, 郭 歆, 胡哲益, 等. 高效液相色谱/质谱/质谱联用法测定人血浆中盐酸贝那普利及贝那普利拉浓度[J]. 中国现代医学杂志, 2005(17):2630-2631.
Zhang G G, Guo X, Hu Z Y,etal. Determination of benazepril and benazeprilate in human plasma by HPLC/MS/MS[J]. China Journal of Modern Medicine, 2005, 15(17): 15-17.
[7] 朱荣华, 李焕德, 阳 剑, 等. 超液相色谱-串联质谱法研究氨氯地平盐酸贝那普利胶囊中盐酸贝那普利及其活性代谢物贝那普利拉的人体药动学[J]. 中国医院药学杂志, 2012,32(18):1437-1442.
Zhu R H, Li H D, Yang J,etal. Pharmacokinetics of benazepril and benazeprilat in Chinese healthy volunteers based on UPLC-MS/MS[J]. Chinese Journal of Hospital Pharmacy, 2012, 32(18): 1437-1442.
[8] Qian M, Chen T, Zhou D,etal. Development of a new benazepril hydrochloride chewable tablet and evaluation of its bioequivalence for treatment of heart failure in dogs[J]. J Vet Pharmacol Ther, 2016, 39(1):98-101.
[9] King J N, Maurer M, Morrison C A,etal. Pharmacokinetics of the angiotensin-converting-enzyme inhibitor, benazepril, and its active metabolite, benazeprilat, in dog[J]. Xenobiotica, 1997, 27(8):819-829.
(编辑:李文平)
StudyonBioequivalenceofBenazeptilHydrochlorideTabletsinDogs
LIU Xin1,2, WEI Li-juan1,2, SONG Ting-ting1,2*, QU Hong-ying1,2, JIA Xing1,2, GENG Zhi-xia1,2, WEI Zhan-yong1,2, ZOU Ming3, CHEN Jie4
(1.HeBeiYuanzhengPharmaceuticalCo.,Ltd.,Shijiazhuang050041,China; 2.HebeiEngineeringResearchCenterofVeterinaryDrugs,
Shijiazhuang050041,China; 3.QingdaoAgriculturialUniversity,Qingdao,Shandong266000,China;
4.ZhejiangProvinceYutaoLizhouStreetOffice,Yutao,Zhejiang315400,China)
SONGTing-ting,E-mail: 1831219739@qq.com
To study the pharmacokinetics and bioequivalence of domestic and imported benazepril hydrochloride in dogs, 20 healthy Beagle dogs were randomly divided into two groups. A two-period crossover trial was designed to batches the tested product and reference product at a single dose of 0.5 mg / kg body weight, respectively. The plasma concentrations of benazepril and benazeprilat was analysed by UPLC-MS/MS. The pharmacokinetic parameters were calculated by WinNonlin5.2.1 software and the bioequivalence of the two products was evaluated. The results showed that theTmaxof benazepril hydrochloride in the tested and reference products were 0.85±0.36 and 0.98±0.40 h,respectively,Cmaxwere 65.85±31.14 and 52.02±25.79 ng/mL;AUC0-twere 46.98±29.77 and 40.54±20.76 h·ng·mL-1;AUC0-∞were 48.28±30.05 and 41.54±20.85 h·ng·mL-1. TheTmaxof benazeprila and the reference product were 1.78±0.55 and 1.90±0.72 h, respectively,Cmaxwere 63.05±28.44 and 55.29±36.01 ng/mL;AUC0-twere 249.09±87.90 and 212.50±90.03 h·ng·mL-1;AUC0-∞were 274.15±93.86 and 264.42±161.86 h·ng·mL-1. There was no significant difference inTmax,Cmax, AUC0-tand AUC0-∞between the two formulations (Pgt;0.05). Double unilateral two one-sidet-test and 90% confidence interval results suggest that the two formulations are bioequivalent and clinically interchangeable. The trial provides a scientific basis for veterinary clinical use of the drug.
benazeptil hydrochloride; benazeprilate; bioequivalence; UPLC-MS/MS
10.11751/ISSN.1002-1280.2017.11.04
2017-02-16
A
1002-1280 (2017) 11-0020-08
S829.2
刘 欣,高级工程师,从事药物制剂研究。
宋婷婷。E-mail:1831219739@qq.com

