硒抗肿瘤机理研究进展和展望
鲍 鹏, 李国祥,3
1.中国科学院城市环境研究所, 城市环境与健康重点实验室, 福建 厦门 361021; 2.中国科学院宁波城市环境观测研究站, 浙江 宁波 315830; 3.中国科学院大学, 北京 100049
硒抗肿瘤机理研究进展和展望
鲍 鹏1,2, 李国祥1,2,3
1.中国科学院城市环境研究所, 城市环境与健康重点实验室, 福建 厦门 361021; 2.中国科学院宁波城市环境观测研究站, 浙江 宁波 315830; 3.中国科学院大学, 北京 100049
作为一种参与生命活动的重要营养元素,硒具有普遍的防癌、抗癌作用。迄今为止对于硒抗肿瘤机理的研究已经得出了众多结论。综述了硒元素的抗肿瘤效用和机理,并重点探讨了最新的研究结论——亚硒酸钠暴露的肿瘤细胞内可以发生亚硒酸钠还原并与细胞内蛋白结合自组装产生纳米硒粒子。这一研究结果很好的解释了超大剂量硒的多重毒理效应以及硒对产生耐受性的肿瘤抑制增强效应。对于肿瘤细胞/组织内自生纳米硒粒子的进一步研究将有望揭示硒元素抗肿瘤的潜藏机制,形成对于硒元素抗肿瘤机理的统一认识。
硒;内自生纳米硒粒子;多重毒理效应;超大剂量;肿瘤耐受性
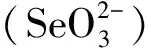
1 硒与癌症相关性及作用机理研究
1.1硒的抗肿瘤作用
人群调查研究显示,食物中的硒含量和血液中的硒含量与人群癌症发生率呈负相关[5~9]。在100余年前,Walker和Klein将亚硒酸盐直接注入舌肿瘤,非常有效地缓解了病情。随后,Kralick等尝试用有机硒——硒代二谷胱甘肽注入肿瘤作为抗癌治疗方法也取得了理想的疗效[8]。1969年,Shamberger等[10]进行了较大范围的普查,他对美国各州白人男性55~64岁特定年龄的癌症死亡率进行调查分析,结果发现在高硒、中硒、低硒州之间差别显著,低硒州人群癌症死亡率明显偏高。1977年,Schrauzer等[11]进一步在世界范围内调查了27个国家和地区硒含量与癌症死亡率的情况,得出了与Shamberger等相同的结论。对于我国国内的调查也有类似的结果。于树玉等[12]随机地检测了我国8个省24个地区人群的血硒含量,揭示这些地区总的癌症标化死亡率与当地人群血硒含量成反比,相关程度依次为食管癌、胃癌、肝癌。在我国江苏省启东市,其肝癌发病率的差异与当地粮食中硒含量或人体血硒含量呈明显的负相关。自1985年起为期8年的营养干预研究在启东市肝癌发病率基本相似的5个乡130 471人中进行,其中1个乡全体居民20 849人食用硒添加食盐,另4个乡食用普通食盐,结果食用含硒食盐的居民原发性肝癌发病率较食用普通食盐的居民下降了50%[13]。
近百年来的科学研究结果显示:亚硒酸钠、硒酸钠、硒代蛋氨酸(SeMet)、硒甲基硒代半胱氨酸(MSC)和甲基硒酸(MSA)具有明显的抗肿瘤作用[9,14]。人们希望将硒作为药物去治疗各类癌症,将硒与维生素A和维生素E联合使用对癌症治疗取得了较好的效果[15]。硒作为癌症辅助治疗药物可以增加癌细胞对放化疗的敏感性、提高治疗效果。超大剂量硒(正常剂量的5~10倍)与化疗药物合并使用可以提高癌症治疗的治愈率,1992年Satoh等[16]将超大剂量亚硒酸钠用于顺铂的化疗中,荷瘤模型动物单独采用顺铂治疗,其存活期大约为7周,而顺铂辅以超大剂量硒则完全抑制了肿瘤。美国在2004年开始尝试使用超大剂量硒与依力替康联用进行模型动物实验,取得了良好的效果,其中对依力替康不敏感性肠癌治愈率达到40%~80%,对敏感性肠癌治愈率则达到100%[17,18]。
硒对癌症的预防与治疗作用长久以来一直存在不同的看法甚至互相对立的结论,目前虽然多数研究表明硒对癌症的治疗有效,但仍有另一些研究认为没有明显治疗作用,比如对于乳腺癌、结/直肠癌、肝癌就存在不同的研究结果[19~21]。因此还需要研究者们对硒抗肿瘤的作用机理进行深入的研究,以便在临床中更科学的应用。
1.2硒抗肿瘤机理研究
一般认为的硒抗肿瘤作用机制主要包括:①诱导氧化致凋亡[9];②诱导肿瘤细胞的程序性调亡[22,23];③调节细胞转录因子[23];④调节机体免疫功能[9,23];⑤调节谷胱甘肽过氧化物酶活性[9];⑥调控癌基因与抗癌基因的表达[9,23];⑦阻断癌细胞分裂增殖的信息传递[22,23];⑧通过氧化胁迫破坏癌细胞线粒体的功能[9];⑨阻断癌细胞的能量供应[24];⑩抑制肿瘤新生血管的生成[9,22,23]。由此可见硒的抗肿瘤作用并非单一机制,而是具有多重毒理效应[9,23~25]。
这些前期研究大多认为在肿瘤细胞内代谢生成的硒代氨基酸或者硒化氢是发挥抗肿瘤作用的主要成分[9],并没有揭示硒的多重毒理效应的内在机理,或者只停留在硒与肿瘤抑制效应关联关系的描述或者抗肿瘤现象的简单陈述。无法解释为何只有超大剂量的硒暴露才对肿瘤具有抑制和治疗作用[26];为何这些剂量接近硒毒性水平;为何硒暴露会对产生抗性的肿瘤细胞更有效。虽然硒与癌症关系的研究看似已达到一定的深度和广度,但许多问题受固有思维、研究手段、研究视角等限制还没得到合理的阐明;而恰恰是这些尚未得到解答的问题是理解硒元素毒理作用的关键,因此对于硒细胞毒性机理研究需要继续深入,而且有必要进一步加大研究力度。
2 内自生纳米硒粒子抗肿瘤机理研究现状和发展趋势
2.1内自生纳米硒粒子的抗肿瘤机理
Bao等[27]于2015年首次提出亚硒酸钠的细胞毒性是由于其在细胞内部产生内自生纳米硒粒子所导致。该研究成果揭示亚硒酸钠对3种肿瘤细胞(肺癌细胞系H157、A549;胃癌细胞系MGC-803)的细胞毒性机理在于亚硒酸钠在肿瘤细胞内可被还原性物质(如:还原型谷胱甘肽)还原生成单质硒,单质硒形成的同时与富含-SH、-NH2的蛋白质/酶发生物理化学结合并在细胞内自组装形成内自生纳米硒颗粒(endogenous selenium nanoparticles, SeNPs)(图1,反应式1),从而将这些重要蛋白质/酶大量结合并固定下来,使之无法参与细胞的代谢活动从而扰乱细胞的新陈代谢。
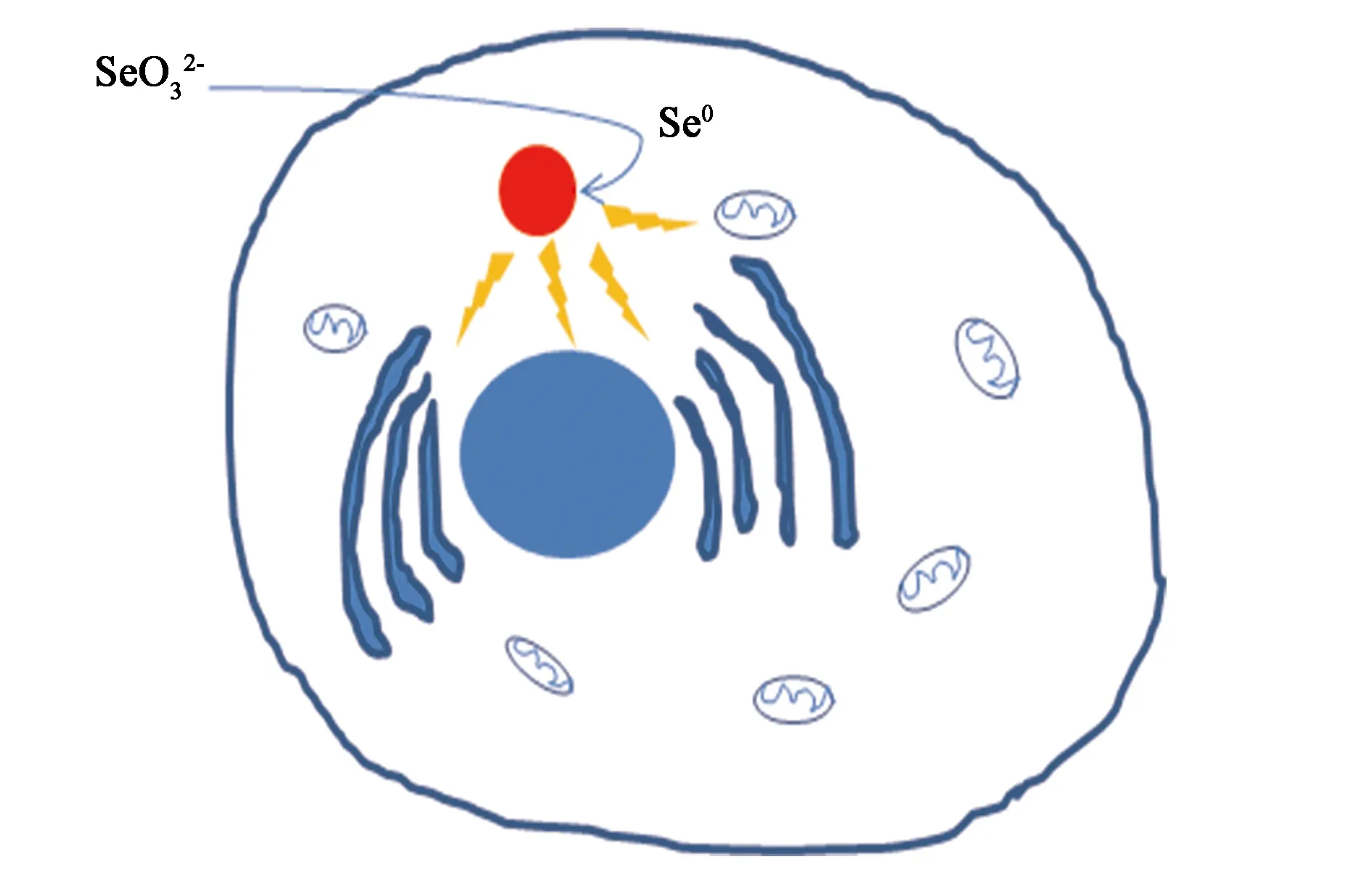
图1 亚硒酸钠暴露肿瘤细胞内自生纳米硒粒子及其抗癌机理[27]Fig.1 SeNPs self-assembly and anti-cancer mechanism in selenite exposed cancer cells[27].
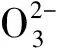
(1)
这是学界首次发现肿瘤细胞内部可以自组装产生纳米级颗粒物;与单质硒高度亲和的蛋白包括多种关键的蛋白与酶[27],其中包括参与糖酵解过程的全部酶类、调节细胞凋亡的热休克蛋白、执行细胞分裂的微管蛋白,这将导致肿瘤细胞能量代谢被抑制、糖酵解依赖的线粒体功能丧失、细胞周期停滞[28]、自吞噬抑制引起的细胞凋亡[27];此外,这些纳米硒粒子本身具有的尺寸效应、边际效应也会产生氧自由基引起细胞氧化损伤;肺癌细胞H157、A549和胃癌细胞MGC-803的存活率与其细胞内部的内自生纳米硒粒子数量呈负相关,与粒径呈正相关[27];Bao等[29]进一步研究证实肿瘤细胞内自组装形成纳米硒粒子是一个动态平衡过程,即不断有新的纳米硒粒子产生和原有纳米硒粒子被缓慢转化成其他硒形态(如:进一步被还原),导致解组装,这一动态变化过程使肿瘤细胞无法通过生物化学调控来应对纳米硒粒子带来的多重毒理效应从而引起细胞的最终凋亡[30](反应式2)。
Se0+2GSH→HSe-+GSSG+H+
(2)
2.2内自生纳米硒粒子的研究意义
Bao等[27,29]的研究成果能够完美解释高剂量下硒的多重毒理效应:即只有在肿瘤细胞内有足够量的硒被转化成单质硒进而自组装形成纳米硒粒子产生纳米毒性才会达到最佳抑制效果;这突破了原有对于硒抑制肿瘤机理的研究理论框架,将硒抑制肿瘤机理的认识提升到了新的高度;对于今后硒制剂在临床上的应用具有直接的指导意义。
此外,这一研究成果还提示了为何亚硒酸钠等硒制剂对于已产生抗药性的肿瘤更有效[31],癌症治疗面临的主要难题是癌细胞产生耐受性,当癌细胞受到物理化学攻击后,一般情况下一部分细胞会生存下来并在细胞内建立相应的防御体系,如提高谷胱甘肽表达量、增强谷胱甘肽硫转移酶P活性、表达糖蛋白和多药耐药蛋白(主要包括热休克蛋白)等[18],当癌细胞再次受到攻击胁迫,谷胱甘肽可以减少细胞氧化损伤[18];谷胱甘肽硫转移酶P可以促进谷胱甘肽与化疗药结合降低药效[18];热休克蛋白可以使化疗药加速排出癌细胞,从而使化疗药不能在癌细胞中有效积累达到有效浓度[18]。癌细胞的这些耐药途径会使癌症治疗效果明显下降。动物实验表明,在给动物注射化疗药物的同时辅以大剂量硒,可以明显降低癌细胞的耐受性[31, 32]。而且愈是对化疗药物不敏感的癌细胞,反而对硒变得十分敏感[33]。用自生纳米硒粒子的多重毒理机理来解释,即:肿瘤组织内还原物质(如:还原型谷胱甘肽、热休克蛋白)含量越高,通过硒(亚硒酸钠)暴露处理在其内部越有利于产生内自生纳米硒粒子,从而对癌细胞产生更强的毒理作用,Bao等[27,29]的研究结果很好地回答了为什么产生耐受性的肿瘤对硒更加敏感;这同时进一步提示我们一种新的设计消除肿瘤耐药性的思路。
纳米硒的出现打破了零价硒无生物活性的认知[18,34],鉴于合并化疗提高癌症治愈率的硒剂量接近或进入了硒的毒性范围,我们有理由相信内自生纳米硒的发现不仅解释了硒对肿瘤的毒性机理,而且预示着这也会是硒对正常生命体的致毒机理,因为在正常生命体内都具备硒还原、自组装的条件;那么这就要求研究者们重新审视原有的对于硒元素毒理学的认识,进一步研究内自生纳米硒粒子在其他生物体内的生成过程与毒性机理。
3 展望
鉴于我国癌症发病率逐年上升的严峻形势,进一步明确硒元素的抗癌机制、合理使用硒制剂、建立适当的给药途径(如:介入),对科学应用硒制剂作为肿瘤辅助治理药物具有重要的现实意义。因此,由于目前只在亚硒酸钠暴露的3种肿瘤细胞中发现并证实了产生纳米硒粒子的抑制肿瘤机理,以下三个方面应该是今后一段时间亟待解决的问题:①其他形态的无机硒和有机硒:硒酸钠、硒代蛋氨酸(SeMet)、硒甲基硒代半胱氨酸(MSC)和甲基硒酸(MSA)是否也会在肿瘤细胞内产生纳米硒粒子?以及产生内自生纳米硒粒子与肿瘤抑制的因果关系?这些纳米硒粒子的组装与解聚是否也以动态变化平衡状态存在?这些纳米硒粒子截留关键蛋白与酶对癌细胞产生何种毒理作用?有哪些类型的肿瘤细胞可以在细胞内自组装形成纳米硒粒子并因此而凋亡?②硒与化疗药物联合使用是否会在癌细胞内更易形成内自生纳米硒粒子?这是否是耐药性肿瘤对硒更加敏感的原因?在模型动物以致患者肿瘤组织中、在以上各种情况下是否也产生内自生纳米硒粒子,并存在着多重毒理作用?③处在高硒背景值地区出现硒中毒症状的生物体组织内是否会产生内自生纳米硒粒子?对以上问题的解答将揭示硒元素毒理学的潜藏机制,形成对于硒元素毒理作用的统一认识。
[1] Greenwood N N, Earnshow A. Chemistry of the Elements (2nd edn) [M]. Amsterdam, Netherlands: Elsevier, 1997.
[2] Tan J A. Environmental Selenium and Health [M]. Beijing: People’s Medical Publishing House, 1989.
[3] Combs G F. Selenium in global food systems [J]. Br. J. Nutr., 2001(85): 517-547.
[4] Carey A M, Lombi E, Donner E,etal.. A review of recent developments in the speciation and location of arsenic and selenium in rice grain [J]. Anal. Bioanal. Chem., 2012, (402): 3275-3286.
[5] 洪素珍,孙 昕. 肿瘤患者及健康人血清硒水平研究[J]. 微量元素与健康研究,1996,13(3): 1-12.
[6] 陈以水,熊 红. 硒与癌症[J]. 广东微量元素科学,2002, 9(10):44-46.
[7] 赵德生,谢立苹. 硒诱导人结肠癌细胞凋亡的实验研究[J]. 北华大学学报:自然科学版,2004, 5(3): 235-236.
[8] 荀黎红,吴丛雅. 硒与癌症关系的研究现状[J]. 国外医学(医学地理分册),2006, 27(3):100-102.
[9] Weekley C M, Harris H H. Which form is that? The importance of selenium speciation and metabolism in the prevention and treatment of disease [J]. Chem. Soc. Rev., 2013(42): 8870-8894.
[10] Shamberger R J, Frost D V. Possible protective effect of selenium against human cancer [J]. Can. Med. Assoc. J., 1969, 100(14): 682-686.
[11] Schrauzer G N, White D A, Schneider C J. Cancer mortality correlation studies: Statistical associations with dietary selenium [J]. Bioinorg. Chem., 1977, 7(1): 23-31.
[12] 于树玉,诸亚君,刘秋燕,等. 硒对艾氏腹水癌生长的抑制作用及对癌细胞线粒体呼吸及氧化磷酸化的影响[J]. 中华肿瘤杂志,1983, 5(1): 8-11.
[13] 李文广,谢金荣,于树玉,等. 启东县原发性肝癌地理分布特点与硒水平的关系[J]. 微量元素,1986, 8(4): 262-264.
[14] 刘洁薇,钟晓蓉,周清华,等. 甲基硒酸对人高转移大细胞肺癌细胞株L9981增殖和凋亡作用及其分子机制的初步研究[J]. 中国肺癌杂志,2006, 9(2): 103-108.
[15] 张 敬,张 军,赵 燕,等. 硒和维生E对白血病细胞凋亡及c-Myc基因表达的影响[J]. 营养学报,2001, 23(4): 324-326.
[16] Satoh M, Naganuma A, Imura N. Effect of coadministration of selenite on the toxicity and antitumor activity of cis-diamminedichloroplatinum (II) given repeatedly to mice [J]. Cancer Chemoth. Pharm., 1992(30): 439-443.
[17] Cao S, Durrani F, Rustum Y M. Selective modulation of the therapeutic efficacy of anticancer drugs by selenium containing compounds against human tumor xenografts [J]. Clin. Cancer Res., 2004(10): 2561-2569.
[18] 张劲松. 硒防治癌症的困扰与求变:纳米硒的创新[J]. 医药世界,2004(10): 39-42.
[19] Bardia A, Tleyjeh I M, Cerhan J R,etal.. Efficacy of antioxidant supplementation in reducing primary cancer incidence and mortality: systematic review and meta-analysis [J]. Mayo. Clin. Proc., 2008, 83(1): 23-34.
[20] Amaral A F S, Cantor K P, Silverman D T,etal.. Selenium and risk of bladder cancer: A meta-analysis of epidemiological studies [J]. Toxicol. Lett., 2009(189): S117.
[21] Jiang L, Yang K H, Tian J H,etal.. Efficacy of antioxidant vitamins and selenium supplement in prostate cancer prevention: A meta-analysis of randomized controlled trials [J]. Nutr. Cancer, 2010(62): 719-727.
[22] 丁 健. 抗肿瘤药物的研究新进展[J]. 中国新药杂志,2000, 9(3): 149-154.
[23] 尹红星,张殊佳,郑学仿,等. 硒的抗肿瘤作用研究综述[J]. 大连大学学报,2008, 29(6):18-25.
[24] 夏献民,于树玉. 硒的抗癌机制的研究-对酵解及有关硒的影响[J]. 中华肿瘤杂志,1987, 9 (4): 255-257.
[25] 吴建民,陈婉蓉. 硒在癌症治疗中的作用[J]. 广东微量元素科学,2000, 7(5):1-4.
[26] Greeder G A, Milner J A. Factors influencing the inhibitory effect of selenium on mice inoculated with Ehrlich ascites tumor cells [J]. Science, 1980(209): 825-827.
[27] Bao P, Chen Z, Tai R Z,etal.. Selenite-induced toxicity in cancer cells is mediated by metabolic generation of endogenous selenium nanoparticles [J]. J. Proteome. Res., 2015a(14): 1127-1136.
[28] Chen Q C, Xu M, Zheng W J,etal.. Se/Ru-decorated porous metal-organic framework nanoparticles for the delivery of pooled siRNAs to reversing multidrug resistance in Taxol-resistant breast cancer cells [J]. ACS Appl. Mater. Interfaces, 2017, 9(8): 6712-6724.
[29] Bao P, Chen S C, Xiao K Q. Dynamic equilibrium of endogenous selenium nanoparticles in selenite-exposed cancer cells: A deep insight into the interaction between endogenous SeNPs and proteins [J]. Mol. Biosyst., 2015b(11): 3355.
[30] Nuttall K L. Elemental selenium and glutathione reductase [J]. Med. Hypotheses, 1985(16): 155-158.
[31] Caffrey P B, Frenkel G D. Sensitivity of melphalan-resistant tumor to selenite in vivo [J]. Cancer Lett., 1997, (121): 177-180.
[32] Frenkel G D, Caffrey P B. A prevention strategy for circumventing drug resistance in cancer chemotherapy [J]. Curr. Pharm. Des., 2001(7): 1595-1614.
[33] Caffrey P B, Frenkel G D. Selenium compounds prevent the induction of drug resistance by cisplatin in human ovarian tumor xenografts in vivo [J]. Cancer Chemother. Pharmacol., 2000(46): 74-78.
[34] Li H C, Zhang J S, Wang T H,etal.. Elemental selenium particles at nano-size (Nano-Se) are more toxic to Medaka (Oryziaslatipes) as a consequence of hyper-accumulation of selenium: A comparison with sodium selenite [J]. Aquatic. Toxicol., 2008(89): 251-256.
ProgressandProspectsofSeleniumAnti-tumorMechanism
BAO Peng1,2, LI Guoxiang1,2,3
1.KeyLabofUrbanEnvironmentandHealth,InstituteofUrbanEnvironment,ChineseAcademyofSciences,FujianXiamen361021,China; 2.NingboUrbanEnvironmentObservationandResearchStation,ChineseAcademyofSciences,ZhejiangNingbo315830,China; 3.UniversityofChineseAcademyofSciences,Beijing100049,China
As an important nutrient element that participate in the activities of life, selenium (Se) has general prevention and anti-cancer effects. So far, variety opinions were concluded on Se anti-tumor mechanism. This paper reviewed the progress on anti-tumor effects and mechanisms of Se, and highlighted the latest study founding, that sodium selenite exposure could occur selenite reduction to elemental Se, and combined with intracellular protein for self-assembly of Se nanoparticles within the tumor cells. The results well explained the multiple toxicology effect of Se with large dose and the enhanced inhibition effect to radiation and chemotherapy tolerance tumors. The further study of the Se nanoparticles in tumor cells/tissues will reveal the underlying anti-tumor mechanisms of Se, and form an unified understanding of Se anti-tumor mechanisms.
selenium; endogenous selenium nanoparticles; multiple toxicology effects; ultra high dose; tumor tolerance
2017-06-27;接受日期2017-07-13
国家自然科学基金项目 (41571240);宁波市科技惠民项目 (2017C50009)资助。
鲍 鹏,副研究员,博士,研究方向为金属组学与生物技术。Tel:0574-86085998;E-mail: pbao@iue.ac.cn
10.19586/j.2095-2341.2017.0068

