婴儿纤维性错构瘤CT、MRI特征与组织病理学对照分析
杨秀军,奚政君,李婷婷,王雪莉,任 翔,樊红梅,张 斌
(1.上海交通大学附属儿童医院影像科,2.病理科,上海 200062)

婴儿纤维性错构瘤CT、MRI特征与组织病理学对照分析
杨秀军1,奚政君2*,李婷婷1,王雪莉2,任 翔1,樊红梅1,张 斌1
(1.上海交通大学附属儿童医院影像科,2.病理科,上海 200062)
目的探讨婴儿纤维性错构瘤(FHI)的CT、MRI表现并与病理对照。方法回顾性分析经手术病理证实的15例FHI患儿的临床、CT、MRI及病理学资料。结果15例FHI中,单灶13例、双灶2例,共17个病灶,CT、MRI表现为皮下型、皮肤型和混合型病灶分别占58.82%(10/17)、17.65%(3/17)和23.53%(4/17)。皮下型、混合型病灶呈“云雾征”(包括“淡云征”及“浓云征”),其中“淡云征”病灶以成熟脂肪细胞为主,“浓云征”病灶的成熟脂肪细胞、致密纤维细胞及原始间叶细胞三相成分构成比较一致。皮肤型病灶呈“倒峦征”,以原始间叶细胞为主。结论FHI的CT、MRI表现复杂但也有一定的特点,可较好地反映其组织病理学特性。
软组织肿瘤;婴儿纤维性错构瘤;体层摄影术,X线计算机;磁共振成像;病理学
软组织肿瘤为儿童常见肿瘤之一,在良性肿瘤中约占50%、恶性肿瘤中约占11%,其组织起源多样、种类繁多、病理分类分型复杂多变,良性、中间性和恶性尤其小儿中间型软组织肿瘤诊断与鉴别颇为不易[1-2]。婴儿纤维性错构瘤(fibrous hamartoma of infancy, FHI)发病率低,但为早期儿童相对常见的软组织肿瘤,目前诊断主要依靠组织病理学检查[2-10],影像诊断研究甚少[4,10-11]。本研究对15例FHI的临床病理、CT和MRI表现进行回顾性分析,探讨其CT、MRI特点与诊断价值,以期提高对本病的认识和影像诊断水平。
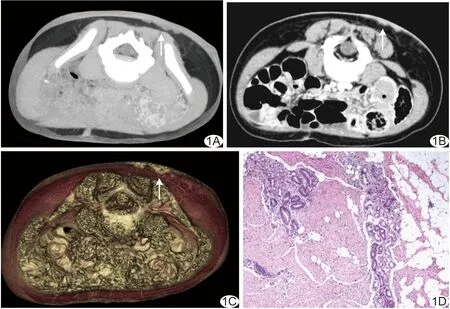
图1 患儿男,10个月,腰骶部皮肤型FHI A.CT平扫示病灶(箭)位于真皮内,呈多峰“倒峦征”向皮下背肤性生长,密度稍低于表皮; B.增强CT病灶呈中度不均匀强化,灶周皮下组织内见多支稍粗、紊乱的血管(箭); C.VR图像显示病灶(箭)更为直观; D.病理检查可见瘤巢由典型的三相成分,即成熟脂肪组织、胶原纤维组织及间叶组织,相互混杂构成器官样结构,同时示增生毛囊、汗腺组织及皮肤基底层黑色素沉着(HE,×40)
1 资料与方法
1.1 一般资料 回顾性分析2009年2月—2016年6月手术及组织病理学证实且CT和/或MRI检查资料较完整的患儿共15例,男11例,女4例,年龄6~29个月,中位年龄14个月。15例均以局部无痛性包块为主诉就诊且其中10例包块渐进性增大,2例伴局部皮肤表面青色且其中1例同时伴少许毛发覆盖。15例中,3例接受MRI平扫,1例同时接受CT、MRI平扫,1例接受MRI平扫与增强扫描,6例接受CT平扫与增强扫描,2例同时接受CT、MRI平扫及增强扫描,1例同时接受CT平扫、增强扫描及MRI平扫,1例同时接受MRI平扫、增强扫描及CT增强扫描。除1例患儿因下肢病灶巨大接受截肢术外,余14例均接受病灶局部手术切除治疗。
1.2 影像学检查
1.2.1 MRI 采用Philips Ingenia 3.0T或Siemens Magnetom Essenza 1.5T MRI仪,扫描至少包括轴位SE-T1WI、T2WI、脂肪抑制T2WI或STIR序列平扫。增强扫描对比剂采用Gd-DTPA,剂量0.1 mmol/kg体质量,经手背静脉推注后,即刻行轴位、冠状位、矢状位SE-T1WI或脂肪抑制SE-T1WI增强扫描。
1.2.2 CT 采用GE LightSpeed VCT或Toshiba Aquilion 64 CT仪。扫描参数:管电压70~100 kV,管电流180~210 mA,层厚5 mm或7 mm,重建层厚 0.625 mm或0.5 mm。以碘海醇或碘佛醇2 ml/kg体质量,经外周静脉团注后,行动脉期、静脉期增强扫描(包括动脉早期及动脉晚期扫描,对其中2例仅行动脉晚期扫描)。CT扫描数据于GE AW 4.6工作站进行冠状位、矢状位MPR及MIP和/或VR等后处理。
1.3 组织病理学检查 对所有患儿手术切除的组织均进行组织病理学检查,其中6例同时进行免疫组化检查。所有标本均经4%中性甲醛固定、常规石蜡包埋、HE染色,于光学显微镜下观察。免疫组化检查采用EnVison两步法、DAB染色。
2 结果
15例FHI共17个病灶,13例为单发病灶,2例为2个病灶。13例发病年龄≤2周岁,占86.67%(13/15);2例发病年龄>2周岁,占13.33%(2/15)。病灶未见明确边界及包膜,最大径约0.7~31.5 cm,其中1例病灶巨大者累及整个大腿,下至膝关节以下、上至臀部。
15例FHI中,病灶位于上臂3例(1例伴腋下病变)、腋前胸壁2例、背部2例、足底2例,大腿、膝部(膝上、膝下共2个病灶)、手掌部、肛旁、头枕部、肩部各1例。
17个FHI病灶CT、MRI表现为皮下型、皮肤型、混合型者分别占58.82%(10/17)、17.65%(3/17)、23.53%(4/17)。皮下型、混合型病灶表现为“云雾征”(包括“淡云征”及“浓云征”),皮肤型病灶表现为“倒峦征”。
17个FHI病灶中,3个皮肤型病灶主体位于表皮下真皮内,呈背肤性向皮下生长,毗邻皮肤整体上不规则增厚但皮肤表面尚平整或稍微膨隆,病灶远皮端凸凹不平呈单峰、双峰或多峰状伸入皮下组织中,似倒立峰峦影,故名“倒峦征”(图1),其密度稍低于表皮但高于皮下脂肪组织,其中1个病灶局部皮下组织可见1支或多支增粗、纡曲的血管与病灶相连;10个皮下型及4个混合型病灶呈中央区域稍高密度/信号的云雾状改变,故名“云雾征”,其中轮廓模糊淡薄阴影者为“淡云征”,勾勒出轮廓浓密阴影者为“浓云征”,“浓云征”混合型FHI病灶呈近皮端较小、远皮端较大类似蘑菇云状浓密阴影,即“蘑菇云样改变”。10个皮下型病灶表现为“淡云征”、“浓云征”各5个病灶,局部皮肤均未见明确增厚;前者CT、MRI上示病灶以脂肪组织为主(图2),仅部分非脂肪组织区域轻度非均质强化,其间可见少量增粗、紊乱的血管,其中2例(2个病灶)CT平扫仅示局部皮下脂肪较厚、但MRI明确显示境界不清的病灶;后者CT、MRI表现为典型的云雾状含脂混杂密度/信号团块(图3),增强后病灶部分区域呈轻-中度非均质强化,其间可见较多增粗、紊乱的血管影,其中2例(2个病灶)伴异常毛细血管团(假血管瘤巢),1例(1个病灶)病灶巨大者伴多发斑点状钙化及1个囊性结节。4个混合型FHI病灶中,3个病灶呈“蘑菇云样改变”(图4),CT、MRI示典型脂肪、纤维及实性(间叶组织)成分,三相成分构成比趋于一致;1个病灶仅见皮下大片增厚脂肪组织及局部皮肤轻微增厚改变(图5),CT软组织窗几无异常发现,宽窗呈“淡云征”,其间见栅栏状结构及轻微强化,MRI显示较佳但所示病灶与正常脂肪无明确分界。
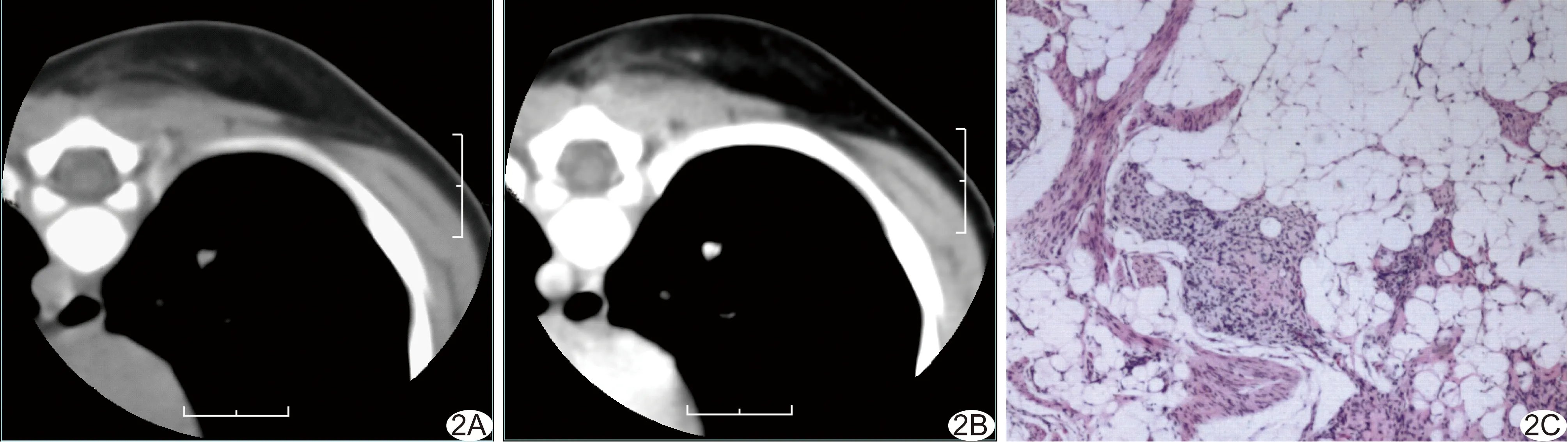
图2 患儿男,5个月,胸背部皮下型FHI A、B.CT平扫(A)及增强扫描(B)示右侧胸背部皮下组织内片状淡云样影,边缘模糊,部分区域与毗邻竖脊肌分界不清,皮肤无增厚; C.病理检查可见典型脂肪、纤维及原始间叶细胞,且前者相对占比较大(HE,×40)
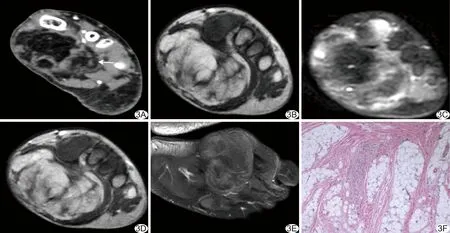
图3 患儿男,29个月,左侧足底皮下型FHI A.增强CT动脉期示足底富含脂肪组织的混杂密度肿块(箭),境界尚清,其间见部分扩张血管; B~E.MRI示云雾状团块影,T1WI(B)示脂肪呈高信号、纤维呈低信号、实性间叶组织呈稍高信号,脂肪抑制T2WI(C)示脂肪及纤维组织呈低信号、实性间叶组织呈稍高信号,增强T1WI(D)仅显示实性间叶组织呈轻-中度强化,脂肪抑制增强T1WI(E)显示更为清晰; F.病理检查可见脂肪、纤维及间叶细胞,三相成分构成比趋于一致(HE,×40)
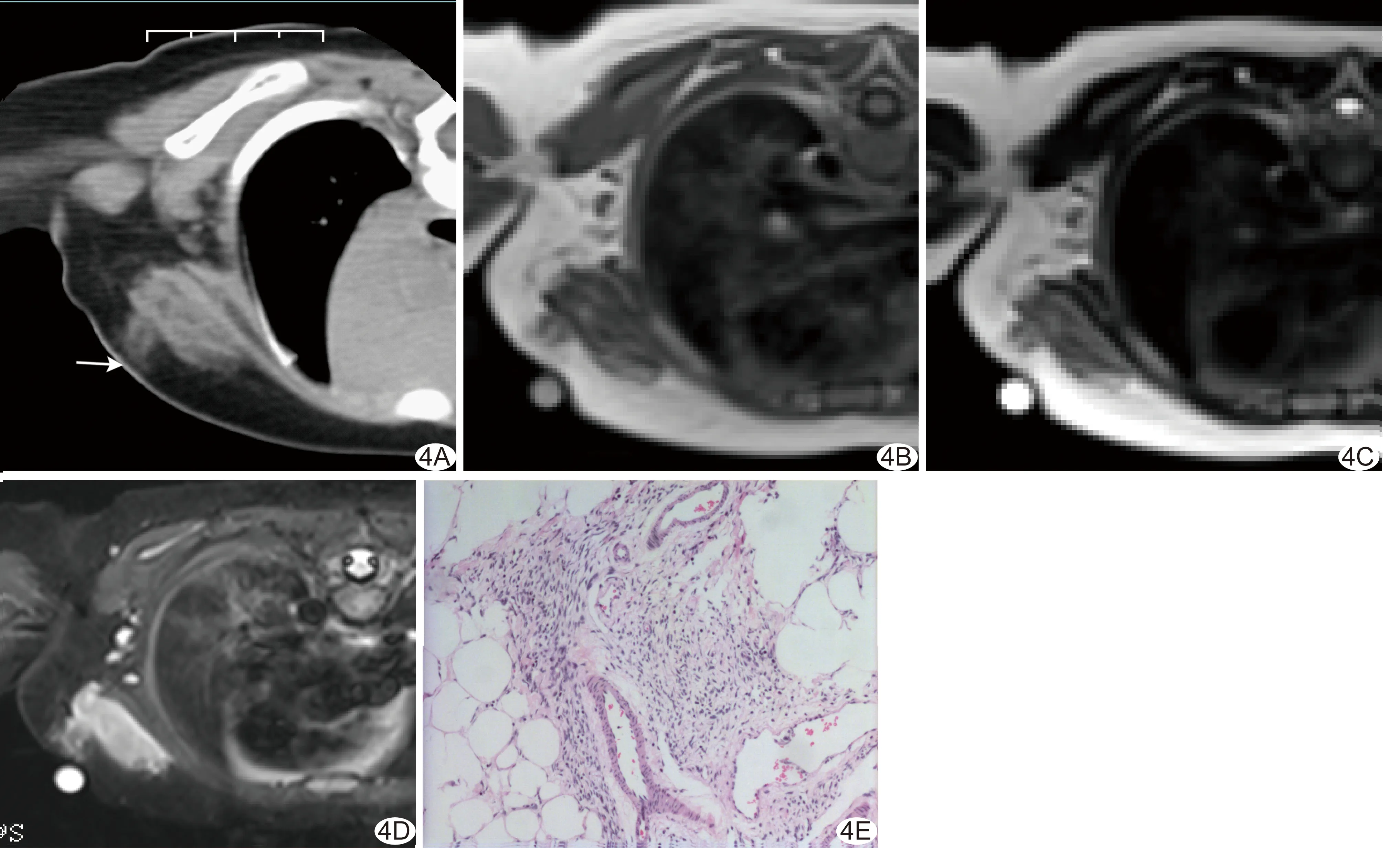
图4患儿男,8个月,左侧腋前胸壁混合型FHI A.CT平扫示病灶呈蘑菇云状并浸润毗邻胸壁肌肉、肌间隙,局部皮肤稍厚(箭); B.MR T1WI(B)、T2WI(C)及STIR(D)图像病灶呈蘑菇云状含脂混杂信号; E.病理检查可见病灶主体为构成较一致的脂肪、纤维及原始间叶细胞,其间见不同程度血管增生及部分血管扩张(HE,×40)

图5 患儿男,27个月,肘后混合型FHI A、B.CT平扫仅示局部脂肪较厚,宽窗似见皮下筋膜淡云样片影,其间见栅栏状结构; C.增强CT病灶呈轻度强化,局部皮肤稍厚; D、E.MR T1WI(D)及STIR(E)明确显示病灶; F.病理检查可见大量空泡脂肪细胞和少量梭形纤维细胞与原始间叶细胞(HE,×40)
除4个病灶因患者仅接受平扫未能评价外,余13个病灶增强扫描均见轻度(6个病灶)或中度(7个病灶)富血供。1个病灶内见少许斑点状钙化。
组织病理学可见影像表现为“浓云征”的病灶由成熟脂肪细胞、致密纤维细胞及原始间叶细胞构成,且三相成分的构成比较一致;“淡云征”病灶以成熟脂肪细胞为主;“倒峦征”病灶以原始间叶细胞为主。免疫组化均显示S-100(+)、SMA(+)、CD99(+)、CD34(+)、Ki-67(阳性细胞<2%)、Bcl-2(+)。
3 讨论
3.1 FHI的病因、病理及临床表现 FHI为发生于儿童真皮或皮下组织内的胚胎发育不良性或错构瘤性良性病变[3-8],约占所有软组织肿瘤的0.6%、良性软组织肿瘤的0.02%和儿童软组织肿瘤的5%[3-6]。其病因及发病机制不明,好发于2岁以内儿童且约25%为先天性[3,12],偶见成人患者[3,13],罕见合并患处皮肤色素沉着、先天性痣斑、多毛症[6,14]和其他部位甚至全身伴随病变,如并指[6]、结节性硬化症[15]、Williams综合症[16]等。有研究[14,17-18]报道,FHI患者可出现部分染色体结构重排、1、2、4、17号染色体t(2,3)(q31,q21)易位和6、8、12号染色体t(6,12,8)(q25,q24.3,q13)易位,其中在2q31染色体上的细胞表面受体-α亚基因可能参与了FHI的发生[17]。有学者[16]认为FHI与Williams综合征有遗传连锁性。近年研究[19-20]显示,FHI呈背肤性向皮下生长,可伸入毗邻骨骼肌间隙内,偶与下方筋膜粘连,累及骨骼肌或神经血管者罕见,突出皮肤表面者罕见[21]。FHI好发于腋窝前、后皱襞,其次为上臂、肩部、大腿、腹股沟、背部和前臂,头皮[8]、会阴部、阴囊[5-6,8,22]、臀骶部[5,9]、眼眶[23]FHI也见报道,但极少发生于手足部[5,8](不同于几乎只发生于手掌及足底的钙化性腱膜纤维瘤[24])和深部组织(如鼻咽部[25])。多数FHI病灶最大径0.5~20.0 cm[12,26],本组最大病灶直径超过30 cm并跨越毗邻关节。FHI病理检查呈三相成分的病理学特征:致密胶原纤维组织(其间可散在纤维母细胞和肌纤维母细胞)、原始间叶细胞、成熟脂肪细胞,但3种成分在不同病例其比例不同,年龄越小者未分化原始间叶细胞成分含量相对越多,易于确诊;而年龄较大者未分化原始间叶成分较少,常需免疫组化来进一步确定其所包含的各种成分以明确诊断,S-100、Vim、CD99、SMA在脂肪细胞中呈阳性表达、Bcl-2在部分梭形细胞成分中呈阳性表达、CD34在不成熟原始间叶细胞成分中呈阳性表达、Ki-67的增殖活性较低且主要表达于不成熟的原始间叶细胞成分中(阳性细胞<10%)[3,5-9,12,19-21]。由于FHI生长迅速,病灶较大时手术不易完全切除,术后复发率达10%~16%[7,12,26],目前临床主张及早确诊并早期手术切除[3,6-7,12],有学者[26]建议对大于10 cm的肿瘤在术中切缘应达瘤周正常组织0.5 cm,以预防复发。但另有学者[5]认为,FHI仅5岁前生长较快,虽不会自行停止生长或消失,但也无恶变倾向,延迟手术不会增加手术难度与并发症风险。
3.2 FHI的影像学诊断与鉴别诊断 多数FHI超声表现为边界不清、轮廓不整的“蛇形”不均质稍高回声团块,CDFI可见病灶内无或散在点状血流信号[10,13,22];CT则呈含脂混杂密度团块影或甚至类似“畸胎瘤”的含有脂肪、软组织及钙化团块影[26],偶见斑点状及小片状钙化灶,巨大病灶可伴囊变,增强扫描仅显示间叶组织成分轻-中度非均质强化;MRI表现为富含脂肪的混杂信号团块[4,11,13,15,22],脂肪和纤维组织信号颇具特征性,增强后无强化,间叶组织呈等信号,脂肪抑制序列图像信号较高且增强扫描可见不同程度强化。本研究中,CT、MRI显示FHI呈皮肤型、皮下型、混合型3种不同类型表现,其中皮肤型表现为“倒峦征”,皮下型和混合型表现为“云雾征”且混合型主要表现为“蘑菇云样改变”,这些征象虽然复杂但也有一定的特点与规律,不但直观揭示了病灶所在皮肤、皮下位置及其累及范围,且直接反映了其组织病理结构尤其3种成分及其构成比不同情况,可为术前定性诊断提供较为可靠的依据。
FHI需与婴幼儿肌纤维瘤(病)、钙化性腱膜纤维瘤、皮下脂膜炎、皮下脂膜炎样T细胞淋巴瘤(subcutaneous panniculitis-like T-cell lymphoma, SPTCL)、肌间血管瘤、脂肪瘤等相鉴别。婴幼儿肌纤维瘤(病)为纤维组织及原始间叶细胞的双相结构,瘤体较大,呈浸润性生长,周围组织包括骨骼常受侵犯[27]且增强扫描多呈“快进快出”强化特点;钙化性腱膜纤维瘤常发生在手足部深部筋膜及骨旁组织且可见软骨样灶及钙化灶;皮下脂膜炎系各种原因引起原发或继发的皮下脂肪组织炎症性疾病,如Weber-Christian病或皮下脂肪组织损伤、变性、坏死引起的反应性炎症性病灶,前者可演变为SPTCL[28],其侵袭范围广、增强后强化明显,常有噬血细胞综合征;肌间血管瘤主要由血管内皮细胞构成,为介于错构瘤畸形和真性肿瘤之间的一种较常见的浅表组织良性肿瘤,增强扫描一般具有持续强化、延迟强化及“快进慢出”特性。
MRI由于无辐射且具有任意轴向与多参数成像特点和高组织分辨率、良好的血流动力学解析能力,不失为FHI较好的检查手段,结合DWI能够显著提高鉴别软组织肿瘤良恶性准确性[29];同时,由于本研究样本量较少,FHI的CT、MRI影像表现及其临床意义有待积累更多病例进一步深入研究。
[1] 韩安家,阎晓初,王坚.软组织肿瘤病理诊断免疫组化指标选择专家共识.临床与实验病理学杂志,2015,31(11):1201-1204.
[2] 赖日权,王蔚.婴幼儿和儿童软组织中间型肿瘤的病理诊断.临床与实验病理学杂志,2014,30(11):1282-1286.
[3] Saab ST, McClain CM, Coffin CM. Fibrous hamartoma of infancy: A clinicopathologic analysis of 60 cases. Am J Surg Pathol, 2014,38(3):394-401.
[4] Stensby JD, Conces MR, Nacey NC. Benign fibrous hamartoma of infancy: A case of MR imaging paralleling histologic findings. Skeletal Radiol, 2014,43(11):1639-1643.
[5] Yu GJ, Wang YB, Wang GJ, et al. Fibrous hamartoma of infancy: A clinical pathological analysis of seventeen cases. Int J Clin Exp Pathol, 2015,8(3):3374-3377.
[6] 徐教生,徐子刚,周春菊,等.婴儿纤维性错构瘤12例临床病理分析.中华皮肤科杂志,2015,48(11):807-809.
[7] Carretto E, Dall'Igna P, Alaggio R, et al. Fibrous hamartoma of infancy: An Italian multi-institutional experience. J Am Acad Dermatol, 2006,54(5):800-803.
[8] 张忠德,奚政君,吴湘如,等.婴儿纤维性错构瘤临床病理分析.临床与实验病理学杂志,2006,20(4):427-429.
[9] 侯欣喜,陈罡,罗殿中,等.婴儿纤维性错构瘤3例报道.诊断病理学杂志,2015,22(10):641-643.
[10] 张静,周翔,罗燕,等.婴儿纤维性错构瘤临床及超声表现.中国医学影像技术,2014,30(4):564-567.
[11] Loyer EM, Shabb NS, Mahon TG, et al. Fibrous hamartoma of infancy: MR-pathologic correlation. J Comput Assist Tomogr, 1992,16(2):311-313.
[12] Dickey GE, Sotelo-Avila C. Fibrous hamartoma of infancy: Current review. Pediatr Dev Pathol, 1999,2(3):236-243.
[13] 葛鹏,邹文远,李胜.骶尾部婴儿纤维性错构瘤1例.医学影像学杂志,2015,25(6):1051.
[14] Tassano E, Nozza P, Tavella E, et al. Cytogenetic characterization of a fibrous hamartoma of infancy with complex translocations. Cancer Genet Cytogenet, 2010,201(1):66-69.
[15] Han HJ, Lim GY, You CY. A large infiltrating fibrous hamartoma of infancy in the abdominal wall with rare associated tuberous sclerosis. Pediatric radio, 2009,39(7):743-746.
[16] Togo T, Araki E, Ota M, et al. Fibrous hamartoma of infancy in a patient with Williams syndrome. Br J Dermatol, 2007,156(5):1052-1055.
[17] Lakshminarayanan R, Konia T, Welborn J. Fibrous hamartoma of infancy: A case report with associated cytogenetic findings. Arch Pathol Lab Med, 2005,129(4):520-522.
[18] Rougemont AL, Fetni R, Murthy S, et al. A complex translocation (6;12;8)(q25;q24.3;q13) in a fibrous hamartoma of infancy. Cancer Genet Cytogenet, 2006,171(2):115-118
[19] Agrawal CS, Agrawal S, Sinha A. Fibrous hamartoma of infancy: A case report. Acta Dermato Venereologica, 2005,85(3):276-277.
[20] 常艳华,昝星有,陈文凯,等.伴有皮肤变化的婴儿纤维性错构瘤1例.诊断病理学杂志,2016,23(12):981-982.
[21] Jesus LE, Gameiro VS, Novelli RS, et al. Children's fibrous hamartoma: Extensive injury involving brachial plexus. Acta ortop bras, 2006,14(4):229-230.
[22] Lee S, Choi YH, Cheon JE, et al. Ultrasonographic features of fibrous hamartoma of infancy. Skeletal Radiol, 2014,43(5):649-653.
[23] Choi SH, Hwang JM, Kim N. Orbital fibrous hamartoma of infancy. JAAPOS, 2016,20(1):68-69.
[24] 曹丽,顾学文,王翠梅,等.钙化性腱膜纤维瘤8例临床病理分析.诊断病理学杂志,2015,22(4):193-196.
[25] Guo YK, Ning G, Zhao FM, et al. Fibrous hamartoma of infancy mimicking teratoma in the parapharyngeal space on multidetector row CT. Pediatr Radiol, 2011,41(6):785-787.
[26] McGowan J 4th, Smith CD, Maize Jr, et al. Giant fibrous hamartoma of infancy: A report of two cases and review of the literature. J Am Acad Dermatol, 2011,64(3):579-586.
[27] 艾斌,李鹤虹,刘鸿圣,等.婴儿型纤维肉瘤的临床病理及影像分析.中华放射学杂志,2012,46(7):656-658.
[28] 曾志光,殷晓荣,曾雪峰,等.婴儿结节性脂膜炎演变为儿童皮下脂膜炎样T细胞淋巴瘤1例报告.中国小儿血液与肿瘤杂志,2016,21(5):275-276.
[29] Lee SY, Jee WH, Jung JY, et al. Differentiation of malignant from benign soft tissue tumours: Use of additive qualitative and quantitative diffusion-weighted MR imaging to standard MR imaging at 3.0 T. Eur Radiol, 2016,26(3):743-754.
CTandMRIfeaturesoffibroushamartomaofinfancy:Comparisonwithhistopathology
YANGXiujun1,XIZhengjun2*,LITingting1,WANGXueli2,RENXiang1,FANHongmei1,ZHANGBin1
(1.DepartmentofRadiology, 2.DepartmentofPathology,ShanghaiChildren'sHospital,ShanghaiJiaoTongUniversity,Shanghai200062,China)
ObjectiveTo discuss CT,MRI features of fibrous hamartoma of infancy (FHI) compared with pathology.MethodsCinical data, CT and MRI findings, as well as pathological results of 15 patients with FHI were retrospectively analyzed.ResultsTotally, there were 17 lesions of FHI in 15 cases, including 13 cases with single lesion and 2 cases with double lesions. The lesions manifesting as subcutaneous-, skin- and mixed-type on CT or MR images accounted for 58.82% (10/17), 17.65% (3/17) and 23.53% (4/17), respectively. The subcutaneous- and mixed-type lesions showed "cloud sign" (including "thin-cloud sign" and "thick-cloud sign"). The thin-cloud sign lesions composed mainly of mature adipose tissue, while the triphasic composition ratio of adipose, fibrous and primitive mesenchymal cells were relatively consistent in the lesions with thick-cloud sign. The skin-type lesions showed "mountain-inverted sign", which composed mainly of immature mesenchymal component.ConclusionCT and MRI features of FHI are complex, yet have certain characteristics, which can preferably reflect the histopathological features of FHI.
Soft tissue tumor; Fibrous hamartoma of infancy; Tomography, X-ray computed; Magnetic resonance imaging; Pathology
杨秀军(1965—),男,湖南湘西人,博士,主任医师。研究方向:影像诊断与介入治疗。E-mail: woothingyang2008@126.com
奚政君,上海交通大学附属儿童医院病理科,200062。E-mail: xizj@shchildren.com.cn
2017-06-02
2017-09-05
R738.6; R445
A
1003-3289(2017)11-1705-06
10.13929/j.1003-3289.201706012

