NaCl对反硝化脱硫工艺运行效果的影响
赵东风, 李文斐, 马文娟, 刘春爽, 贾魁莉
(中国石油大学化学工程学院,山东青岛 266580)
NaCl对反硝化脱硫工艺运行效果的影响
赵东风, 李文斐, 马文娟, 刘春爽, 贾魁莉
(中国石油大学化学工程学院,山东青岛 266580)
采用UASB反应器研究当NaCl质量浓度为2~35 g/L时对反硝化脱硫工艺以及微生物群落结构的影响。结果表明:NaCl从2 g/L增加至35 g/L的过程中,提高S∶C∶N至1∶3∶1可以保持高的单质硫产率;反应器内异养反硝化菌属所占比例随NaCl质量浓度的增加而减小,而自养反硝化菌属所占比例却随之增加;NaCl存在时,有机物的增加能够影响亚硝酸盐还原速率,从而使硫化物氧化停留在单质硫阶段,且高质量浓度NaCl条件下兼性自养反硝化微生物能同时参与硫化物的氧化、硝酸盐的反硝化和有机物的降解,使反硝化脱硫工艺维持较好的处理效果。
反硝化脱硫 ;氯化钠; 微生物群落结构; 影响机制
1 材料与方法
1.1 试验装置
采用改进的UASB反应器[9],其反应区内径5 cm,高80 cm,有效容积1.57 L,总容积为3 L。进水采用蠕动泵从反应器底部入口引入,经柱内污泥区生物处理后,产物经三相分离器,部分回流,其余自三角堰经U形管排出,反应器内生成的气体自顶部导气管流出,经吸收瓶吸收后排出。
1.2 试验用水
反硝化脱硫工艺启动所用接种污泥来自青岛市泥布湾污水处理厂二沉池污泥,初始混合液悬浮物(MLSS)为11.1 g/L,挥发性悬浮物(MLVSS)为4.9 g/L,接种量为1.5 L。试验用水采用人工配水,其中进水硫化物、乙酸盐和硝酸盐分别通过投加化学试剂Na2S·9H2O,CH3COONa和KNO3提供,NaHCO3和K2HPO4分别作为无机碳源和磷源,反应pH为7.5±0.2,温度(32±1) ℃,水力停留时间为10 h。
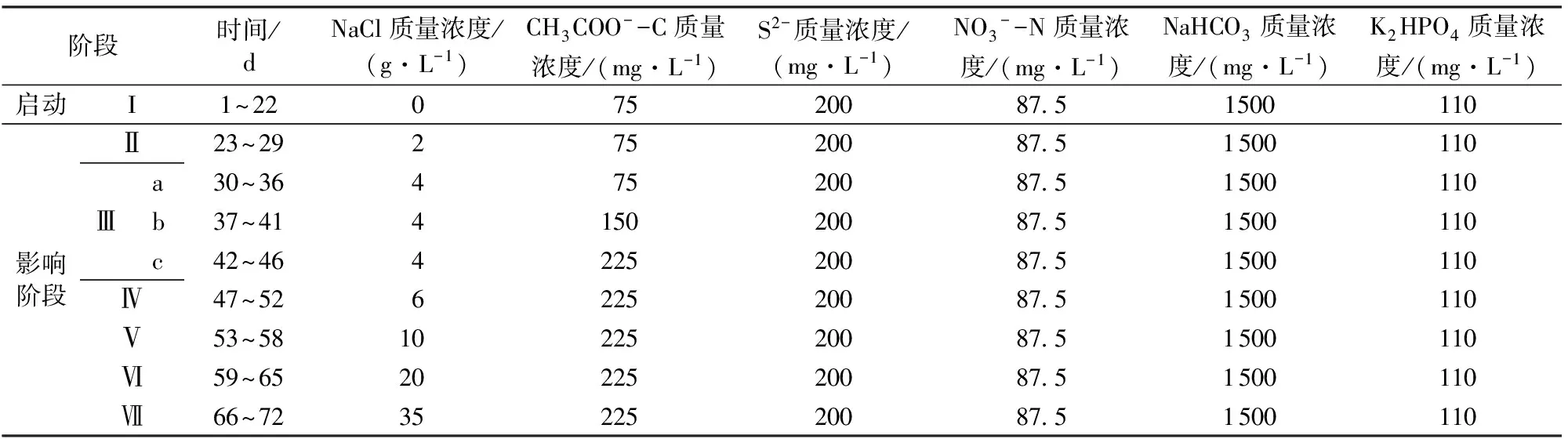
表1 UASB反应器各阶段运行参数
注:背景钠质量浓度为985 mg/L。
1.3 分析指标及方法
反应器出水经0.45 μm滤膜过滤后分别对S2-、NO2--N、NO3--N、SO42-以及CH3COO-进行检测分析[10],其中S2-采用亚甲基蓝分光光度法,NO3--N采用紫外分光光度法,NO2--N采用乙二胺分光光度法,SO42-采用铬酸钡分光光度法,CH3COO-采用离子色谱法;通过硫平衡推算法计算理论上单质硫产率。混合液悬浮物(MLSS)和挥发性悬浮物(MLVSS)测定采用标准重量法。
1.4 微生物群落动态
ESP课程自产生之日起逐渐受到国际语言教育界的重视,并成为应用语言学之下语言教学的一个学科分支,见图1。
从UASB反应器中取各阶段污泥样品于-80 ℃下储存。根据制造商指令对每个样品使用细菌基因组DNA提取试剂盒(MO BIO Laboratories公司)提取总基因组DNA,每个样本2个重复,然后利用1%琼脂糖凝胶电泳检测抽提的基因组DNA并用紫外-可见分光光度计(NanoDrop 2000,USA)对其浓度进行测定。以纯化后的DNA为模板,采用细菌16SrDNA V3-V4区PCR扩增引物为通用引物带338F (5′-ACTCCT ACG GGA GGC AGC AG-3′)和806R (5′-GGACTA CHV GGG TWT CTA AT-3′)对基因进行扩增。20 μL扩增体系主要包含:FastPfu DNA聚合酶(1 U·μL-1) 0.5 μL,5×PCR Buffer 4.0 μL,模板DNA 1 μL,dNTP(2.5 mmol/L)0.5 μL,无菌水14 μL。扩增条件为:95 ℃预变性2 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环,最后72 ℃延伸5 min。通过2.0%琼脂糖凝胶电泳检测PCR产物纯化效果后采用AxyPrep DNA凝胶萃取设备收集。将2个样品16SrRNA 基因的PCR纯化产物等摩尔数混合,利用上海美吉生物医药科技有限公司Illumina Miseq测序平台进行测序分析。
2 结果分析
2.1 NaCl对硫化物的去除及其转化产物的影响
不同NaCl质量浓度下硫化物去除效果及其转化产物的变化情况如图1所示。
由图1可知,反应器启动阶段,即NaCl质量浓度为0 g/L时,硫化物去除率从第14 d开始增加至100%并保持稳定,单质硫产率稳定在约87%。在NaCl质量浓度从2 g/L增加到4 g/L过程中,硫化物去除率一直保持在100%,而出水SO42-的含量从120 mg/L增加至270 mg/L,相对应的单质硫产率为从88%下降至65%。实验在Ⅲb和Ⅲc阶段将CH3COO--C质量浓度增加至150 mg/L和225 mg/L且随后一直保持S∶C∶N=1∶3∶1后,出水SO42-的含量逐渐降低,且最终与进水SO42-的含量基本相等,单质硫产率上升至100%并稳定不变。
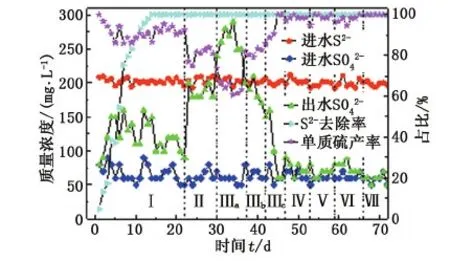
图1 NaCl对硫化物的去除及其转化产物的影响Fig.1 Effects of NaCl on sulfide removal and converted products
2.2 NaCl对硝酸盐和乙酸盐去除的影响
不同NaCl投加量下硝酸盐和乙酸盐的去除效果见图2。

图2 NaCl对硝酸盐和乙酸盐去除效果Fig.2 Effects of NaCl on removal of nitrate and acetate
由图2可知,在NaCl质量浓度从0 g/L增加至4 g/L的过程中,硝酸盐和乙酸盐的去除率下降至约90%,同时出水中有NO2-检出,约为15 mg/L。在Ⅲb和Ⅲc阶段将CH3COO--C质量浓度增加至150 mg/L和225 mg/L并保持不变后,出水NO2-消失,NO3-的去除率恢复至98%以上且随着NaCl质量浓度的增加保持稳定,而CH3COO-的去除率下降至约85%,这可能是提高了CH3COO-基质浓度所致[11-12]。
2.3 NaCl对反硝化脱硫工艺微生物群落结构的影响
分别对接种污泥以及NaCl质量浓度为0、2、10、35 g/L(Ⅰ、Ⅱ、Ⅴ、Ⅶ)4个阶段的污泥取样(标记为样品1、2、3、4、5)进行高通量测序分析。对细菌16sRNA序列在门水平和属水平上的系统分类如图3、4所示。
由图3可知,样品1、2、3、4、5中主要有9个细菌门类,其中1、3、4三个群落均表现出了较高的生物多样性,这五个群落最明显的差异在于Proteobacteria(变形菌门),Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门)分别在各自群落中所占比例的不同。此三个门类的细菌总和分别占菌落总序列数的84.71%(样品1),96.21%(样品2),95.59%(样品3),97.44%(样品4)和97.70%(样品5)。此外,Chloroflexi(绿弯菌门)在样品“5”中的含量最少(0.44%),在样品“1”中的含量最高(2.12%)。
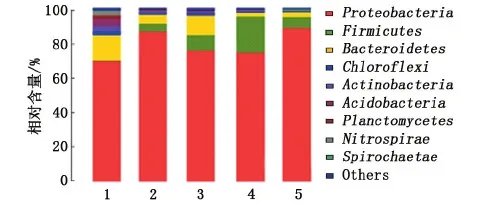
图3 测序序列在门水平上的分布Fig.3 Distribution of DNA sequence at gate level
由图4可知,接种污泥(样品1)群落微生物菌属种类较丰富,分布较为均匀,主要菌属有Chitinophagaceae(11.48%)、Xanthomonadales(9.08%)、Thauera(6.39%)和Piscinibacter(7.10%),其中Chitinophagaceae、Xanthomonadales和Thauera为典型的异养反硝化菌属;Piscinibacter为典型的自养反硝化菌属。
反应器启动完成后(样品2,NaCl质量浓度为0 g/L),污泥内微生物多样性有所降低,这可能是因为污泥微生物在含S、N、C的特定污染物废水中驯化的结果。其中主要的异养反硝化菌属有Thauera(39.24%)、Thermomonas(22.50%);主要的自养反硝化菌属有Arenimonas(9.32%)。与接种污泥相比,异养反硝化菌Thauera、Thermomonas所占比例大幅增加。
当NaCl质量浓度为2、10和35 g/L时,反硝化脱硫反应器内微生物类群分别为Thauera、Thermomonas、Arenimonas和Azoarcus;NaCl质量浓度从2 g/L增加到10 g/L进而增加到35 g/L的过程中,典型的异养反硝化微生物Thauera和Thermomonas所占比例逐渐降低,分别从30.65%和22.50%降低至15.18%和0%;而典型的自养反硝化微生物Azoarcus所占比例大幅增加,从0%增加至37.13%,Arenimonas所占比例变化不大,稳定在约9%。

图4 测序序列在属水平上的分布Fig.4 The distribution of DNA sequence at the genus level
2.4NaCl对反硝化脱硫工艺影响的机制
反硝化脱硫(DSR)工艺之所以将硫化物氧化停留在单质硫阶段,主要因为自养反硝化微生物发生R1途径的代谢速率大于乙酸盐还原硝酸盐为亚硝酸盐的速率;而自养反硝化微生物发生R2途径的代谢速率却要小于异养反硝化微生物发生R3途径的代谢速率[13-16]。当NaCl质量浓度增加到4 g/L(阶段Ⅲa)时,虽然体系中硫化物去除率保持100%不变,但硝酸盐和乙酸盐去除率下降至90%且有NO2-检出,同时SO42-的含量从120 mg/L增加至270 mg/L,单质硫产率下降至65%,这可能是因为当体系内有NaCl存在时,减缓了异养微生物的代谢速率(R2途径)而使得R3途径更容易发生,从而使单质硫因进一步被氧化为SO42-而产率降低。在此条件下,进一步增加进水乙酸盐至225 mg/L (阶段Ⅲc)后,硝酸盐去除率增加至98%以上且不再有NO2-检出,同时,SO42-的含量降低至80 mg/L,单质硫产率上升至100%,这可能是因为乙酸盐浓度的增加使R2途径代谢速率变快,从而促进了单质硫的积累。
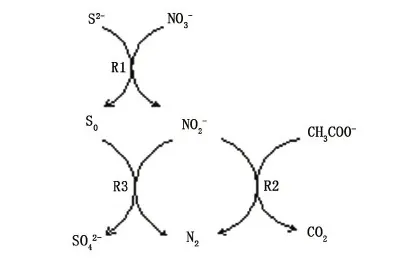
图5 DSR过程代谢途径Fig.5 Metabolic pathways of DSR
NaCl质量浓度从2 g/L增加到35 g/L过程中,尽管自养反硝化微生物所占比例由13.12%增加到74.70%,异养反硝化微生物所占比例由86.88%降低到25.30%,但反应器仍能保持良好的运行效果,硝酸盐去除率超过90%,乙酸盐去除率超过85%,硫化物去除率为100%,去除的硫化物主要以单质硫形式存在,单质硫产率超过65%,这可能是由于反应器内微生物群落中存在一定的兼性自养反硝化微生物[13],当进水中无NaCl或NaCl质量浓度较低时,兼性自养反硝化菌只参与硫化物的氧化和硝酸盐的反硝化,不参与有机物的降解,此时有机物降解主要由异养反硝化微生物完成;但当NaCl质量浓度较高时,兼性自养反硝化菌同时参与硫化物的氧化、硝酸盐的反硝化和有机物的降解,使得异养反硝化微生物所占比例减少的状态下,反硝化脱硫工艺的仍能维持较好的处理效果。
3 结 论
(1)NaCl质量浓度从2 g/L增加至35 g/L的过程中,对反应器中硫化物的去除率无明显影响,但当NaCl质量浓度增加至4 g/L,体系中S∶C∶N=1∶1∶1时,单质硫产率下降至65%,硝酸盐和乙酸盐的去除率下降至约90%;提高进水乙酸盐的浓度至S∶C∶N=1∶3∶1后,随着NaCl质量浓度增加,硝酸盐去除率恢复至98%以上,单质硫产率提高至100%,而高浓度的乙酸盐使得乙酸盐去除率降低至85%。
(2)反硝化脱硫工艺污泥中主要的自养反硝化微生物有Piscinibacter、Arenimonas、Azoarcus,主要的异养微生物有Thauera、Xanthomonadales、Chitinophagaceae和Thermomonas,当NaCl质量浓度由2 g/L增加到35 g/L时,异养微生物所占比例由86.88%下降至25.30%,而自养微生物所占比例由13.12%增加到74.70%。
(3)当体系中S∶C∶N=1∶1∶1时,由于NaCl质量浓度的增加减缓了异养微生物的代谢速率而使得自养反硝化代谢途径更容易发生,因此导致单质硫进一步被氧化为SO42-而产率降低,提高S∶C∶N=1∶3∶1,可以加快异养微生物的代谢速率,维持高的单质硫产率。
(4)反应器内微生物群落中存在一定的兼性自养反硝化微生物,使得随着NaCl质量浓度的增加,异养反硝化微生物所占比例减少的状态下,这些兼性自养反硝化微生物能同时参与硫化物的氧化、硝酸盐的反硝化和有机物的降解,从而使反硝化脱硫工艺维持较好的处理效果。
[1] EFFLER S W, BROOKS C M, AUER M T, et al. Free ammonia and toxicity criteria in a polluted Urban Lake[J]. J Water Pollut Control Fed, 1990,62:771-779.
[2] PETER F, VENKATRAGHAVAN V. Coupled anaerobic/aerobic treatment of high-sulfate wastewater with sulfate reduction and biological sulfide oxidation[J]. Wat Sci Tech, 1996,34:359-366.
[3] CADENA F, PETERS R W. Evaluation of chemical oxidizer for hydrogen sulfide control[J]. J Water Pollut Control Fed, 1988,60:1259-1263.
[4] NG K K, SHI X Q, TANG M K Y, et al. A novel application of anaerobic bio-entrapped membrane reactor for the treatment of chemical synthesis-based pharmaceutical wastewater[J]. Sep Purif Technol, 2014,132(1/2):634-643.
[5] SHI X Q, LEFEBVRE O, NG K K, et al. Sequential anaerobic-aerobic treatment of pharmaceutical wastewater with high salinity[J]. Bioresour Technol, 2014,153(3):79-86.
[6] BERISTAIN-CARDOSO R, TEXIER A C, SIERRA-ALVAREA R, et al. Effect of initial sulfide concentration on sulfide and phenol oxidation under denitrifying conditions[J]. Chemosphere, 2009,74:200-205.
[7] LEE D J, WONG B T, ADAV S S. Azoarcus taiwanensis sp. nov, a denitrifying species isolated from a hot spring[J]. Appl Microbiol Biotechnol, 2014,98(3):1301-1307.
[8] WONG B, LEE D J. Denitrifying sulfide removal and carbon methanogenesis in a mesophilic, methanogenic culture[J]. Bioresour Technol, 2011,102(12):6673-6679.
[9] 刘春爽,李甲国,闫来洪,等.废水中硫化物、硝酸盐和氨氮生物同步去除及其机制[J].化工学报,2015(2):779-784.
LIU Chunshuang, LI Jiaguo, YAN Laihong, et al. Simultaneous biological removal of nitrate, sulfide and ammonia from wastewater and its mechanism[J]. CIESC Journal, 2015(2):779-784.
[10] American Public Health Association. APHA (1998) standard methods for the examination of water and wastewater[S]. Washington D C: American Public Health Association, 1998.
[11] LEE D J, WONG B T. Denitrifying sulfide removal by enriched microbial consortium: Kinetic diagram[J]. Bioresoupce Technology, 2014,164:386-393.
[12] 郜爽. 高碳氮比条件下反硝化脱硫效能及微氧强化生物产硫研究[D].哈尔滨:哈尔滨工业大学,2013.
GAO Shuang. Study of denitrifying sulfide removal process and enrichment of elemental sulfur reclamation under micro-aerobic condition from wastewater of high carbon to nitrogen ration[D]. Harbin: Harbin Institute of Technology, 2013.
[13] GOMMERS P J F, BULEVELD W, KUENEN G. Simultaneous sulfide and acetate oxidation in a denitrifying fluidized bed reactor-Ⅰ[J]. Water Research,1988,22(9):1075-1083.
[14] GOMMERS P J F, BULEVELD W, ZUIDERWIJK F J M, et al. Simultaneous sulfide and acetate oxidation in a denitrifying fluidized bed reactor-Ⅱ[J]. Water Research, 1988,22(9):1085-1092.
[15] JESUS R A, ELIAS R F, JORGE G. Simultaneous biological removal of nitrogen, carbon and sulfur by denitrification[J]. Water Research, 2004,38:3313-3321.
[16] LEE D J, PAN X L, WANG A J, et al. Facultative autotrophic denitrifiers in denitrifying sulfide removal granules[J]. Bioresource Technology, 2013,132:356-360.
(编辑 刘为清)
EffectofNaClondenitrifyingsulfideremovalprocess
ZHAO Dongfeng, LI Wenfei, MA Wenjuan, LIU Chunshuang, JIA Kuili
(CollegeofChemicalEngineeringinChinaUniversityofPetroleum,Qingdao266580,China)
The UASB reactor was used to investigate the effects of NaCl on denitrifying sulfide removal process performance and microbial community structure when concentration of NaCl ranges from 2 g/L to 35 g/L in this study. The results show that high production rate of S in the process could be maintained by increasing the ratio of S∶C∶N up to 1∶3∶1 when concentration of NaCl is increased from 2 g/L to 35 g/L. It is also found that with the increase of NaCl concentration, the proportion of heterotrophic denitrification bacteria decreases instead of the proportion of autotrophic denitrification bacteria increases. When there is NaCl, the increase of organic compounds could influence the reduction rate of nitrite, which keeps the sulfide oxidation at the elemental sulfur stage. Also, the autotrophic denitrification microorganism can simultaneously participate in the sulphide oxidization, denitrification of nitrate, and degradation of organic compounds at high NaCl concentration, which lead to the good results of the denitrifying sulfide removal process.
denitrifying sulfide removal; NaCl; microbial community structure; influencing mechanism
2016-09-13
国家自然科学基金项目(21307160);山东省自然科学基金项目(ZR2013EEQ030);中央高校基本科研业务费专项(16CX02040A)
赵东风(1968-),男,教授,博士,博士生导师,研究方向为安全与环保节能。E-mail: zhaodf@vip.sina.com。
1673-5005(2017)05-0176-05
10.3969/j.issn.1673-5005.2017.05.022
X 703.1
A
赵东风,李文斐,马文娟,等.NaCl对反硝化脱硫工艺运行效果的影响[J].中国石油大学学报(自然科学版),2017,41(5):176-180.
ZHAO Dongfeng, LI Wenfei, MA Wenjuan, et al. Effect of NaCl on denitrifying sulfide removal process[J].Journal of China University of Petroleum (Edition of Natural Science),2017,41(5):176-180.

