快速检测鲤春病毒血症荧光RT-PCR方法的建立与应用
吴 斌 王 红 张 琳 肇慧君
(1.辽宁出入境检验检疫局,辽宁大连 116001;2.大连医科大学,辽宁大连 116044)
快速检测鲤春病毒血症荧光RT-PCR方法的建立与应用
吴 斌1王 红2张 琳1肇慧君1
(1.辽宁出入境检验检疫局,辽宁大连 116001;2.大连医科大学,辽宁大连 116044)
本文建立快速检测鲤春病毒血症的荧光RT-PCR方法。利用同一对引物和探针,以梯度稀释的方法测定荧光RT-PCR法针对SVCV的灵敏性、特异性及重现性。荧光RT-PCR方法能够检测出104倍稀释的SVCV,灵敏度性高。同时,该方法的特异性很强,对其他病毒,如传染性胰腺坏死病毒(IPNV)、传染性造血器官坏死病毒(IHNV)、病毒性出血败血病毒(VHSV)均未有扩增反应。方法的重现性也较好。荧光RT-PCR具有较高的灵敏度特异性和重现性,在鱼类疫病的早期快速诊断方面具有重要作用。
鲤春病毒血症(SVC);荧光RT-PCR;灵敏性;特异性;重现性
鲤春病毒血症(Spring Viraemia of Carp,SVC)又称鲤鱼传染性腹水症,是一种急性、出血性、传染性败血病[1]。该病可以危害鲤鱼、鲶鱼、鲫鱼、鲢鱼、鳙鱼等[2],在欧、亚两洲均有流行。鲤春病毒血症是鱼类口岸检疫的第一类检疫对象,世界动物卫生组织(OIE)将其列为需要向申报的疫病,我国农业部定为一类动物疫病。荧光RT-PCR法能够简单方便、特异性的、高灵敏性的定量病毒RNA,由于不用处理PCR产物,检测过程中污染和假阳性出现的概率得到了有效的降低,检测效率得到了极大的提高,而且通过融解曲线、探针等方式还可以防止非特异性扩增,故荧光RT-PCR法正在逐渐取代常规RT-PCR法。
1 材料与方法
1.1 材料
1.1.1 病毒
实验所用的病料、细胞系(鲤鱼上皮瘤细胞EPC等)、病毒(鲤春病毒SVCV、传染性胰脏坏死病毒IPNV、传染性造血器官坏死病毒IHNV、病毒性出血性败血病毒VHSV)等均为本实验室保存。
1.1.2 仪器和试剂
仪器:LC480Real-time RT-PCR System;
试剂:One step prime script RT-RT-PCR kit,购自宝生物(大连)有限公司。
1.2 方法
1.2.1 引物和探针的设计
选取SVCV的糖蛋白基因,由宝生物(大连)有限公司合成,序列如表1所示。
1.2.2 RNA的提取
按照宝生物试剂盒提取。将提取的RNA作为原始模板,分别稀释107,106,105,104,103,102,101倍,于-20℃冰箱中保存备用。
1.2.3 荧光RT-PCR试验
将SVCV稀释模板107、106、105、104、103、102、101、NTC(H2O)进行实验,重复四次,得到扩增曲线及Ct值。
1.2.4 样品检测
通过饲料浸毒、1:5000饲养水投毒、人工注射背鳍三种方式进行人工感染鲤鱼鱼苗,选取出现SVCV典型病症的病鱼两条,进行验证。
1.2.5 数据分析
利用SDS软件对建立的荧光RT-PCR反应体系进行数据分析,查看扩增曲线及Ct值,在结果的判断过程中,主要以扩增曲线是否为“S”型和荧光值的大小作为判断标准。
2 结果与分析
2.1 灵敏性实验结果
将SVCV样本进行10倍系列稀释,每个稀释度做4个平行,进行荧光RT-PCR试验。图1表示SVCV各个稀释度的扩增曲线。其中X轴代表PCR反应循环数,Y轴代表荧光信号强度。从图1中可以看出,SVCV稀释度107-101的7个数量级范围内的荧光RT-PCR均有“S”型扩增曲线,反映了PCR的指数增长期、线性增长期、平台期三个阶段,并且阴性对照没有扩增。同时,每个稀释度的4个平行扩增曲线基本吻合,表明实验的重复性很好。图1表示SVCV的101CT值为32.48,有典型的扩增曲线,因此可初步判定检测低限大于101。
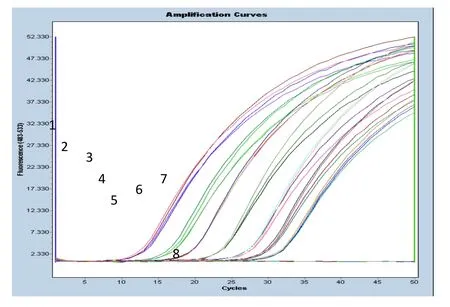
图1 SVCV荧光RT-PCR的扩增曲线

表1 SVCV引物和探针序列
2.2 特异性实验结果
以SVCV、IPNV、VHSV、IHNV的核酸作为模板,进行荧光RT-PCR检测。结果如图2所示,本实验针对SVCV糖蛋白基因设计的引物和Tagman探针能够特异性地检测出SVCV,而不能检测出其他三种病毒。
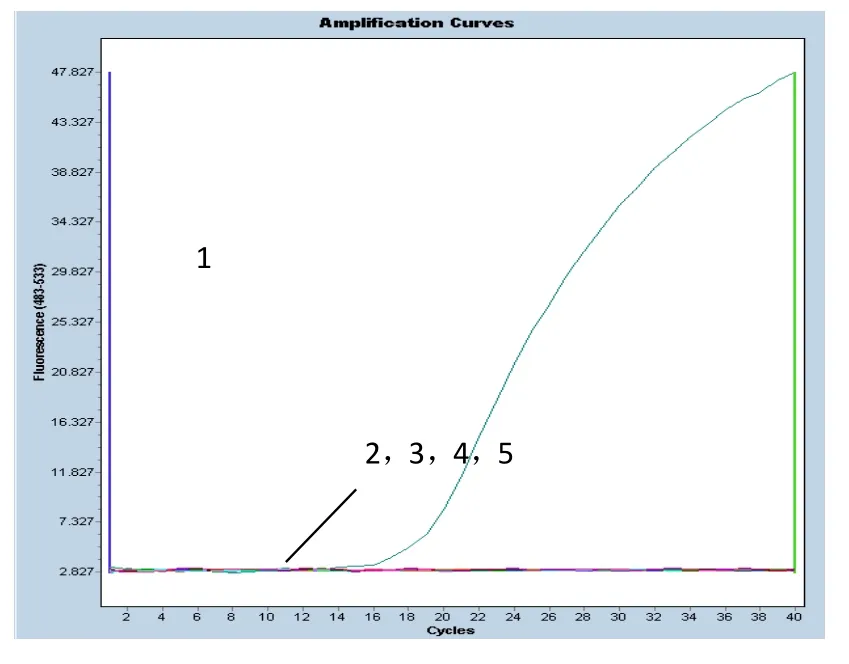
图2 SVCV特异性检测结果
2.3 重现性实验结果
经过8次重现试验得到荧光RT-PCR检测结果,如表2所示。由表2可知,8次重复性试验得到Ct值的标准误差在0.36~1.31之间,误差较小,表明本文建立的荧光RT-PCR方法重现性较好。

表2 SVCV重现性实验结果(mean±SE)
2.4 标准曲线的建立
进一步分析扩增曲线,发现指数增长期的曲线平行,反映了PCR扩增效率相近;而不同稀释度之间的CP相差均匀,符合荧光RT-PCR的CP值与起始拷贝数之间严格的线性关系。根据拷贝数与CP值的相关性,由LightCycler480 Software1.5软件直接得到标准曲线,如图3。横坐标代表质粒稀释度的对数值(X),纵坐标为CP值。图3为软件生成的SVCV标准曲线,拷贝数(X)与CP(Y)值得关系为:CP=-3.33lgX+32.00,其扩增效率为1.882,Error为0.0297。CP值与浓度的对数值均有非常好的线性关系,以4次重复性实验结果制作标准曲线,主要是避免实验操作、设备等因素对实验结果的影响。
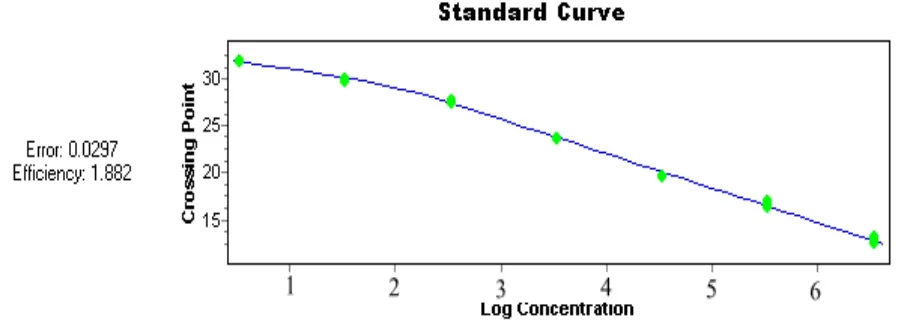
图3 SVCV 荧光RT-PCR标准曲线
2.5 样品检测
采用本文建立的荧光RT-PCR法对人工感染鲤鱼进行检测。以质粒、病毒RNA、人工感染鲤鱼组织RNA、水,分别作为阳性对照、样本、阴性对照和空白对照,防止出现假阳性和假阴性结果。结果表明,阳性对照出现典型的“S”扩增曲线,而阴性对照和空白对照均没有出现扩增,对照组实验均成立,可排除假阳性、假阴性结果。图4中,人工感染鲤鱼组织RNA均出现“S”型扩增曲线,其CP值分别为18.22、21.04,利用图3的标准曲线可计算出人工感染的鲤鱼中SVCV含量为104.14和103.29。
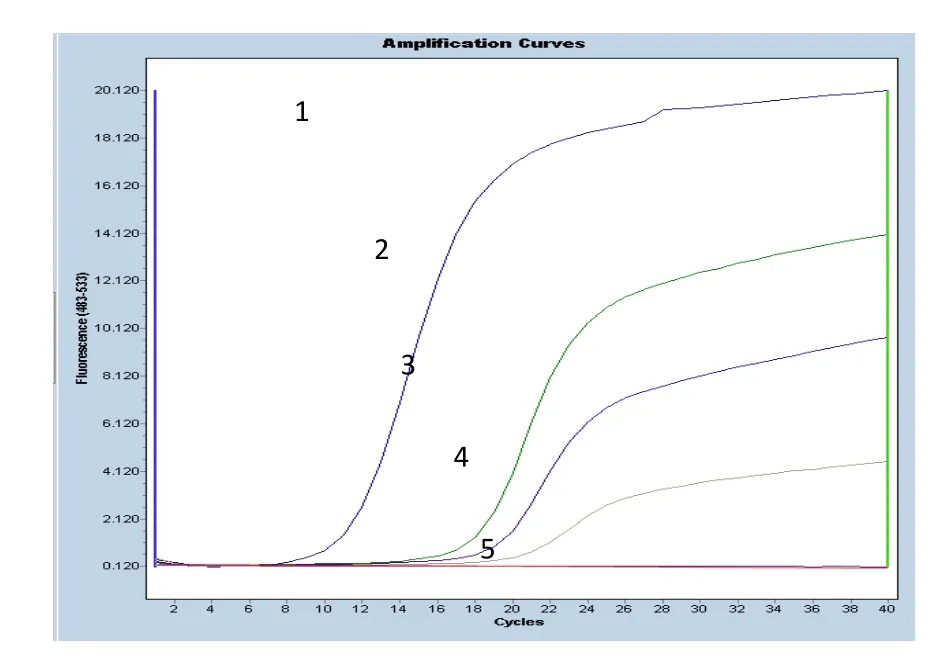
图4 人工感染SVCV鲤鱼检测结果
3 结论
传统的SVCV诊断方法是对病毒先进行细胞培养,再通过ELISA等方法进行鉴定,这些方法往往耗时较长,而SVCV难以制备高效价抗体[5]。开发快速灵敏、能够定量检测病毒的方法,不仅对疾病的诊断,也为在分子水平上研究病毒感染,包括流行病学,发病机制和宿主细胞相互作用等各个方面具有重要意义。本文中的荧光RT-PCR检测方法,操作简单、速度快、灵敏度高、定量准确、特异性高。该方法可在短时间内进行大批量样品的检测,非常适合鱼类病毒的快速检测。在水产养殖中,可以对SVCV进行早期诊断,及时切断其传播途径,从而保护水产养殖业的健康发展。
[1]景宏丽,张昊,王娜,等.鲤春血症病毒单克隆抗体建立及免疫学特性鉴定[J].检验检疫学刊,2014,(3):55-59.
[2]Reschova S,Pokorova D,Nevorankova Z,et al.Detection of spring viraemia of carp virus(SVCV)with monoclonal antibodies[J].Veterinarni Medicina,2007,(7):308-316.
[3]徐敏,向华.流感病毒核酸检测方法研究进展[J].动物医学进展,2011,32(1):89-92.
[4]高隆英,史秀杰,刘荭,等.用RT-PCR法快速检测鲤春病毒血症病毒基因[J].水生生物学报,2002,(26):452-456.
国家质检公益项目(201410059)
吴斌(1968—),女,辽宁大连人,博士研究生,研究员,主要从事水生动物疫病研究。