沉默HMGB1基因对非小细胞肺癌细胞上皮间质转化的影响及作用机制
蒲江涛,唐小军,宋琦,胡智,何开明,吴云飞,戴天阳
(西南医科大学附属医院,四川泸州646000)
沉默HMGB1基因对非小细胞肺癌细胞上皮间质转化的影响及作用机制
蒲江涛,唐小军,宋琦,胡智,何开明,吴云飞,戴天阳
(西南医科大学附属医院,四川泸州646000)
目的探讨沉默高迁移率族蛋白1(HMGB1)基因对非小细胞肺癌细胞上皮间质转化(EMT)的影响及其作用机制。方法取传3代非小细胞肺癌A549细胞,随机分为si- HMGB1组、阴性对照组、空白组。si- HMGB1组、阴性对照组分别转染HMGB1 siRNA序列、阴性对照siRNA序列,空白组不予转染。各组继续孵育72 h,检测HMGB1 mRNA表达。收集各组孵育72 h细胞,采用Western blotting法检测EMT相关蛋白(E- cadherin、VDR、N- cadherin、Vimentin)和TGF- β/Smad信号通路相关蛋白(Snail、NF- κB p65、p- NF- κB p65)表达。结果si- HMGB1组HMGB1 mRNA相对表达量明显低于阴性对照组和空白组(P均<0.05),而阴性对照组与空白组比较P>0.05。si- HMGB1组E- cadherin、VDR蛋白相对表达量明显高于阴性对照组和空白组(P均<0.05),N- cadherin、Vimentin蛋白相对表达量明显低于阴性对照组和空白组(P均<0.05),而阴性对照组与空白组各EMT相关蛋白相对表达量比较P均>0.05。si- HMGB1组Snail、p- NF- κB p65蛋白相对表达量明显低于阴性对照组和空白组(P均<0.05),而阴性对照组与空白组比较P均>0.05。三组间NF- κB p65蛋白相对表达量比较P均>0.05。结论沉默HMGB1基因能够逆转非小细胞肺癌细胞EMT,其机制可能与阻断Snail/NF- κB信号通路有关。
非小细胞肺癌;高迁移率族蛋白1;上皮间质转化;基因沉默
肺癌是我国发病率最高的恶性肿瘤之一,其中70%~80%为非小细胞肺癌。绝大多数非小细胞肺癌患者就诊时已出现侵袭和转移,丧失了最佳手术时机,5年生存率不超过15%[1]。上皮间质转化(EMT)是调控肿瘤侵袭和转移的始动因素之一,且与肿瘤细胞的放疗抵抗和化疗耐药密切相关[2,3]。高迁移率族蛋白1(HMGB1)是一种高度保守的核蛋白,在哺乳动物细胞中广泛存在。有研究发现,HMGB1在肝癌、卵巢癌等细胞中高表达,并与肿瘤的侵袭和转移密切相关,其机制可能是通过HMGB1介导EMT而实现的[4]。但在肺癌细胞中HMGB1与EMT的关系及其可能的作用机制尚不清楚。2017年2~5月,本研究通过小干扰RNA(siRNA)技术沉默非小细胞肺癌A549细胞HMGB1基因,观察其对EMT的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 材料 非小细胞肺癌细胞株A549,购自中国科学院上海细胞库。HMGB1 siRNA片段由上海吉凯基因化学技术有限公司设计合成,靶序列:GGAGAACGCCCGTTATGAA,正义链:5′- GGACAAC-GCCGGUUAUGAA- 3′,反义链:3′- CCUGUUGCGGCC-AAUAGUU- 5′。阴性对照siRNA序列,美国Invitrogen公司。7500型实时荧光定量PCR仪,美国ABI公司;凝胶成像分析系统,美国Bio- Rad公司;垂直电泳槽,美国GE公司;连续光谱酶标仪,美国Molecular Devvices公司;DU800型紫外/可见光分光光度计,美国Beckman Coulter公司。RPMI 1640培养基,美国Gibco公司;TRIzol试剂、RT- PCR试剂盒、Lipofectamine 2000,美国Invitrogen公司;M- MLV逆转录酶、RNase抑制剂、dNTP,宝生物工程(大连)有限公司;RIPA裂解液、胰蛋白酶、二甲基亚砜(DMSO)、BCA蛋白浓度测定试剂盒,广州碧云天生物技术研究所。Transwell小室、Matrigel人工基底膜,美国BD公司。抗HMGB1(1∶100)、抗NF- κB p65(1∶100)、p- NF- κB p65(1∶100)、抗GAPDH(1∶200),武汉博士德生物工程有限公司;抗E- cadherin(1∶100)、抗VDR(1∶50)、抗N- cadherin(1∶100)、抗Vimentin(1∶200),江苏碧云天生物技术研究所;抗Snail(1∶100),生工生物工程(上海)股份有限公司;辣根过氧化物酶标记的山羊抗小鼠IgG二抗(1∶4 000)、聚丙烯酰胺、PVDF膜、十二烷基硫酸钠,美国Sigma公司。
1.2 细胞培养 将非小细胞肺癌A549细胞接种于RPMI 1640培养基(含10% FBS、100 U/mL青霉素和100 mg/mL链霉素),37 ℃、5% CO2细胞培养箱中常规培养,每2~3天更换1次培养基,每3天传代1次,取传3代细胞用于后续实验。
1.3 沉默HMGB1基因及效果验证 取传3代对数生长期细胞,0.125%胰蛋白酶消化,加入不含血清的PRMI 1640培养基重悬,使细胞悬液密度为1.5×105个/mL,然后接种于6孔板,每孔2×104个。随机将细胞分为si- HMGB1组、阴性对照组、空白组。si- HMGB1组每孔加入Lipofectamine 2000 5 μL、HMGB1 siRNA干扰序列5 μL和不含血清的培养基500 μL;阴性对照组每孔中加入Lipofectamine 2000 5 μL、阴性对照siRNA 5 μL和不含血清的培养基500 μL;空白组仅加入不含血清的培养基500 μL。所有细胞在37 ℃、5% CO2细胞培养箱中孵育72 h。 采用RT- PCR法验证HMGB1基因沉默效果。收集各组孵育72 h生长状态良好细胞,采用TRIzol法提取细胞总RNA,紫外分光光度计检测260、280 nm波长处的吸光度(A)值,A260/A280>2.0表示细胞总RNA纯度合格。取总RNA 2 μL,按照逆转录试剂盒说明逆转录为cDNA,然后按SYBRPremix ExTaqⅡ试剂盒说明进行PCR扩增。引物序列:HMGB1上游引物:5′- ATGCCTGTAACAAAGAAGCCCC- 3′,下游引物:5′- CACACAGTTGCCCCCGTTTTTAC- 3′;GAPDH上游引物:5′- ATGTCGTGGAGTCTACTGGC- 3′,下游引物:5′- TGACCTTGCCCACAGCCTTG- 3′。PCR反应体系:ddH2O 8 μL,2×SYBR Green Ⅰ Master 10 μL,DNA模板2 μL,上下游引物各0.5 μL;反应条件:95 ℃预变性30 s,95 ℃变性10 s,60 ℃延伸40 s,35个循环后,74 ℃延伸5 min。以GAPDH为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。结果显示,阴性对照组HMGB1 mRNA相对表达量为0.043±0.002、空白组为0.045±0.005、si- HMGB1组为0.007±0.001。si- HMGB1组HMGB1 mRNA相对表达量明显低于阴性对照组和空白组(P均<0.05),而阴性对照组与空白组比较P>0.05。
1.4 EMT相关蛋白及TGF- β/Smad信号通路相关蛋白表达检测
1.4.1 E- cadherin、VDR、N- cadherin、Vimentin蛋白表达 采用Western blotting法。取各组传3代对数生长期细胞,RIPA裂解液充分裂解,4 ℃、2 500 r/min离心20 min,留取上清液。BCA法蛋白定量合格后,移至EP管中,加入等量上样缓冲液,100 ℃水浴5 min,行SDS- PAGE,并转印至PVDF膜上,5%脱脂牛奶封闭2 h,分别加入E- cadherin、VDR、N- cadherin、Vimentin抗体,4 ℃孵育过夜;PBS冲洗3次,加入辣根过氧化物酶标记的二抗,室温振荡孵育2 h;PBS冲洗3次,ECL显色,凝胶成像分析系统采集图像。以GAPDH为内参,以目的蛋白电泳条带灰度值与GAPDH蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3次,取平均值。
1.4.2 Snail、NF- κB p65、p- NF- κB p65蛋白表达 采用Western blotting法。加入的一抗分别为Snail、NF- κB p65、p- NF- κB p65抗体,其余操作同1.4.1。

2 结果
2.1 各组E- cadherin、VDR、N- cadherin、Vimentin蛋白表达比较 见表1。
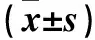
表1 各组E- cadherin、VDR、N- cadherin、Vimentin 蛋白相对表达量比较
注:与空白组比较,*P<0.01;与阴性对照组比较,#P<0.01。
2.2 各组Snail、NF- κB p65、p- NF- κB p65蛋白表达比较 见表2。
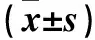
表2 各组Snail、NF- κB p65、p- NF- κB p65 蛋白相对表达量比较
注:与空白组比较,*P<0.01;与阴性对照组比较,#P<0.01。
3 讨论
EMT是肿瘤上皮细胞获得侵袭和迁移能力的主要机制。在EMT过程中,上皮细胞从原来的致密圆形变成细长梭形,在细长的胞体末端形成丝状伪足,使细胞获得运动能力[5];细胞间的黏附力减弱,排列疏松,细胞逐渐从原部位脱离并侵袭至细胞间,继而进入血液或淋巴循环,最终发生远处转移[6]。EMT的主要特征为上皮标志物(如E- cadherin、VDR)表达缺失,而间质标志物(如N- cadherin、Vimentin)表达增加。Avtanski等[7]研究发现,在EMT过程中,肺癌上皮细胞逐渐失去原来的极性,即从顶-底极性转化为前-后极性,继而使肺癌细胞的侵袭和迁移能力增强。
HMGB1是哺乳动物细胞中普遍存在的核蛋白。既往研究认为,HMGB1在细胞中发挥类似炎症因子的作用,可介导激活免疫系统,引起局部或全身炎症反应[8]。近年研究显示,HMGB1可在TNF- α的刺激下诱导肿瘤细胞的侵袭和迁移等生物学行为[9];侵袭期肿瘤细胞分泌的HMGB1能够与特异性受体晚期糖基化蛋白(RAGE)结合,并激活基质金属蛋白酶2(MMP- 2)和MMP- 9,导致纤维蛋白溶酶发生级联反应,使细胞外基质发生降解,最终诱导肿瘤细胞侵袭和迁移[10];HMGB1/RAGE复合物激活后能够调节肝癌细胞的增殖和侵袭,而抑制HMGB1则可抑制肝癌细胞生长,提示HMGB1或与肝癌的发生和转移有关[11]。HMGB1能够调控上皮标志物E- cadherin和间质标志物Vimentin等表达,提示HMGB1可促进EMT的发生[12]。HMGB1过表达可诱导肿瘤细胞由上皮表型向间质表型转化,故沉默HMGB1基因可能抑制肿瘤的侵袭和转移[13]。
有研究发现,HMGB1能够通过抑制NF- κB信号通路的p63蛋白表达抑制乳腺癌细胞发生EMT,继而阻断乳腺癌的侵袭和转移[14]。Zhang等[15]采用真核载体pc- DNA3.1将HMGB1转染至卵巢癌细胞中发现,细胞中E- cadherin、VDR表达明显降低,N- cadherin、Vimentin表达明显上升,提示HMGB1能够促进细胞发生EMT。既往研究认为,HMGB1过表达能够抑制凋亡因子Caspase- 3、Caspase- 9的活性,具有抑制细胞凋亡作用[16]。Leite等[17]利用荧光素酶报告基因发现,高表达HMGB1可使NF- κB活化,并诱导抗凋亡NF- κB靶基因高表达,使抗凋亡蛋白C- IAP2 mRNA表达增加,从而增强肿瘤细胞的增殖能力。Liang等[18]通过沉默HMGB1使内皮生长因子刺激的易感性上调,导致细胞外信号调节激酶磷酸化,可加速细胞周期进展,进而促进细胞增殖。本研究采用siRNA技术沉默非小细胞肺癌A549细胞HMGB1基因,结果显示si- HMGB1组细胞形态发生明显改变,即从上皮表型向间质表型转化;抑制非小细胞肺癌A549细胞HMGB1表达后,上皮标志物E- cadherin、VDR表达明显增加,而间质标志物N- cadherin、Vimentin表达明显降低,说明抑制HMGB1表达能够逆转非小细胞肺癌A549细胞EMT。推测HMGB1可能为抑制非小细胞肺癌细胞EMT的作用靶点。
TGF- β/Smad信号通路是调控器官形成和干细胞活性的重要信号通路。目前关于HMGB1与TGF- β/Smad信号通路关系的报道较少。有研究认为,TGF- β/Smad信号通路能定向调节干细胞向肿瘤发展[19,20]。蔡琳等[21]研究认为,HMGB1能够激活NF- κB和活化素信号,进而触发EMT。Cheng等[22]研究亦证实,上调HMGB1表达能增加TGF- β表达,并激活Snail,使Smad2/3与Smad4结合,抑制上皮细胞标志性蛋白表达和促进间质细胞标志性蛋白表达,从而促进EMT。本研究阴性对照组、空白组Snail、p- NF- κB p65蛋白相对表达量明显高于si- HMGB1组,说明沉默HMGB1基因能够抑制TGF- β/Smad信号通路。靶向沉默HMGB1可能通过阻断TGF- β/Smad信号通路,逆转非小细胞肺癌细胞EMT。
综上所述,沉默HMGB1基因能够逆转非小细胞肺癌细胞EMT,其作用机制可能与阻断TGF- β/Smad信号通路有关。
[1] 蒋晓岚,王佳.非小细胞肺癌骨转移患者预后影响因素分析[J].山东医药,2016,56(35):88- 90.
[2] Kim SJ, Chung TW, Choi HJ, et al. Ganglioside GM3 participates in the TGF- β1- induced epithelial- mesenchymal transition of human lens epithelial cells[J]. Biochem J, 2013,449(1):241- 251.
[3] Engelsvold DH, Utheim TP, Olstad OK, et al. miRNA and mRNA expression profiling identifies members of the miR- 200 family as potential regulators of epithelial- mesenchymal transition in pterygium[J]. Exp Eye Res, 2013(115):189- 198.
[4] Zhu L, Li X, Chen Y, et al. High- mobility group Box 1: a novel inducer of the epithelial- mesenchymal transition in colorectal carcinoma[J]. Cancer Lett, 2015,357(2):527- 534.
[5] Lange T, Samatov TR, Tonevitsky AG, et al. Importance of altered glycoprotein- bound N- and O- glycans for epithelial- to- mesenchymal transition and adhesion of cancer cells[J]. Carbohydr Res, 2014(389):39- 45.
[6] Rizvi I, Gurkan UA, Tasoglu S, et al. Flow induces epithelial- mesenchymal transition, cellular heterogeneity and biomarker modulation in 3D ovarian cancer nodules[J]. Proc Natl Acad Sci U S A, 2013,110(22):1974- 1983.
[7] Avtanski DB, Nagalingam A, Bonner MY, et al. Honokiol inhibits epithelial- mesenchymal transition in breast cancer cells by targeting signal transducer and activator of transcription 3/Zeb1/E- cadherin axis[J]. Mol Oncol, 2014,8(3):565- 580.
[8] Kwak MS, Lim M, Lee YJ, et al. HMGB1 binds to lipoteichoic acid and enhances TNF- α and IL- 6 production through HMGB1- mediated transfer of lipoteichoic acid to CD14 and TLR2[J]. J Innate Immun, 2015,7(4):405- 416.
[9] 何贤辉,欧阳东云.细胞自噬与高迁移率族蛋白B- 1(HMGB1)介导肿瘤耐药的研究进展[J].暨南大学学报(医学版),2011,32(2):126- 130,140.
[10] Cheng P, Dai W, Wang F, et al. Ethyl pyruvate inhibits proliferation and induces apoptosis of hepatocellular carcinoma via regulation of the HMGB1- RAGE and AKT pathways[J]. Biochem Biophys Res Commun, 2014,443(4):1162- 1168.
[11] 郭云娣,白光辉.胃癌组织HMGB1和RAGE蛋白表达与临床病理因素相关性分析[J].中华肿瘤防治杂志,2014,21(9):684- 687,691.
[12] Chung HW, Jang S, Kim H, et al. Combined targeting of high- mobility group box- 1 and interleukin- 8 to control micrometastasis potential in gastric cancer[J]. Int J Cancer, 2015,137(7):1598- 1609.
[13] 李增军,王海鹏,宋宝,等.RNA干扰沉默高迁移率族蛋白B1的表达对结直肠癌LoVo细胞增殖和侵袭的抑制作用[J].中华肿瘤杂志,2015,37(9):664- 670.
[14] Yang Y, Wang J, Yang Q, et al. Shikonin inhibits the lipopolysaccharide- induced release of HMGB1 in RAW264.7 cells via IFN and NF- κB signaling pathways[J]. Int Immunopharmacol, 2014,19(1):81- 87.
[15] Zhang CC, Gdynia G, Ehemann V, et al. The HMGB1 protein sensitizes colon carcinoma cells to cell death triggered by pro- apoptotic agents[J]. Int J Oncol, 2015,46(2):667- 676.
[16] Dhumale SS, Waghela BN, Pathak C. Quercetin protects necrotic insult and promotes apoptosis by attenuating the expression of RAGE and its ligand HMGB1 in human breast adenocarcinoma cells[J]. IUBMB Life, 2015,67(5):361- 373.
[17] Leite PE, Lima- Araújo KG, Franca GR, et al. Implant of polymer containing pentacyclic triterpenes from eugenia punicifolia inhibits inflammation and activates skeletal muscle remodeling[J]. Arch Immunol Ther Exp (Warsz), 2014,62(6):483- 491.
[18] Liang Y, Hou C, Kong J, et al. HMGB1 binding to receptor for advanced glycation end products enhances inflammatory responses of human bronchial epithelial cells by activating p38 MAPK and ERK1/2[J]. Mol Cell Biochem, 2015,405(1- 2):63- 71.
[19] Zhang L, Ji Y, Kang Z, et al. Protocatechuic aldehyde ameliorates experimental pulmonary fibrosis by modulating HMGB1/RAGE pathway[J]. Toxicol Appl Pharmacol, 2015,283(1):50- 56.
[20] Devine DJ, Rostas JW, Metge BJ, et al. Loss of N- Myc interactor promotes epithelial- mesenchymal transition by activation of TGF- β/SMAD signaling[J]. Oncogene, 2014,33(20):2620- 2628.
[21] 蔡琳,阮志燕,徐军.HMGB1 RNAi抑制TGF- β1诱导的A549细胞系EMT[J].基础医学与临床,2015,35(2):183- 186.
[22] Cheng M, Liu H, Zhang D, et al. HMGB1 enhances the AGE- induced expression of CTGF and TGF- β via RAGE- dependent signaling in renal tubular epithelial cells[J]. Am J Nephrol, 2015,41(3):257- 266.
EffectofsilencingHMGB1onepithelialmesenchymaltransitionofnon-small-celllungcancer
PUJiangtao,TANGXiaojun,SONGQi,HUZhi,HEKaiming,WUYunfei,DAITianyang
(TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
ObjectiveTo explore the effect of high mobility group box 1 (HMGB1) on epithelial mesenchymal transition (EMT) of non- small- cell lung cancer (NSCLC) and its mechanism.MethodsNSCLC A549 cells in the third generation were randomly divided into the si- HMGB1 group, negative control group, and blank group. Cells in the si- HMGB1 group and negative control group were transfected with HMGB1 small interfering RNA (siRNA) sequence, HMGB1 negative control siRNA transfection, and cells in the blank group were not transfected. After 72 h, the HMGB1 silencing efficiency of each group was verified. The expression of EMT- related proteins (E- cadherin, V- cadherin, Vimentin) and signal pathway- related proteins (Snail, NF- κB p65, p- NF- κB p65) in cells collected after 72- hour transfection was detected by Western blotting.ResultsThe expression of HMGB1 mRNA in the si- HMGB1 group was significantly lower than that in the negative control group and blank group (P<0.05), and there was no significant difference between the negative control group and the blank group (P>0.05). The protein expression of E- cadherin and VDR of the si- HMGB1 group was significantly higher, and the protein expression of N- cadherin and Vimentin was significantly lower than that of the negative control group and blank group (allP<0.05), and there was no significant difference between the negative control group and the blank group (P>0.05). The expression of Snail, p- NF- κB p65 protein of the si- HMGB1 group was lower than that of the negative control group and the blank group (P<0.05), and there was no significant difference between the negative control group and the blank group (P>0.05). No significant difference was found in the expression of p- NF- κB p65 among these three groups (allP>0.05).ConclusionHMGB1 silencing can reverse the EMT process in A549 cells by blocking the Snail/NF- κB signaling pathway.
non- small- cell lung cancer; high mobility group box 1; epithelial mesenchymal transition; gene silencing
卫生部医药卫生科技发展研究(卫技中[2011]24号)。
蒲江涛(1972- ),男,副教授,主要研究方向为肺癌、肺移植、胸部微创等。E- mail: pujiangtao72@sina.com
10.3969/j.issn.1002- 266X.2017.36.002
R734.2
A
1002- 266X(2017)36- 0005- 04
2017- 04- 21)

