环形铁粒幼细胞水平变化与MDS患者染色体核型、基因突变及预后的关系
谢宇端,郭洁,董国伟,韩艳,李延伟,肖林娜,孙磊
(中国中医科学院望京医院,北京100102)
环形铁粒幼细胞水平变化与MDS患者染色体核型、基因突变及预后的关系
谢宇端,郭洁,董国伟,韩艳,李延伟,肖林娜,孙磊
(中国中医科学院望京医院,北京100102)
目的探讨环形铁粒幼细胞(RS)水平变化与骨髓增生异常综合征(MDS)患者染色体核型、基因突变及预后的关系。方法取203例MDS患者的血液及骨髓样本,检测血红蛋白、白细胞、血小板;行骨髓细胞形态学检查,观察红系增生、病态造血(红系巨幼变),计算RS占有核红细胞比例。RS计数<15%者为非RS增高MDS组(n=139)、≥15%者为RS增高MDS组(n=64);骨髓原始细胞计数<5%分为低原始细胞非RS增高MDS组(n=47)、低原始细胞RS增高MDS组(n=53),骨髓原始细胞数≥5%分为非RS增高难治性贫血伴原始细胞增多(RAEB)组(n=92)、RS增高RAEB组(n=11)。用染色体图像自动分析系统进行染色体核型分析;用实时定量PCR法检测基因突变率。通过电话、门诊复诊等方式对患者进行随访,记录生存时间。采用COX回归模型分析MDS患者预后影响因素。结果与非RS增高MDS组比较,RS增高MDS组年龄、白细胞计数、血小板计数、红系增生程度及巨幼变阳性率、基因突变率高(P均<0.05);与低原始细胞非RS增高MDS组比较,低原始细胞RS增高MDS组以上指标高(P均<0.05);与非RS增高RAEB组比较,RS增高RAEB组白细胞计数、红系增生程度高,核型分布较差(P均<0.05)。伴RS增高组的中位生存时间短于非RS增高组(P<0.05)。采用COX回归模型分析结果显示,RS是MDS患者预后的独立影响因素。结论RS水平升高的MDS患者染色体核型分布差、基因突变率高、预后差。
骨髓增生异常综合征;环形铁粒幼细胞;染色体核型;基因突变率;预后
骨髓增生异常综合征(MDS)是一种后天疾病,由造血干细胞、祖细胞发育异常引起,最早起源于某个造血干细胞、祖细胞,故称为克隆性造血异常。此种造血细胞的发育异常导致无效造血,即造血质量差。骨髓中发育异常的血细胞形态异常,统称为病态造血[1]。其病因至今未明。MDS患者存在染色体异常、癌基因和抑癌基因突变及骨髓造血干细胞、祖细胞体外培养生长异常、多种免疫功能异常[2]。部分MDS患者缓慢地向急性白血病转化[3],故MDS又称为白血病前期。铁粒幼细胞性贫血是一组铁利用障碍性疾病。铁粒幼细胞性贫血患者骨髓出现大量环形铁粒幼细胞(RS),红细胞无效生成,组织铁储量过多,外周血呈小细胞低色素性贫血。RS也是MDS分型的一个重要指标[4]。本研究探讨环形铁粒幼细胞水平变化与MDS患者染色体核型、基因突变及预后的关系。
1 资料与方法
1.1 临床资料 选择2010年3月~2017年3月我院初诊为MDS的患者203例,男118例、女85例;年龄14~82(54.90±10.37)岁,14~40岁19例、41~50岁27例、51~60岁44例、61~79岁83例,80~82岁30例;起病表现为头昏乏力184例,其他表现主要为出血倾向;均行骨髓穿刺和骨髓活检确诊,符合法国、美国、英国协作组关于MDS的诊断标准;排除继发性MDS及患其他引起血细胞病态造血疾病的患者。
1.2 血常规检测 入院次日晨抽取患者空腹静脉血,检测血红蛋白、白细胞、血小板。
1.3 骨髓形态检查 骨髓穿刺或骨髓活检时收集骨髓标本。取标本,油镜下计数骨髓涂片细胞,原始细胞计数为髓系原始细胞在有核细胞中的占比。以红系所占比≥35%为红系增生活跃。参照《协和血液病学》,油镜下计数粒系、红系及巨核系细胞,每系细胞中存在的病态细胞≥10%认为是病态造血,如红系巨幼变。取骨髓涂片行骨髓内铁染色,骨髓片置甲醛蒸气中固定,3 min后将等量亚铁氰化钾和盐酸溶液混合,加热至56 ℃,放入骨髓片,30 min后流水冲洗,用碱性复红应用液复染5 min,用蒸馏水。无水乙醇。蒸馏水冲洗,干燥后显微镜下检查,计算细胞内铁水平。沉积于胞质铁颗粒≥5个并环核周≥1/3为铁染色RS[4]。计算RS占有核红细胞比例。根据RS比例对患者进行分组,RS比例<15%者为非RS增高MDS组(n=139)、≥15%者为RS增高MDS组(n=64)。依据骨髓原始细胞比例<5%,分为低原始细胞非RS增高MDS组(n=47)、低原始细胞RS增高MDS组(n=53);骨髓原始细胞比例≥5%,分为非RS增高难治性贫血伴原始细胞增多(RAEB)组(n=92)、RS增高RAEB组(n=11)。
1.4 染色体核型检测 取骨髓标本3 mL,按照白细胞1.5×109/L接种于培养液培养24 h,加入终浓度0.1 μg/mL秋水仙碱、0.075 mol/mL氯化钾溶液低渗30 min,以甲醇冰乙酸溶液固定,4 ℃过夜。用染色体图像自动分析系统进行染色体核型分析。将染色体核型根据文献[5]分为预后好、中、差三型。
1.5 基因突变检测 取骨髓标本3 mL,提取其RNA,反转录合成cDNA。实时定量PCR扩增目的基因特异引物。分析GATA1基因及预后不良基因(N-RAS、MLL、FLT3、EVI-1等基因)突变情况[5]。
1.6 预后观察 通过电话、门诊复诊等方式对患者进行随访,随访至患者死亡或至2017年3月1日。

2 结果
2.1 各组年龄及血常规指标比较 非RS增高MDS组与RS增高MDS组血红蛋白水平比较,P>0.05;RS增高MDS组年龄、白细胞计数、血小板计数高于非RS增高MDS组(P均<0.05)。低原始细胞非RS增高MDS组与低原始细胞RS增高MDS组血红蛋白水平比较,P>0.05;低原始细胞RS增高MDS组年龄、白细胞计数、血小板计数高于低原始细胞非RS增高MDS组(P均<0.05)。非RS增高RAEB组与RS增高RAEB组年龄、血红蛋白水平、血小板计数比较,P均>0.05;RS增高RAEB组白细胞计数高于非RS增高RAEB组(P<0.05)。见表1。
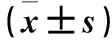
表1 各组年龄及血常规指标比较
2.2 各组骨髓细胞形态及基因变化比较 非RS增高MDS组与RS增高MDS组染色体核型比较,P>0.05;RS增高MDS组红系增生程度及巨幼变阳性率、基因突变率高于非RS增高MDS组(P均<0.05)。低原始细胞非RS增高MDS组与低原始细胞RS增高MDS组染色体核型比较,P>0.05。低原始细胞RS增高MDS组红系增生程度及巨幼变阳性率、基因突变率高于低原始细胞非RS增高MDS组(P均<0.05)。非RS增高RAEB组与RS增高RAEB组基因突变率比较,P>0.05;RS增高RAEB组红系增生程度高于非RS增高RAEB组,核型分布较差(P均<0.05)。见表2。
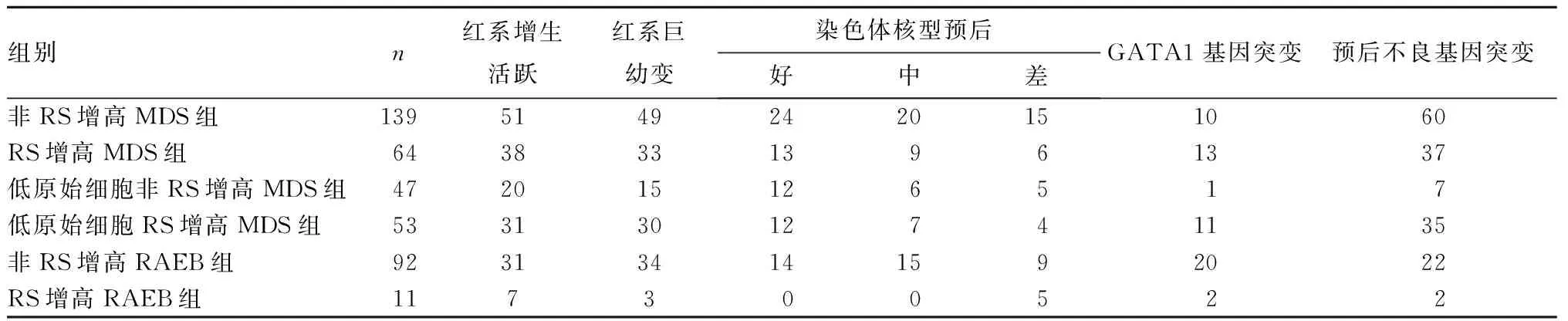
表2 各组骨髓细胞形态及基因变化比较(例)
2.3 RS水平对MDS患者预后的影响 截止至2017年3月1日,非RS增高MDS组中位生存时间为21.9个月,RS增高MDS组中位生存时间为12.5个月;低原始细胞非RS增高MDS组中位生存时间为24.1个月,低原始细胞RS增高MDS组中位生存时间为17.9个月;非RS增高RAEB组中位生存时间为14.6个月,RS增高RAEB组中位生存时间为6.8个月。伴RS增高组的中位生存时间均短于非RS增高组(P均<0.05)。
2.4 MDS预后的影响因素 采用COX回归模型对MDS患者预后影响因素进行分析,结果显示,RS是MDS患者预后的独立影响因素(P<0.05)。
3 讨论
研究发现,MDS患者存在染色体异常、癌基因和抑癌基因突变、骨髓造血干、祖细胞体外培养生长异常及多种免疫功能异常[6],但以上异常现象是MDS的结果还是病因仍不清楚,大部分研究倾向于是其结果。贫血是其主要临床征象,可有不同程度的出血,但程度较轻。大部分MDS患者病情稳定,甚至有好转的趋势。正常幼红细胞(主要是晚幼红细胞)的细胞核周围可见到1~5个呈蓝色的细小铁颗粒。含有铁颗粒的幼红细胞称为铁粒幼细胞。铁粒幼细胞性贫血患者骨髓出现大量RS,铁利用不良、血红素合成障碍、红细胞无效生成是本病发病的关键。因MDS异质性极大,临床无诊断的“金标准”。WHO根据RS占有核红细胞百分比及原始细胞百分比将MDS分为5型:难治性贫血、环形铁粒幼细胞性难治性贫血、RAEB、难治性贫血伴原始细胞增多向白血病转变型、慢性粒-单核细胞性白血病[7]。本研究根据RS占有核红细胞百分比进行分组,分析环形铁粒幼细胞水平变化与MDS患者染色体核型、基因突变及预后的关系。
大部分MDS患者具有染色体异常克隆,畸变类型复杂,包括染色体数目、结构,可涉及每条染色体。主要常见染色体数目异常,较少见染色体易位,因此细胞遗传学研究对MDS诊治及预后评估有重要价值。有研究显示,异常核型的MDS患者其中位生存期仅为8.7个月,而正常核型的MDS患者其中位生存期可达53.4个月;且正常核型的MDS患者仅有20%~40%转化为急性白血病,而异常核型的MDS患者60%~70%转化为急性白血病[8]。本研究,RS增高RAEB组核型分布较非RS增高RAEB组差,说明RS增高的MDS患者其染色体核型分布差,可见RS水平变化与染色体核型有一定关系,具体因果需进一步研究证实。
通过单核苷酸多态性微阵列技术和全基因组或外显子组测序,发现了25~30种参与MDS发生的基因突变。正常造血干或祖细胞获得多种遗传性体细胞突变和(或)表观遗传学异常导致细胞自我更新以及分化、成熟异常,形成恶性造血干细胞克隆是MDS的发病基础。研究证实基因突变和异常表达也能作为分子生物学标志来评估MDS预后,MLL、NRAS、p53基因突变及GATA1、KIT、EVI1基因突变表达与MDS发展有密切关系[9]。本研究RS增高MDS组基因突变率高于非RS增高MDS组,低原始细胞RS增高MDS组基因突变率高于低原始细胞非RS增高MDS组,说明RS水平升高的MDS患者其基因突变率高。
MDS患者外周血细胞减少可反映MDS无效造血,本研究RS增高MDS组白细胞、血小板水平相对较高,说明RS可能主要影响红系造血,对粒系和巨核系影响不大。RS≥15%的患者骨髓红系增生程度和巨幼变更加明显,证明RS主要影响红系造血而不影响粒系及巨核系。无效性红细胞易发生原位溶血,是MDS高铁负荷的形成机制,过高的铁负荷增加RS形成及MDS转为白血病的概率,加快MDS进程。本研究随访发现,伴RS增高组的中位生存时间短于非RS增高组。进一步经COX回归模型对MDS患者预后影响因素进行分析,结果显示,RS是MDS患者预后的独立影响因素。说明对RS进行检测可以预测MDS患者预后。
[1] 刘家希,王化泉.骨髓增生异常综合征诊断和治疗进展[J].中国癌症防治杂志,2017,9(2):158-163.
[2] 王利军,刘明娟,赵小利,等.异基因造血干细胞移植治疗45例骨髓增生异常综合征临床及预后分析[J].中国实验血液学杂志,2016,24(2):502-509.
[3] Wei J, Zhou XF, Zhao F, et al. Immunologic characteristics and prognosis of myelodysplastic syndrome new subtype: refractory anemia with excess blasts-Ⅱ[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2009,17(1):111-116.
[4] Mufti GJ, Bennett JM, Goasguen J, et al. Diagnosis and classification of myelodysplastic syndrome: International Working Group on Morphology of myelodysplastic syndrome (IWGM-MDS)consensus proposals for the definition and enumeration of myeloblasts and ring sideroblasts[J].Haematologica, 2008,93(11):1712-1717
[5] 葛素君,李绵洋,康慧媛,等.骨髓增生异常综合征中环形铁粒幼细胞增高对预后的判断意义[J].中华检验医学杂志,2017,40(2):126-132.
[6] 顾李霖,康慧媛,潘玉玲,等.骨髓细胞形态、细胞化学染色及骨髓活检切片联合检测在低原始细胞骨髓增生异常综合征与溶血性贫血鉴别诊断中的价值[J].中国实验血液学杂志,2016,(1):138-143.
[7] 上海市中关联合白血病协作组.282例原发性骨髓增生异常综合征诊断和分型的前瞻性临床研究[J].中华血液学杂志,2006,27(8):546-549.
[8] Facon T, Lai JL, Nataf E, et al. Improved cytogenetic analysis of bone marrow plasma cells after cytokine stimulation in multiple myeloma: a report on 46 patients[J]. Br J Haematol, 1993,84(4):743-745.
[9] 安利,江明.114例骨髓增生异常综合征的染色体核型与预后分析[J].中山大学学报(医学科学版),2014,35(4):575-578
10.3969/j.issn.1002-266X.2017.37.025
R551.3
B
1002-266X(2017)37-0073-03
郭洁(E-mail:1984xyd@163.com)
2017-07-28)

