气道压力释放通气个体化治疗对ARDS患者呼吸机相关性肺损伤的影响
宋邵华,王来,杨秀芬
(河北医科大学第一医院,石家庄050031)
气道压力释放通气个体化治疗对ARDS患者呼吸机相关性肺损伤的影响
宋邵华,王来,杨秀芬
(河北医科大学第一医院,石家庄050031)
目的探讨气道压力释放通气个体化治疗(P-APRV)对急性呼吸窘迫综合征(ARDS)患者呼吸机相关性肺损伤(VILI)的影响。方法将44例ARDS患者随机分为同步间歇指令通气(SIMV)组24例、气道压力释放通气(APRV)组20例。SIMV组应用AVEA呼吸机同步间歇指令通气(SIMV)+压力支持(PS)模式通气48 h;APRV组给予P-APRV,根据时间-压力曲线、时间-流速曲线设置APRV参数,通气24 h后复测呼吸曲线并调整参数。分别于入组时及通气24、48 h记录两组呼吸力学指标、血流动力学指标,采用ELISA法测定血清肺损伤生物学标记物肺表面活性蛋白D(SP-D)、唾液酸化大分子黏蛋白(KL-6)。结果通气24、48 h,APRV组呼吸力学指标改善优于SIMV组(P均<0.05)。两组通气前后血流动力学指标比较差异无统计学意义(P均>0.05)。与通气前比较,通气24、48 h两组血清SP-D、KL-6水平下降(P均<0.05),APRV组下降更明显(P均<0.05)。结论P-APRV可减轻ARDS患者呼吸机相关性肺损伤。
呼吸机相关性肺损伤;急性呼吸窘迫综合征;气道压力释放通气;个体化治疗;肺复张
气道压力释放通气(APRV)通过周期性释放压力以减少肺容积,同时允许自主呼吸,充分发挥膈肌呼吸功能,避免了肺泡的过度扩张,在低气道峰压和低呼气末正压(PEEP)下改善通气/血流灌注比例,且血流动力学损失小,是肺保护性通气策略的理想通气模式。近年临床提出个体化APRV(P-APRV),可减轻呼吸机相关性肺损伤。P-APRV通过传统肺保护性通气模式下时间-压力曲线、时间-流速曲线,设置呼吸机个体化参数。本研究观察P-APRV对急性呼吸窘迫综合征(ARDS)患者呼吸机相关性肺损伤的影响。报告如下。
1 资料与方法
1.1 临床资料 选择本院2014年1月~2015年12月收治的ARDS患者44例,均符合欧洲危重病医学会与美国胸科学会委员会制定的ARDS诊断标准[1]。其中男23例、女21例,年龄32~85岁,急性生理功能和慢性健康状况评分系统Ⅱ评分(18±5)分,肺损伤评分系统评分(1.9±0.8)分。纳入标准:年龄≥18岁,发病24 h内经口气管插管接受机械通气且入组时机械通气<72 h,患者家属知情同意。排除标准:胸廓畸形、气胸、严重心肌缺血、颅内高压、脑供血不足、血流动力学极不稳定;已存在严重慢性器官功能障碍、晚期肿瘤垂危状态,濒死状态(估计在12 h内死亡);接受干扰本研究的其他治疗;妊娠期、哺乳期。本研究符合医学伦理学标准,并经医院伦理委员会批准。将患者随机分为同步间歇指令通气(SIMV)组24例、气道压力释放通气(APRV)组20例,两组临床资料具有可比性。
1.2 治疗方法 两组均应用AVEA呼吸机(VIASYS HEALTHCARE伟亚医疗)SIMV+压力支持(PS)模式通气,记录设置参数及平均压(Pmean)、脉搏氧饱和度(SpO2)、平均动脉压(MAP)、心率(HR)、中心静脉压(CVP),同时记录每小时每公斤体质量尿量(UO)、动脉血气分析指标。测定时间-压力曲线、时间-流速曲线,记录气道平台压(Pplat)、呼气峰流速(PEF)、PEF下降75%的呼气时间(PEF 75%)。应用AVEA呼吸机转折点(Pflex)操作,采用低流速法描记肺准静态压力-容量(P-V )曲线,自动测算高、低位拐点和三角区Pflex容积(Vdelta)。SIMV组持续SIMV+PS模式,氧浓度(FiO2)维持不变,吸气潮气量为6 mL/kg,气道峰压<35 cmH2O,设置呼吸频率为14~20次/min,PEEP为肺准静态P-V曲线低位拐点+2 cm H2O。APRV组采用P-APRV,根据以上参数进行调整,FiO2不变,高压力水平(Phigh)=Pplat,低压力水平(Plow)=0 cm H2O,高压力相时间(Thigh)=4.5 s,低压力相时间(Tlow)=PEF 75%。监测动脉血气分析,维持PO2≥60 mm Hg、30 mmHg≤PCO2≤50 mmHg,适当调整Phigh、Tlow;通气12 h复测时间-流速曲线、PEF、PEF 75%,微调Tlow。通气24 h测定时间-压力曲线、时间-流速曲线、准静态P-V曲线,调整呼吸机参数,继续通气24 h。
1.3 肺损伤生物学标记物检测 分别于两组通气前及通气24、48 h留取外周静脉血,以3 000 r/min离心,取血清冻存待检。采用ELISA法测定血清肺表面活性蛋白D(SP-D)、唾液酸化大分子黏蛋白(KL-6)。

2 结果
2.1 两组通气前后呼吸力学指标比较 与通气前比较,通气24、48 h两组PO2/FiO2均升高(P均<0.05),但两组间比较差异无统计学意义(P均>0.05)。两组通气前后Pplat、PEF、PEF 75%组内、组间比较差异均无统计学意义(P均>0.05)。通气前,两组Pmean比较差异无统计学意义(P>0.05);通气24、48 h,APRV组Pmean高于SIMV组(P均<0.05)。通气24 h,APRV组Vdelta增加比例[85%(17/20)]高于SIMV组[66.7%(16/24)],比较差异有统计学意义(P<0.05)。见表1。
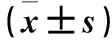
表1 两组通气前后呼吸力学指标比较
2.2 两组通气前后血流动力学指标比较 两组通气前后血流动力学指标比较差异无统计学意义(P均>0.05)。见表2。
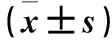
表2 两组通气前后血流动力学指标比较
2.3 两组通气前后血清SP-D、KL-6水平比较 与通气前比较,通气24、48 h两组血清SP-D、KL-6水平下降(P均<0.05),APRV组下降更明显(P均<0.05)。见表3。
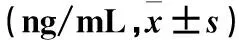
表3 两组通气前后血清SP-D、KL-6水平比较
3 讨论
APRV是压力限制通气模式,并且保留自主呼吸,增加二氧化碳的排出,改善人机协调性,减少镇静和肌松剂的需要;自主呼吸使得通气重新分配,靠近膈肌的重力依赖区优先通气,促进血流丰富的重力依赖区肺泡复张,获得更好的通气/血流比;同时自主呼吸提供分钟通气量,所以呼吸机的压力支持可能会低于其他机械通气模式[3],优点在于利用自主呼吸在较低的气道压下达到肺复张效果,因此被认为是预防呼吸机相关性肺损伤的肺保护性通气策略[4]。ARDS动物模型研究提示,APRV可能避免呼吸机相关肺损伤的发生[5]。
APRV模式提出近30年来,参数设置一直没有统一标准[6],近年研究主要围绕压力和释放时间的个体化治疗。本研究以ARDS患者为研究对象,根据患者不同的肺功能状态,依据肺顺应性和呼吸力学变化,设置APRV参数Phigh、Plow。Thigh是利用持续气道压力通气(CPAP)作用复张萎陷肺泡的时间[7],也是参数中最为重要的一个。设置Thigh维持较高的气道压和肺泡内压,维持肺泡开放;根据PEF设置Tlow,避免了呼气时间过长导致气道压力降低、肺容积减少、肺泡塌陷,也不会出现呼气时间过短导致二氧化碳潴留。理论上最佳Tlow既允许充分通气又能阻止慢时间常数肺泡(顺应性高或呼气阻力大的区域)的完全呼气,产生内源性PEEP,有利于肺泡的复张;过长的Tlow会对氧合产生负面影响,过短则会使呼气不足,增加死腔通气,发生高碳酸血症进而加重肺损伤。动物实验也证实根据呼气流速降低到峰流速的75%的时间确定Tlow能够稳定肺泡、避免肺泡塌陷,实现肺保护通气[8,9]。限于当前绝大多数呼吸机不能根据PEF设置Tlow。本研究由传统SIMV模式转换前,通过观察时间-流速曲线测定PEF、PEF 75%,设置Tlow,既保证了有效呼气,又避免气道压力降低、肺泡塌陷。研究过程中复测PEF 75%,适时调整Tlow。研究中测定呼气流速降低到峰流速的75%的时间为0.6~1.3 s,研究过程中未见对氧合有负面影响及二氧化碳潴留。
目前研究发现,P-APRV限制了气道压力,延长吸气时间,促进气体的再分布,降低了局部应力[10],减轻气压伤[8];通过个体化的呼气时间设置,维持肺泡的开放,避免肺泡萎陷和剪切力损伤[3]。动物研究也提示,APRV阻止ARDS的发展[9],早期应用能降低ARDS的发生率[11]。本研究通过测定血清中SP-D、KL-6水平,证实P-APRV能减轻呼吸机相关性肺损伤。也有研究显示,APRV过强的自主呼吸增加跨肺压,而过强的跨肺压可能是肺损伤的潜在因素[12]。该研究中ARDS患者多数对镇痛、镇静剂敏感,未见较强的自主呼吸。
P-APRV通过个体化的参数设置能够减轻ARDS患者呼吸机相关性肺损伤,有利于改善预后。
[1] Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012,307(23):2526-2533.
[2] Stock MC, Downs JB, Frolicher DA. Airway pressure release ventilation[J]. Crit Care Med, 1987,15(5):462-466.
[3] Myers TR, Macintyre NR. Respiratory controversies in the critical care setting. Does airway pressure release ventilation offer important new advantages in mechanical ventilator support[J]. Respir Care, 2007,52(4):452-458,458-460.
[4] 黄志俭,陈荣昌.气道压力释放通气治疗急性肺损伤和急性呼吸窘迫综合征的临床研究进展[J].国际呼吸杂志,2006,26(11):810-812.
[5] Matsuzawa Y, Nakazawa K, Yamamura A, et al. Airway pressure release ventilation reduces the increase in bronchoalveolar lavage fluid high-mobility group box-1 levels and lung water in experimental acute respiratory distress syndrome induced by lung lavage[J]. Eur J Anaesthesiol, 2010,27(8):726-733.
[6] Jain SV, Kollisch-Singule M, Sadowitz B, et al. The 30-year evolution of airway pressure release ventilation(APRV)[J]. Intensive Care Med Exp, 2016,4(1):11.
[7] Artigas A, Bernard GR, Carlet J, et al. The American-european consensus conference on ARDS, part 2. Ventilatory, pharmacologic, supportive therapy, study design strategies and issues related to recovery and remodeling[J]. Intensive Care Med, 1998,24(4):378-398.
[8] Roy S, Habashi N, Sadowitz B, et al. Early airway pressure release ventilation prevents ARDS-a novel preventive approach to lung injury[J]. Shock, 2013,39(1):28-38.
[9] Roy S, Sadowitz B, Andrews P, et al. Early stabilizing alveolar ventilation prevents acute respiratory distress syndrome: a novel timing-based ventilatory intervention to avert lung injury[J]. J Trauma Acute Care Surg, 2012,73(2):391-400.
[10] Kollisch-Singule M, Emr B, Smith B, et al. Airway pressure release ventilation reduces conducting airway micro-strain in lung injury[J]. J Am Coll Surg, 2014,219(5):968-976.
[11] Emr B, Gatto LA, Roy S, et al. Airway pressure release ventilation prevents ventilator-induced lung injury in normal lungs[J]. JAMA Surg, 2013,148(11):1005-1012.
[12] Slutsky AS, Ranieri VM. Ventilator-induced lung injury[J]. N Engl J Med, 2013,369(22):2126-2136.
河北省医学科学研究重点课题(20110305)。
10.3969/j.issn.1002-266X.2017.37.017
R563
B
1002-266X(2017)37-0051-03
2017-07-02)

