大鼠骨髓间充质干细胞对不同品系小鼠移植皮肤存活时间的影响及机制
郝贵亮,解童玲,李玉奎,杨宗军
(1青岛市妇女儿童医院,山东青岛266000;2宁夏医科大学总医院)
大鼠骨髓间充质干细胞对不同品系小鼠移植皮肤存活时间的影响及机制
郝贵亮1,解童玲1,李玉奎2,杨宗军1
(1青岛市妇女儿童医院,山东青岛266000;2宁夏医科大学总医院)
目的探讨经尾静脉注射大鼠骨髓间充质干细胞(BMMSC)对不同品系小鼠移植皮肤存活时间的影响及机制。方法分离SD大鼠BMMSC培养至第3代。用皮肤取样器切取60只ICR乳鼠圆形皮片(直径12 mm),将其移植至成年C57BL/6小鼠背部,建立不同品系小鼠间皮肤移植免疫排斥模型。将60只模型小鼠随机均分为PBS组及低、中、高剂量BMMSC组,分别经尾静脉注射PBS、5×104个BMMSC、10×104个BMMSC、20×104个BMMSC各0.2 mL。记录各组移植皮肤存活时间。术后第7天,HE染色观察移植皮肤病理组织学变化;每组随机取5只小鼠处死取其脾脏组织及血清,分别用RT-PCR及ELISA法检测IL-10、TNF-α、IFN-γ。结果中、高剂量BMMSC组皮肤存活时间较PBS组、低剂量BMMSC组长(P均<0.05);中、高剂量BMMSC组皮肤存活时间比较,P>0.05。术后第7天,病理切片镜下观察显示PBS组炎性细胞浸润最明显,高剂量BMMSC组炎性细胞浸润最少。术后第7天,与PBS组比较,低、中、高剂量BMMSC组脾脏组织TNF-α、IFN-γ mRNA相对表达量低(P均<0.05)。与PBS组比较,中、高剂量BMMSC组血清IL-10水平高(P均<0.05),低、中、高剂量BMMSC组血清TNF-α、IFN-γ水平低(P均<0.05);与低剂量BMMSC组比较,中剂量BMMSC组血清TNF-α、IFN-γ水平低(P均<0.05),高剂量BMMSC组血清IL-10水平高、TNF-α水平低(P均<0.05)。结论经尾静脉注射适当剂量的大鼠BMMSC可延长不同品系小鼠移植皮肤存活时间;该作用可能与BMMSC调控受体小鼠IL-10、TNF-α、IFN-γ的表达有关。
皮肤移植;骨髓间充质干细胞;免疫排斥;小鼠
大面积烧烫伤发生后,快速有效封闭创面可减少感染、休克等的发生,并提高患者生存率,皮肤移植是有效封闭创面的重要手段之一。临床用于移植的皮肤主要有三个来源:自体、异体和异种。对大面积烧烫伤患者来说,自体皮肤移植往往不足,而后两者会发生严重的排斥反应。烧烫伤患者在2~3周进入全身感染的高峰期,此时有效皮肤覆盖是治疗成功的关键。异种移植皮肤的临时覆盖时间仅为2周,同种异体皮肤也仅3周。如何延长异体移植皮肤的存活时间是皮肤移植亟待解决的问题[1]。骨髓间充质干细胞(BMMSC)具有低免疫原性和抑制免疫排斥等作用。2014年8月~2016年3月,本研究构建不同品系间小鼠皮肤移植的免疫排斥模型,经尾静脉注射BMMSC至模型小鼠体内,观察移植皮肤的存活时间,并进一步探讨其作用机制。
1 材料与方法
1.1 动物、试剂及仪器来源 SD大鼠(雄性、6~8周龄、体质量120~150 g)、ICR乳鼠(雄性、2~4日龄、体质量2~3 g)、C57BL/6小鼠(雌雄各半、8~10周龄,体质量18~22 g)由宁夏医科大学实验动物中心提供;DMEM、FBS购自Gibco公司;PBS购自Hyclone公司;TRIzol购自Invitrogen公司;多聚甲醛、水合氯醛、苏木素、伊红、无水乙醇等购自生工生物有限责任公司;ELISA试剂盒购自博士德生物有限公司;反转录试剂盒、ROX qPCR Master Mix(2×)、3423型CO2培养箱购自Thermo公司;CKX41型倒置显微镜购自Olympus公司;IQ5型荧光定量PCR仪、680型酶标仪购自Bio-Rad公司。
1.2 BMMSC分离、培养及鉴定 根据文献[2]利用梯度离心和贴壁法分离培养SD大鼠BMMSC,培养至第3代时利用流式细胞仪检测BMMSC CD73、CD105、CD45、CD90、CD14、CD34、HLA-DR的阳性率。分离后的BMMSC在体外培养24 h后已有部分贴壁,培养至第3代时,BMMSC呈条索状排列,流式细胞仪鉴定结果显示: CD73、CD105、CD90阳性率均在95%以上,而CD14、CD34、HLA-DR、CD45阳性率均低于5%,证明分离培养的细胞为BMMSC[3]。
1.3 不同品系间小鼠皮肤移植免疫排斥模型建立 按文献[4]方法,用皮肤取样器切取60只ICR乳鼠圆形皮片(直径12 mm),置于PBS中备用。4%水合氯醛腹腔注射麻醉C57BL/6小鼠,在其背部靠近左前肢处剪取直径12 mm左右全层皮肤缺损,将ICR乳鼠皮片覆盖在C57BL/6小鼠皮肤缺损处,建立不同品系小鼠间皮肤移植免疫排斥模型,凡士林纱布覆盖后创可贴包扎固定。造模后将60只C57BL/6 小鼠随机分为PBS组、低剂量BMMSC组、中剂量BMMSC组和高剂量BMMSC组,每组15只;分别注射PBS、5×104个BMMSC、10×104个BMMSC、20×104个BMMSC各0.2 mL。术后从第3天开始拆包观察移植皮肤排异情况并拍照。从手术之日起至移植皮肤出现变硬、发黑、坏死、翘起或脱落中的任一现象的面积大于50%的时间为移植皮肤存活时间,面积计算方法采用画表格法进行统计。
1.4 移植皮肤病理组织学观察 术后第7天,每组随机取5只小鼠,切取移植部位皮肤用4%多聚甲醛固定,梯度酒精脱水、二甲苯透明,浸蜡后行石蜡包裹切片,置于65 ℃烘箱2 h后经二甲苯脱蜡、梯度酒精脱水行HE染色,中性树脂封片后显微镜下观察并采集照片。
1.5 模型小鼠脾脏组织白细胞介素10(IL-10)、肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)mRNA表达检测 采用RT-qPCR技术。术后第7天,每组随机取5只小鼠,脱臼法处死后取其脾脏。TRIzol法提取脾脏组织总RNA,按试剂盒说明书经65 ℃ 5 min,42 ℃ 60 min,70 ℃ 5 min在PCR仪中反转录合成cDNA。RT-qPCR法按95 ℃ 3 min ,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环, 72 ℃10 min。根据公式2-△△Ct计算IL-10、TNF-α、IFN-γ mRNA相对表达量,引物序列由生工生物有限责任公司合成。IL-10正义链:5′-AGACAATAACTGCACCCACTTCC-3′,反义链:5′-GTCGGTTAGCAGTATGTTGTCCAG-3′;TNF-α正义链:5′-CCAGGTTCTCTTCAAGGGACAA-3′,反义链:5′-GGCAGAGAGGAGGTTGACTTTC-3′;IFN-γ正义链:5′-GTGGCATAGATGTGGAAGAAAAGA-3′,反义链:5′-GCTGAAGAAG-GTAGTAATCAGGTGTG-3′;β-Actin正义链:5′-GAG-ACCTTCAACACCCCAGC-3′,反义链:5′-GGAGAGCATAGCCCTCGTAGAT-3′。
1.6 模型小鼠血清中IL-10、TNF-α、IFN-γ检测 采用ELISA法。术后第7天,每组取5只小鼠,摘除眼球取血,4 ℃过夜,离心分离血清,按试剂盒详细说明书检测小鼠血清中IL-10、TNF-α、IFN-γ。

2 结果
2.1 各组移植皮肤存活情况 术后小鼠运动饮食正常,24 h开始小鼠有大量出汗现象。PBS组术后第3天,3只小鼠移植皮肤出现发黑坏死;第5天,8只小鼠坏死面积已超过50%。低剂量BMMSC组术后第3天,2只小鼠移植皮肤出现发黑坏死;第5天,6只小鼠移植皮肤坏死面积大于50%。中剂量BMMSC组术后5天,皮肤红润,无发黑、坏死、翘起、脱落等现象;第6天,开始出现较弱的排异反应;第9天,7只小鼠移植皮肤出现变硬、坏死等面积达50%。高剂量BMMSC组术后第5天,移植皮肤红润柔软,无排异反应发生;第9天,8只小鼠移植皮肤发黑、坏死面积超过50%。PBS组、低剂量BMMSC组、中剂量BMMSC组和高剂量BMMSC组皮肤存活时间分别为(5.13±1.37)、(6.15±1.29)、(9.29±1.14)、(9.41±1.71)d;中、高剂量BMMSC组皮肤存活时间较PBS组、低剂量BMMSC组长(P均<0.05);PBS组与低剂量BMMSC组存活时间比较差异无统计学意义(P>0.05),中、高剂量BMMSC组皮肤存活时间比较差异无统计学意义(P>0.05)。
2.2 各组移植皮肤病理组织学变化 术后第7天,PBS组炎性细胞浸润最明显,随着BMMSC剂量的增加,炎性细胞浸润逐渐减少,高剂量BMMSC组炎性细胞浸润最少。
2.3 各组脾脏组织IL-10、TNF-α、IFN-γ mRNA表达比较 术后第7天,与PBS组比较,低、中、高剂量BMMSC组脾脏组织IL-10 mRNA相对表达量比较差异无统计学意义(P均>0.05),TNF-α、IFN-γ mRNA相对表达量低(P均<0.05)。见表1。
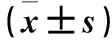
表1 各组脾脏组织IL-10、TNF-α、IFN-γ mRNA相对表达量比较
2.4 各组血清IL-10、TNF-α、IFN-γ水平比较 与PBS组比较,中、高剂量BMMSC组血清IL-10水平高(P均<0.05),低、中、高剂量BMMSC组血清TNF-α、IFN-γ水平低(P均<0.05);与低剂量BMMSC组比较,中剂量BMMSC组血清TNF-α、IFN-γ水平低(P均<0.05),高剂量BMMSC组血清IL-10水平高、TNF-α水平低(P均<0.05)。见表2。
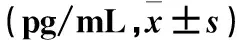
表2 各组血清IL-10、TNF-α、IFN-γ水平比较
3 讨论
烧烫伤是日常生活中比较常见的意外伤害之一,据不完全统计我国每年有500万~1 000万人被不同程度的烧烫伤[5],尤其是大面积、Ⅱ度、Ⅲ度及其他重度烧烫伤患者如果不能得到及时治疗,病死率极高;而最常用的治疗方法之一就是皮肤移植。对于大面积烧烫伤来说,自体皮肤移植很难实现,而异体或异种皮肤移植都不可避免出现严重的免疫排斥反应。因此降低甚至是消除移植后的免疫排斥反应是器官移植面临的主要问题之一。目前研究最多的抑制移植免疫排斥的方法有:建立不同品系间嵌合体、阻断第二信号等。建立不同品系间嵌合体常用射线照射或应用骨髓生长抑制剂的方法建立不同品系间骨髓嵌合体[6];阻断第二信号常通过结合抗原提成细胞CD80和CD86受体,从而阻断T细胞活化的共刺激信号诱导免疫耐[7]。上述方法效果显著,但有较高的危险性。间充质干细胞具有低免疫原性和抑制移植后的免疫排斥反应而备受关注,其主要来源有骨髓、脂肪、胎盘、脐血等,具有安全性高,取材来源广泛等优势。
研究表明,IL-10的主要生物学活性是免疫抑制作用,可通过抑制活化的T细胞分泌IL-12、TNF-α、IFN-γ,从而抑制迟发型变态反应[8]。陈富超等[9]发现,IL-10有抗家兔皮肤移植排斥反应的作用。Singla等[10,11]认为,免疫抑制剂主要通过调节调节性T细胞活性抑制IFN-γ、TNF-α等的分泌,从而抑制皮肤移植等免疫排斥反应[12,13]。TNF-α主要损伤内皮细胞,使移植皮肤因缺血而坏死[14,15]。因此,IL-10水平升高及IFN-γ、TNF-α水平降低均有助于降低免疫排斥反应,延长移植皮肤的存活时间。本研究通过建立不同品系间小鼠皮肤移植免疫排斥模型,探讨BMMSC对移植皮肤存活时间的影响,并进一步探讨其作用机制。当BMMSC通过尾静脉注入受体小鼠体内后,通过血液循环迅速到达移植部位,调节免疫因子IL-10、TNF-α及IFN-γ等的表达,达到降低移植皮肤免疫排斥作用。结果,中、高剂量BMMSC组移植皮肤的存活时间明显延长;低、中、高剂量BMMSC组TNF-α、IFN-γ 表达降低,中、高剂量BMMSC组IL-10 表达升高。进一步证明以上论点。
综上所述,适当剂量的BMMSC通过尾静脉注射至免疫排斥模型受体小鼠体内可明显延长小鼠移植皮肤的存活时间,这可能与调节受体小鼠免疫因子IL-10、TNF-α及IFN-γ的表达有关。
[1] 吴在德,吴肇汉,郑树,等.外科学[M].7版.北京:人民卫生出版社,2008:181-187.
[2] Zhang J, Li Y, Zhang ZG, et al. Bone marrow stromal cells increase oligodendrogenesis after stroke[J]. Cereb Blood Flow Metab, 2009,29(6):1166-1174.
[3] In′t Anker PS, Scherjon SA, Kleijburg-van der Keur C, et al. Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta[J]. Stem Cells, 2004,22(7):1338-1345.
[4] 王琼,严秀蕊,王立斌,等.裸小鼠皮肤移植模型的构建及其效果评价[J].宁夏医科大学学报,2013,35(1):110-112.
[5] 盛志勇, 郭振荣. 危重烧伤治疗与康复学[M].北京:科学技术出版社,2001:260-263.
[6] Mathes DW, Hwang B, Graves SS, et al. Tolerance to vascularized composite allografts in canine mixed hematopoietic chimeras[J]. Transplantation, 2011,92(12):1301.
[7] Charpentier B. Belatacept: a novel immunosuppressive agent for kidney transplant recipients[J]. Expert Rev Clin Immunol, 2012,8(8):719.
[8] 方航荣,邱明链,刘景辛,等.IL-10基因修饰的树突状细胞诱导大鼠肝移植免疫耐受的实验研究[J].实用医学杂志,2012,28(16):2705-2708.
[9] 陈富超,孙万邦,刘凯山,等.重组hIL-10 抗家兔皮肤移植排斥反应中血清IL-10及其抗体的检测[J].中国现代医药杂志,2011,13(9):1-3.
[10] Singla AK, Gurram RK, Chauhan A, et al. Caerulomycin A suppresses Immunity by inhibiting T cell activity[J]. PLoS One, 2014,9(10):e107051.
[11] Tsai SF, Cheng CY, Shu KH, et al. Trends in maintenance immunosuppressive drugs used in taiwanese kidney transplant recipients: an analysis of the national health insurance research database[J]. Transplant Proc, 2012,44(1):190-192.
[12] Gurram RK, Kujur W, Maurya SK, et al. Caerulomycin a enhances transforming growth factor-beta (TGF-beta)-smad3 protein signaling by suppressing interferon-gamma (IFN-gamma)-signal transducer and activator of transcription 1 (STAT1) protein signaling to expand regulatory T cells (Tregs)[J]. J Biol Chem, 2014,289(25):17515-17528.
[13] Singla AK, Gurram RK, Chauhan A, et al. Caerulomycin a: a potent novel immunosuppressive agent[J]. Transplantation, 2014,97:e57-59.
[14] Shen H, Goldstein DR. IL-6 and TNF-alpha synergistically inhibit allograft acceptance[J]. J Am Soc Nephrol, 2009,20(5):1032-1040.
[15] Brehm MA, Mangada J, Markees TG, et al. Rapid quantification of naive alloreactive T cells by TNF-alpha production and correlation with allograft rejection in mice[J]. Blood, 2007,109(2):819-826.
10.3969/j.issn.1002-266X.2017.37.011
R622.1
A
1002-266X(2017)37-0034-03
杨宗军(E-mail:a13789856688@126.com)
2017-07-05)

