下调LSINCT5对人脑胶质瘤细胞系U251增殖、迁移和放疗敏感性的影响
冯基高,莫业和,徐鹏翔,胡德献,欧阳一彬,刘达远,张彩彩
(1海南医学院第二附属医院,海口 570311;2海南医学院)
下调LSINCT5对人脑胶质瘤细胞系U251增殖、迁移和放疗敏感性的影响
冯基高1,莫业和1,徐鹏翔1,胡德献1,欧阳一彬1,刘达远1,张彩彩2
(1海南医学院第二附属医院,海口 570311;2海南医学院)
目的观察下调LSINCT5对人脑胶质瘤细胞系U251增殖、迁移能力和放疗敏感性的影响。方法采用慢病毒转染法构建稳定干扰LSINCT5的细胞株(U251 sh LSINCT5细胞),得到干扰效率高的sh LSINCT5 1#组、sh LSINCT5 3#组和转染GV248的对照组细胞进行后续实验。采用噻唑蓝比色法(MTS)观察细胞培养0、24、48、72 h时增殖能力变化,划痕修复实验观察细胞迁移能力的变化,Western blotting法检测细胞中细胞黏附分子(E-cadherin)、紧密连接蛋白-1(Zo-1)、细胞骨架蛋白(Vimentin)表达,MTS法观察X射线仪下分别照射0、2、4、8 Gy后细胞增殖能力。结果sh LSINCT5 1#组、sh LSINCT5 3#组培养48、72 h时细胞增殖能力均较对照组低(P均<0.05)。sh LSINCT5 1#组、sh LSINCT5 3#组细胞的修复距离均较对照组短,P均<0.05。与对照组相比,sh LSINCT5 1#组、sh LSINCT5 3#组E-cadherin、Zo-1表达高,Vimentin表达低(P均<0.05)。sh LSINCT5 1#组、sh LSINCT5 3#组在2、4 Gy剂量照射时细胞增殖能力均较对照组低(P均<0.05)。结论下调人胶质瘤细胞系U251中LSINCT5的表达,能抑制细胞增殖、转移,并增强细胞放疗敏感性。
长链非编码RNA LSINCT5;胶质瘤;细胞增殖;细胞迁移;上皮间充质转化;放疗敏感性
脑胶质瘤是最常见的颅内原发性肿瘤,占所有颅内肿瘤的50%~60%[1]。脑胶质瘤的恶性程度高,具有高度的侵袭、迁移及增殖能力,尤其是高级别胶质瘤,单纯手术往往难以到达满意疗效,常需术后对患者辅以放疗,以降低复发率、提高远期生存率[2]。但放疗存在很大的个体差异,且随着时间延长,癌组织可发生放疗抵抗,导致放疗失败。因此,如何提高胶质瘤的放疗敏感性,是临床工作中面临的重要问题。长链非编码RNA(lncRNA)家族是近年新发现的重要的表观调控因子,与恶性肿瘤有紧密联系。LSINCT5作为lncRNA中的一员,已被发现在卵巢癌、胃癌、乳腺癌等多种恶性肿瘤中高表达,并与患者的临床表现及肿瘤细胞的生物学效应有着密切的关系[3~5]。2014年6月~2016年9月,本研究通过体外实验的方法,探讨下调人脑胶质瘤细胞系U251中LSINCT5的表达对细胞生物学效应和放疗敏感性的影响,为揭示人脑胶质瘤发生发展的确切机制及其临床诊治工作提供新的依据。
1 材料与方法
1.1 细胞来源及培养 胶质瘤细胞系U87、U251、U373、A172、SHG44、U118、U138、T98G及人胚肾细胞293T均来自中国医学科学院研究中心。胶质瘤细胞系培养采用RPMI1640培养基+10%胎牛血清(FBS,Hyclone),293T细胞系培养采用DMEM培养基+10% FBS,均于37 ℃、5% CO2条件下培养。
1.2 高表达LSINCT5细胞系筛选 采用RT-PCR法。采用RNAiso Plus(TaKaRa公司,Code No. 9108)分别抽提细胞总RNA,超微量分光光度计(NanoDrop2000)检测RNA浓度。取5 μg RNA进行逆转录反应(逆转录试剂盒,Maxima®First Strand cDNA Synthesis Kit, Fermentas),采用SYBR Green荧光实时定量PCR反应体系(iQ SYBR Green Supermix, BioRad)检测其表达水平。荧光定量PCR仪(ABI 7500)进行反应分析,反应条件:预变性94 ℃ 4 min,扩增条件为94 ℃ 30 s,60 ℃ 1 min,40个循环。LSINCT5上游引物:CAGGTTGCTGATGTCCTTGG,下游引物:ACCCAGAGAACATCAGACTTCA,扩增引物大小为173 bp。以β-actin为内参基因,其上游引物序列:TGGCACCCAGCACAATGAA,下游引物序列:CTAAGTCATAGTCCGCCTAGAAGCA,片段大小为186 bp。采用2-ΔΔCt法计算LSINCT5相对表达量。U251细胞系LSINCT5相对表达量(2.300±0.407)高于U87(1.006±0.309)、U373(1.112±0.184)、A172(0.460±0.170)、SHG44(0.767±0.104)、U118(1.456±0.161)、U138(0.314±0.130)、T98G(0.799±0.179),P均<0.05。选择U251进行下述试验。
1.3 U251 sh LSINCT5细胞的构建 ①慢病毒包装:接种293T细胞于6孔板,待细胞融合度80%左右,将packing质粒(psPAX2,1.5 μg/皿)、envelop质粒(pMD2.G,1.5 μg/皿)及4 μg目的质粒与10 μL Lipofectamine2000(Thermo Fisher Scientific)转染试剂混合,室温放置20 min。同时无血清DMEM处理293T细胞,将混合液均匀滴入细胞中,37 ℃、5% CO2培养8 h,更换DMEM+10%FBS培养。48、72 h后收集上清液并用0.45 μm滤器过滤。②慢病毒感染:接种U251细胞于6孔板,待细胞融合度40%左右,RPMI1640+10% FBS与病毒悬液2∶1培养细胞,同时加入3 μL Polubrene,重复感染2 d,1 μg/mL puromycin筛选细胞至细胞生长状态良好。实验分为sh LSINCT5 1#、2#、3#、4#组及对照组,分别插入如下序列,sh LSINCT5 1#:TGGGTCTATTTCTGTCCTTTCTGGT;sh LSINCT5 2#:ATCAATACAGTCAGCACTGAATCTT;sh LSINCT5 3#:TGGCTTTGGAGCTGGAGGAGACAGCG;sh LSINCT5 4#:GCTCTTGCCTGCTGAGTGGAAAGATC;GV248:CCTATTTCCCATGATTCCTTCATA。质粒构建具体步骤参见文献[6]。细胞系筛选完成后收集细胞系RNA并保种,通过RT-PCR技术观察干扰效果。sh LSINCT5 1#组、sh LSINCT5 3#组LSINCT5相对表达量分别为0.127±0.006、0.134±0.025,干扰效率均在70%以上,低于对照组(1.200±0.092),P均<0.05。选取sh LSINCT5 1#组、sh LSINCT5 3#组进行后续实验。
1.4 细胞增殖活力观察 采用噻唑蓝比色法(MTS)法。将对数生长期对照组、sh LSINCT5 1#组、sh LSINCT5 3#组细胞以1 000个细胞每孔的细胞密度接种至96孔板中,每孔加入100 μL细胞悬液(设置5个平行孔),置于5% CO2、37 ℃培养箱中培养。待细胞贴壁后,在0、24、48、72 h时将MTS溶液(Promega)与培养基以1∶5的比例混合均匀,替换旧培养基避光培养1 h,多孔板酶标仪检测490 nm处吸光度,以吸光度值代表细胞增殖活力。
1.5 细胞迁移能力观察 采用划痕修复实验。培养对数生长期的上述3组细胞于6孔板中,待细胞长满后使用灭菌100 μL一次性移液枪头垂直水平面在细胞中进行划痕,每孔5条,PBS小心冲洗细胞3次后,加入无血清培养基,于0、24 h显微拍照观察划痕修复程度。
1.6 细胞中细胞黏附分子(E-cadherin)、紧密连接蛋白-1(Zo-1)、细胞骨架蛋白(Vimentin)表达检测 采用Western blotting法。收集对数生长期细胞,加入胰酶消化,离心弃上清,PBS洗涤。加入300 μL IP裂解液与10 μL蛋白酶抑制剂,置离心管中,冰上裂解90 min,最大转速4 ℃,15 min离心提取蛋白质,BCA法行蛋白定量(Pierce Chemical)分析并根据各蛋白浓度将不同细胞株蛋白量调至一致。配制10%丙烯酰胺胶,待胶凝固后上样,80 V稳压跑胶30 min,120 V稳压跑胶1 h,湿转至PVDF(Millpore)膜,10%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,二抗37 ℃孵育1 h,ECL发光液曝光显影。一抗E-cadherin抗体(Abcam,ab15148)、Zo-1抗体(Abcam,ab59720)、Vimentin抗体(Abcam,ab92547)、β-actin抗体(santa cruz,sc-4778)浓度比为1∶1 000,以β-actin作为内参,二抗Goat Anti-Mouse IgG H&L(FITC,ab6785),Goat Anti-Rabbit IgG H&L(Alexa Fluor®488,ab150077),浓度比为1∶2 000,ImageLab软件进行灰度扫描,以灰度值表示蛋白浓度。
1.7 细胞放射敏感性观察 将对数生长期上述3组细胞以4×103/孔接种至96孔板中,在X射线仪下分别照射0、2、4、8 Gy,过程中无菌操作,于5% CO2、37 ℃培养箱中培养48 h左右,MTS法检测细胞增殖能力。

2 结果
2.1 各组细胞增殖能力比较 见表1。
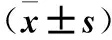
表1 各组细胞增殖能力比较
注:与对照组相比,*P<0.05。
2.2 各组细胞迁移能力比较 sh LSINCT5 1#组、sh LSINCT5 3#组细胞的修复距离分别为(0.381±0.226)、(0.745±0.262)mm,均短于对照组的(1.470±0.435)mm,P均<0.05。
2.3 各组细胞E-cadherin、Zo-1、Vimentin表达比较 见表2。
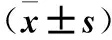
表2 各组细胞E-cadherin、Zo-1、Vimentin表达比较
注:与对照组相比,*P<0.05。
2.4 各组细胞放射敏感性比较 见表3。
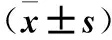
表3 各组细胞放射敏感性比较
注:与对照组相比,*P<0.05。
3 讨论
lncRNA是长度超过200 nt的非编码RNA(ncRNA),和众多ncRNA一样缺少开放阅读框,不参与蛋白质的翻译,近年来发现其可通过多种表观遗传调控机制发挥生物学作用,包括染色质重塑、细胞周期调控、剪接调控及RNA降解等[7]。由于lncRNA数量庞大及功能广泛,其与肿瘤的关系也逐步引起重视。LSINCT5是lncRNA家族中的成员之一,基因位于5p15.33染色体上,长度为2.6 kb[8]。有研究显示,LSINCT5在乳腺癌、卵巢癌、胃癌等多种恶性肿瘤中高表达,且可通过多种机制在恶性肿瘤细胞中发挥促细胞增殖、转移及抗凋亡等生物学作用,包括促进抗凋亡因子核旁斑点结构蛋白1及凋亡因子Caspase-3的表达[9~11],其中细胞凋亡是影响恶性肿瘤细胞放化疗敏感性的关键因素[12]。基于上述研究,本实验拟探究LSINCT5对胶质瘤细胞生物学效应的影响及其与胶质瘤放疗抵抗的关系。
胶质瘤中以胶质母细胞瘤及星型胶质瘤最为常见,其中胶质母细胞瘤及多种间变性星型胶质瘤在WHO的分级中均属于高级别胶质瘤,其恶性程度高,局部浸润能力强,胶质母细胞瘤患者平均生存期仅1年左右,5年生存率低于3.3%。目前胶质瘤主要采用手术治疗[13],但由于脑组织本身结构疏松,且多数胶质瘤恶性程度高,肿瘤浸润生长,与脑组织分界不清,除少数患者瘤体部位较好、体积小、恶性程度低外,大部分患者难以做到手术全部切除,故临床中往往术后配合放疗或化疗等,以延缓胶质瘤的复发,延长患者生存期。放疗虽然可在短时间内缩小肿瘤体积,但随着放疗剂量的累积,未被射线杀死的胶质瘤细胞内发生“4R”,即放射损伤修复、再氧合作用、细胞周期的再分布及细胞再增生[14],成为放射抵抗细胞,最终导致放疗失败、肿瘤复发。许多针对肿瘤细胞放疗抵抗的研究显示,放疗抵抗的发生与许多调控表观遗传的分子联系紧密,其中就包括lncRNA。徐小雯等[15]在HT29、SW480、RKO、Lovo和HCT116结直肠癌细胞系中发现3种与放疗敏感性密切相关的lncRNA,包括NR_05532、NR_015441和NR_033374,其基因表达水平与细胞放疗抵抗呈正相关。Jing等[16]研究发现lncRNA HOTAIR在宫颈癌细胞中可促进细胞的增殖转移能力,还可以通过影响p21基因的表达诱导宫颈癌细胞的抗辐射能力。Yang等[17]研究发现,lncRNA-ROR可通过p53/miR-145途径促进结直肠癌细胞放疗抵抗的发生。
E-cadherin的减少或缺失是EMT最主要的标志性变化,它是细胞间连接黏附的重要分子,并参与维持细胞极性。许多研究显示,E-cadherin的下调与癌细胞的侵袭转移具有密切关系[18]。Zo-1在细胞中起到封闭细胞间间隙的作用,其下调可导致细胞间紧密连接的中断,从而促进癌细胞的扩散[19]。Vimentin是成纤维细胞中等纤维的主要成分之一,其表达上调往往意味着细胞具有发生EMT的倾向[20]。本研究结果表明,sh LSINCT5 1#组、sh LSINCT5 3#组在48、72 h时细胞增殖能力及细胞修复距离均较对照组低,且与对照组相比,sh LSINCT5 1#组、sh LSINCT5 3#组E-cadherin、Zo-1表达高,Vimentin表达低;显示干扰LSINCT5的表达后,U251的增殖、迁移能力下降,E-cadherin、Zo-1表达上调,且Vimentin表达下调。提示LSINCT5可能通过促进胶质瘤细胞EMT过程,促进细胞的侵袭转移。本研究结果发现,sh LSINCT5 1#组、sh LSINCT5 3#组在2、4 Gy剂量照射时细胞增殖能力均较对照组低。可见,U251 sh LSINCT5细胞放射敏感性明显增强,提示LSINCT5可能参与胶质瘤放疗抵抗形成的过程。
综上可见,下调人胶质瘤细胞系U251中LSINCT5的表达,能抑制细胞增殖、转移,并增强细胞放疗敏感性。接下来的研究中,我们将通过体内实验进一步确认LSINCT5的促癌效应,并对其可能存在的相互作用分子进行深入探究,确定其可能的靶标分子,为人脑胶质瘤的临床诊治提供新的依据。
[1] 范阳华,叶敏华,祝新根.粘合连接相关蛋白1在脑胶质瘤中的研究现状及进展[J].肿瘤防治研究,2015,42(9):920-923.
[2] 罗飞.WHOⅢ级胶质瘤患者放疗或联合化疗治疗的预后因素分析[J].重庆医科大学学报,2012,37(11):976-979.
[3] Sato F. Significance of non-coding RNAs in breast cancer[J]. Nihon Geka Gakkai Zasshi, 2015,116(6):873-888.
[4] Hansji H, Leung EY, Baguley BC, et al. Keeping abreast with long non-coding RNAs in mammary gland development and breast cancer[J]. Front Genet, 2014,5(4):379-380.
[5] Smith DI, Jessica SM. Abstract A1: Long stress-induced non-coding transcripts (LSINCTs) and Cancer[J]. Cancer Res, 2013,72(2):419-434.
[6] 李文怡,范余娟,徐红,等.人SNCG基因shRNA慢病毒载体质粒的构建及鉴定[J].山东医药,2016,56(26):13-16.
[7] Bhartiya D, Kapoor S, Jalali S, et al. Conceptual approaches for lncRNA drug discovery and future strategies[J]. Expert Opin Drug Discov, 2012,7(6):503-513.
[8] Zhang R, Zhang L, Yu W. Genome-wide expression of non-coding RNA and global chromatin modification[J]. Acta Biochimica Biophys Sin (Shanghai), 2012,44(1):40-47.
[9] Silva JM, Boczek NJ, Berres MW, et al. LSINCT5 is over expressed in breast and ovarian cancer and affects cellular proliferation[J]. RNA Biol, 2011,8(3):496-505.
[10] Xu MD, Qi P, Weng WW, et al. Long non-coding RNA LSINCT5 predicts negative prognosis and exhibits oncogenic activity in gastric cancer[J]. Med, 2014,93(28):e303-e303.
[11] 王莉,王红英,黄群,等.siRNA LSINCT5联合顺铂对卵巢癌SKOV3细胞增殖和凋亡的影响[J].现代妇产科进展,2016,25(5):349-353.
[12] Bai M, Ma X, Li X, et al. The Accomplices of NF-κB Lead to Radioresistance[J]. Curr Protein Pept Sci, 2015,16(4):279-294.
[13] 陈正和,陈忠平.高级别胶质瘤的治疗现状及思考[J].中国临床神经外科杂志,2016,21(6):350-352.
[14] Yang D, Tan M, Wang G, et al. The p21-dependent radiosensitization of human breast cancer cells by MLN4924, an investigational inhibitor of NEDD8 activating enzyme[J]. PLoS One, 2012,7(3):384.
[15] 徐小雯,袁捷,左志贵,等.与放疗抵抗相关的长链非编码RNA在不同放疗敏感性结直肠癌细胞株中的表达[J].中华胃肠外科杂志,2014,17(11):1096-1100.
[16] Jing L, Yuan W, Ruofan D, et al. HOTAIR enhanced aggressive biological behaviors and induced radio-resistance via inhibiting p21 in cervical cancer[J]. Tumour Biol, 2015,36(5):3611-3619.
[17] Yang P, Yang Y, An W, et al. The long non-coding RNA-ROR promotes the resistance of radiotherapy for human colorectal cancer cells by targeting the P53/miR-145 pathway[J]. J Gastroenterol Hepatol, 2016,10(11):738-746.
[18] Yu JM, Sun W, Hua F, et al. BCL6 induces EMT by promoting the ZEB1-mediated transcription repression of E-cadherin in breast cancer cells[J]. Cancer Lett, 2015,365(2):190-200.
[19] Jain K, Basu A. Protein Kinase C-ε Promotes EMT in Breast Cancer[J]. Breast Cancer(Auckl), 2014,8(1):61-67.
[20] 张春冬,张莲,卜友泉.肺癌细胞A549中过表达PRR11影响Vimentin组装[J].重庆医科大学学报,2016,21(7):733-737.
Effectofdown-regulationofLSINCT5onproliferation,migration,andradiosensitivityofhumangliomacelllineU251
FENGJigao1,MOYehe,XUPengxiang,HUDexian1,OUYANGYibin,LIUDayuan,ZHANGCaicai
(1TheSecondAffiliatedHospitalofHainanMedicalUniversity,Haikou570311,China)
ObjectiveTo investigate the effect of down-regulation of LSINCT5 on proliferation, migration ability, and radiosensitivity of human glioma cell line U251.MethodsLentiviral transfection was used to construct stable LSINCT5 interference cells (U251 shLSINCT5 cells), and the cells in the sh LSINCT5 1# group and sh LSINCT5 3# group with high efficiency of interference and the cells in the control group (transfected with GV248) were used for the subsequent experiments. MTS method was used to detect the changes of cell proliferation abilities at 0, 24, 48, and 72 h. Scratch healing assay was used to detect the changes of cell migration abilities. Western blotting was used to detect the expression of E-cadherin, Zo-1 and Vimentin. MTS assay was used to detect the changes of cell proliferation abilities at 0, 2, 4, 8 Gy under X-ray.ResultsThe proliferation abilities of the sh LSINCT5 1# group and sh LSINCT5 3# group were significantly lower than that of the control group at 48 and 72 h (allP<0.05). The repair distance of the sh LSINCT5 1# and sh LSINCT5 3# groups were significantly lower than that of the control group (P<0.05). Compared with the control group, the expression levels of E-cadherin and Zo-1 in the sh LSINCT5 1# group and sh LSINCT5 3# group increased, and the expression of Vimentin decreased (allP<0.05). The proliferation abilities of sh LSINCT5 1# group and sh LSINCT5 3# group were lower than that of the control group at 2 and 4 Gy doses (bothP<0.05).ConclusionDown-regulation of LSINCT5 expression in human glioma cell line U251 can inhibit cell proliferation and metastasis, and increase radiosensitivity of cells.
long non-coding RNA LSINCT5; glioma; cell proliferation; cell migration; epithelial mesenchymal transition; radiosensitivity
10.3969/j.issn.1002-266X.2017.38.008
R739.41
A
1002-266X(2017)38-0027-04
冯基高(1982-),男,硕士,主治医师,主要研究方向为神经外科相关疾病的诊断和治疗。E-mail: gaoxingf2016@163.com
张彩彩(1983-),女,博士,讲师,主要研究方向为神经生物学。E-mail: olderfeng@163.com
2017-04-03)

