水下LED光照对凡纳滨对虾养殖水体环境因子和浮游植物群落变化的影响
徐华兵, 王龙乐, 曾权辉, 王首吉, 梅志平, 杜虹,
1.汕头大学海洋生物研究所, 汕头 515063 2.汕头大学生物系, 汕头 515063
水下LED光照对凡纳滨对虾养殖水体环境因子和浮游植物群落变化的影响
徐华兵1, 王龙乐2, 曾权辉2, 王首吉1, 梅志平1, 杜虹2,*
1.汕头大学海洋生物研究所, 汕头 515063 2.汕头大学生物系, 汕头 515063
为了研究水下LED光照对凡纳滨对虾养殖环境的影响, 从2013年5月到12月对架设水下LED光源和未加光源的养殖池塘进行水质和浮游植物样品的分析。结果显示, 在有水下 LED(LED组)和未装光源(对照组)的养殖池塘内温度、碱度、pH、透明度、总悬浮物、溶解氧、硅酸盐和磷酸盐变化趋势均相似。养殖前期LED组和对照组各项指标变化相似。在养殖中期LED组的叶绿素a含量高于对照组, 说明水下LED有助于提高微藻生物量的积累。同时养殖中期LED组的浮游植物群落的多样性指数和均匀度指数高于对照组, 说明水下LED光照有助于提高浮游植物群落稳定性。而在养殖后期LED组的硝酸盐和亚硝酸盐的含量低于对照组, 说明水下LED光照有助于水质的稳定。养殖周期内LED组和对照组优势种变化趋势体现为前期蓝藻-绿藻-硅藻, 中期蓝藻-绿藻(少量)和后期蓝藻-绿藻。
光源; 凡纳滨对虾; 养殖环境; 浮游植物
1 前言
光照是影响对虾生长的重要环境因素之一, 已有很多文献发现不同的光照对虾的行为、摄食、生长有较大的影响[1–3]。采用不同的传统光源光照(荧光灯、日光灯和金属卤化物灯)[4–6]时,,凡纳滨对虾在金属卤化物灯的照射下能够快速的生长, 同时含有更高的虾青素含量。而目前传统光源的缺点是包含了大部分不适合对虾生长的光谱。研究发现不同光谱光照对凡纳滨对虾产生不同的影响, 在从蓝色光谱到绿色光谱的周期性变化和规律性变化的条件下,获得最大的特定生长率[3,7]。目前新型的白色发光二极管(LED)主要的光谱就集中在蓝色和绿色光谱间,同时LED相对于传统光源还具有环保、低耗电量、小型化和寿命长等优点[8]。而有关LED对凡纳滨对虾的影响还鲜有报道。
在养殖水体中微藻是对虾生活环境中重要组成部分, 由于微藻含有丰富的蛋白、色素等营养物质能够满足对虾生长的需要, 在养殖前期部分微藻是对虾幼苗的天然活饵料。另外微藻能够吸收水体内的主要营养盐和有害物质, 净化水体环境, 从而保持对虾健康的生长[9]。研究发现LED光照对微藻的生长、生化组成和对水体营养盐的吸收有很大的影响, 然而不同的微藻对特定的光谱具有选择性[10–12],对于养殖环境中不同的微藻组成的环境, 哪种光谱更适合用于光源也鲜有报道。由于LED光源含有不同于传统光源的光谱, 因此有必要研究LED光照对养殖池塘环境中浮游植物和环境因子影响。
本研究尝试在对虾养殖池塘水下架设白色LED光照, 通过监测水体水质理化因子变化、浮游植物群落结构的变化和对虾生长, 评估增加水下白色LED光照对养殖生态和对虾生长的影响, 旨在为对虾养殖生产的环境调控提供参考依据。
2 材料与方法
2.1 凡纳滨对虾养殖场基本情况及采样点布设
本研究和美国 Once公司合作, 采用该公司生产的白色LED灯进行实验, 该灯已经过防水处理。在广东省汕头市牛田洋养殖区选取6个凡纳滨对虾养殖池塘, 在3个池塘(0.82±0.1) hm2水下各安装6盏LED作为实验组(pond-L)(安装方式见图1), 3个未安装 LED 的池塘(0.72±0.29) hm2作为对照组(pond-C)。LED光照时间为晚上6点到次日早上6点。养殖期间水体盐度变化范围0.8—1.9, 水深1 m左右, 养殖的密度约为每平方米170条。养殖期间的饲料投放和对虾的捕获等工作由合作的养殖户进行。实验从2013年5月31日开始到12月28日结束, 在8月3日到11月9日期间每隔两周采一次样外, 其他时间段均为每隔一周采样。采样点设置在图1的红色位置, 采样时间为早上8点到10点。将整个养殖阶段分为养殖初期(5月31日到7月31日, 共 9次采样)、养殖中期(8月1日到10月31日, 共7次采样)和养殖后期(11月1日至12月28日, 共8次采样)。
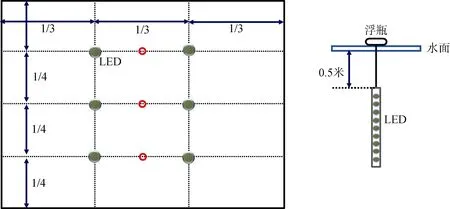
图1 LED安装示意图Fig.1 The sketches of the installation of LED
2.2 水体理化因子样品的采集与检测
水温(T)、溶解氧(DO)、盐度(S)和 pH 由美国Smartroll便携式水质测定仪测定。透明度(Tran)用黑白盘法现场测定。在每个池塘水面下0.5 m处用2.5 L采水器各采水样1份, 充分混匀, 按不同的理化指标分装水样, 并迅速对一些需要处理样品按要求进行0—4 ℃冷藏, 带回实验室检测。主要测定的指标包括: 碱度(ALK)、总悬浮物(TSS)、亚硝酸氮(NO2--N)、硝酸氮(NO3--N)、总氨氮(TAN)、、总氮(TN)、活性磷酸盐(PO43--P)、总磷(TP)、硅酸盐(SiO32--Si)和叶绿素 a(Chl a)。硝酸盐测定参照Bulgariu等[13]进行测定, 总氨氮测定采用水杨酸分光光度法(中华人民共和国国家环境保护标准 HJ 536—2009), 其他参考《海洋监测规范》(2007)。
2.3 浮游植物的采集与检测
采样时, 在每个池塘的3个采样点水下0.5 m处用2.5 L采水器各采水样1份, 取1 L倒入聚乙烯塑料瓶, 加入5%卢戈氏液固定, 静置24—48 h浓缩到50 mL后, 进行浮游植物的定量检测。同时, 参照《海洋监测规范》(2007)进行浮游植物定性样品的采集, 采集浮游植物样品定容至100 mL, 加入1 mL甲醛固定, 进行浮游植物的定性检测。浮游植物的定性和定量检测均送往南海水产所进行。
2.4 凡纳滨对虾体重体长测定
自2012年6月29日至11月16日, 每周一次早上8:00用虾网在每个虾池抓获30条虾, 测量虾长和虾重。
2.5 数据分析
用 PRIMER5.0版软件计算浮游植物群落的种类数(S)、Shannon-Weiner多样性指数(H)和Pilou均匀度指数(J)。用SPSS18.0进行统计分析(以p< 0.05作为差异显著水平), Origin8.0进行绘图。
3 结果与分析
3.1 虾池主要理化因子变化
养殖期间随着季节的变化, 虾池水温逐渐降低,最低温出现在12月19日(图2a)。LED组和对照组的碱度变化趋势相似, 养殖开始到养殖中期虾池的碱度值逐渐升高, 但在10月初出现骤减, 随后又缓慢上升(图2b)。养殖期间LED组和对照组的pH变化接近, LED组和对照组的pH均在6月中下旬达到峰值, 随后逐渐下降(图2c)。凡纳滨对虾适宜pH在7.5—8.6之间, 养殖期间LED组和对照组93.05%的pH值均在此范围内。
LED组和对照组的水体透明度变化趋势较为接近。养殖初期, 由于引入新的水源, 水体中浮游植物浓度较低, 透明度较高。随着时间推移浮游植物浓度增加, 透明度在养殖前期骤减, 随后稳定在 20—30 cm内。养殖前期两组透明度没有明显差异, 而养殖中期对照组透明度大部分时间高于LED组, 且在9月30日显著高于LED组(p<0.05), 后期LED组则均高于对照组(图2d)。
LED组和对照组的叶绿素a浓度与透明度的变化趋势相反, 养殖初期浓度较低, 中后期较高(图2e)。养殖前期两组叶绿素a浓度没有明显差异, 中期LED组的叶绿素a浓度高于对照组, 并且LED组的叶绿素a浓度在8月17日到9月14日显著高于对照组(p<0.05)。后期除了12月28日, 其他时间对照组的叶绿素a浓度均高于LED组。LED组和对照组的总悬浮物变化与叶绿素a变化趋势相似, 和透明度变化趋势相反(图2f), 仅在8月31日LED组的总悬浮浓度显著高于对照组(p<0.05)。两组溶解氧变化相近, 监测期间溶氧大于4 mg·L-1达到76.39%(图 2g)。
随着养殖的进行, 总氨氮的浓度逐渐增加, 养殖前期和中期总氨氮的含量较低, 后期含量增高不利于凡纳滨对虾生长(图2j)。养殖期间硝酸盐和亚硝酸盐的变化趋势相似, 在养殖初期达到一个峰值后降到很低浓度。养殖中后期两组硝酸盐和亚硝酸盐浓度略有增加, 但对照组在后期硝酸氮和亚硝酸氮急剧增加(图2h和图2i), 在养殖结束时分别达到最大值 6.90 mg·L-1和 2.66 mg·L-1。活性磷酸盐和活性硅酸盐均表现出养殖前期含量较高, 中后期含量较低的趋势(图2k和图2l)。
在整个养殖期间, 两组总氮的浓度逐渐增加,在养殖中期 LED组的总氮浓度均高于对照组(图2m)。从9月14日到10月26日的连续四次采样结果显示LED组总氮的浓度显著高于对照组。养殖期间总磷的最大值出现在养殖中期, 养殖中期LED组的总磷浓度大部分时间高于对照组, 且在9月30日和10月26日LED组总磷的浓度显著高于对照组,而养殖前期和后期两组总磷的浓度相近(图2n)。
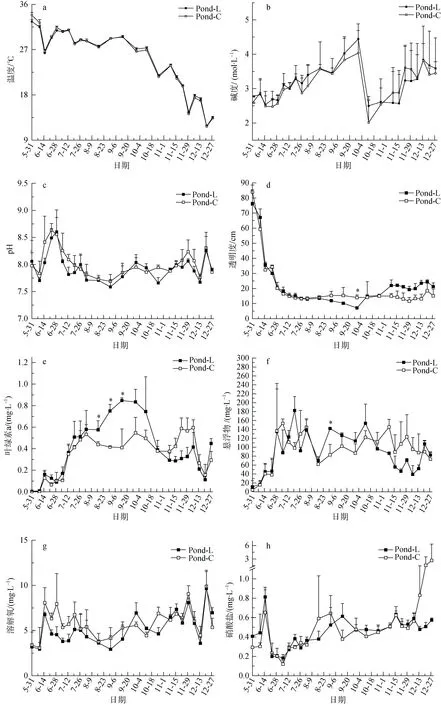
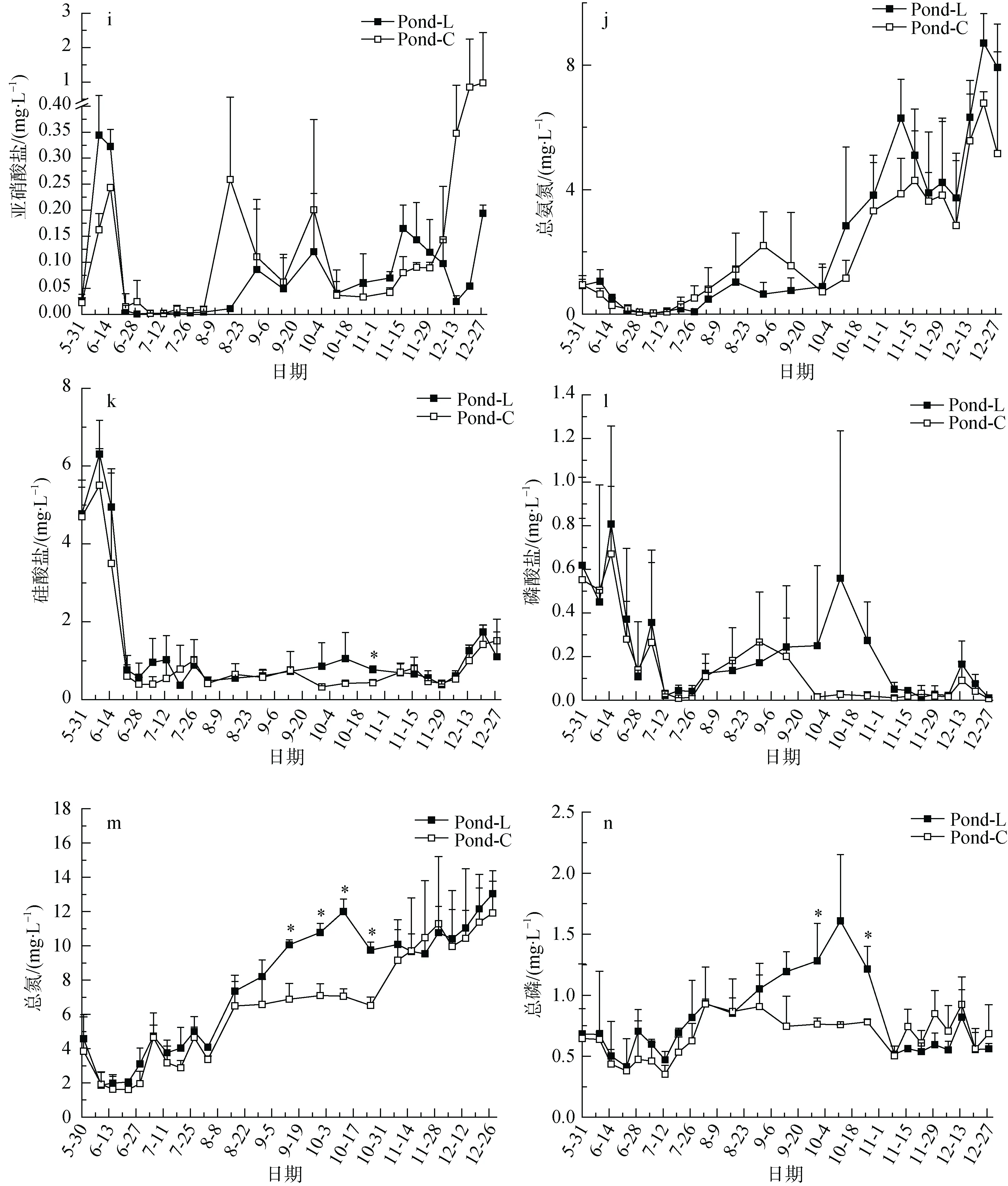
图2 养殖期间LED组和对照组水质因子变化Fig.2 The change of water quality between LED group and control group during culture period
3.2 虾池浮游微藻的变化
3.2.1 浮游植物种类组成与数量
养殖期间LED组和对照组共鉴定出微藻 8 门293 种, 其中绿藻125 种, 蓝藻47 种, 硅藻48 种,裸藻 47 种, 隐藻 12种, 黄藻 7种, 甲藻 5 种, 金藻 2 种。种类最多的是绿藻门, 占种类数的42.66%,其次是硅藻门, 占 16.38%, 蓝藻和裸藻门各占16.04%(图3)。
在整个养殖周期, LED组和对照组均呈现出绿藻生物量前期较高, 中期逐渐降低, 到后期又逐渐增加, 最高达 58.8%。蓝藻的生物量则与绿藻相反,中期最多, 最高达91.74%。整个养殖周期优势种的变化为前期绿藻-蓝藻-硅藻, 中期蓝藻-绿藻, 后期绿藻-蓝藻(图4)。

图3 养殖期间浮游植物门类比例Fig.3 The percentage of phytoplankton phyla during the culture period

图4 养殖期间LED组(左)对照组(右)浮游植物门类比例变化Fig.4 The percentage change of phyla phytoplankton phyla between LED group and control group during culture period
3.2.2 优势种、丰度、多样性和均匀度
在本次研究中, 将每次取样中个体的数量占总数量10%以上的定为优势种, 在1%—10%范围内的定为常见种, 在1%以下的定为稀有种[14]。LED组和对照组藻相分布在不同时期均存在差异(表1)。养殖前期LED组和对照组共同出现的优势种有蓝藻门的平裂藻、色球藻、隐球藻、束丝藻、绿藻门的栅藻、衣藻和硅藻门中的囊裸藻、小环藻、舟形藻。只在LED组出现的有蓝隐藻, 而只在对照组出现的有十字藻、直链藻、月牙藻、实球藻和卵囊藻。在养殖中期的优势种大量出现的平裂藻、色球藻、隐球藻和尖头藻, 只在LED组出现的有栅藻, 仅在对照组出现的是欧氏藻。养殖后期优势种主要有平裂藻、色球藻、隐球藻、束球藻、栅藻和衣藻。仅在 LED组出现的优势种有腔球藻、网球藻和隐杆藻, 仅在对照组出现的十字藻和集胞藻。
整个养殖周期中蓝藻门的平裂藻、色球藻、隐球藻为 LED组和对照组主要的优势种, 其中隐球藻在前期和中期作为优势种出现的概率小于平裂藻和色球藻, 而后期隐球藻出现的概率增加, 与平裂藻和色球藻出现的概率相似。束丝藻在养殖前期和养殖中期均是 LED组和对照组池塘中常见的优势种, 而在后期则未形成优势种。尖头藻是养殖中期才形成为LED组和对照组优势种, 在 LED组出现的概率大于对照组。绿藻门中的栅藻在前期和后期均为LED组和对照组的优势种, 但是仅在中期LED光照组出现。
养殖期间, LED组和对照组浮游植物的丰度呈现出前期较低, 养殖中期高, 后期逐渐降低。养殖期间出现三次峰值, 分别在7月27日、8月31日、10月12日。而在8月17日、9月30日、11月16日细胞丰度出现三次骤降。LED组浮游植物丰度变化范围是 2.267×104—1.769×109cells·L-1, 平均值为 3.462×108cells·L-1。对照组浮游植物丰度变化范围是 1.187×104—2.124×109cells·L-1, 平均值为 4.323×108cells·L-1(图 5a)。
LED组和对照组浮游植物多样性指数和均匀度指数变化如图5所示。LED组的浮游植物多样性指数和均匀度指数在养殖中期的大部分时间均高于对照组。并且LED组的浮游植物多样性指数和均匀度指数在8月3日均显著高于对照组(p<0.05)。在LED组多样性指数变化范围为0.98—3.92, 平均值为2.94±0.53,对照组变化范围为 1.12—4.13, 平均值为 2.82±0.65。LED组均匀度指数变化范围为 0.19—0.81, 平均值为0.62±0.11, 对照组变化范围为 0.22—0.84, 平均值为0.6±0.14。两组浮游植物种类数无明显差异, LED组变化范围为26—94, 均值为49.24±13.68, 对照组变化范围为 30—81, 均值为 47.21±11.73(图5)。
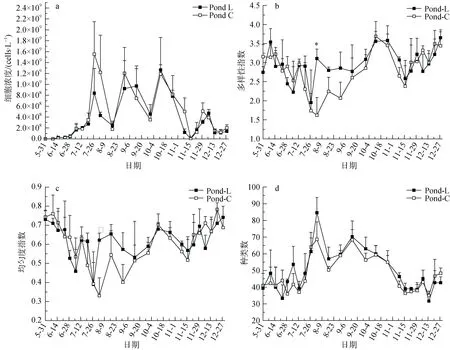
图5 养殖期间LED组和对照组浮游植物细胞浓度(图5a)、多样性指数(图5b)、均匀度指数(图5c)和种类数变化(图5d)Fig.5 Cell density, diversity index, evenness index and species number of phytoplankton between LED group and control group during culture period
3.3 对虾生长
自6月29日到11月16日进行对虾的采样, 11月16日后由于温度降低, 虾网无法捕获对虾, 遂停止采样。在这期间LED组和对照组对虾的体重和体长随着养殖的进行逐渐增大, 但是两组间没有显著性差异(图 6)。LED 组对虾体重变化范围为 0.54—7.36 g, 均值为(2.57±1.4) g。对照组体长变化范围为0.54—8.44 g, 均值为(2.86±1.63) g。LED组对虾体长变化范围为3.27—7.72 cm, 均值为(5.2±1.00) cm。对照组体长变化范围为 3.29—7.89 cm, 均值为(5.4±1.04) cm。
4 讨论
目前, 关于在海水养殖中增加水下LED光照来改善水体养殖环境的研究鲜有报道。本次实验, 在低盐度凡纳滨对虾养殖池塘水下架设白色LED光照是一次新的尝试。夜间水下添加人工LED后, 会增加水中光照, 对养殖池塘的环境产生影响。其中最先受到影响的是浮游植物, 额外的光照能够促进浮游微藻的生长, 从而吸收更多的营养盐, 导致水体的N、P含量减少, 有利于改善水体的环境。同时藻体夜间的光合作用能够释放 O2, 提高夜间水体内的溶解氧, 有利于高密度的养殖。
本次实验中, 养殖期间 LED组和对照组水体中的温度、碱度、pH、透明度、总悬浮物、溶解氧、硅酸盐和磷酸盐没有明显差异。但养殖后期LED组的硝酸盐和亚硝酸盐的浓度明显低于对照组, 亚硝酸盐是一种具有潜在毒性的无机氮化合物, 它能同血红蛋白结合形成高铁血红蛋白, 从而使血红蛋白失去携氧能力, 诱发动物病变, 不利于对虾生长。同时养殖后期对照组池塘的硝酸盐和亚硝酸盐的浓度变化差异很大, 水质不稳定。水质的稳定与否和浮游植物的生长是密切相关的。浮游植物种类越多或各种类的个体数量分布越均匀, 多样性指数越高, 说明浮游植物群落组成的重复性小, 群落的稳定性大, 水环境状况良好[15]。在本次实验中养殖中期LED组有较高的多样性指数和均匀度指数, 且在8月3日显著高于对照组(p<0.05), 说明了水中增加光照对促进池塘中微藻的群落稳定性有帮助。多样性指数和均匀度指数增加的原因可能是因为原先某些藻类在水面下由于光照传播距离很短无法得到充足的光照无法繁殖, 在水下增加光照后改善了生存条件, 促进了这些藻类的生长和繁殖, 从而使多样性指数和均匀度指数得到提高。所以增加水下LED光照有助于提高水质的稳定。

图6 养殖期间凡纳滨对虾生长变化Fig.6 The growth of Litopenaeus vannamei during the culture period
养殖期间LED组和对照组的浮游植物在不同的养殖阶段的组成不同, 但两组之间的变化趋势大体相似。在本次研究中前期养殖水体内的浮游植物优势种主要有硅藻, 绿藻和蓝藻, 种类丰度较低, 生物量很少。随着养殖的进行, 微藻生物量的增加, 水体的透明度降低(小于 20 cm), 水中光照减弱, 水温和pH值较高, 且营养丰富更适合蓝藻的生长[16–17], 遂逐渐形成以蓝藻为主要优势种,还有少量绿藻优势种。其中尖头藻仅在养殖中期形成优势种。后期水体温度降低不利于某些微藻的生长, 有些蓝藻和绿藻则仅在夏天水温较高时出现[18], 但后期优势种由蓝藻和绿藻为主, 而绿藻的生物量增多, 后期隐球藻形成优势种的频率明显高于养殖前期和中期。实验结果显示在养殖中期LED组叶绿素a含量高于对照组, 且在8月17日到9月14日的差异达到显著水平(p<0.05)。说明增加水下白色LED光照能促进微藻的快速生长。主要的原因可能是增加了光照时间, 延长了微藻的生长时间, 使微藻大量繁殖。另一方面白色LED包含大部分蓝色光谱和绿色光谱, 研究发现蓝绿光谱能够在海水中很好地穿透, 同时大量微藻内含有能够捕获蓝绿光谱的色素[19], 从而有助于相关微藻的生长。但是研究表明不同微藻对于不同光谱具有特定的选择性[10–12], 本实验现有的数据还无法说明这种LED促进了哪些种类微藻的生长, 需要进一步的研究。
本次实验通过添加水下LED光照, 监测整个养殖周期过程中水体环境因子和浮游植物群落的变化。实验结果表明水下添加白色LED光源在一定程度上有助于减少部分对对虾生长有害环境因子的浓度, 有利于养殖环境中水质的稳定, 同时也促进了浮游植物的生长和群落的稳定性。但整个研究过程中也存在一些不足之处。例如, 由于水体浮游微藻的平均细胞丰度可达3.9×108cells·L-1, 光线在水体传播距离很短(不超过 0.5米), 安置的 LED数量不足。此外实验中选取的是传统的土池, 每个养殖池塘的底质环境存在很大差别, 池塘边生长着各类水生植物也对养殖环境产生很大影响, 对实验结果产生影响。
致谢:感谢汪洋、肖喜林、温金艳、史姗姗和陆晨阳等协助采样并提供部分数据。
[1]WANG Fang, DONG Shuanglin, HUANG Guoqiang, et al.The effect of light color on the growth of Chinese shrimpFenneropenaeu schinensis[J].Aquaculture, 2003, 228(1):351–360.
[2]WANG Fang, DONG Shuanglin, DONG Shaoshuai, et al.The effect of light intensity on the growth of Chinese shrimpFenneropenaeus chinensis[J].Aquaculture, 2004,234(1): 475–483.
[3]GUO Biao, WANG Fang, DONG Shuanglin, et al.The effect of rhythmic light color fluctuation on the molting and growth ofLitopenaeus vannamei[J].Aquaculture, 2011,314(1): 210–214.
[4]HOANG T, BARCHIESIS M, LEE S Y, et al.Influences of light intensity and photoperiod on moulting and growth ofPenaeus merguiensiscultured under laboratory conditions[J].Aquaculture, 2003, 216(1): 343–354.
[5]YOU Kui, YANG Hongsheng, LIU Ying, et al.Effects of different light sources and illumination methods on growth and body color of shrimpLitopenaeus vannamei[J].Aquaculture, 2006, 252(2): 557–565.
[6]COYLE S D, BRIGHT L A, WOOD D R, et al.Performance of Pacific White ShrimpLitopenaeus vannamei, Reared in Zero-Exchange Tank Systems Exposed to Different Light Sources and Intensities[J].Journal of the World Aquaculture Society, 2011, 42(5):687–695.
[7]GUO Biao, MU Yingchun, WANG Fang, et al.Effect of periodic light color change on the molting frequency and growth ofLitopenaeus vannamei[J].Aquaculture, 2012,362: 67–71.
[8]SCHULZE P S C, BARREIRA L A, PEREIRA H G C, et al.Light emitting diodes (LEDs) applied to microalgae production[J].Trends in biotechnology, 2014, 32(8):422–430.
[9]查广才, 周昌清, 黄建荣, 等.凡纳对虾淡化养殖虾池微型浮游生物群落及多样性[J].生态学报, 2004, 24(8):1752–1759.
[10]KATSUDA T, LABABPOUR A, SHIMAHARA K, et al.Astaxanthin production byHaematococcus pluvialisunder illumination with LEDs[J].Enzyme and microbial technology, 2004, 35(1): 81–86.
[11]WANG Chihyu, FU Chunchong, LIU Yungchuan.Effects of using light-emitting diodes on the cultivation ofSpirulina platensis[J].Biochemical Engineering Journal,2007, 37(1): 21–25.
[12]KIM T H, LEE Y, HAN S H, et al.The effects of wavelength and wavelength mixing ratios on microalgae growth and nitrogen, phosphorus removal usingScenedesmussp.for wastewater treatment[J].Bioresource technology, 2013, 130: 75–80.
[13]BULGARIU L, BULGARIU D.Direct determination of nitrate in small volumes of natural surface waters using a simple spectrophotometric method[J].Reviews in Analytical Chemistry, 2012, 31(3): 201–207
[14]刘孝竹, 李卓佳, 曹煜成, 等.低盐度养殖池塘常见浮游微藻的种类组成数量及优势种群变动[J].南方水产科学,2009, 5(1): 9–16.
[15]路学堂.东平湖浮游植物群落结构与驱动因子及蓝藻水华可能性研究[D].山东: 山东大学, 2013: 45–52.
[16]SCHEFFER M, RINALDI S, GRAGNANI A, et al.On the dominance of filamentous cyanobacteria in shallow, turbid lakes[J].Ecology, 1997, 78(1): 272–282.
[17]刘孝竹, 李卓佳, 曹煜成, 等.珠江三角洲低盐度虾池秋冬季浮游微藻群落结构特征的研究[J].农业环境科学学报, 2009, 28(5): 1010–1018.
[18]杨东方, 陈生涛, 胡均, 等.光照, 水温和营养盐对浮游植物生长重要影响大小的顺序[J].海洋环境科学, 2007,26(3): 201–207.
[19]WOOD A M.Adaptation of photosynthetic apparatus of marine ultraphytoplankton to natural light fields[J].NATURE, 1985, 316(6025): 253–255.
The effect of underwater LED on the environmental factors of water and community composition of phytoplankton
XU Huabing1, WANG Longle2, ZENG Quanhui2, WANG Shouji1, MEI Zhiping1, DU Hong2,*
1.Marine Biology Institute,Shantou University,Shantou515063,China2.Department of Biology,Shantou University,Shantou515063,China
In order to investigate the effect of underwater white LED on the cultural environment ofLitopenaeus vannamei,this study investigated the water quality and phytoplankton through 24 samplings in three ponds installed underwater LEDs(LED group) and three ponds without LEDs (the control group) during May 2013 to December 2013.The results show that the time courses of temperature, alkalinity, pH, transparency, total suspended solids, dissolved oxygen, silicate and phosphate were similar between two groups.For the remaining variables, in earlier stage, they were similar for the two groups.In mid stage, the contents of total nitrogen, total phosphorus and chlorophyll a in the LED group were higher than those in the control group, manifesting that underwater LED contributed to the accumulation of biomass of microalgae.In the mid stage,the index for diversity and evenness of phytoplankton community in the LED group were higher than those in the control group, but the difference was not significant.In later stage, the contents of nitrate and nitrite were lower in the LED group than those in the control group, revealing that underwater LED contributed to the stability of water quality.During the cultural period, the time course of dominant species between LED group and the control group reflected as Cyanophyta-Chlorophyta-Bacillariophyta in the earlier stage, Cyanophyta- Chlorophyta (few) in mid stage and Cyanophyta-Chlorophyta in later stage.
light source;Litopenaeus vannamei; cultural environment; phytoplankton
10.14108/j.cnki.1008-8873.2017.05.014
X826
A
1008-8873(2017)05-104-10
徐华兵, 王龙乐, 曾权辉, 等.水下LED光照对凡纳滨对虾养殖水体环境因子和浮游植物群落变化的影响[J].生态科学, 2017,36(5): 104-113.
XU Huabing, WANG Longle, ZENG Quanhui, et al.The effect of underwater LED on the environmental factors of water and community composition of phytoplankton[J].Ecological Science, 2017, 36(5): 104-113.
2016-08-18;
2016-10-29
广东省海洋与渔业局科技推广专项项目(A201405B06)
徐华兵(1990—), 男, 博士研究生, 安徽安庆人, 水生环境保护与修复, E-mail: xuhuabing1990@163.com
*通信作者:杜虹, 女, 博士, 教授, 主要从事生态学研究, E-mail: hdu@stu.edu.cn

