生长调节剂和渗透调节物质对水曲柳体胚发生的影响
杨 玲 刘虹男 张冬严 魏 骋 沈海龙
(东北林业大学林木遗传育种与生物技术教育部重点实验室,哈尔滨 150040)
生长调节剂和渗透调节物质对水曲柳体胚发生的影响
杨 玲 刘虹男 张冬严 魏 骋 沈海龙*
(东北林业大学林木遗传育种与生物技术教育部重点实验室,哈尔滨 150040)
以水曲柳成熟合子胚子叶为材料诱导体胚发生,通过改变诱导培养基中植物生长调节剂和渗透调节物质的种类及浓度,分析二者对水曲柳体胚发生的影响。研究结果表明:诱导培养基中的生长调节剂在水曲柳体胚发生过程中是必不可少的因素;高渗透压有利于体胚诱导:在添加生长调节剂的条件下,添加75 g·L-1的蔗糖可提高体胚诱导率;通过在诱导培养基中添加100 g·L-1蔗糖产生的体胚在含有BA的分化培养基上分化率更高。研究结果为提高水曲柳体胚诱导率、改善体胚发生状况和优化体胚发生体系奠定了基础。
水曲柳;体胚发生;植物生长调节剂;渗透调节
水曲柳(FraxinusmandshuricaRupr.)属木犀科(Oleaceae )白蜡树属(Fraxinus)树种,是我国重要的珍贵阔叶树种,是寒温带森林生态系统中最重要的构成部分[1~2]。其分布范围广泛,在中国东北,朝鲜,日本和俄罗斯远东地区均有分布[3~4]。其材质优良,强度适中,纹理美观,木材利用价值和园林应用价值极高[5]。然而,水曲柳资源较为缺乏,加之不合理采伐和利用,已被列为我国濒危树种,迫切需要保护[6~7]。水曲柳以种子繁殖为主,但种子具有休眠的特性[8],需要经过240~270 d的层积处理,才能打破休眠。现在,传统的繁殖方法虽有所改善但并未取得突破性的进展,通过离体无性繁殖与生物技术相结合可以大大缩短育种时间[5]。体细胞胚胎发生(以下简称体胚发生)是离体培养条件下植物体细胞的一个基本发育途径[9]。其作为研究植物胚胎发育过程中形态发生、生理生化及分子生物学变化的良好替代体系[2,10~11],因其具有数量多、速度快、结构完整、再生频率高等优点而被广泛应用[12]。
目前,以水曲柳幼胚[3]和成熟胚[4]为外植体通过体胚发生途径诱导植株再生的培养体系已经建立,但对水曲柳体细胞胚性获得的机理尚不明确。前期研究中发现,水曲柳体胚多数发生在褐化的外植体上[4],同时在高糖诱导的水曲柳体胚发生中检测到了过氧化氢(H2O2)的显著释放,推测与体胚诱导阶段培养基中较高渗透压产生渗透胁迫并导致细胞内活性氧积累有关。为了解生长调节剂和培养基渗透压在水曲柳体胚诱导和分化阶段的确切作用,本文以水曲柳成熟胚的单片子叶为外植体,在诱导培养基中添加不同植物生长调节剂和渗透调节物质,分析生长调节剂和渗透调节物质对水曲柳体胚发生的影响。研究结果为提高水曲柳体胚诱导率、改善水曲柳体胚发生状况和优化水曲柳体胚发生系统奠定了基础。
1 材料与方法
1.1 试验材料
水曲柳成熟合子胚采自东北林业大学(哈尔滨市,中国)校园内10株生长健壮的60 a生的母树,于2015年10月中旬收集具有褐色果皮的成熟翅果备用。
1.2 方法
1.2.1 外植体处理
外植体处理方法参考Yang等的方法,采集到的种子混匀去翅后在流水下冲洗2 d,然后在75%(v/v)乙醇溶液中浸泡搅拌30 s,随后在5%(v/v)次氯酸钠溶液中浸泡15 min,最后在超净工作台中,用无菌蒸馏水冲洗5次。将消毒处理后的成熟种子挤出完整合子胚,切下单片子叶,将其近轴端接触培养基表面放置。
1.2.2生长调节剂和渗透调节物质对水曲柳体胚诱导的影响
(1)培养基中添加NAA和BA时渗透调节物质的作用分析

(2)培养基中无生长调节剂条件下渗透调节物质的作用分析

1.2.3生长调节剂和渗透调节物质对水曲柳体胚分化的影响
将上述方法(1)中所有处理的培养60 d的材料分别分成3份,分别继代到含有不同生长调剂的培养基上继续培养。共3个处理,处理Ⅰ(对照):不添加任何生长调节剂;处理Ⅱ:添加5.0 mg·L-1NAA;处理Ⅲ:添加2.0 mg·L-1BA。培养基其余成分和制备方法同方法(1),每个处理接种5个培养皿,每皿接种10个培养物。培养条件同方法(1)。培养60 d后观察统计体胚发生数量和体胚分化率。
1.2.4 数据处理与统计分析
利用体视解剖镜(OLYMPUS SZX7)进行胚胎发育时期鉴定,拍照使用Moticam 3000C系统。采用Excel 2003软件进行数据处理,利用SPSS 17.0软件进行单因素方差分析和邓肯多重比较以及双因素方差分析,平均数在P=0.05水平或P=0.01水平上进行邓肯多重比较,百分数数据在分析前进行反正弦转换。使用Origin 8.0软件进行制图,图表中数据均为平均值,“±”之后为标准差。主要计算公式如下:
体胚诱导率(%)=有体胚发生的外植体数×100/接种的外植体数量
(1)
体胚分化率(%)=有体胚分化的培养物数量×100/继代的培养物数量
(2)
2 结果与分析
2.1生长调节剂和渗透调节物质对水曲柳体胚诱导的影响
2.1.1生长调节剂和渗透调节物质对体胚诱导率的影响
不同渗透调节物质蔗糖和(或)甘露醇处理下,培养时间与浓度对水曲柳体胚诱导率影响均达到差异极显著(P<0.01)(表1)。甘露醇处理下,培养时间与浓度的交互作用对水曲柳体胚诱导率的影响均达到差异极显著(P<0.01);但蔗糖处理下,培养时间与浓度的交互作用对水曲柳体胚诱导率的影响差异不显著(P>0.05)。多重比较结果表明,培养基中添加不同浓度甘露醇和(或)蔗糖对水曲柳体胚诱导率的影响差异显著(诱导培养45 d时达到显著水平,P<0.05;培养60 d时达到极显著水平,P<0.01)。诱导培养45 d时(图1:a,c),75 g·L-1蔗糖浓度下的体胚诱导率达到最大(50.33%)(图2);25 g·L-1甘露醇浓度下的体胚诱导率达到最大(20.00%),比75 g·L-1蔗糖浓度下的体胚诱导率低60.26%(图3)。诱导培养60 d时(图1:b,d),100 g·L-1蔗糖浓度下的体胚诱导率达到最大(72.44%),其发生在褐化子叶上的体胚诱导率达最大(67.11%),占体胚诱导率的92.64%;85 g·L-1甘露醇浓度下的体胚诱导率达到最大(67.33%),比75 g·L-1蔗糖浓度下的体胚诱导率低7.05%,其中发生在褐化子叶上的体胚诱导率最大(56.00%),占体胚诱导率的83.17%。说明随着培养时间的增加,体胚主要产生在褐化的外植体上,较高渗透压促进了外植体的褐化和体胚发生。
在诱导培养基中有生长调节剂存在的条件下,添加不同浓度的蔗糖和(或)甘露醇均可以诱导外植体产生体胚。而在无生长调节剂存在的条件下,没有体胚产生。说明生长调节剂是水曲柳体胚诱导过程中所必需的。
表1渗透调节物质对水曲柳体胚诱导率的方差分析
Table1VarianceanalysisofosmoregulationsubstancesonsomaticembryogenesispercentageofF.mandshurica

渗透调节物质Osmoregulationsubstances源Variations平方和Sumofsquares自由度df均方MeansquareSig.蔗糖Sucrose诱导培养时间Culturetime2313.88112313.8810浓度Concentration2718.044679.510诱导培养时间×浓度Culturetime×Concentration403.5884100.8970.216误差Error1270.3422063.517总计Total47435.4230甘露醇Mannitol诱导培养时间Culturetime4845.05214845.0520浓度Concentration1167.9864291.9960诱导培养时间×浓度Culturetime×Concentration590.654147.6630.009误差Error643.2082032.16总计Total38722.20230

图1 水曲柳成熟合子胚的体胚诱导培养 a.培养45 d时以蔗糖为渗透压调节剂的培养基上的体胚;b.培养60 d时以蔗糖为渗透压调节剂的培养基上的体胚;c.培养45 d时以甘露醇为渗透压调节剂的培养基上的体胚;d.培养60 d时以甘露醇为渗透压调节剂的培养基上的体胚Fig.1 Somatic embryogenesis from zygotic embryo of F.mandshurica on induction medium a. Somatic embryogenesis on culture medium with sucrose as osmotic stress regulator after 45 d; b. Somatic embryogenesis on culture medium with sucrose as osmotic stress regulator after 60 d; c. Somatic embryogenesis on culture medium with mannitol as osmotic stress regulator after 45 d; d. Somatic embryogenesis on culture medium with mannitol as osmotic stress regulator after 60 d

图2 不同浓度蔗糖对水曲柳体胚诱导率的影响 字母表示方差分析和邓肯多重比较结果,不同大写字母表示在P=0.01水平上差异极显著; 不同小写字母表示在P=0.05水平上差异显著,相同字母表示在P=0.05水平上差异不显著,下同。Fig.2 Effects of sucrose concentrations on somatic embryogenesis percentage of F.mandshurica Different letter indicate that the values are significantly different from each other at P=0.05 and P=0.01 with capital letters and the same letters aren’t significantly from each other at P=0.05 using Duncan’s Multiple Range Test.The same as below.
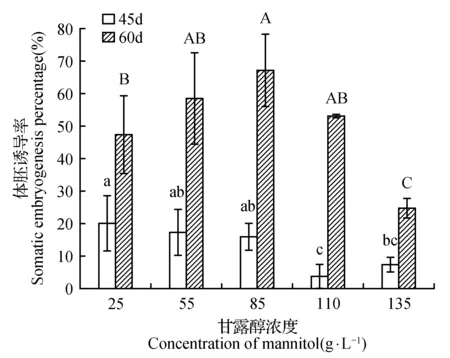
图3 不同浓度甘露醇对水曲柳体胚诱导率的影响Fig.3 Effects of mannitol concentrations on somatic embryogenesis percentage of F.mandshurica
2.1.2生长调节剂和渗透调节物质对平均体胚发生数量的影响
培养时间和蔗糖浓度对水曲柳平均体胚发生数量的影响达到极显著差异(P<0.01),且二者交互作用对水曲柳平均体胚发生数量影响差异显著(P<0.05);甘露醇处理下, 甘露醇浓度对水曲柳平均体胚发生数量的影响不显著(P>0.05),培养时间对水曲柳平均体胚发生数量有极显著影响(P<0.01),培养时间和甘露醇浓度的交互作用对水曲柳平均体胚发生数量存在显著差异(P<0.05)(表2)。培养45和60 d时,不同浓度蔗糖对水曲柳平均体胚发生数量的影响均差异极显著(P<0.01)。诱导培养45 d时,当蔗糖浓度为125 g·L-1时,平均体胚发生数量达到最大(每外植体13个),比85 g·L-1甘露醇处理的平均体胚发生数量(每外植体9个)高出53.00%。诱导培养60 d时,100 g·L-1蔗糖浓度处理的平均体胚发生数量最高(每外植体13个),比110 g·L-1甘露醇处理(每外植体11个)高出20.50%。此外,随培养基中渗透调节物质浓度的增加,体胚发育进程也随之加快,较高渗透压条件下,诱导培养60 d时外植体上已有子叶形体胚出现(表3~4)。
表2渗透调节物质对水曲柳平均体胚发生数量的方差分析
Table2VarianceanalysisofosmoregulationsubstancesonsomaticembryogenesisnumberofF.mandshurica

渗透调节物质Osmoregulationsubstances源Variations平方和Sumofsquares自由度df均方MeansquareSig.蔗糖Sucrose诱导培养时间Culturetime70.717170.7170.001浓度Concentration201.378450.3440诱导培养时间×浓度Culturetime×Concentration65.854416.4630.017误差Error85.091204.255总计Total2761.04830甘露醇Mannitol诱导培养时间Culturetime92.647192.6470.001浓度Concentration31.88247.9710.299诱导培养时间×浓度Culturetime×Concentration71.424417.8560.046误差Error121.251206.063总计Total2106.08230
表3蔗糖浓度对水曲柳体胚发生数量的影响
Table3EffectsofsucroseconcentrationsonsomaticembryogenesisnumberofF.mandshurica

诱导培养时间Culturetime(d)蔗糖浓度Concentrationofsucrose(g·L-1)体胚发生情况SituationofSSEs体胚数量SEinduction(ind.)单个外植体上的体胚数SSEs/explant(ind.)体胚发生阶段SEstage45253.06±2.68C1~14球形Globular504.64±1.12BC1~14球形Globular757.15±1.59BC1~26球形、心形Globular,Heart⁃shaped1008.65±3.00B1~40球形、心形、鱼雷形Globular,Heart⁃shaped,Torpedo12512.96±2.59A2~26球形、心形、鱼雷形Globular,Heart⁃shaped,Torpedo60256.06±0.80B1~41球形Globular509.94±1.53A1~45球形Globular7512.42±2.10A1~54球形、心形、鱼雷形Globular,Heart⁃shaped,Torpedo10013.05±2.71A1~39球形、心形、鱼雷形、子叶形Globular,Heart⁃shaped,Torpedo,Cotyledonary12510.35±1.07A1~38球形、心形、鱼雷形、子叶形Globular,Heart⁃shaped,Torpedo,Cotyledonary
表4甘露醇浓度对水曲柳体胚发生数量的影响
Table4EffectsofmannitolconcentrationsonsomaticembryogenesisnumberofF.mandshurica

诱导培养时间Culturetime(d)甘露醇浓度Concentrationofmannitol(g·L-1)体胚发生情况SituationofSSEs体胚数量SEinduction(ind.)单个外植体上的体胚数SSEs/explant(ind.)体胚发生阶段SEstage45257.84±2.822~23球形、心形Globular,Heart⁃shaped557.14±2.582~19球形、心形Globular,Heart⁃shaped858.47±3.821~32球形Globular1103.00±3.001~10球形、心形Globular,Heart⁃shaped1353.38±2.291~11球形、心形Globular,Heart⁃shaped60258.31±0.591~36球形、心形、鱼雷形、子叶形Globular,Heart⁃shaped,Torpedo,Cotyledonary557.71±2.271~33球形、鱼雷形Globular,Torpedo8510.61±0.541~43鱼雷形Torpedo11010.83±1.971~34球形、心形、鱼雷形Globular,Heart⁃shaped,Torpedo1359.92±2.741~31球形、子叶形Globular,Cotyledonary
2.2生长调节剂和渗透调节物质对水曲柳体胚分化的影响
经过不同诱导培养基诱导出的体胚在不同分化培养基上的体胚分化率不同(图4~6)。经过在诱导培养基中添加100 g·L-1蔗糖诱导出的体胚在含有BA的分化培养基上分化率最高(71.67%)。经过诱导培养基中添加125或75 g·L-1蔗糖诱导出的体胚在不添加生长调节剂的分化培养基中分化率均可达70.00%。
在3种分化培养基上的平均体胚数量随着前期诱导培养基中蔗糖浓度的增加而增加(表5)。当诱导培养基中蔗糖浓度为125 g·L-1时,均可获得较高的体胚发生数量,其中对照组平均体胚发生数量最高(每外植体11个),其次是添加BA处理(每外植体9个),最后是添加NAA处理(每外植体8个)。当诱导培养基中甘露醇浓度为110 g·L-1时,含有NAA的分化培养基中平均体胚数量最多(每外植体10个),显著高于对照和BA处理(P<0.05)。渗透调节物质蔗糖(或甘露醇)浓度和生长调节剂对水曲柳体胚分化率和平均体胚分化数量的影响均差异不显著(P>0.05),并且二者不存在显著交互作用(P>0.05)。说明诱导培养基中的渗透调节物质蔗糖(或甘露醇)和生长调节剂对水曲柳体胚分化的影响不显著(表6~7)。

图4 培养60 d时分化培养基上不同来源水曲柳体胚分化率Fig.4 Differentiationrate of SSEs with different sources on proliferation medium of F.mandshurica after 60 d culture

图5 培养60 d时分化培养基上不同来源水曲柳体胚分化率Fig.5 Differentiation rate of SSEs with different mannitol on proliferation medium of F.mandshurica after 60 d culture

图6 水曲柳成熟合子胚的体胚分化培养 a.在含有NAA的分化培养基上的子叶期体胚;b.在含有BA分化培养基上的子叶期体胚;c.不含植物生长调节剂的分化培养基上的子叶期体胚Fig.6 Somatic embryogenesis from zygotic embryo of F.mandshurica on proliferation medium a. The SSEs of cotyledon stage on proliferation medium with NAA; b. The SSEs of cotyledon stage on proliferation medium with BA; c. The SSEs of cotyledon stage on proliferation medium with free-PGRs
表5生长和渗透调节物质对分化培养中水曲柳体胚数量的影响
Table5EffectsofosmoregulationsubstancesandPGRsofsomaticembryogenesisnumberonproliferationmediumofF.mandshurica

诱导培养基中渗透调节物质Osmoregulationsubstances种类Type浓度Concentration(g·L-1)分化培养方法Culturemethod体胚发生数量SSEsformation(ind.)平均体胚发生数量AverageofSSEsinduction(ind.)单个外植体上的体胚数SSEs/explant(ind.)蔗糖Sucrose75100125无生长调节剂Free⁃PGRs6.99±1.167.16±2.1010.98±0.492~172~183~1775100125添加NAAAdditionofNAA4.57±0.477.11±2.198.32±2.631~151~181~2275100125添加BAAdditionofBA6.77±1.708.34±0.769.28±1.701~222~193~23甘露醇Mannitol85110135无生长调节剂Free⁃PGRs7.14±0.907.03±1.08b7.56±3.212~183~171~3285110135添加NAAAdditionofNAA6.65±1.769.88±0.18a5.09±1.531~181~221~1285110135添加BAAdditionofBA7.38±2.317.12±1.03b6.40±1.532~193~231~17
3 讨论
体细胞转化为胚性细胞的一个重要前提是这些细胞必须脱离整体的束缚[13]。仅离体培养并非是胚性细胞发生的充分条件,因为这一转化过程是在相应诱导因子的作用下基因差别表达的结果。诱导植物体胚发生是一个多因素事件,其发生机理的研究也是多层次多方面的。到目前为止,还没有统一的诱导各种植物体胚发生模式[14]。植物生长调节剂和渗透胁迫等胁迫因子对植物体胚发生和胚性细胞感受态的获得起着重要作用[14]。
表6渗透调节物质对分化培养中水曲柳分化率的方差分析
Table6VarianceanalysisofosmoregulationsubstancesofdifferentiationrateofSSEsonproliferationmediumofF.mandshurica

渗透调节物质Osmoregulationsubstances源Variations平方和Sumofsquares自由度df均方MeansquareSig.蔗糖Sucrose分化培养方法Culturemethod189.694294.8470.587浓度Concentration608.4622304.2310.2分化培养方法×浓度Culturemethod×Concentration434.1744108.5430.648误差Error3106.98218172.61总计Total68597.2127甘露醇Mannitol分化培养方法Culturemethod295.3192147.6590.382浓度Concentration252.6662126.3330.436分化培养方法×浓度Culturemethod×Concentration996.0134249.0030.191误差Error2614.66218145.259总计Total61510.7527
表7渗透调节物质对分化培养中水曲柳平均体胚发生数量的方差分析
Table7VarianceanalysisofosmoregulationsubstancesofsomaticembryogenesisnumberonproliferationmediumofF.mandshurica

渗透调节物质Osmoregulationsubstances源Variations平方和Sumofsquares自由度df均方MeansquareSig.蔗糖Sucrose分化培养方法Culturemethod9.74924.8750.384浓度Concentration29.841214.920.07分化培养方法×浓度Culturemethod×Concentration5.56241.390.882误差Error86.964184.831总计Total1627.85327甘露醇Mannitol分化培养方法Culturemethod0.40320.2010.938浓度Concentration11.47525.7370.189分化培养方法×浓度Culturemethod×Concentration21.26545.3160.195误差Error52.908173.112总计Total1369.62826
糖类对诱导植物体胚发生是不可缺少的重要成分,其作用主要有两个:一是作为碳源,二是作为渗透调节物质调节渗透压[15]。细胞是通过培养基的渗透压来吸取营养的,只有培养材料和培养基之间处于等渗或略低于培养基的渗透压时,培养材料才有可能从培养基汲取养分和水分,常用的胁迫剂主要有蔗糖、甘露醇、聚乙二醇(PEG)、NaCl等。通常胁迫剂的类型和浓度影响体胚形成。在植物组织培养中,蔗糖是最常用的碳源和渗透调节剂。有研究发现,培养基中添加多种碳源可以提高体胚诱导率[16]。在美国白松(Pinusstrobus)成熟体胚的研究中发现,提高蔗糖浓度,或者添加蔗糖的同时用甘露醇或山梨糖醇替代部分蔗糖,更有利于体胚形成[17]。这与本研究的研究结果相似。在维持25 g·L-1的蔗糖浓度基础上添加85 g·L-1甘露醇使得外植体的体胚发生能力增强。同时研究发现,当诱导水曲柳体胚发生的蔗糖浓度为100 g·L-1,体胚诱导率达72.44%,比Yang等2013研究中,筛选出的最佳蔗糖浓度为75 g·L-1,所获得的最高体胚诱导率(67.50%)高7.31%。因此认为,水曲柳体胚诱导的适宜蔗糖浓度还可以略微提高,如使用100 g·L-1,但从经济效益考虑,可选用75 g·L-1。
生长调节剂是体胚发生过程中最重要的调节物质[18]。体胚发生过程通常分为诱导和分化两个阶段,在胚胎发育的早期阶段,建立一个有效的生长调节剂浓度梯度,对合子胚和体胚的不对称结构的建成是必不可少的条件[19]。不同的植物所使用的生长调节物质种类也大不相同,在苜蓿(Medicagosativa)体胚分化过程中,必须同时使用生长素和细胞分裂素,而对红豆草(Onobrychisviciaefolia)则只在附加一定量BA的情况下才能分化,且分化率较高[20]。糖和生长调节剂信号在植物生长和发育中的复杂相互作用已经被广泛研究[21],在龙胆(Gentianalutea)体胚发生的长期培养中[22],适度的甘露醇和山梨糖醇产生渗透胁迫比添加植物生长调节剂所获得的体胚诱导率高。在樟树(Cinnamomumcamphora)未成熟胚外植体诱导体胚发生中[23],0.5 mol·L-1蔗糖4℃预处理72 h后再转移到无生长调节剂培养基中培养,所获得的体胚诱导率最高。本研究中,在水曲柳体胚诱导阶段,只有当生长调节剂存在的条件下,在适宜的高渗透压下才能诱导出体胚。在体胚分化阶段,当培养基中存在BA时,高渗透压(100 g·L-1蔗糖)下产生的体胚分化率更高。但当分化培养基中不添加生长调节剂时,125 g·L-1蔗糖诱导产生的体胚分化率最大。由此认为,植物生长调节剂在水曲柳诱导阶段其决定性作用,但在体胚分化阶段,高渗透压下植物生长调节剂对水曲柳体胚分化的影响不显著。低渗透压诱导下,水曲柳体胚分化率亦较低。当诱导培养基中的添加低浓度的蔗糖(25和50 g·L-1)或甘露醇(25和55 g·L-1)时,在含有NAA的分化培养基中,水曲柳体胚诱导分化率较低,分别为30.00%、16.67%、16.67%和46.67%(数据未在文中列出)。
褐化现象在植物组织培养的建立过程中是必须消除的因素[24]。在水曲柳成熟和未成熟子叶诱导体胚的研究中发现[25],体胚大部分直接发生在褐化的外植体上,同时也发现抗氧化剂(Vc;PVP;L-谷氨酸)添加到诱导培养基中虽然抑制了外植体的褐化,但体胚诱导率也减小。因此认为褐化现象在水曲柳体胚发生中扮演着重要的角色[4]。在本研究中也同样发现这个现象,当蔗糖浓度为100 g·L-1或者甘露醇浓度为85 g·L-1时,褐化外植体上的体胚诱导率最高。体胚诱导培养基中较高的渗透压是造成外植体褐化的主要原因。高渗透压对于水曲柳体细胞胚胎发生感受性的获得是必需的,但其细胞学机理还需进一步揭示。
1.Wang Z Q,Guo D L,Wang X R,et al.Fine root architecture,morphology,and biomass of different branch orders of two Chinese temperate tree species[J].Plant and Soil,2006,288(1-2):155-171.
2.Mei L,Gu J C,Zhang Z W,et al.Responses of fine root mass,length,production and turnover to soil nitrogen fertilization inLarixgmeliniiandFraxinusmandshuricaforests in Northeastern China[J].Journal of Forest Research,2010,15(3):194-201.
3.Kong D M,Preece J E,Shen H L.Somatic embryogenesis in immature cotyledons of Manchurian ash(FraxinusmandshuricaRupr.)[J].Plant Cell,Tissue and Organ Culture,2012,108(3):485-492.
4.Yang L,Bian L,Shen H L,et al.Somatic embryogenesis and plantlet regeneration from mature zygotic embryos of Manchurian ash(FraxinusmandshuricaRupr.)[J].Plant Cell,Tissue and Organ Culture,2013,115(2):115-125.
5.Kong D M,Shen H L,Li N.Influence of AgNO3on somatic embryo induction and development in Manchurian ash(FraxinusmandshuricaRupr.)[J].African Journal Biotechnology,2012,11(1):120-125.
6.易雪梅,张悦,王远遐,等.长白山水曲柳种群动态[J].生态学报,2015,35(1):91-97.
Yi X M,Zhang Y,Wang Y X,et al.Population structure and dynamics ofFraxinusmandshuricain Changbai mountain[J].Acta Ecologica Sinica,2015,35(1):91-97.
7.孔冬梅,沈海龙,吕晋慧.水曲柳雌花发育、大孢子发生及胚胎发育的解剖学观察[J].植物研究,2008,28(4):387-391.
Kong D M,Shen H L,Lü J H.Anatomic observation on female flower development,megasporogenesis and embryo development ofFraxinusmandshurica[J].Bulletin of Botanical Research,2008,28(4):387-391.
8.张鹏,沈海龙.白蜡树属树种种子休眠及其萌发的调控[J].植物生理学通讯,2006,42(2):354-360.
Zhang P,Shen H L.Regulation of seed dormancy and germination ofFraxinusspecies[J].Plant Physiology Communications,2006,42(2):354-360.
9.Ghanti S K,Sujata K G,Rao M S,et al.Direct somatic embryogenesis and plant regeneration from immature explants of chickpea[J].Biologia Plantarum,2010,54(1):121-125.
10.Stasolla C,Yeung E C.Recent advances in conifer somatic embryogenesis:improving somatic embryo quality[J].Plant Cell,Tissue and Organ Culture,2003,74(1):15-35.
11.Merkle S A,Nairn C J.Hardwood tree biotechnology[J].In Vitro Cellular & Developmental Biology-Plant,2005,41(5):602-619.
12.Gupta P K,Pullman G,Timmis R,et al.Forestry in the 21st century[J].Nature Biotechnology,1993,11(4):454-459.
13.崔凯荣,邢更生,周功克,等.植物激素对体细胞胚胎发生的诱导与调节[J].遗传,2000,22(5):349-354.
Cui K R,Xing G S,Zhou G K,et al.The induced and regulatory effects of plant hormones in somatic embryogenesis[J].Hereditas,2000,22(5):349-354.
14.由香玲,谭啸,戴金玲,等.胁迫诱导植物体细胞胚发生的研究进展[J].西北植物学报,2010,30(9):1929-1934.
You X L,Tan X,Dai J L,et al.Progress on the stress induction of plant somatic embryogenesis[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(9):1929-1934.
15.徐志微,杨丽丽,杜国强,等.培养基渗透压和生长调节剂对葡萄种质离体保存的效应[J].分子植物育种,2014,12(4):720-725.
Xu Z W,Yang L L,Du G Q,et al.Efficacy of osmotic pressure and plant growth regulators in media on conservation of grape plantlets in vitro[J].Molecular Plant Breeding,2014,12(4):720-725.
16.Gaj M D.Factors Influencing Somatic embryogenesis induction and plant regeneration with particular reference toArabidopsisthaliana(L.) heynh[J].Plant Growth Regulation,2004,43(1):27-47.
17.Garin É,Bernier-Cardou M,Isabel N,et al.Effect of sugars,amino acids,and culture technique on maturation of somatic embryos ofPinusstrobuson medium with two gellan gum concentrations[J].Plant Cell,Tissue and Organ Culture,2000,62(1):27-37.
18.Ceasar S A,Ignacimuthu S.Effects of cytokinins,carbohydrates and amino acids on induction and maturation of somatic embryos in kodo millet(PaspalumscorbiculatumLinn.)[J].Plant Cell,Tissue and Organ Culture,2010,102(2):153-162.
19.Schiavone F M,Cooke T J.Unusual patterns of somatic embryogenesis in the domesticated carrot:developmental effects of exogenous auxins and auxin transport inhibitors[J].Cell Differentiation,1987,21(1):53-62.
20.李明,王树香,冯大领.植物体细胞胚发生及发育研究进展[J].中国农学通报,2011,(3):237-241.
Li M,Wang S X,Feng D L.The advance of plant somatic embryogenesis and development[J].Chinese Agricultural Science Bulletin,2011,(3):237-241.
21.León P,Sheen J.Sugar and hormone connections[J].Trends in Plant Science,2003,8(3):110-116.
22.Irina H,Catana R.Recurrent somatic embryogenesis in long-term cultures ofGentianaluteaL.as a source for synthetic seed production for medium-term preservation[J].Archives of Biological Sciences,2012,64(2):809-817.
23.Shi X P,Dai X G,Liu G F,et al.Enhancement of somatic embryogenesis in camphor tree(CinnamomumcamphoraL.):osmotic stress and other factors affecting somatic embryo formation on hormone-free medium[J].Trees,2009,23(5):1033-1042.
24.Pirttilä A M,Podolich O,Koskimaki J J,et al.Role of origin and endophyte infection in browning of bud-derived tissue cultures of Scots pine(PinussylvestrisL.)[J].Plant Cell,Tissue and Organ Culture,2008,95(1):47-55.
25.Liu C P,Yang L,Shen H L.Proteomic analysis of immatureFraxinusmandshuricacotyledon tissues during somatic embryogenesis:effects of explant browning on somatic embryogenesis[J].International Journal of Molecular Sciences,2015,16(6):13692-13713.
The National Natural Science Foundation of China(31400535)
introduction:YANG Ling(1977—),female,PhD,mainly engaged in plant physiology research work.
date:2017-05-05
EffectofPlantGrowthRegulatorsandOsmoticumsonSomaticEmbryogenesisofFraxinusmandshuricaRupr.
YANG Ling LIU Hong-Nan ZHANG Dong-Yan WEI Cheng SHEN Hai-Long*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
An experiment was conducted to study the effects of plant growth regulators (PGRs) and osmotic adjustment substances on somatic embryogenesis ofFraxinusmandshuricaRupr. by changing the kinds and concentrations of them, which was taken cotyledon of mature zygotic as explants. PGRs were the essential factors for somatic embryogenesis ofF.mandshuricaon the induction medium. The induction medium higher osmotic stress was beneficial to induce somatic embryos. Under PGRs, the induction medium of highest SSEs induction rate was added with 75 g·L-1sucrose. The somatic embryo was induced by the induction medium was added with 100 g·L-1sucrose had higher differentiation rate on the differential medium contained BA. This study laid the foundation in increasing SE induction rate and improving the status of somatic embryogenesis and optimizing the somatic embryogenesis system ofF.mandshurica.
Fraxinusmandshurica;somatic embryogenesis;plant growth regulator;osmoticums
国家自然科学基金(31400535)
杨玲(1977—),女,博士,主要从事植物生理学研究。
* 通信作者:E-mial:shenhl-cf@nefu.edu.cn
2017-05-05
* Corresponding author:E-mial:shenhl-cf@nefu.edu.cn
Q949.776.2
A
10.7525/j.issn.1673-5102.2017.05.007

