PCSK9基因D374Y突变体转基因猪的制备与分析
张雪,黄雷,阮进学,刘志国,程英,冯书堂,牟玉莲,李奎
PCSK9基因突变体转基因猪的制备与分析
张雪,黄雷,阮进学,刘志国,程英,冯书堂,牟玉莲,李奎
(中国农业科学院北京畜牧兽医研究所,北京100193)
【】前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/Kexin type 9,)基因是人类高胆固醇血症(autosomal dominant hypercholesterolemia, ADH)的主效基因之一,其获得型突变与人类家族性高胆固醇血症有直接的关系。PCSK9-D374Y突变体对低密度脂蛋白受体(low density lipoprotein receptor,LDLR)的降解能力比野生型蛋白强十倍,增加了患高胆固醇血症的风险,从而加速动脉粥样硬化的进程。猪心血管系统和血脂代谢方面与人类非常相近,成为研究动脉粥样硬化疾病的理想模型之一。然而自然发病的猪缺乏,且诱导病征发生缓慢。因此拟利用体细胞克隆技术制备获得型突变体转基因猪,以模拟动脉血管的病理学变化,加速发病进程,为动脉粥样硬化的研究提供理想的动物模型。【】研究使用人PCSK9基因突变体载体,用电转染的方法将其整合到五指山小型猪近交系胎儿成纤维细胞中,并通过体细胞核移植技术获得了人PCSK9基因突变体转基因猪个体。通过Southern-blot、实时荧光定量PCR、Western-blot等方法,分别从DNA、RNA、蛋白的水平检测了人PCSK9基因在转基因猪肝脏中的整合表达情况。同时,通过组织化学染色与H.E.染色的方法对转基因猪进行了组织学检测。【】转基因阳性细胞集落在药筛的第3天开始出现,至第7天形成较大的单克隆点,且PCR检测结果显示扩增产物可以拼接为完整片段,说明外源片段在基因组中具有完整性;将筛选得到的阳性细胞作为体细胞克隆的供体细胞,通过体细胞核移植技术获得了转基因猪个体。PCR及Southern-blot 检测结果显示,D374Y-PCSK9基因可以完整的插入猪的基因组中,且有串联重复现象;RT-PCR和QPCR检测结果表明,人PCSK9基因能在猪肝脏内正常转录且不影响猪内源性PCSK9基因的转录,且在其它内脏器官,如心、脾、肺、肾也能检测人PCSK9基因的表达,而猪内源性PCSK9基因在这些组织中表达量很低;Western-blot检测结果与RNA水平的检测类似。这些结果说明人D374Y-PCSK9基因成功整合到猪基因猪中,且能够正常转录与翻译。通过组织化学染色发现,与野生型猪肝脏相比,克隆猪肝脏中LDLR蛋白水平极显著低于野生型。另外,对克隆猪进行H.E.染色后发现其肝脏组织有明显的病理学变化,该结果说明,LDLR水平的急剧下降有可能是导致肝脏病变的原因。【】成功获得了人PCSK9基因突变体的克隆猪;与野生型猪肝脏相比,克隆猪肝脏中LDLR水平显著降低,并且克隆猪肝脏发生了明显病变。
突变体;体细胞核移植;五指山小型猪近交系;LDLR
0 引言
【研究意义】动脉粥样硬化疾病模型在小鼠等模式动物中得到了广泛深入的研究。然而,受到体型的限制,且小鼠血液获取量小,血管的损伤表型和心血管系统也与人类相应病征有一定的差异,因此需要在大动物中建立动脉粥样硬化疾病模型,对人类疾病进行更好的模拟。猪心血管解剖结构、血流动力学、血脂代谢等方面与人类极其相似[1-2],因此是研究动脉粥样硬化疾病模型的理想动物之一。【前人研究进展】是继、载脂蛋白B(apolipoprotein,)后被定位的第三个ADH主效基因[3-5]。SEIDAH等2003年首次克隆得到该基因[6]。血液中的PCSK9可以与低密度脂蛋白胆固醇(low-density lipoprotein Cholesterol,LDL-c)竞争性地结合肝脏细胞表面的LDLR,并诱导LDLR发生降解,使血液中LDL-c浓度升高,增加患高胆固醇血症的风险,从而加速动脉粥样硬化病变的进程[7-9]。研究发现的获得型突变与人类家族性高胆固醇血症有直接的关系,如突变体对LDLR降解的体外检测结果显示其对LDLR的降解能力比野生型蛋白强十倍,且突变体与LDLR的结合能力也有所增强[10-11]。目前敲除型和获得型突变的小鼠,已经作为动物模型广泛地应用于研究中。相关学者制备了人获得型突变的转基因小鼠,结果发现肝脏是的主要靶器官,分泌型蛋白对肝脏具有重要的作用[12-16]。另有研究制作了缺失型突变的小鼠模型[17]。JENSEN等利用载脂蛋白E(apo lipoprotein,)基因纯合子的克隆杜洛克猪群成功制备了动脉粥样硬化的饮食诱导动物模型[18]。该模型提高了实验动物遗传背景的一致性,降低了动物个体水平的差异,因此能够适当减少实验动物的使用数量。但是商品猪种的饲养成本较高且体型大,使试验操作具有一定的难度。与之相比,小型猪具有体型小、易操作的优势[19],此外,小型猪近交系还具有遗传稳定的特点[20-21]。近年来有研究对尤卡坦小型猪(Yucatan miniature swine)进行基因修饰,如人类突变体的过表达和敲除,促使动物较快的出现高胆固醇血症,且在一定时期的饮食诱导后能够清晰地观察到动脉血管的严重病变[22-23]。但此类研究在近交系小型猪中未见相关报道。【本研究切入点】五指山小型猪近交系是北京畜牧兽医研究所培育的小型猪近交系,其全基因组序列分析结果于2012年发表在GigaScience上[24]。另有研究发现仅对青年猪进行短期高脂高胆固醇饮食诱导能出现早期的血管重塑性病变[1, 25]。但如果对小型猪ADH基因进行修饰,如过表达PCSK9基因或敲除LDLR基因;并在此基础上再进行饮食诱导,将加速疾病的进程,有望出现血管的不同程度的损伤,为临床研究提供大动物疾病模型[26-27]。【拟解决的关键问题】本研究以五指山小型猪近交系作为研究对象,利用转基因方法结合体细胞克隆技术制备了人PCSK9基因突变体转基因猪,以模拟高胆固醇血症的病理状态,为心血管疾病的研究提供有效的动物模型。
1 材料与方法
本研究于2013年1月至2015年5月在中国农业科学院北京畜牧兽医研究所猪基因工程与种质创新团队实验室完成。
1.1 主要材料与试剂
材料:五指山小型猪近交系胎儿成纤维细胞和人PCSK9基因突变体载体,均为中国农业科学院北京畜牧兽医研究所猪基因工程与种质创新团队实验室保存。
主要试剂及配制:I限制性内切酶(NEB);G418(Gibco);rabbit polyclonal anti-human(CircuLex),mouse monoclonal anti-human(Millipore);SYBR Green qPCR Master Mix(Life technology);ECL Plus Western Blotting Substrate (Pierce)。DMEM细胞培养液:DMEM(gibco)、20% FBS(gibico),2%PS(gibico)、NEAA(gibico)、Glutamine(gibico)。
1.2 方法
1.2.1 人PCSK9基因突变体转基因猪阳性胎儿成纤维细胞的筛选 用I限制性内切酶对突变体过表达载体进行线性化,利用电转染方法将线性化的载体转入五指山小型猪近交系胎儿成纤维细胞;经G418筛选12 d后,挑选状态良好的单克隆重新铺板培养,通过PCR的方法进行基因型鉴定,所用引物为IPF2 / IPR2和2818 F / 2818 R,其序列见表1,以这两对引物扩增产物都出现目的条带视为阳性克隆。将阳性的细胞克隆进行传代,待细胞汇合率达95%后,冻存以备后续研究使用。
1.2.2 人PCSK9基因突变体转基因猪的制备 收集并挑选体外培养成熟的猪卵母细胞,利用猪体细胞核移植的方法进行重构胚胎的构建。在猪体细胞核移植的显微操作过程中,采用盲吸法去核,电融合法融合。将构建好的重构胚移植到代孕母猪体内,用超声波检查法确认母猪的怀孕情况。
1.2.3 转基因猪的鉴定和表达检测 提取转基因猪耳组织DNA,PCR扩增,利用引物2054F/R和2818F/R进行PCR扩增。以人、猪特异性引物(HumanF/R,Porcine)进行RT-PCR扩增,并用这两对引物和猪内参(PorcineF)引物进行荧光定量PCR检测,所用引物序列见表1。

表1 试验所需引物序列
Southern blot:提取转基因猪耳组织DNA,用I酶切过夜,阳性质粒和阴性对照DNA以同样的方法处理。酶切产物使用1%琼脂糖凝胶电泳分离,然后利用虹吸法将其转移到尼龙膜上。尼龙膜在65℃预杂交15min后用地高辛标记的特异性识别Neo基因的探针进行杂交。探针标记引物如下:
neo-f 5'-CAAgATggATTgCACgCAgg-3',
neo-r 5'-ggTAgCCAACgCTATgTCCT-3'。
Western blot:取PCSK9转基因猪的肝脏、心脏、脾脏、肺脏组织加入组织裂解液和蛋白酶抑制剂匀浆,冰上裂解30 min;4℃,12 000 r/min,离心10 min,收集上清液并用BCA法检测蛋白浓度;变性后的蛋白用10% SDS-PAGE电泳进行分离,然后转移到NC膜上,并用5%脱脂奶粉封闭;选用兔抗人多克隆抗体作为一抗,作为内参蛋白孵育;然后用辣根过氧化物标记的抗兔二抗进行孵育;最终目的条带显色反应后,进行x-射线胶片的压片以及显影和定影。
1.2.4 组织学分析 将转基因猪的新鲜组织样品用4%多聚甲醛进行固定和保存,并分别将野生型五指山小型猪和转基因猪的肝脏组织固定,进行石蜡包埋和切片,然后对切片进行H.E.染色或组织化学染色,最后进行显微图片的采集,所使用的一抗为兔抗人多克隆抗体和小鼠抗人的抗体进行孵育。
1.2.5 数据分析 利用Prism软件对实验数据进行分析(GraphPad Software),使用ANOVA方法进行多重比较,显著性水平设为<0.05。
2 结果
2.1 PCSK9 D374Y突变体转基因细胞阳性克隆的筛选
转基因细胞阳性细胞集落在药筛的第3 天开始出现,至第7 天形成较大的单克隆点(图1 -A)。PCR检测克隆点基因组中外源基因片段的整合情况,分段检测目的片段5′和3′端的整合情况,以此判断外源片段在基因组中完整性,引物2818 F / 2818 R 扩增3′端,结果见图1-B (a),片段大小2 818 bp,引物IPF2 / IPR2扩增5′端,结果见图1-B (b),片段大小2 978 bp。结果表明获得阳性克隆细胞。

A:阳性克隆点形成过程。B:PCR检测克隆点基因组中外源基因片段整合情况,(a)图扩增产物为2818 F / 2818 R,片段大小2 818 bp;(b)图扩增引物是IPF2 / IPR2,片段大小2 978 bp。泳道1、3、4为阳性克隆
2.2 D374Y-PCSK9转基因猪的制备
将筛选得到的阳性细胞克隆作为体细胞克隆的供体细胞,利用体细胞核移植技术构建重构胚, 利用胚胎移植技术移入代孕母猪子宫内,最终获得克隆猪(图2)。
2.3 转基因猪DNA、RNA、蛋白水平的检测
转基因猪DNA样品的PCR及Southern-blot 检测结果显示,PCR扩增产物5′端2 054 bp片段和3′端2 818 bp片段能够拼接为完整的目的序列,说明D374Y-PCSK9基因完整的插入到猪的基因组中(图3-A),且有串联重复的现象(图3-B);分别用特异性识别人和猪mRNA的引物进行RT-PCR和QPCR检测,结果表明,人PCSK9基因能在猪肝脏内正常转录且不影响猪内源性PCSK9基因的转录(图3-C、E)。同时在心、脾、肺、肾组织中也能检测人PCSK9基因的表达,而猪内源性PCSK9基因在这些组织中表达量很低(图 3-F)。Western-blot检测结果也说明,人PCSK9基因在肝脏中表达,同时也在心、脾、肺、肾组织中表达(图3-D)。由此可见,人D374Y-PCSK9基因完整整合到猪基因猪中,且能够正常转录与翻译。
2.4 转基因猪组织学检测
分别对-转基因猪和野生型对照猪的肝脏进行了PCSK9和LDLR的免疫组织化学染色,阳性应为黄褐色,细胞核应为淡蓝色。结果显示,PCSK9的表达量在转基因猪和野生型猪肝脏中无明显的差异(图4),而转基因猪肝脏LDLR水平极显著的低于野生型对照猪;同时肝脏石蜡切片的H.E.染色结果显示,与野生型对照猪相比,转基因猪肝脏有明显病变,主要表现为肝窦扩张,肝细胞脂肪变性,肝小叶上可见淋巴细胞浸润(图5)。由此可以推测,转基因猪肝脏的病变可能与LDLR水平急剧下降有关。

图2 克隆猪

A:PCSK9转基因猪PCR检测结果。泳道1—4所用引物为2 054F/R,扩增片段长度为2 054 bp,依次为PCSK9克隆猪,阳性质粒,阴性对照猪,空白对照;泳道5—8所用引物为2818F/R,扩增片段长度为2818 bp,依次为PCSK9克隆猪,阳性质粒,阴性对照猪,空白对照。B:Southern-blot检测结果。泳道1—4依次为阴性对照组,PCSK9克隆猪,空白对照,阳性质粒。C:PCSK9克隆猪肝脏RT-PCR检测结果。泳道1—4所用引物为Human D374Y F/R,依次为PCSK9克隆猪,PCSK9克隆猪,阴性对照猪,阳性质粒;泳道5—8所用引物为Porcine PCSK9 F/R特异性结合猪PCSK9基因,依次为PCSK9克隆猪,PCSK9克隆猪,阴性对照猪,阳性质粒。D:PCSK9克隆猪Western-blot检测结果。泳道1—6依次为PCSK9克隆猪组织,心脏、肝脏、脾脏、肺脏、肾脏,及阴性对照猪肝脏,以GAPDH为内参。 E、F:PCSK9克隆猪定量PCR检测结果。 E为人D374Y-PCSK9特异性引物Human D374Y F/R;F为猪PCSK9特异性引物Porcine PCSK9 F/R,顺序依次为肝脏、心脏、脾脏、肺脏、肾脏,control表示阳性对照猪肝脏
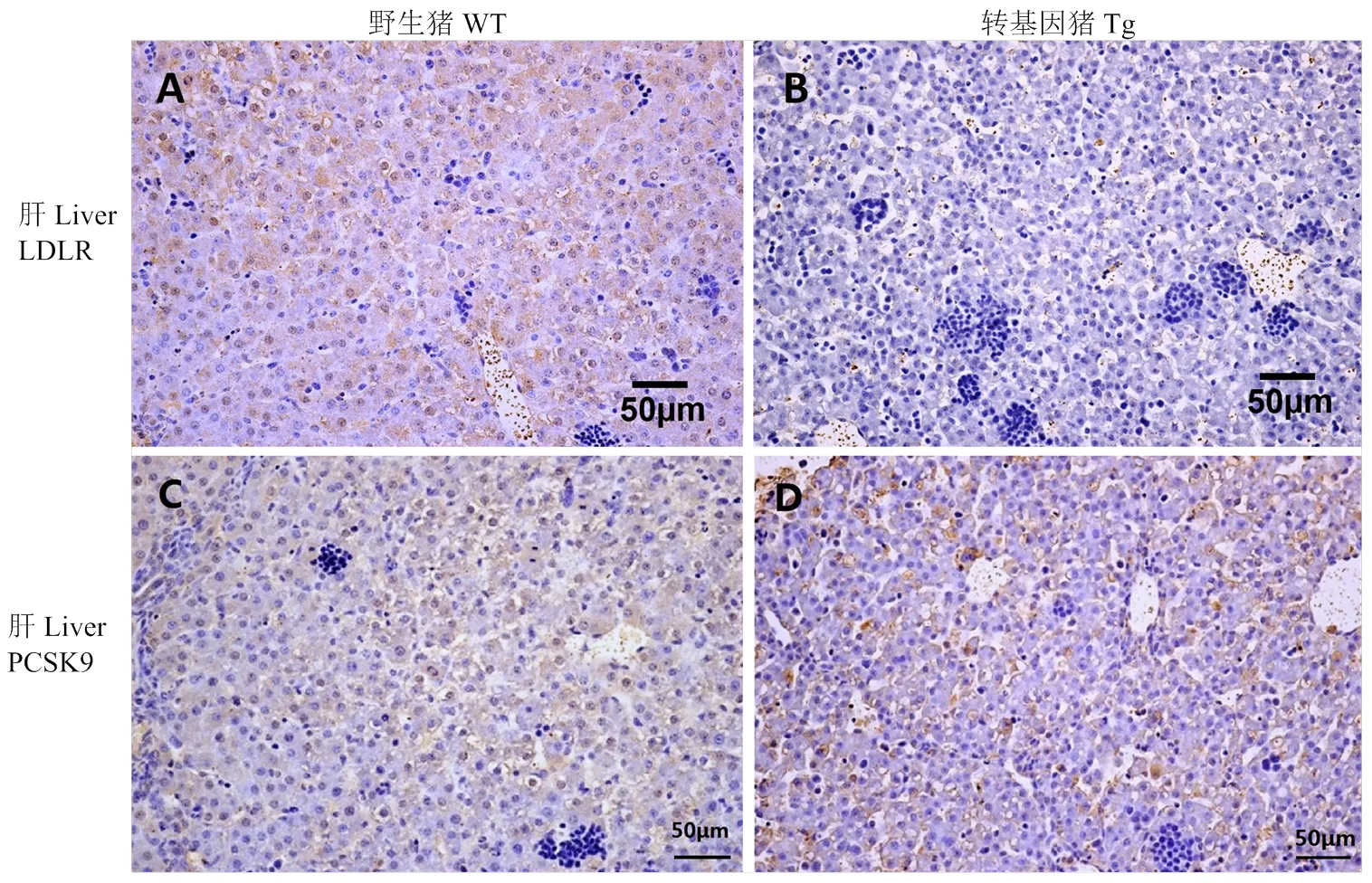
A,B:猪肝脏组织LDLR免疫组化学染色图。C,D:猪肝脏组织PCSK9免疫组化学染色图。WT:野生型猪;Tg:转基因猪

A, C:猪肝脏H.E.染色; B, D:局部放大图。WT:野生型猪;Tg:转基因猪
3 讨论
本文对PCSK9转基因猪的检测分为三个方面:DNA整合、RNA转录、蛋白表达。人和猪的基因的DNA序列和蛋白序列相似性非常高,因此我们会面临如何有效区分转基因猪中人源和猪源PCSK9基因的问题。该研究在对PCSK9基因转录水平进行检测时,设计了10对检测引物,希望能够区分人源和猪源的RNA序列,结果都不理想(数据未发布)。AL-MASHHADI于2013年发表了转基因猪的文章[22],通过参考其检测引物的设计,发现了引物序列的5′和3′有部分碱基的改变使得特异性结合人PCSK9基因或猪PCSK9基因,得到了预期的结果。由于猪作为动物模型没有小鼠的应用广泛,在进行Western-blot检测时,很多蛋白检测所需的抗体不全面,笔者只能利用抗人PCSK9蛋白的抗体对转基因猪的蛋白进行检测,期间尝试了包括abcam、cayman、bioss、MBL等公司的产品,只有MBL的抗人多抗能够很好区分人源和猪源的蛋白,即转基因猪组织蛋白检测出人源蛋白的表达,而野生型对照猪几乎检测不到。蛋白水平的检测结果说明,人-基因可以在克隆猪的心脏、肝脏、脾脏、肺、肾脏中正常翻译。该研究在对克隆猪进行组织化学染色时,也遇到了抗体选择的问题。然而对PCSK9进行组织化学染色时,野生型猪的肝脏出现了阳性染色区域,可能是由于多抗在组织中产生的非特异性结合而产生的假阳性结果。
可以调节血浆中LDL-c的浓度,参与机体内血脂平衡和胆固醇代谢平衡的调控,从而影响动脉粥样硬化的发病过程。对LDL-c浓度的调节主要通过诱导LDLR降解的方式,且PCSK9不仅可以降解细胞膜表面的LDLR,还可以介导细胞内新合成的LDLR发生降解[15, 28]。由此可见,肝脏中LDLR的表达量与PCSK9的表达量密切相关。因此为了分析人在克隆猪体内是否能够正常发挥功能,通过组织化学染色的方法对突变体克隆猪肝脏中LDLR的表达进行了检测分析。结果发现,LDLR蛋白在转基因猪肝脏组织染色中几乎检测不到阳性区域,表明人在转基因猪肝脏的高表达引起了肝脏中LDLR蛋白水平极显著的降低。
有研究发现,敲除的小鼠,肝再生的功能受到阻碍,表现为在肝再生过程中肝脏炎性因子表达量升高,肝脏脂肪变性,并且肝脏淋巴细胞的增多会加重动脉粥样硬化病变[29-30]。该研究通过H.E.染色发现,与野生型猪相比,转基因猪肝脏有明显病变,这可能与PCSK9过表达后引起LDLR水平下降有关。研究说明该克隆猪体内人PCSK9蛋白可以正常发挥功能,有望成为研究人类动脉粥样硬化的动物疾病模型。
4 结论
本研究以五指山小型猪近交系胎儿成纤维细胞为材料,通过转基因和体细胞克隆技术,成功地制备出了人PCSK9基因突变体转基因克隆猪。与野生型猪肝脏比较,转基因克隆猪肝脏中LDLR水平显著减少,并且转基因克隆猪的肝脏发生了明显病变。
[1] ARTINGER S D C, LODDENKEMPER C, SCHWIMMBECK P L, SCHULTHEISS H P, PELS K. Complex porcine model of atherosclerosis: induction of early coronary lesions after long-term hyperlipidemia without sustained hyperglycemia., 2009, 25(4): e109-114.
[2] WANG M D S. Human microbiota-associated swine: current progress and future opportunities., 2015, 56(1): 63-73.
[3] HOPKINS PN D J, FOUCHIER SW, BRUCKERT E, LUC G, CARIOU B, SJOUKE B, LEREN TP, HARADA-SHIBA M, MABUCHI H, RABÈS J P, CARRIÉ A, VAN HEYNINGEN C, CARREAU V, FARNIER M, TEOH Y P, BOURBON M, KAWASHIRI M A, NOHARA A, SORAN H, MARAIS A D, TADA H, ABIFADEL M, BOILEAU C, CHANU B, KATSUDA S, KISHIMOTO I, LAMBERT G, MAKINO H, MIYAMOTO Y, PICHELIN M, YAGI K, YAMAGISHI M, ZAIR Y, MELLIS S, YANCOPOULOS G D, STAHL N, MENDOZA J, DU Y, HAMON S, KREMPF M, SWERGOLD G D. Characterization of autosomal dominant hypercholesterolemia caused by PCSK9 gain of function mutations and its specific treatment with alirocumab, a PCSK9 monoclonal antibody., 2015, 8(6): 823-831.
[4] ETTCHETO M P D, PEDRÓS I, DE LEMOS L, PALLÀS M, ALEGRET M, LAGUNA J C, FOLCH J, CAMINS A. Hypercholesterolemia and neurodegeneration. Comparison of hippocampal phenotypes in LDLr knockout and APPswe/PS1dE9 mice., 2015, 65:69-78.
[5] ALVES A C E A, SOUTAR A K, MARTIN C, BOURBON M. Novel functional APOB mutations outside LDL-binding region causing familial hypercholesterolaemia., 2014, 23(7): 1817-1828.
[6] ABIFADEL M V M, RABÈS JP, ALLARD D, OUGUERRAM K, DEVILLERS M, CRUAUD C, BENJANNET S, WICKHAM L, ERLICH D, DERRÉ A, VILLÉGER L, FARNIER M, BEUCLER I, BRUCKERT E, CHAMBAZ J, CHANU B, LECERF JM, LUC G, MOULIN P, WEISSENBACH J, PRAT A, KREMPF M, JUNIEN C, SEIDAH N G, BOILEAU C. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia., 2003, 34(2): 154-156.
[7] MAXWELL K N, BRESLOW J L. Adenoviral-mediated expression of Pcsk9 in mice results in a low-density lipoprotein receptor knockout phenotype., 2004, 101(18): 7100-7105.
[8] MAXWELL K N, FISHER E A, BRESLOW J L. Overexpression of PCSK9 accelerates the degradation of the LDLR in a post- endoplasmic reticulum compartment., 2005, 102(6): 2069-2074.
[9] POIRIER S, HAMOUDA H A, VILLENEUVE L, DEMERS A, MAYER G. Trafficking dynamics of PCSK9-induced LDLR degradation: Focus on human PCSK9 mutations and C-terminal domain., 2016, 11(6): e0157230.
[10] HUMPHRIES S E, NEELY R D, WHITTALL R A, TROUTT J S, KONRAD R J, SCARTEZINI M, LI K W, COOPER J A, ACHARYA J, NEIL A. Healthy individuals carrying the PCSK9 p.R46L variant and familial hypercholesterolemia patients carrying PCSK9 p.D374Y exhibit lower plasma concentrations of PCSK9., 2009, 55(12): 2153-2161.
[11] Nguyen M A K T, Lagace T A. Internalized PCSK9 dissociates from recycling LDL receptors in PCSK9-resistant SV-589 fibroblasts., 2014, 55(2): 266-275.
[12] Herbert B P D, Waddington S N, Eden E R, McAleenan A, Sun X M, Soutar A K. Increased secretion of lipoproteins in transgenic mice expressing human D374Y PCSK9 under physiological genetic control., 2010, 30(7): 1333-1339.
[13] Liu M, Wu G, Baysarowich J, Kavana M, Addona G H, Bierilo K K, Mudgett J S, Pavlovic G, Sitlani A, Renger J J, Hubbard B K, Fisher T S, Zerbinatti C V. PCSK9 is not involved in the degradation of LDL receptors and BACE1 in the adult mouse brain., 2010, 51(9): 2611-2618.
[14] ROCHE-MOLINA M S-R D, CRUZ F M, GARCÍA-PRIETO J, LÓPEZ S, ABIA R, MURIANA F J, FUSTER V, IBÁÑEZ B, BERNAL J A. Induction of sustained hypercholesterolemia by single adeno-associated virus-mediated gene transfer of mutant hPCSK9., 2015, 35(1): 50-59.
[15] LAGACE T A C D, GARUTI R, MCNUTT M C, PARK S W, PRATHER H B, ANDERSON N N, HO Y K, HAMMER R E, HORTON J D. Secreted PCSK9 decreases the number of LDL receptors in hepatocytes and in livers of parabiotic mice., 2006, 116(11): 2995-3005.
[16] LUO Y W L, XIA D, JENSEN H, SAND T, PETRAS S, QIN W, MILLER K S, HAWKINS J. Function and distribution of circulating human PCSK9 expressed extrahepatically in transgenic mice., 2009, 50(8): 1581-1588.
[17] DING Q, STRONG A, PATEL K M, NG S L, GOSIS B S, REGAN S N, COWAN C A, RADER D J, MUSUNURU K. Permanent alteration of PCSK9 withCRISPR-Cas9 genome editing., 2014, 115(5): 488-492.
[18] JENSEN TW M M, PETTIGEW J E, PEREZ-MENDOZA V G, ZACHARY J, SCHOOK L B. A cloned pig model for examining atherosclerosis induced by high fat, high cholesterol diets.2010, 21(3): 179-187.
[19] SHIM J A-M R, SØRENSEN C B, BENTZON J F. Large animal models of atherosclerosis-new tools for persistent problems in cardiovascular medicine., 2016, 238(2): 257-266.
[20] Duran-Struuck R M A, Huang C A. Myeloid leukemias and virally induced lymphomas in miniature inbred Swine: Development of a large animal tumor model., 2015, 6:332.
[21] 冯书堂. 中国实验用小型猪. 北京: 中国农业出版社, 2009.
FENG S T.. Beijing: China Agriculture Press, 2009.(in Chinese)
[22] AL-MASHHADI R H, SORENSEN C B, KRAGH P M, CHRISTOFFERSEN C, MORTENSEN M B, TOLBOD L P, THIM T, DU Y T, LI J, LIU Y, MOLDT B, SCHMIDT M, VAJTA G, LARSEN T, PURUP S, BOLUND L, NIELSEN L B, CALLESEN H, FALK E, MIKKELSEN J G, BENTZON J F. Familial hypercholesterolemia and atherosclerosis in cloned minipigs created by DNA transposition of a human PCSK9 gain-of-function mutant., 2013, 5(166): 166 rai.
[23] DAVIS B T, WANG X J, ROHRET J A, STRUZYNSKI J T, MERRICKS E P, BELLINGER D A, ROHRET F A, NICHOLS T C, ROGERS C S. Targeted disruption of LDLR causes hypercholesterolemia and atherosclerosis in Yucatan miniature pigs., 2014, 9(4): e93457.
[24] FANG X, M Y, HUANG Z, LI Y, HAN L, ZHANG Y, FENG Y, CHEN Y, JIANG X, ZHAO W, SUN X, XIONG Z, YANG L, LIU H, FAN D, MAO L, REN L, LIU C, WANG J, LI K, WANG G, YANG S, LAI L, ZHANG G, LI Y, WANG J, BOLUND L, YANG H, WANG J, FENG S, LI S, DU Y. The sequence and analysis of a Chinese pig genome., 2012, 1(1): 16.
[25] XIONG Y R Y, XU J, YANG D Y, HE X H, LUO J Y, RANA J S, ZHANG Y, ZHENG Z S, LIU D H, WU G F. Enhanced external counterpulsation inhibits endothelial apoptosis via modulation of BIRC2 and Apaf-1 genes in porcine hypercholesterolemia., 2014, 171(2): 161-168.
[26] OGITA M M K, ONISHI A, TSUBOI S, WADA H, KONISHI H, NAITO R, DOHI T, KASAI T, KOJIMA Y, SCHWARTZ R S, DAIDA H. Development of accelerated coronary atherosclerosis model using low density lipoprotein receptor knock-out swine with balloon injury.2016, 11(9): e0163055.
[27] HAMAMDZIC D W R. Porcine models of accelerated coronary atherosclerosis: role of diabetes mellitus and hypercholesterolemia., 2013, 2013:c761415.
[28] POIRIER S, MAYER G, POUPON V, MCPHERSON P S, DESJARDINS R, LY K, ASSELIN M C, DAY R, DUCLOS F J, WITMER M, PARKER R, PRAT A, SEIDAH N G. Dissection of the endogenous cellular pathways of PCSK9-induced low density lipoprotein receptor degradation: evidence for an intracellular route., 2009, 284(42): 28856-28864.
[29] PAUTA M, ROTLLAN N, VALES F, FERNANDEZ-HERNANDO A, ALLEN R M, FORD D A, MARI M, JIMENEZ W, BALDAN A, MORALES-RUIZ M, FERNANDEZ-HERNANDO C. Impaired liver regeneration in Ldlr-/-mice is associated with an altered hepatic profile of cytokines, growth factors, and lipids., 2013, 59(4): 731-737.
[30] SUBRAMANIAN S, TURNER M S, DING Y, GOODSPEED L, WANG S, BUCKNER J H, O'BRIEN K, GETZ G S, REARDON C A, CHAIT A. Increased levels of invariant natural killer T lymphocytes worsen metabolic abnormalities and atherosclerosis in obese mice., 2013, 54(10): 2831-2841.
(责任编辑 林鉴非)
Production of Transgenic Pigs Over-expressedMutant
ZHANG Xue, HUANG Lei, RUAN JinXue, LIU ZhiGuo, CHENG Ying, FENG ShuTang, MU YuLian, LI Kui
(Institute of Animal Sciences of Chinese Academy of Agricultural Sciences,Beijing 100193)
【】Proprotein convertase subtilisin/kexin type 9 () is the third major gene of autosomal dominant hypercholesterolemia (ADH). Gain-of-function mutations ofare directly associated with human familial hypercholesterolemia, such as themutant. In vitro detection experimental results on the degradation of LDLR by the PCSK9 D374Y mutant showed that its LDLR degradation ability is ten times stronger than that of the wild-type protein. This ability increases the risk of hypercholesterolemia, and promotes atherosclerotic lesions. The miniature pig is a useful animal model for biomedical research. However the utility of pigs for diseases model preparation is relatively infrequent because of their individual differences. Inbred lines increased the consistency of the genetic background of the experimental animals, thus consequently, would simplify disease progression of the animal model. This study used Wuzhishan minipig intending to make a transgenic pig with gain-of-functionmutation of human, and to contribute to the model of atherosclerosis. 【】 In this study,-over-expressing plasmids were transferred into Wuzhishan porcine embryonic fibroblasts by electroporation, and somatic cell nuclear transplantation and embryo transfer were used to make-over-expressing pig. Using transgenic pig liver, the humanexpression was assessed by PCR, Southern blot and Western blot in DNA, RNA and protein levels. At the same time, istochemical staining and hematoxylin-eosin (HE) staining were used to identify the pathological changes in liver betweentransgenic pigs and wild-type Wuzhishan pigs.【】the positive cloned cells appeared for 3 days, and colony point was formed for 7 days. The PCR results showed that the-fragments could be spliced into a complete fragment. That means the-over-expressing plasmids were successfully integrated into fibroblasts of Wuzhishan pig. The screened positive cloned cellswere used as donor cells for somatic cell nuclear transfer (SCNT) and transplanted into recipient sows, and finally, the transgenic pig was got. PCR and Southern blot detection results of the DNA samples demonstrated that the entire-gene was integrated into the genomes. RT-PCR and QPCR were performed using primers specifically recognizing human or pigmRNA. The results showed that the humangene could be normally transcribed in the pig liver and did not influence the transcription of the endogenous pig. Surprisingly, the expression of the humangene could be detected in other organs including the heart, spleen, lung, and kidney, whereas the expression levels of the endogenous pig-gene integrated into pig genomes was normally transcribed and translated. Besides, transgenic pig’s liver had pathological changes were detected by HE staining and histochemical staining and the results showed that the LDLR level in the transgenic pigs’ liver was significantly lower than wild-type controls’.【】 In conclusion, humanprotein was successfully over-expressed in Wuzhishan inbred miniature pigs. Compared with wild type pigs, transgenic pigs had a low LDLR level in liver. At the same time, there were obvious pathological changes in transgenic pigs’ liver.
; SCNT; Wuzhishan Minipig Inbred; LDLR
2017-03-10;接受日期:2017-05-19
国家自然科学基金(31572378)、国家高技术研究发展计划(863 计划,2012AA020603)
张雪,Tel:13161163940;E-mail:zhangxuecaas@163.com。通信作者牟玉莲,E-mail:muyulian76@iascaas.net.cn

