微生物源挥发性化合物苯并噻唑对灰霉病菌的抑制效应
崔凯娣,黄学屏,何磊鸣,翟永彪,慕卫,刘峰,3
微生物源挥发性化合物苯并噻唑对灰霉病菌的抑制效应
崔凯娣1,3,黄学屏1,3,何磊鸣1,2,翟永彪1,慕卫1,2,刘峰1,2,3
(1山东农业大学植物保护学院,山东泰安 271018;2山东省农药毒理与应用技术省级重点实验室,山东泰安 271018;3山东农业大学山东省蔬菜病虫生物学重点实验室,山东泰安 271018)
【】评价挥发性化合物苯并噻唑防治灰霉病的应用潜力,为进一步开发利用提供依据。【】采用密封盘菌丝生长速率法测定山东省73株灰霉病菌()对苯并噻唑的敏感性,并比较不同地区和不同表现型菌株(多菌灵抗性和敏感菌株:CarR,CarS;腐霉利抗性和敏感菌株:PrcR,PrcS;嘧霉胺抗性和敏感菌株:PyrR,PyrS;啶酰菌胺抗性和敏感菌株:BosR,BosS)间的敏感性差异;测定苯并噻唑与多菌灵、啶酰菌胺室内混用对灰霉病菌的抑制作用。通过离体黄瓜叶片接种试验验证苯并噻唑对黄瓜灰霉病的保护、治疗效果以及不同熏蒸剂量和时间对灰霉病菌致病力的影响,并用扫描电子显微镜观察苯并噻唑对灰霉菌丝形态的影响。【】苯并噻唑对灰霉病菌菌丝的EC50范围为0.38—1.08 μL·L-1,均值为0.62 μL·L-1,不同地区之间无敏感性差异;山东地区多菌灵、腐霉利、嘧霉胺、啶酰菌胺抗性和敏感灰霉病菌对苯并噻唑均比较敏感,说明这4种杀菌剂与苯并噻唑无交互抗性;在苯并噻唑0.1—3 μL·L-1范围内,菌丝比孢子对其更敏感;2 μL·L-1苯并噻唑对菌丝的抑制率高达86.12%,对芽管伸长的抑制率为55.15%,而对孢子萌发的抑制率仅为19.30%。可见,病菌不同生长阶段对此化合物的敏感性不同。苯并噻唑与多菌灵混用防治黄瓜灰霉病无增效或相加作用,两者混用时哪种药剂发挥主要抑菌作用与各组分在混用中使用的浓度和比例有关;苯并噻唑与啶酰菌胺混用有显著增效作用,其田间实际应用方式、效果以及增效机制还有待进一步明确。离体叶片试验表明,苯并噻唑对黄瓜灰霉病兼具保护和治疗防效,2 μL·L-1的治疗防效为91.01%,高于对照药剂啶酰菌胺300mg·L-1(78.90%),并显著高于48.25%的保护防效。苯并噻唑能够显著降低灰霉病菌菌丝的致病力,受抑制程度与苯并噻唑浓度呈正相关。扫描电镜观察发现,苯并噻唑能够使菌丝形态异常,菌丝干瘪,分枝增多,表面凹陷。【】苯并噻唑对山东省不同地区的灰霉病菌均有较高的毒力,适合作为防治灰霉病的熏蒸剂使用。
挥发性化合物;苯并噻唑;灰霉病菌;毒力;敏感性
0 引言
【研究意义】灰霉病是由灰葡萄孢()引起的世界性病害[1]。灰霉病菌可以侵染生长期和储藏期的蔬菜、水果等作物,严重影响其产量和品质。目前,在中国灰霉病的防治以化学防治为主,常用药剂包括苯并咪唑类(如多菌灵)、二甲基酰亚胺类(如腐霉利)、苯胺基嘧啶类(如嘧霉胺)和琥珀酸脱氢酶抑制剂类(如啶酰菌胺)杀菌剂等。化学药剂的频繁使用使灰霉病菌对以上几类杀菌剂产生了不同程度的抗性[2],为保证防效,农民往往通过加大施药剂量和使用频率等方式防治病害,导致农药残留超标。因此,亟需开发与常规杀菌剂无交互抗性、安全、高效的友好型杀菌剂。苯并噻唑是一种微生物源挥发性有机化合物,目前在食品中主要用作香料添加剂,对人畜安全,有望开发为较理想的果蔬杀菌剂。【前人研究进展】挥发性化合物广泛存在于植物和微生物次生代谢产物中,具有易挥发、安全高效、低残留等特点[3-4],逐渐应用于植物病虫害防治。研究表明,具有高效抑菌活性的挥发性化合物有望用于保护地或储藏病害的防治,如内生真菌白色麝香霉()已被美国Agraquest公司注册专利成为商业化生防产品,其产生的挥发物对黄萎病菌等具有抑菌活性,同时可防治温室土传病害[5],预防采后水果腐烂[6];生姜()和碧桃()产生的植物精油用于采后葡萄灰霉病的防治等[7]。有研究表明,苯并噻唑具有广泛的杀菌谱,能够抑制菌核病菌()[8]、尖镰孢()[9]和水稻纹枯病菌()[10]菌丝的生长。同时,苯并噻唑对赤拟谷盗()[10]和马铃薯腐烂茎线虫()[11]具有强烈的毒杀活性,对韭菜迟眼蕈蚊()表现出显著的熏蒸活性[12]。这些研究表明,苯并噻唑兼具杀虫和杀菌活性,具有开发为生物源熏蒸剂用于农业有害生物防治的潜力。【本研究切入点】苯并噻唑杀菌谱广,对灰霉病菌具有很高的熏蒸抑制活性,而山东省灰霉病菌菌株对苯并噻唑的敏感性尚不明确,苯并噻唑对灰霉病菌的抑制作用也未进行系统研究。【拟解决的关键问题】通过比较苯并噻唑对多菌灵、腐霉利、嘧霉胺、啶酰菌胺抗性和敏感灰霉菌株的抑制活性,观察它们之间是否存在交互抗性,通过离体叶片接种试验以及对灰霉病菌致病力和菌丝形态的影响明确苯并噻唑防治灰霉病的作用方式,并通过与多菌灵、啶酰菌胺的混用效果探索其应用途径,以期为苯并噻唑的开发利用提供理论依据。
1 材料与方法
试验于2014—2016年在山东农业大学植物保护学院完成。
1.1 材料
1.1.1 供试菌株 2014—2016年从山东济南、潍坊、莱芜、泰安、济宁、聊城和临沂地区发病设施菜田随机采集灰霉病果、病茎或病叶,装入自封袋内带回实验室,经单孢分离得到73个灰霉病菌菌株。采用区分剂量法判定抗性菌株,多菌灵(carbendazim)、腐霉利(procymidone)的区分剂量为1 mg·L-1,嘧霉胺(pyrimethanil)0.45 mg·L-1,啶酰菌胺(boscalid)5 mg·L-1[13-14]。
1.1.2 供试药剂 挥发性化合物:99%苯并噻唑(北京百灵威化学技术有限公司);杀菌剂:98%多菌灵原药,山东潍坊润丰化工股份有限公司;97%啶酰菌胺原药,陕西美邦农药有限公司。50%啶酰菌胺WG,江阴苏利化学股份有限公司。
多菌灵和啶酰菌胺原药分别用0.1 mol·L-1的盐酸溶液和甲醇溶解,配制成1.0×104mg·L-1的母液,于4℃避光保存备用。用无菌水配成系列浓度,每个药剂浓度与PDA按1﹕9的比例倒入培养基中,制备含药平板。甲醇或盐酸的体积分数均<0.25%,同样体积的溶剂水溶液加入到培养基中作为空白对照。
1.1.3 供试培养基 马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,琼脂20 g,葡萄糖20 g,去离子水1 L;水琼脂(water agar,WA)培养基:琼脂20 g,葡萄糖20 g,去离子水1 L。
1.2 方法
1.2.1 苯并噻唑对山东省不同敏感水平灰霉病菌的抑制活性测定 苯并噻唑对灰霉病菌的抑制活性采用密封盘菌丝生长速率法测定[15]。将供试菌株在PDA培养基上25℃黑暗培养3 d后,在菌落边缘打取直径5 mm的菌饼,在直径9 cm的培养皿皿底倒入PDA培养基,将菌饼接入培养基中央,用移液枪定量移取0、0.04、0.1、0.2、0.4、0.8、1.6 μL苯并噻唑滴加到固定于另一皿底的滤纸片(方形,1 cm×1 cm)上,迅速两底合扣(熏蒸体积为200 mL),形成0、0.2、0.5、1、2、4、8 μL·L-1的熏蒸浓度,用封口膜密封后倒置放于25℃培养箱中黑暗培养,每处理4个重复。待空白对照菌落生长至培养皿的2/3时,采用十字交叉法测定菌落直径并计算苯并噻唑对灰霉病菌菌丝生长抑制率。菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)∕(对照菌落直径-菌饼直径)× 100。
1.2.2 对灰霉病菌菌丝生长、孢子萌发和芽管伸长的抑制活性 采用孢子萌发法[16]。由于所有测试菌株对苯并噻唑敏感,因此随机选取3个菌株测定苯并噻唑对灰霉病菌菌丝生长、孢子萌发和芽管伸长的影响,对菌丝生长的测定方法同1.2.1,熏蒸浓度设置为0、0.1、0.2、0.5、1、2、3、4、6、8 μL·L-1。灰霉病菌菌株在PDA培养基上25℃黑暗培养10 d,用0.05%的吐温80水溶液洗脱孢子并用两层纱布过滤,在光学显微镜下用血球计数板计算孢子悬浮液的浓度,将孢子悬浮液浓度配至1×105个/mL。100 μL孢子悬浮液均匀涂布于1%的水琼脂培养基,定量苯并噻唑(0、0.02、0.04、0.1、0.2、0.4、0.6、0.8、1.2、1.6 μL)滴加到固定于另一皿底的滤纸片上形成系列熏蒸浓度(0、0.1、0.2、0.5、1、2、3、4、6、8 μL·L-1),迅速两底合扣,用密封膜封严,于25℃恒温黑暗培养8 h后观察孢子萌发情况,以芽管长度超过孢子长度的1/2为萌发标准,每个平板观察200个孢子的萌发情况。每个平板测量50个萌发孢子的芽管长度。每处理进行6次重复。孢子萌发抑制率(%)=(对照孢子萌发率-处理孢子萌发率)∕对照孢子萌发率×100;芽管伸长抑制率(%)=(对照芽管长度-处理芽管长度)∕对照芽管长度×100。
1.2.3 苯并噻唑与多菌灵、啶酰菌胺的联合毒力 随机选取多菌灵敏感菌株(MY-3),啶酰菌胺敏感菌株(SH-9)为试验菌株,在PDA培养基上纯化3 d,在菌落边缘打取直径5 mm的菌饼,分别接入含系列梯度浓度的多菌灵、啶酰菌胺含药平板,其中多菌灵系列浓度为0、0.5、2、4、8 mg·L-1,啶酰菌胺系列浓度为0、0.1、1、5、20 mg·L-1。另一培养皿皿底加入0或0.1 μL苯并噻唑,使熏蒸浓度为0或0.5 μL·L-1,迅速倒扣在接有菌饼的含药平板上,用密封膜封严,25℃培养箱中黑暗倒置培养,每处理重复4次。3 d后用十字交叉法测量菌丝直径,分别计算苯并噻唑和多菌灵、啶酰菌胺的单一使用和联合使用对灰霉病菌菌丝生长的抑制率。
1.2.4 苯并噻唑对黄瓜灰霉病的保护与治疗作用测定 参照Kuang等[17]的方法,略做改进。选取大小一致的同一叶龄健康黄瓜叶片(品种新泰密刺),用0.5%的NaClO溶液浸泡1 min,无菌蒸馏水冲洗3次后自然晾干,放置于铺有湿润滤纸的直径9 cm培养皿皿底。0、0.1、0.2、0.4、0.8、1.6 μL苯并噻唑滴加到固定在另一皿底的滤纸片上,熏蒸浓度为0、0.5、1、2、4、8 μL·L-1,300 mg·L-1的50%啶酰菌胺WG为对照药剂,水为空白对照,每浓度重复6次,试验重复2次。
保护作用测定:苯并噻唑熏蒸处理黄瓜叶片24 h后,打开封口膜散失挥发物5 min,在黄瓜叶片正面的中心叶脉左右两侧接种5 mm的灰霉病菌菌饼(SH-9菌株),在培养箱(25℃;L﹕D = 12 h﹕12 h;相对湿度85%)培养3 d后用十字交叉法测量病斑直径并计算防效。防效(%)=(对照菌落增长直径-处理菌落增长直径)/(对照菌落直径-菌饼直径)×100。
治疗作用测定:在黄瓜叶片正面的中心叶脉左右两侧接种5 mm的灰霉病菌菌饼(SH-9菌株),25℃生长24 h后测量各菌落初始直径(d0),苯并噻唑熏蒸处理24 h,散发挥发物继续在培养箱(25℃;L﹕D = 12 h﹕12 h;相对湿度85%)培养3 d,用十字交叉法测量病斑直径(d),并计算防效。病斑增长直径(mm)= d-d0;防效(%)=(对照菌落增长直径-处理菌落增长直径)/对照菌落增长直径×100。
1.2.5 苯并噻唑对灰霉病菌致病力的影响 参照Liu等[18]的离体叶片接种法。剪取生长一致的黄瓜叶片,用0.5%的NaClO溶液消毒1 min,无菌蒸馏水冲洗3次后自然晾干,展平铺展到垫有湿润滤纸的直径9 cm培养皿中。采用密封盘法对预培养24 h的灰霉病菌(SH-9菌株)利用苯并噻唑(0、0.5、1、2、4、8 μL·L-1)熏蒸处理12、24、36、48 h,用直径5 mm的打孔器分别在熏蒸处理后的灰霉菌落边缘打取菌饼,接种于黄瓜叶片正面。在每片叶上接 2块菌饼,每个处理接种6片叶。接种后置于培养箱(25℃;L﹕D = 12 h﹕12 h;相对湿度85%)培养。3 d后用十字交叉法测量病斑直径大小,试验重复2次。
1.2.6 苯并噻唑对灰霉病菌菌丝形态的影响 结合致病力试验结果,对预培养24 h的灰霉病菌进行4 μL·L-1苯并噻唑熏蒸处理36 h,以不受苯并噻唑处理的菌丝作对照,取边缘菌丝进行扫描电镜形态观察。按康振生[19]的方法进行扫描电镜样品的加工。
1.3 数据分析
利用DPS 7.05软件计算苯并噻唑的EC50、EC90及95%置信限,用Duncan’s新复极差法进行处理间差异显著性检验。
2 结果
2.1 苯并噻唑对不同敏感程度灰霉病菌的抑制活性
山东地区多菌灵、腐霉利、嘧霉胺、啶酰菌胺抗性和敏感灰霉病菌对苯并噻唑均比较敏感(表1)。73个灰霉病菌菌株的EC50范围为0.38—1.08 μL·L-1,平均EC50为0.62 μL·L-1,EC90范围为3.57—6.39 μL·L-1,平均EC90为4.45 μL·L-1(表2)。苯并噻唑对灰霉病菌菌丝生长和孢子萌发均有显著的抑制作用,而灰霉病菌菌丝比孢子对苯并噻唑更敏感(图1)。2 μL·L-1苯并噻唑对菌丝的抑制率高达86.12%,对芽管伸长的抑制率为55.15%,而对孢子萌发的抑制率仅有19.30%。苯并噻唑浓度的升高,对灰霉病菌的抑制率越高,同时,4 μL·L-1能够完全抑制灰霉病菌孢子的萌发,8 μL·L-1完全抑制灰霉病菌菌丝的生长。

图中数据为平均值±标准误Data in the figure were mean±SE
2.2 苯并噻唑与多菌灵、啶酰菌胺的联合毒力
0.5 μL·L-1苯并噻唑与低剂量多菌灵0.5 mg·L-1混用时,主要是苯并噻唑发挥抑菌作用;随着多菌灵浓度的升高,两者混用主要由多菌灵发挥抑菌效果,两者混用无增效(图2-A)。0.5 μL·L-1苯并噻唑与0.1 mg·L-1啶酰菌胺混用时主要是苯并噻唑发挥抑菌作用;0.5 μL·L-1苯并噻唑与1 mg·L-1啶酰菌胺防效相当,随着啶酰菌胺浓度的升高(1—20 mg·L-1),苯并噻唑与啶酰菌胺混用与两单剂相比,抑菌率有显著的增加(图2-B)。

表1 山东省8种灰霉病菌菌株类型对苯并噻唑的敏感性
R:抗性菌株resistant isolates;S:敏感菌株sensitive isolates;Car=多菌灵Carbendazim;Prc=腐霉利Procymidone;Pyr=嘧霉胺Pyrimethanil;Bos=啶酰菌胺Boscalid

表2 山东省不同地区灰霉病菌对苯并噻唑的敏感性

图中数据为平均值±标准误。柱上不同字母表示经Duncan 氏新复极差法检验在P<0.05水平差异显著。下同
2.3 苯并噻唑对黄瓜灰霉病的保护与治疗作用
苯并噻唑的治疗效果比保护效果更强(表3),2 μL·L-1的治疗效果为91.01%,显著高于对照药剂啶酰菌胺,4 μL·L-1的防效达到100%,能够完全控制灰霉病的菌丝生长。苯并噻唑的保护效果较弱,2 μL·L-1的防效仅为48.25%,最高剂量8 μL·L-1的防效为92.98%,而其他剂量处理防效均远低于对照药剂啶酰菌胺300 mg·L-1。
2.4 苯并噻唑对灰霉病菌致病力的影响
随着熏蒸时间的延长,苯并噻唑对灰霉病菌致病力的抑制作用更明显。苯并噻唑不同浓度熏蒸处理灰霉病菌12 h接种于黄瓜叶片,形成的病斑直径与对照无显著性差异。熏蒸时间延长至24 h时,高剂量8 μL·L-1处理组病菌侵染形成的病斑直径显著低于对照组,仅为对照直径的72%,说明此剂量下可以有效抑制灰霉病菌对黄瓜叶片的侵染。熏蒸时间达到36 h时,各浓度苯并噻唑不同程度地降低了所形成病斑的直径,4和8 μL·L-1处理下,病斑直径分别为对照的83%和59%。苯并噻唑熏蒸处理灰霉病菌48 h后,2、4和8 μL·L-1处理显著降低灰霉病菌致病力的作用更显著,病斑直径分别为对照的89%、78%和54%(图3)。

图3 苯并噻唑对灰霉病菌致病力的影响
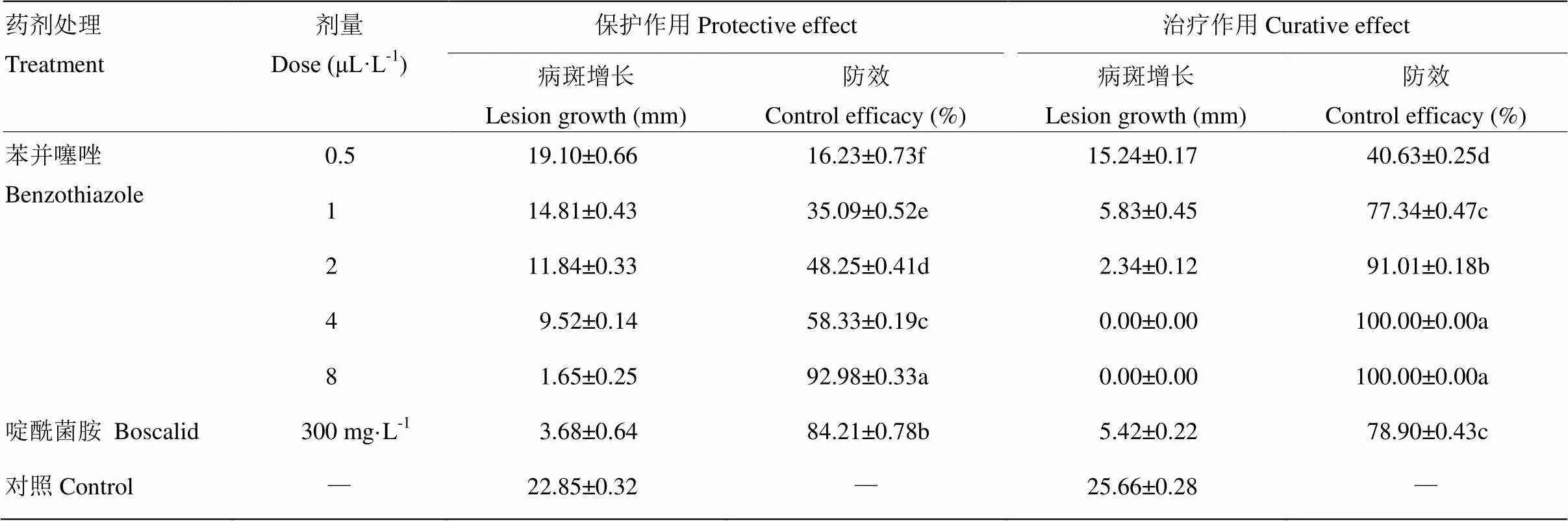
表3 苯并噻唑对黄瓜灰霉病的保护和治疗作用
表中数据为平均值±标准误。同列不同字母表示经 Duncan 氏新复极差法检验在<0.05水平差异显著
Data in the table were mean±SE. Different letters in the same column indicated significant difference at<0.05 level by Duncan’s multiple range test
2.5 苯并噻唑对灰霉病菌菌丝形态的影响
对照菌丝形态完整,表面细滑,线条流畅, 生长状态良好(图4-A—C);4 μL·L-1苯并噻唑处理36 h后,菌丝破损,表面干瘪(图4-D),菌丝末端膨大,分支增多(图4-E),表面有凹陷(图4-F)。
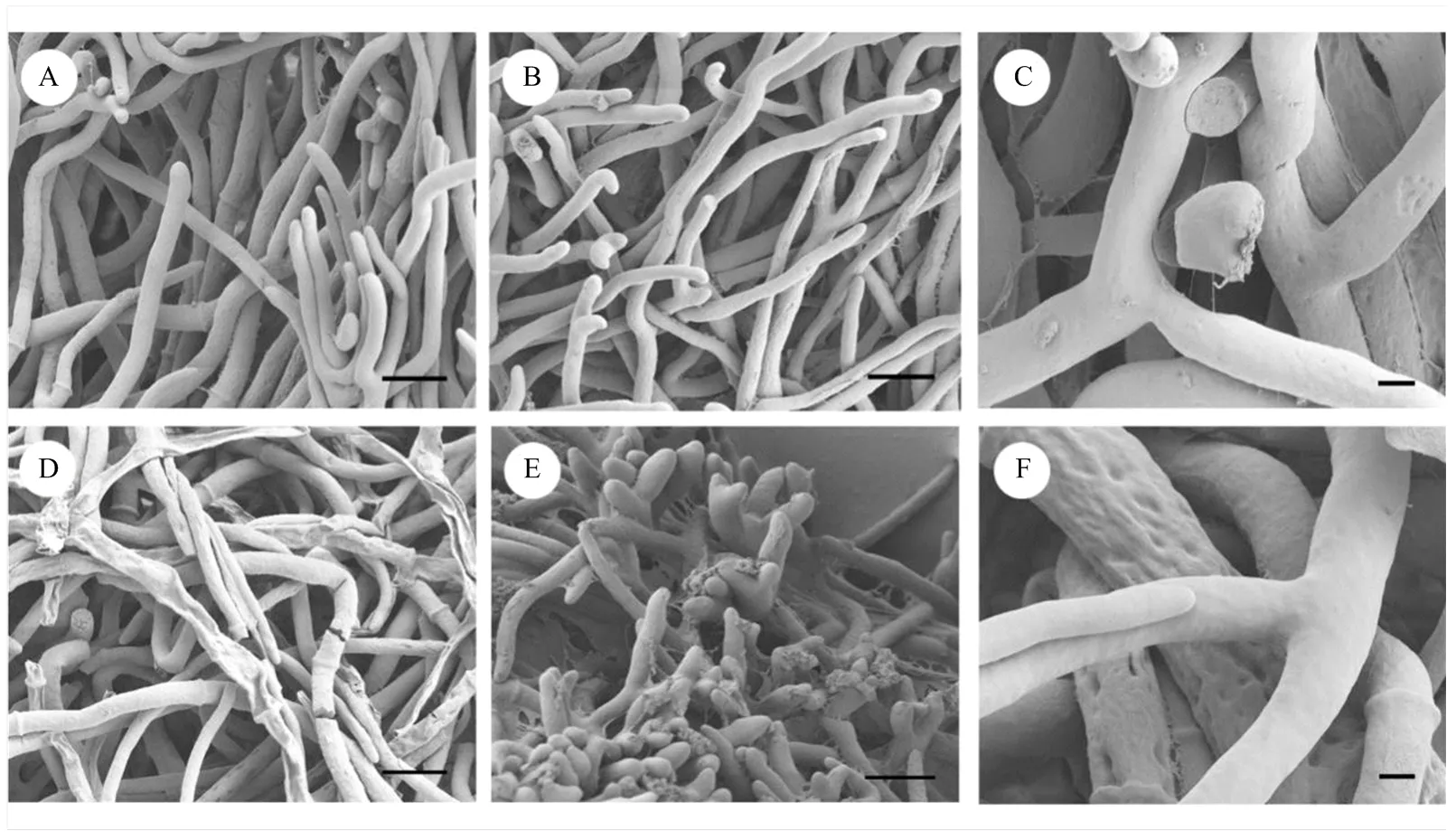
A—C:对照菌丝Mycelia of untreated control;D—F:4 μL·L-1苯并噻唑处理36 h的菌丝Mycelia treated with 4 μL·L-1 benzothiazole for 36 h
3 讨论
山东各地区灰霉病菌对常规杀菌剂已经产生了不同程度的抗性,需要不断开发新的防治药剂。本研究表明,不论抗性还是敏感菌株均对苯并噻唑的敏感性一致,这也从侧面证明苯并咪唑与常规杀菌剂多菌灵、腐霉利、嘧霉胺和啶酰菌胺等没有交互抗性。苯并噻唑在不同浓度下对灰霉病菌均具有不同程度的抑制作用,且随着处理浓度的升高,抑制活性增强。
生物防治与化学药剂联合防治已成为研究热点之一。Maki等[20]研究发现,枯草芽孢杆菌()与氟酰胺(flutolanil)混用可大大提高单独使用氟酰胺防治马铃薯猝倒病的效果;牛芳胜等[21]研究表明,哈茨木霉()与啶酰菌胺联合使用,增强了对番茄灰霉病菌的抑菌活性。本研究评价了苯并噻唑与两种杀菌剂混用的有效性,其中苯并咪唑类的杀菌剂多菌灵是通过干扰有丝分裂中的纺锤体形成,影响细胞的分裂[22],属于琥珀酸脱氢酶抑制剂的啶酰菌胺是作用于植物病原菌细胞内的线粒体,结合呼吸链蛋白质复合体Ⅱ,干扰呼吸作用,进而阻碍能量代谢,造成菌体死亡[23]。测定结果表明,苯并噻唑与多菌灵混用无协同作用,两者混用时哪种药剂发挥主要抑菌作用与各组分在混用中使用的浓度和比例有关;苯并噻唑与啶酰菌胺混用有明显的增效作用,其田间实际应用方式、效果以及增效机制还有待进一步明确。
苯并噻唑能显著降低灰霉病菌的致病力,受抑制程度与苯并噻唑浓度呈正相关。菌丝在药物胁迫下生长,药物浓度越高,对菌丝的抑制率越强,达到致病力显著减弱的时间越短。致病力结果表明,抑制率约90%的剂量4 μL·L-1开始显著降低病菌致病力的时间为36 h。为了探究灰霉菌丝致病力减弱的原因,笔者从超微形态观察苯并噻唑对菌丝的影响,发现苯并噻唑处理后的菌丝破损现象明显,内生物质外漏造成菌丝干瘪,这应该是造成致病力下降的原因。
苯并噻唑作为一种微生物源挥发性化合物,是棒曲霉()[24]、枯草芽孢杆菌[11]和担子菌(ligninolytic Basidiomycetes)[25]的次生代谢产物。苯并噻唑的化学结构简单,与苯并咪唑类似,而它的作用机理仍不清楚。笔者实验室前期研究发现,苯并噻唑能影响韭菜迟眼蕈蚊的取食量、解毒酶和消化酶活性[26],干扰其能量代谢[27]。陈澄宇等[12]发现,苯并噻唑能影响韭菜迟眼蕈蚊的呼吸速率,熏蒸0.5—1 h能使幼虫呼吸速率明显升高,随后降低至对照水平。Ginsberg等[28]认为苯并噻唑是一种呼吸刺激剂。仅有的关于苯并噻唑作用机理的研究推测,苯并噻唑与能量代谢有关,而其具体作用机制仍待研究。
由于挥发性化合物具有残留量低、安全性高、高效的特点[29],从自然资源中寻找化学药剂的替代化合物已成为当前新药剂研究的热点。Arrebola等[4]研究发现,芽孢杆菌产生的挥发物能防治青霉等采后腐烂病;Fujioka等[30]研究发现,柠檬醛能保护拟南芥免受炭疽病的危害;Kishimoto等[31]证实,1-辛烯-3-醇能诱导拟南芥抵御灰霉病的侵染。本研究发现,苯并噻唑对黄瓜灰霉病兼具保护和治疗作用,同等浓度下治疗效果高于保护效果,这归因于灰霉病菌的菌丝比孢子对苯并噻唑更敏感。因此,苯并噻唑对黄瓜灰霉病具有很好的防治效果。作为一种挥发性化合物,苯并噻唑更适用于温室大棚、仓储等密闭环境中灰霉病的防治,其使用方法和效果尚需进一步评价。此外,苯并噻唑作用广谱,对菌核病、韭菜迟眼蕈蚊、根结线虫等均有效[8,11-12],未来还有开发为土壤熏蒸剂使用的潜力。
4 结论
微生物源挥发性化合物苯并噻唑对灰霉病菌具有较高的熏蒸活性,山东地区灰霉菌株对苯并噻唑的EC50平均值为0.62 μL·L-1,病菌不同生长阶段对此化合物的敏感性依次为菌丝生长>芽管伸长>孢子萌发。苯并噻唑对灰霉病害兼具保护和治疗作用,对菌丝形态具有破坏作用,在植物保护领域具有较大的应用潜力。
[1] Dean R, Van Kan J A L, Pretorius Z A, Hammond- Kosack K E, Di Pietro A, Spanu P D, Rudd J J, Dickman M, Kahmann R, Ellis J, Foster G D. The top 10 fungal pathogens in molecular plant pathology., 2012, 13(4): 414-430.
[2] 于永学, 王英姿.灰霉病菌抗药性发生概况及机理研究进展. 现代农业科技, 2009(11): 117-118.
Yu Y X, Wang Y Z. Studies on the resistance to drugs ofand its mechanism., 2009(11): 117-118. (in Chinese)
[3] Morath S U, Hung R, Bennett J W. Fungal volatile organic compounds: a review with emphasis on their biotechnological potential., 2012, 26(3): 73-83.
[4] Arrebola E, Sivakumar D, Korsten L. Effect of volatile compounds produced bystrains on postharvest decay in citrus., 2010, 53(1): 122-128.
[5] Mercier J, Manker D C. Biocontrol of soil-borne diseases and plant growth enhancement in greenhouse soilless mix by the volatile-producing fungus., 2005, 24(4): 355-362.
[6] Mercier J, Jiménez J I. Control of fungal decay of apples and peaches by the biofumigant fungus., 2004, 31(1): 1-8.
[7] Tripathi P, Dubey N K, Shukla A K. Use of some essential oils as post-harvest botanical fungicides in the management of grey mould of grapes caused by., 2008, 24(1): 39-46.
[8] Fernando W G D, Ramarathnam R, Krishnamoorthy A S, Savchuk S C. Identification and use of potential bacterial organic antifungal volatiles in biocontrol., 2005, 37(5): 955-964.
[9] Raza W, Yuan J, Ling N, Huang Q, Shen Q. Production of volatile organic compounds by an antagonistic strainWR-2 in the presence of root exudates and organic fertilizer and their antifungal activity againstf. sp.., 2015, 80: 89-95.
[10] Zhao L J, Yang X N, Li X Y, Mu W, Liu F. Antifungal, insecticidal and herbicidal properties of volatile components fromstrain BMP-11., 2011, 10(5): 728-736.
[11] 刘玮玮, 赵丽静, 王超, 慕卫, 刘峰. 五株土壤细菌所产抑菌挥发性物质的生物活性评估及其应用. 植物保护学报, 2009, 36(2): 97-105.
Liu W W, ZHAO L J, Wang C, Mu W, Liu F. Bioactive evaluation and application of antifungal volatiles generated by five soil bacteria., 2009, 36(2): 97-105. (in Chinese)
[12] 陈澄宇, 赵云贺, 李慧, 张鹏, 慕卫, 刘峰.苯并噻唑对不同虫态韭菜迟眼蕈蚊的生物活性. 昆虫学报, 2014, 57(1): 45-51.
Chen C Y, Zhao Y H, Li H, Zhang P, Mu W, Liu F. Biological activity of benzothiazole against(Diptera: Sciaridae) at different developmental stages., 2014, 57(1): 45-51. (in Chinese)
[13] 张传清, 张雅, 魏方林, 刘少颖, 朱国念. 设施蔬菜灰霉病菌对不同类型杀菌剂的抗性检测. 农药学学报, 2006, 8(3): 245-249.
Zhang C Q, Zhang Y, Wei F L, Liu S Y, Zhu G N. Detection of resistance offrom protected vegetables to different classes of fungicides., 2006, 8(3): 245-249. (in Chinese)
[14] Zhang C Q, Yuan S K, Sun H Y, Qi Z Q, Zhou M G, ZHU G N. Sensitivity offrom vegetable greenhouses to boscalid., 2007, 56(4): 646-653.
[15] 苗建强, 王猛, 李秀环, 杨法辉, 刘峰. 五种挥发性化合物对土传病原真菌及线虫的生物活性. 植物保护学报, 2012, 39(6): 561-566.
Miao J Q, Wang M, Li X H, Yang F H, Liu F. Antifungal and nematicidal activities of five volatile compounds against soil-borne pathogenic fungi and nematodes., 2012, 39(6): 561-566. (in Chinese)
[16] Veloukas T, Karaoglanidis G S. Biological activity of the succinate dehydrogenase inhibitor fluopyram against, and fungal baseline sensitivity., 2012, 68(6): 858-864.
[17] Kuang J, Hou Y P, Wang J X, Zhou M G. Sensitivity ofto fludioxonil:determination of baseline sensitivity and resistance risk., 2011, 30(7): 876-882.
[18] Liu S M, Che Z P, Chen G Q. Multiple-fungicide resistance to carbendazim, diethofencarb, procymidone, and pyrimethanil in field isolates offrom tomato in Henan Province, China., 2016, 84: 56-61.
[19] 康振生. 植物病原菌超微结构. 北京: 中国科学技术出版社, 1996: 7-11.
Kang Z S.. Beijing: China Science and Technology Press, 1996: 7-11. (in Chinese)
[20] Maki K, Mitsuyo H, Makoto S. Co-utilization ofand flutolanil in controlling damping-off of tomato caused by., 2000, 22(21): 1693-1697.
[21] 牛芳胜, 马志强, 毕秋艳, 韩秀英, 王文桥, 张小风. 哈茨木霉菌与5种杀菌剂对番茄灰霉病菌的协同作用. 农药学学报, 2013, 15(2): 165-170.
Niu F S, Ma Z Q, Bi Q Y, Han X Y, Wang W Q, Zhang X F. Synergism ofand five fungicides to., 2013, 15(2): 165-170. (in Chinese)
[22] 韩君, 范怀峰, 王海娜, 刘峰. 防治灰霉病药剂的开发进展. 农药研究与应用, 2011, 15(3): 5-10.
Han J, Fan H F, Wang H N, Liu F. Development progress of fungicides against., 2011, 15(3): 5-10. (in Chinese)
[23] 亦冰. 新颖杀菌剂——啶酰菌胺. 世界农药, 2006, 28(5): 51-53.
Yi B. A novel fungicides-boscalid., 2006, 28(5): 51-53. (in Chinese)
[24] Seifert R M, Jr A D K. Identification of some volatile constituents of., 1982, 30(4): 786-790.
[25] Gallois A, Gross B, Langlois D, Spinnler H E, Brunerie P. Influence of culture conditions on production of flavour compounds by 29 ligninolytic Basidiomycetes., 1990, 94(4): 494-504.
[26] Zhao Y H, Xu C M, Wang Q H, Wei Y, Liu F, Xu S Y, Zhang Z Q, Mu W. Effects of the microbial secondary metabolite benzothiazole on the nutritional physiology and enzyme activities of(Diptera: Sciaridae)., 2016, 129: 49-55.
[27] Zhao Y H, Cui K D, Xu C M, Wang Q H, Wang Y, Zhang Z Q, Liu F, Mu W. Proteomic profile of thein response to the microbial secondary metabolite benzothiazole., 2016, 6: 37730.
[28] Ginsberg G, Toal B, Kurland T. Benzothiazole toxicity assessment in support of synthetic turf field human health risk assessment., 2011, 74(17): 1175-1183.
[29] Mercier J, Smilanick J L. Control of green mold and sour rot of stored lemon by biofumigation with., 2005, 32(3): 401-407.
[30] Fujioka K, Gotoh H, Noumi T, Yoshida A, Noutoshi Y, Inagaki Y, Yamamoto M, Ichinose Y, Shiraishi T, Toyoda K. Protection induced by volatile limonene against anthracnose disease in., 2015, 81(6): 415-419.
[31] Kishimoto K, Matsui K, OZAWA R, TAKABAYASHI J. Volatile 1-octen-3-ol induces a defensive response in., 2007, 73(1): 35-37.
(责任编辑 岳梅)
The inhibition effect of microbial volatile compound benzothiazole on
CUI KaiDi1,3, HUANG XuePing1,3, HE LeiMing1,2, ZHAI YongBiao1, MU Wei1,2, LIU Feng1,2,3
(1College of Plant Protection, Shandong Agricultural University, Taian 271018, Shandong;2Key Laboratory of Pesticide Toxicology & Application Technique, Shandong Agricultural University, Taian 271018, Shandong;3Shandong Provincial Key Laboratory for Biology of Vegetable Diseases and Insect Pests, Shandong Agricultural University, Taian 271018, Shandong)
【】The objective of this study is to evaluate the application potential of microbial volatile compound benzothiazole on, and to provide a valuable information for further exploitation and utilization.【】The sensitivity of 73isolates in Shandong Province to benzothiazole was measured by mycelium growth rate of sealed dishes method. The sensitivity differences among different regions and phynotypes ofisolates (resistant and sensitive to carbendazim, procymidone, pyrimethanil or boscalid: CarR, CarS, PrcR, PrcS, PyrR, PyrS, BosR, BosS) were compared. The combination efficiencies onof benzothiazole with carbendazim or boscalid were determined. The protective and curative effect of benzothiazole against cucumber gray mold, and the effects of benzothiazole at different doses and fumigation times on the pathogenicity ofwere determined on detached cucumber leaves. The mycelial morphology oftreated by benzothiazole was observed with scanning electron microscope (SEM). 【】 All the testedisolates were sensitive to benzothiazole, range of EC50from 0.38 to 1.08 μL·L-1, with a mean EC50value at 0.62 μL·L-1. There was no sensitivity difference among different regions. All the phynotypes of isolates (CarR, CarS, PrcR, PrcS, PyrR, PyrS, BosR, BosS) were sensitive to benzothiazole, suggesting that there was no cross-resistance between these fungicides and benzothiazole. In the range of 0.1-3 μL·L-1of benzothiazole, mycelia were more sensitive than spores to benzothiazole. The inhibition rate of 2 μL·L-1benzothiazole for mycelial growth, germ tube elongation and spore germination was 86.12%, 55.15%, and 19.30%, respectively. It is suggested that the sensitivities of different growth stages ofto benzothiazole were different. There was no synergism when benzothiazole combined with carbendazim, and which active ingredient performed the main antifungal activity depended on the concentration and proportion of each compound in the mixture. The synergism of benzothiazole combined with boscalid was obvious, but the exact field practical application method, efficacy and mechanism of synergism remains to be further investigated. The result ofleaf test showed that benzothiazole had protective and curative effect against cucumber gray mold, and the curative effect was superior to the protective effect. The curative effect of 2 μL·L-1benzothiazole against cucumber gray mold was 91.01%, which was higher than the control fungicide boscalid at 300 mg·L-1(78.90%) and the protective effect (48.25%). Benzothiazole could significantly reduce the pathogenicity ofmycelia on detached cucumber leaves, and the inhibition level was positively correlated with the concentration of benzothiazole. The results of SEM images indicated that benzothiazole caused large alterations in mycelial morphology of, showing a wrinkled surface and anomalous branching of the terminal mycelia. 【】Benzothiazole has high toxicity toin different regions of Shandong Province, which indicates that benzothiazole could be applied as a fumigant for controlling gray mold.
volatile compounds; benzothiazole;; toxicity; sensitivity
10.3864/j.issn.0578-1752.2017.19.008
2017-05-02;接受日期:2017-06-21
国家重点研发计划(2016YFD0200500)
崔凯娣,E-mail:ckd921209@163.com。通信作者刘峰,Tel/Fax:0538-8242611;E-mail:fliu@sdau.edu.cn

