青蒿琥酯对小鼠玫瑰痤疮样炎症的作用观察
李婷 曾庆文 陈向明 胡阳 张海清 俞爱华 王海瑞
201802上海市嘉定区南翔医院皮肤科(李婷、陈向明、胡阳、张海清、俞爱华、王海瑞);上海交通大学医学院附属新华医院儿科 上海市儿科医学研究所(曾庆文)
青蒿琥酯对小鼠玫瑰痤疮样炎症的作用观察
李婷 曾庆文 陈向明 胡阳 张海清 俞爱华 王海瑞
201802上海市嘉定区南翔医院皮肤科(李婷、陈向明、胡阳、张海清、俞爱华、王海瑞);上海交通大学医学院附属新华医院儿科 上海市儿科医学研究所(曾庆文)
目的观察青蒿琥酯对小鼠玫瑰痤疮样炎症的影响。方法在25只7周龄BALB/c雄鼠背部皮下注射40 μl抗菌肽LL⁃37,每12小时1次,共4次,制备玫瑰痤疮样小鼠模型,并将其随机等分为5组,每次注射LL⁃37后模型组给予生理氯化钠溶液灌胃,治疗组分别给予25、50、100 mg/kg青蒿琥酯溶液灌胃,阳性对照组给予30 mg/kg盐酸多西环素溶液灌胃;另取5只小鼠作为空白对照组,仅背部皮下注射4次纯水。首次注射LL⁃37后48 h观察各组皮损和红斑评分,取背部注射部位皮肤行HE染色,观察组织结构并计数炎症细胞数量,ELISA法检测皮损髓过氧化物酶(MPO)活性。结果模型组皮损炎症反应明显,红斑评分(3.20±0.84)、炎症细胞计数(517.27±99.43)和MPO活性(0.57±0.08)均显著高于空白对照组(均P<0.01),阳性对照组红斑评分(1.60±0.89)、炎症细胞计数(270.93±124.63)和MPO活性(0.40±0.05)均显著低于模型组,差异有统计学意义(P<0.05、0.01、0.01)。50和100 mg/kg青蒿琥酯组红斑评分分别是1.80±0.84和1.40±0.55,显著低于模型组(P<0.05、0.01),炎症细胞计数分别为286.00±33.72和258.00±36.44,显著低于模型组(均P<0.01),MPO活性分别是0.43±0.05和0.40±0.06,亦明显低于模型组(P<0.05、0.01)。50 mg/kg和100 mg/kg青蒿琥酯组红斑评分、炎症细胞计数和MPO活性与阳性对照组差异均无统计学意义。结论青蒿琥酯能抑制小鼠玫瑰痤疮样炎症反应,以中、高剂量最为明显。
肥大性酒渣鼻;青蒿素类;多西环素;内源性抗菌多肽类物质;疾病模型,动物;青蒿琥酯;LL⁃37
玫瑰痤疮是一种以面部皮肤潮红、毛细血管扩张及丘疹、脓疱为表现的慢性炎症性皮肤病。血管反应和炎症反应是玫瑰痤疮发病的两个必要因素[1]。研究发现青蒿琥酯具有抗炎和抑制血管新生的作用[2],这些药理活性可能与其临床治疗玫瑰痤疮的作用机制有关。我们观察青蒿琥酯对小鼠玫瑰痤疮样炎症炎症反应的影响,为临床应用青蒿琥酯治疗玫瑰痤疮提供依据。
资料和方法
一、资料
1.实验动物:SPF级[SCXK(沪)2012⁃0002]7周龄BALB/c健康雄鼠30只,体重18~20 g,动物来自上海斯莱克实验动物有限公司(合格证号0151124)。小鼠每笼5只,自由进食饮水,12 h昼夜交替(7:00~19:00灯亮),室温(23±1)℃,相对湿度45%~55%。饲养于华东师范大学脑功能基因组学教育部重点实验室动物中心。
2.实验试剂与设备:抑菌肽LL⁃37由吉尔(上海)生化有限公司合成,用纯水溶解成320 μmol/L;青蒿琥酯片(广西桂林制药厂,批号AS116401),溶解于5%碳酸氢钠溶液后再用生理氯化钠溶液配制成所需浓度。盐酸多西环素分散片(vibramycin⁃D,美国辉瑞制药有限公司,批号11700200),溶于超纯水后均置4℃冰箱保存,3 d内用完。小鼠髓过氧化物酶(MPO)ELISA试剂盒来自美国RD公司。光学显微镜(Olympus B×43 F)及成像系统(micropublisher3.3RTV,加拿大Qimaging公司),直径8 mm皮肤圆形打孔器(上海医疗器械有限公司手术器械厂),BIO⁃TEK酶标仪(ELX⁃800型,美国BioTek仪器有限公司)。
二、方法
1.造模[3]:动物以标准饲料饲养适应1周后进入实验。实验前1天,剃除小鼠背部3 cm×3 cm范围毛发。向小鼠背部备皮部位用胰岛素注射器皮内注射LL⁃37(320 μmol/L),每次注射40 μl,间隔12 h重复注射,共连续注射 4次,即0、12、24、36 h各1次。
2.分组与给药:第1次注射LL⁃37后即分为模型组、治疗组(低、中、高剂量青蒿琥酯组)和阳性对照组,每组5只小鼠。另有5只小鼠为空白组,仅皮下注射4次40 μl纯水。每次注射LL⁃37后模型组给予0.2 ml生理氯化钠溶液灌胃,3个治疗组分别给予25 mg/kg(低剂量组),50 mg/kg(中剂量组)和100 mg/kg(高剂量组)青蒿琥酯溶液灌胃,阳性对照组给予30 mg/kg盐酸多西环素溶液灌胃,共4次。
3.大体观察及皮损红斑评分[2⁃3]:首次注射LL⁃37后48 h观察各组注射部位皮损变化,并对皮肤红斑给予评分,0分为无红斑,1分为隐约可见红斑,2分为明显可见淡红斑,边界模糊,3分为红斑明显且边界清晰,4分为红斑颜色深边界清晰。
4.组织病理观察:首次注射LL⁃37后48 h处死小鼠,剪下背部注射部位的皮肤,用钻孔器钻取红斑处皮损,等分为两份,一份常规固定在甲醛溶液中,另一份置于低温冰箱中备用。将甲醛液固定好的标本常规脱水,石蜡包埋,切片,HE染色,每张切片在×100光镜下观察组织结构,×400光镜下观察皮损内3个不重叠视野,计数炎症细胞数量,取均值。
5.皮损内MPO测定:将钻取的另一半皮损从低温冰箱中取出,剪碎,匀浆,按试剂盒说明操作,最后用酶标仪在450 nm波长下测定吸光度值。
三、统计学方法
结 果
一、大体观察
48 h后,空白组小鼠背部皮肤正常(图1A);模型组局部注射部位皮肤形成中央水肿或坏死结痂的红斑(图1B)。阳性对照组皮肤红斑明显减轻(图1C),红斑评分显著低于模型组(P<0.05),见表1。不同剂量青蒿琥酯治疗后皮损红斑反应均有不同程度减轻(图1D~1F)。其中,50和100 mg/kg青蒿琥酯组红斑评分较模型组均显著下降(P< 0.05、0.01),但两组间差异均无统计学意义(P>0.05),且与阳性对照组相比差异无统计学意义(q值均为0.63,均P>0.05),见表1。

图1 首次注射LL⁃37后48 h各组皮损表现 1A:空白组局部无红肿;1B:模型组局部红斑充血、水肿明显;1C:阳性对照组局部红斑充血轻微,水肿轻微;1D:低剂量青蒿琥酯组局部红斑充血较明显,水肿轻微;1E:中剂量青蒿琥酯组局部红斑充血轻微,水肿轻微;1F:高剂量青蒿琥酯组局部红斑充血轻微,水肿轻微
表1 各组小鼠红斑评分和炎症细胞计数比较(±s)

表1 各组小鼠红斑评分和炎症细胞计数比较(±s)
注:n=5。a:与空白组比,P < 0.05;b:与阳性对照组比,P <0.05;c:与模型组比,P < 0.05
组别模型组青蒿琥酯组25 mg/kg 50 mg/kg 100 mg/kg阳性对照组空白组F值P值红斑评分3.20±0.84ab炎症细胞计数517.27±99.43ab髓过氧化物酶(pg/mg)0.57±0.08ab 2.20±0.45a 1.80±0.84ac 1.40±0.55c 1.60±0.89c 0.40±0.55c 8.55<0.01 378.13±62.55a 286.00±33.72ac 258.00±36.44ac 270.93±124.63ac 52.2±51.10bc 20.45<0.01 0.45±0.09a 0.43±0.05ac 0.40±0.06ac 0.40±0.05ac 0.11±0.05bc 26.41<0.01
二、组织病理和炎症细胞计数
空白组小鼠(图2A)表皮无坏死结痂,细胞间及细胞内未见水肿,真皮内及皮下脂肪层少量炎症细胞浸润。模型组(图2B)部分区域有明显坏死,表皮缺如,部分区域表皮反应性增生,真皮及皮下组织毛细血管扩张和大量以中性粒细胞为主的炎症细胞浸润。阳性对照组(图2C)表皮坏死程度减轻,炎症细胞浸润明显少于模型组(P<0.01)。25 mg/kg青蒿琥酯组(图2D)组织病理变化与模型组相近;50、100 mg/kg青蒿琥酯两组(图2E、2F)炎症细胞计数均较模型组显著下降(均P<0.01),但两组间差异无统计学意义(P>0.05),与阳性对照组比较差异亦无统计学意义(均P>0.05),见表1。
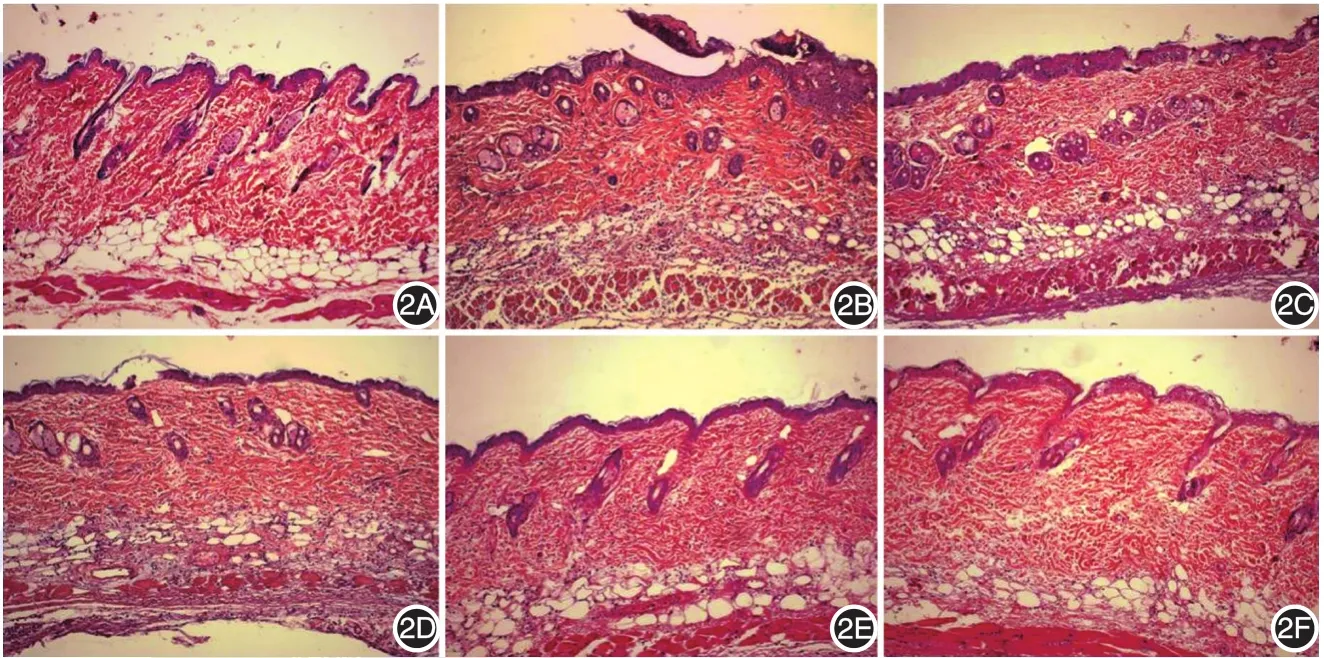
图2 各组小鼠皮损织病理(HE×100)A:空白组皮肤各层结构完整,无明显炎症细胞浸润;2B:模型组表皮严重坏死缺如,表皮下大量炎症细胞浸润;2C:阳性对照组表皮无明显坏死,表皮下少量炎症细胞浸润;2D:低剂量青蒿琥酯组表皮轻度坏死缺如,表皮下见较多炎症细胞浸润;2E:中剂量青蒿琥酯组表皮无明显坏死,表皮下少量炎症细胞浸润;2F:高剂量青蒿琥酯组表皮完整,表皮下少量炎症细胞浸润
三、MPO活性比较
模型组MPO活性明显高于空白对照组(P<0.01),阳性对照组MPO活性显著低于模型组(P<0.01);50 mg/kg和100 mg/kg青蒿琥酯组MPO活性均显著低于模型组(P<0.05、0.01),但两组间差异无统计学意义(P>0.05),且与阳性对照组比较差异 无统计学意义(均P>0.05),见表1。
讨 论
大量研究表明,紫外线、毛囊蠕型螨等外界刺激会激活多种信号途径,引起皮损处先天免疫异常,丝氨酸蛋白酶和抗菌肽分泌增多[2,4]。LL⁃37是唯一存在于人体的Cathelicidin类抗菌肽,含有37个氨基酸,具有诱导新生血管生成和促进炎症反应的作用,在玫瑰痤疮的发病机制中发挥重要作用[5⁃6]。Yamasaki等[7]用组织病理免疫染色发现玫瑰痤疮患者皮损处有大量抗菌肽,其中LL⁃37最为显著。向小鼠背部皮下注射LL⁃37,48 h后注射部位出现与玫瑰痤疮病理表现相似的皮损。我们研究发现,LL⁃37可以引起小鼠注射部位皮肤产生红斑、水肿,组织病理显示以中性粒细胞为主的炎症细胞浸润,与文献[3,7]一致。
目前玫瑰痤疮的系统治疗多以抗生素治疗为主,其中盐酸多西环素使用最广,临床疗效明确,故在本研究中作为阳性对照。但多西环素对小鼠玫瑰痤疮样炎症反应影响的国内外资料很有限。最近研究发现多西环素治疗玫瑰痤疮的作用机制与抗菌活性无关,而与抑制玫瑰痤疮的先天免疫反应有关[8]。所以寻找其他具有抗炎作用的非抗生素类药物治疗玫瑰痤疮非常重要,有助于减少抗生素使用量,避免菌群失调和耐药菌的产生。
青蒿琥酯价格低廉,安全性高,已被广泛用于治疗各型疟疾。近些年,国内外研究发现青蒿琥酯还具有其他非抗疟药理活性[9]。Chen等[10]早年发现外用青蒿琥酯可以抑制豚鼠变应性接触性皮炎。王国江等[11]还发现青蒿琥酯通过抑制IL⁃8所致的嗜中性粒细胞趋化减轻皮炎小鼠的炎症反应。另外,青蒿素类药物可以通过抑制血管内皮生长因子和基质金属蛋白酶等发挥抗血管生成作用[9]。青蒿琥酯抗炎和抑制血管增生的药理活性均与玫瑰痤疮的发病机制有关。前期[12]研究我们发现青蒿琥酯能有效治疗轻、中度玫瑰痤疮,疗效与盐酸多西环素相近。本研究中我们应用小鼠玫瑰痤疮模型,在第1次皮下注射LL⁃37后即给阳性对照组小鼠和治疗组小鼠盐酸多西环素和不同浓度的青蒿琥酯灌胃,共4次。48 h后盐酸多西环素和中、高剂量的青蒿琥酯均可以显著降低红斑评分和炎症细胞计数,与模型组差异有统计学意义,但该3组间差异无统计学意义。本文结果提示,作为阳性对照的盐酸多西环素能明显抑制LL⁃37诱导的玫瑰痤疮样小鼠模型炎症反应,中、高剂量的青蒿琥酯与盐酸多西环素的抑制作用相近。但是青蒿琥酯治疗玫瑰痤疮的抗炎和抑制血管反应的机制还需进一步研究。
玫瑰痤疮样小鼠模型炎症细胞浸润以中性粒细胞为主,MPO是中性粒细胞中含量较高的一种酶,皮损部位MPO含量的增高可以反映中性粒细胞浸润的程度[13]。本文结果显示,模型组皮损内MPO活性明显高于空白组,盐酸多西环素干预可明显降低MPO活性,且中、高剂量青蒿琥酯干预也能明显降低MPO活性,表明中、高剂量的青蒿琥酯和盐酸多西环素均具有抗中性粒细胞浸润的作用。
志谢 上海市周浦医院王国江主任和华东师范大学脑功能研究所曹晓华教授
[1]Cribier B.Pathophysiology of rosacea:redness,telangiectasia,and rosacea[J].Ann Dermatol Venereol,2011,138 Suppl 3:S184 ⁃191.DOI:10.1016/S0151⁃9638(11)70088⁃6.
[2]Del RJQ.Advances in understanding and managing rosacea:part 1:connecting the dots between pathophysiological mechanisms and common clinical features of rosacea with emphasis on vascular changes and facial erythema[J].J Clin Aesthet Dermatol,2012,5(3):16⁃25.
[3]Zhang J,Xu X,Rao NV,et al.Novel sulfated polysaccharides disruptcathelicidins,inhibitRAGE and reducecutaneous inflammation in a mouse model of rosacea[J].PLoS One,2011,6(2):e16658[2013⁃11⁃28].DOI:10.1371/journal.pone.0016658.
[4]Salzer S,Ruzicka T,Schauber J.Face⁃to⁃face with anti⁃inflam⁃matory therapy for rosacea[J].Exp Dermatol,2014,23(6):379⁃381.DOI:10.1111/exd.12401.
[5]Salvado MD,Di GA,Lindbom L,et al.Cathelicidin LL⁃37 induces angiogenesis via PGE2⁃EP3 signaling in endothelial cells,in vivoinhibition by aspirin[J].Arterioscler Thromb Vasc Biol,2013,33(8):1965⁃1972.DOI:10.1161/ATVBAHA.113.301851.
[6]Marcinkiewicz M,Majewski S.The role of antimicrobial peptides in chronic inflammatory skin diseases[J].Postepy Dermatol Alergol,2016,33(1):6⁃12.DOI:10.5114/pdia.2015.48066.
[7]Yamasaki K,Di NA,Bardan A,et al.Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea[J].Nat Med,2007,13(8):975⁃980.DOI:10.1038/nm1616.
[8]Kanada KN,Nakatsuji T,Gallo RL.Doxycycline indirectly inhibits proteolytic activation of tryptic kallikrein⁃related peptidases and activation of cathelicidin[J].J Invest Dermatol,2012,132(5):1435⁃1442.DOI:10.1038/jid.2012.14.
[9]Ho WE,Peh HY,Chan TK,et al.Artemisinins:pharmacological actions beyond anti⁃malarial[J].Pharmacol Ther,2014,142(1):126⁃139.DOI:10.1016/j.pharmthera.2013.12.001.
[10]Chen H,Maibach HI.Topical application of artesunate on guinea pig allergic contact dermatitis[J].Contact Dermatitis,1994,30(5):280⁃282.DOI:10.1111/j.1600⁃0536.1994.tb00598.x.
[11]王国江,顾军,张海清.青蒿琥酯对中性粒细胞趋化的影响[J].中国皮肤性病学杂志,2004,18(7):391⁃393,411.DOI:10.3969/j.issn.1001⁃7089.2004.07.004.
[12]李婷,胡阳,俞爱华,等.口服青蒿琥酯治疗酒渣鼻31例临床观察[J].中国皮肤性病学杂志,2015,29(3):330⁃332.DOI:10.13735/j.cjdv.1001⁃7089.201402021.
[13]Lazarevic⁃Pasti T,Leskovac A,Vasic V.Myeloperoxidase inhi⁃bitors as potential drugs[J].Curr Drug Metab,2015,16(3):168⁃190.
Effects of artesunate on rosacea⁃like inflammation in mouse models
Li Ting,Zeng Qingwen,Chen Xiangming,Hu Yang,Zhang Haiqing,Yu Aihua,Wang Hairui
Department of Dermatology,Nanxiang Hospital of Jiading District,Shanghai 201802,China(Li T,Chen XM,Hu Y,Zhang HQ,Yu AH,Wang HR);Department of Pediatrics,Xin Hua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine,Shanghai Institute for Pediatric Research,Shanghai 200092,China(Zeng QW)
Hu Yang,Email:huyang0620@163.com
ObjectiveTo evaluate effects of artesunate on rosacea⁃like inflammation in mouse models.MethodsTwenty⁃five male BALB/c mice aged 7 weeks were injected subcutaneously with 40 μl antibacterial peptide LL⁃37 into the back once every 12 hours for 4 sessions to establish mouse models with rosacea⁃like inflammation.These 25 mice were randomly and equally divided into 5 groups:after each injection of LL⁃37,model group were gavaged with sodium chloride physiological solution,treatment groups gavaged with 25,50 and 100 mg/kg artesunate solution separately,and positive control group gavaged with 30 mg/kg doxycycline hydrochloride solution.Another 5 healthy mice injected subcutaneously with pure water into the back for 4 sessions served as blank control group.Forty⁃eight hours after the initial injection of LL⁃37,changes in skin lesions and the intensity of erythema were assessed.Skin tissues at the dorsal injection site were resected and subjected to HE staining,the tissue structure was observed and the number of inflammatory cells was counted.Enzyme⁃linked immunosorbent assay(ELISA)was performed to estimate the activity of myeloperoxidase(MPO)in skin lesions.ResultsThe model group showed obvious inflammatory reactions,and significantly increased erythema score(3.20 ± 0.84),inflammatory cell count(517.27 ± 99.43)and MPO activity(0.57 ± 0.08)compared with the blank control group(allP< 0.01).The positive control group showed significantly decreased erythema score(1.60 ± 0.89),inflammatory cell count(270.93 ± 124.63)and MPO activity(0.40 ± 0.05)compared with the model group(P< 0.05,0.01,0.01,respectively).Moreover,the erythema score,inflammatory cell counts and MPO activity were all significantly lower in 50⁃(1.80 ± 0.84,286.00 ± 33.72,0.43 ± 0.05,respectively)and 100⁃mg/kg artesunate groups(1.40±0.55,258.00±36.44,0.40±0.06,respectively)than in the model group(P<0.05 or 0.01).However,there were no significant differences in the erythema score,inflammatory cell count and MPO activity between 50⁃or 100⁃mg/kg artesunate group and the positive control group(P> 0.05).ConclusionArtesunate can inhibit rosacea⁃like inflammatory reactions in mouse models,especially the middle⁃and high⁃dose artesunate.
Rhinophyma;Artemisinins;Doxycycline;Cathelicidins;Disease models,animal;Artesunate;LL⁃37
胡阳,Email:huyang0620@163.com
10.3760/cma.j.issn.0412⁃4030.2017.09.007
上海市医学重点专科建设项目(ZK2012B18);上海市嘉定区医学重点学科建设项目(ZD06)
Fund programs:Shanghai Medical Key Subject Construction Project(ZK2012B18);Medical Key Subject Construction Project of Jiading District of Shanghai Municipality(ZD06)
2016⁃10⁃08)
(本文编辑:尚淑贤)

