黄色粘球菌基于复杂社会性细胞行为的生物被膜
王川东,王艳,郑悦,张坤梅,胡玮,施文元,李越中
1 山东大学 生命科学学院 微生物技术国家重点实验室,山东 济南 250100
2 加州大学洛杉矶分校 牙学院,美国 洛杉矶 CA90095
·环境生物技术·
黄色粘球菌基于复杂社会性细胞行为的生物被膜
王川东1,王艳1,郑悦1,张坤梅1,胡玮1,施文元2,李越中1
1 山东大学 生命科学学院 微生物技术国家重点实验室,山东 济南 250100
2 加州大学洛杉矶分校 牙学院,美国 洛杉矶 CA90095
黄色粘球菌具有多样化的细胞行为,具备典型多细胞水平的社会性特征。其形成的生物被膜是目前认知的最为复杂的单种群细菌生物被膜之一。黄色粘球菌的社会性细胞行为主导了其生物被膜形成过程中的关键环节,包括固体介质表面的细胞运动、群体细胞的捕食、亲缘细胞的识别、子实体的发育、粘孢子的分化以及细胞程序性死亡等行为过程。文中将介绍相关领域的研究进展。
黄色粘球菌,生物被膜,细胞行为,社会性
在自然或者人工培养条件下,细菌的细胞之间会互相聚集并被其自身分泌的大分子胞外基质(Extracellular matrix,ECM)包裹形成高度结构化和群落化的生物被膜(Biofilm)[1],该类结构可以附着在特定介质(Substratum)的表面或者以絮状结构(Flocs)悬浮于液体环境中[2]。越来越多的研究结果表明,作为细菌在自然环境中首选的生存方式,生物被膜已成为地球上分布最为广泛并且最为成功的生物生活模式[3];该模式无论是在内部细胞的群体属性、胞外基质的理化性质还是细胞间的相互作用等方面,均与以浮游生长(Planktonic growth)为代表的细菌自由生活(Free-living bacterial cells)模式存在着显著的差异[2-3]。胞外基质(ECM),也称为胞外聚合物(Extracellular polymeric substances),是构建和维持高度结构化和整合性的生物被膜的基本物质基础,主要由胞外多糖(Exopolysaccharides,EPS)、蛋白质、核酸和脂类等由细胞分泌或者渗漏到胞外的生物大分子构成[4]。ECM 可以介导细胞之间以及细胞与介质表面的粘附过程,同时提供紧密聚合的网状空间结构用以维持生物被膜的机械稳定性[3,5]。在生物被膜形成过程中,完成初始吸附的细菌细胞的生物学特性将发生明显的改变,尤其是在生理响应(Physiological responses)和发育动态(Developmental dynamics)等方面,细胞将启动有别于单细胞状态的另外一套基因表达策略[6];同时,细胞之间以合作共赢的方式进行交流、适应与整合,通过自身的社会性表型相互影响[7],使整个生物被膜结构转变成为群落化的“高等”生物。另外,自然条件下的生物被膜可以由单一种群构成,也可以由彼此邻近的不同种群共同构成。在多种群生物被膜(Multi-species biofilms)中,不同种类细胞之间通过交流协作与优势整合增强了整体应对突发事件的能力,形成了共生适应的进化方式[8],这一模式的广泛存在极大地增加了生物被膜相关研究的复杂性。
作为细菌应对不利环境(例如捕食者、营养匮乏、缺氧、干旱、高温和抗生素作用等)而进化出的一种自我保护式生存策略[9],生物被膜不仅对于细菌在自然条件下的存活至关重要,同时还对人类生活产生了广泛的影响。临床上的细菌耐药性感染[10]、食品加工及储存过程中的细菌污染[11]以及工业生产中的生物淤积[12]等问题很多都起源于细菌形成的难以根除的生物被膜;与此同时,在废水处理、生物修复、电力生产和生物过滤等过程中,细菌的生物被膜又发挥了不可替代的作用[13]。因此,对细菌生物被膜的研究具有重要的基础理论意义和广泛的应用价值。
粘细菌(Myxobacteria)是一类革兰氏阴性杆状细菌,属于变形菌门(Proteobacteria)的δ分支,由于其具有特殊的细胞行为(Cellular behaviors)[14]和多样的次级代谢特征[15]而受到科研工作者们的重视,被认为是一类由单细胞生物向多细胞生物过渡的高等原核生物类群[16]。粘细菌最初从土壤生境中分离得到,近期的分子生态学分析表明该类细菌在自然环境中广泛存在[17]。作为粘细菌的模式种群,黄色粘球菌Myxococcus xanthus能够行使多样化的单细胞和社会性的多细胞行为[18],并在此基础上形成目前认知的最为复杂的单种群细菌生物被膜之一[19-20],是研究生物被膜理想的模式材料。本文将介绍相关领域的研究进展。
1 黄色粘球菌构建生物被膜的基本过程
黄色粘球菌的复杂细胞行为存在于其生命周期的各个环节,参与甚至主导了生物被膜的形成过程。这些细胞行为大多具备多细胞水平的社会性特征,主要包括:在固体介质表面进行单细胞和群体细胞的运动过程[21];群体细胞的捕食(Predation)行为[22-23];亲缘细胞的识别能力[24];子实体(Fruiting body)的发育和抗逆性粘孢子(Myxospore)的分化过程[25];细胞的程序性死亡(Programmed cell death,PCD)现象[14,26]等。
黄色粘球菌生物被膜的形成过程十分复杂(图1),根据目前已有的研究结果可以描述为[16,27]:浮游状态下的细胞通过ECM完成在固体介质表面的稳定吸附,并由探险性运动(Adventurous motility,A-运动)和社会性运动(Social motility,S-运动)系统分别介导,在固体表面进行单细胞和群体细胞水平的运动,从而实现对于周围环境的探索和初始的有序聚集过程[28];在这一阶段,细胞群体可以采取“狼群战术”捕食其他微生物的活体细胞,从而为自身的生长和繁殖获取营养[29];在持续性的饥饿条件诱导下,黄色粘球菌可以识别自我细胞,并且利用运动能力使其发生大规模的聚集;同时上调胞外基质的合成能力,形成初始的生物被膜结构;如果缺少外源性钙离子,黄色粘球菌细胞将在固体介质表面形成带有多个凸起结构(Mound)的较为简单的非发育型生物被膜,也称为饥饿诱导的生物被膜,该结构的构成细胞呈现出均一性并且在形态上与营养细胞无明显区别;当外源性钙离子达到一定浓度(0.1−5mmol/L)时[30],黄色粘球菌将激活一系列的信号过程和发育调控途径,球状或嵴(Ridge)状聚集的细胞开始子实体形态构成(Morphogenesis)和分化过程[31-32];分泌并构建更加结构化的ECM,与部分细胞分化形成的“结构细胞”一起构建子实体的基本形态结构[33];在发育型生物被膜形成的中后期,大量的细胞发生自溶(Autolysis),其实质是细胞程序性死亡过程[26];少部分的细胞在子实体结构中发育形成休眠性的粘孢子;当环境条件适宜时,非发育型生物被膜可以发生解聚(Dispersal)使得细胞恢复浮游状态[34];同时,成熟的发育型生物被膜可以通过子实体的崩解释放粘孢子到环境中,从而进入下一个循环周期。这一过程中涉及了复杂的信号网络调控机制,例如单细胞对营养匮乏的感应以及应答、群体感应、双组分信号系统调节相关基因的转录等过程,从而实现了在时空维度上对黄色粘球菌生物被膜形成过程的严谨调控[35]。
2 黄色粘球菌生物被膜中高度结构化和组织化的胞外基质(ECM)
在黄色粘球菌的生物被膜中,ECM在菌体细胞表面和周围空间形成了一层厚厚的丝网状结构,介导了细胞之间的聚集、粘连以及细胞与固体表面之间的粘附作用,为生物被膜的聚集和整合性结构的形成提供物质基础[36]。黄色粘球菌的ECM主要是由胞外多糖(EPS)、蛋白质和胞外DNA(Extracellular DNA,eDNA)组成[16],并且通过这些大分子的复杂相互作用形成高度有序化和组织化的空间结构,这在其发育型生物被膜中表现得更为突出。
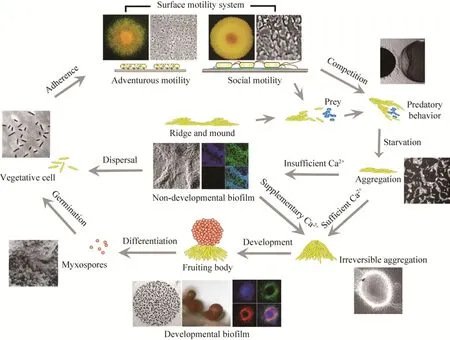
图1 黄色粘球菌构建复杂生物被膜的基本过程Fig.1 Basic process of establishing the intricate biofilms byMyxococcus xanthus.After adherence on the solid surface,M.xanthusvegetative cells employ adventurous and social motilities in coordinated efforts to explore the surrounding environment and accomplish various tasks of their complex life cycle.Competing with other microorganisms,M.xanthuscooperatively preys on microbial cells by collectively spreading over the prey and grows on the released nutrients.Under starvation conditions,M.xanthuscells initiate and undergo an intricate process culminating in the formation of biofilms.By controlling the concentration of Ca2+in submerged cultures, simple non-developmental starvation biofilms and highly-organized developmental biofilms ofM.xanthuscan both be cultivated.With insufficient Ca2+,M.xanthuscells aggregate into ridges and mounds to form the non-developmental biofilm, which is a reversible process.At high Ca2+concentration, cells execute a complex multicellular developmental program by forming fruiting bodies, and differentiating into dormant myxospores.When the environmental condition becomes favorable, the cells inside the non-developmental biofilm disperse into planktonic state, and the developmental biofilm releases the myxospores that germinate to produce new vegetative cells for the subsequent life cycle.
2.1 胞外多糖(EPS)
EPS是黄色粘球菌 ECM的关键组分,构成了生物被膜的基本骨架结构,其基本组成单糖包括甘露糖、半乳糖、氨基半乳糖、葡萄糖、氨基葡萄糖、鼠李糖和木糖等[37]。EPS的生物合成至少包括了单糖合成、单糖装配成多糖以及多糖转运到细胞表面等3个步骤,由合成基因簇(eps)和相关基因簇(eas)编码的糖基转移酶、葡聚糖酶和EPS转运蛋白同系物[38]参与完成。整个过程受到多个基因位点的严格调控,例如:趋化性操纵子dif系统[39]和frzS基因[40],编码运动蛋白的pilA基因[41],编码DnaK类似物的stkA[42]和sglK基因[43]等。
EPS在黄色粘球菌形成生物被膜的过程中发挥了重要的生物学功能。在细胞群体运动过程中,EPS为四型菌毛(Type Ⅳ pili,TFP)提供了锚定位点,触发TFP的收缩进而介导细胞运动[44],并对单细胞的运动模式产生深刻影响[45]。利用特异性荧光探针和激光共聚焦显微镜技术对EPS进行定位分析[46]发现,EPS在黄色粘球菌生物被膜的ECM内部形成了基本的脚手架结构[47]。能够显著影响细胞的粘附和聚集过程[4]。作为一种天然的生物吸附剂,EPS能够有效隔离大量的铅和银等重金属离子,从而避免细胞直接暴露在高浓度的有毒重金属环境中[48-49]。当影响EPS合成的关键基因缺失后,细胞的长期存活率和对不良环境因素(例如紫外照射和 SDS处理)的应激能力也会随之显著下降[50];同时,过量的EPS能够把细胞限制在高粘度的ECM团块中,从而减弱了细胞的生长和分裂能力,表明在黄色粘球菌的生物被膜形成过程中相对精密的EPS生物合成调控是有必要的[50]。
2.2 胞外蛋白
在黄色粘球菌的ECM中,胞外蛋白分子的含量可达45%左右[37],但是对其生物功能目前了解不多。在结构层面上,胞外蛋白更多的是作为EPS的附属分子存在,即使利用蛋白酶水解除去胞外蛋白后,黄色粘球菌依然能够形成相对完整的生物被膜。蛋白质组学分析确定了ECM中的41个蛋白组分,其中有20个是膜蛋白或胞内蛋白,剩余的21个被认为可能是专一性的胞外蛋白。有5个胞外蛋白的功能得到了鉴定,包括蛋白酶、氨基水解酶和粘孢子包被蛋白等[51]。除了编码 FibA金属蛋白酶的fibA基因以外,其他编码基因的失活并不影响黄色粘球菌发育型生物被膜的形成[52]。
2.3 胞外DNA(eDNA)
近年来的研究表明,eDNA积极参与了细菌生物被膜的形成和功能发挥过程,对维持生物被膜的整体稳定和抗逆性具有非常重要的作用[53]。虽然在一些细菌生物被膜中,eDNA可能独立存在于ECM的特定区域[54],更多的情况是eDNA与其他胞外大分子共同构建了复合型的ECM[55]。在黄色粘球菌的ECM 中也存在着数量可观的eDNA,并且这些DNA分子与EPS之间存在着特异性的相互作用,从而形成了强度更高的复合型网状结构,增加了ECM对机械清除和表面活性剂处理的抵抗能力,并为生物被膜履行各种生物功能提供了物质和结构基础[56]。随着在其他细菌类群生物被膜中获得相似的发现[57-58],eDNA-EPS之间的相互作用被认为广泛存在并成为DNA分子整合进入ECM结构中的主要介导作用,可以作为细菌生物被膜感染防治的重要靶点[59]。作为水平基因转移(Horizontal gene transfer,HGT)所需遗传物质的重要来源,在自然界微生物生境中 eDNA形成了一个动态的基因库,感受态细胞能够通过水平基因转移的方式获取其中的遗传物质[60]。在黄色粘球菌中,只有EPS缺失突变株可以发生质粒的自然转化,这不但使得黄色粘球菌成为变形菌门 δ分支中首个能够发生自然转化的细菌类群,还进一步提示了EPS作为一类胞外屏障可以通过与eDNA的相互作用而抑制DNA进入细胞的过程[61]。当然,关于eDNA-EPS之间相互作用的物化本质和调控过程的细节还有待进一步研究阐明。
3 黄色粘球菌的表面运动系统
运动能力是众多细菌在进化初期就形成的一种用于趋利避害的细胞行为,这对于它们在自然环境中的生长和存活至关重要。在初始的海洋环境中,基于鞭毛(Flagella)旋转的泳动(Swimming)行为在细菌运动中占了主导地位,但却不适用于高粘度的液体或者含水量较少的固体生境[62]。因此,在生物被膜形成过程中,实现细胞的有效聚集主要借助细胞在固体表面不依赖鞭毛的运动能力,例如铜绿假单胞菌Pseudomonas aeruginosa的颤动(Twitching motility)[63]。黄色粘球菌则进化出了在固体表面沿着其长轴方向迁移的两个相对独立的运动系统:介导细胞个体独立运动的探险性运动系统(A-运动)和介导细胞群体聚集及菌落扩展的群体性运动系统(S-运动)[28]。两个系统均通过Frz化学感应信号通路调控细胞运动过程中的方向反转(Reversal)而实现趋化性过程[64-65]。
A-运动系统可以驱动单个黄色粘球菌细胞在固体表面进行不依赖于细胞外附属性推进器的平滑运动,因而被认为是真正意义上的滑行运动(Gliding motility)[66]。关于A-运动的分子机制,存在着不同的理论模型[21],其中的焦点粘附模型(Focal adhesion model)[67]和螺旋转子模型(Helical rotor model)[68]获得了更多实验结果的支持。S-运动系统主要介导了黄色粘球菌细胞在固体表面的群体运动过程,在运动机制上与颤动系统非常类似[66]。Shi等提出的S-运动模型被广泛接受[44,69-70]:首先,细胞通过 TFP系统的两个ATP酶PilB和PilT催化位于单极的菌毛蛋白(Pilin)PilA的聚合和解聚,从而实现TFP蛋白细丝的延伸和收缩;胞外基质的EPS部分为TFP的收缩提供了一个特异性的锚定位点;进行S-运动时,细胞前导端伸出的TFP细丝抓住附近细胞产生的EPS并激发收缩,从而拉动细胞以粘-滑(Stick-slip)交替的方式前进;当细胞通过反转改变运动方向时,TFP的产生端在化学感应系统 Frz的调控下发生切换;同时,对于EPS的强烈依赖使得黄色粘球菌在固体表面进行S-运动时,细胞必须以群体方式进行。
黄色粘球菌同时拥有的两套相对独立的表面运动系统在细菌中是不常见的,它们在形成生物被膜过程中是否存在着功能分化是一个重要的科学问题。在相对坚硬、干燥的支持介质上,黄色粘球菌主要依赖于 A-运动系统驱动菌落(Swarm)外单个细胞的位移[71],其生物被膜的整体扩展能力和菌落外新聚集结构的形成能力受到明显抑制。在柔软、湿润的支持介质上,S-运动系统主导了黄色粘球菌细胞的群组化扩展[71],从而使得生物被膜的形成能力大大提高。在浸润于液体中的固体表面上,细胞完全吸附的要求使得 A-运动系统不再发挥作用,黄色粘球菌只使用S-运动系统驱动细胞的聚集和扩散[69];与此同时,部分细胞还可以摆脱对于EPS的依赖,进行单细胞水平的S-运动过程,从而实现对新环境的快速探索[72]。更为重要的是,S-运动过程中TFP-EPS的特异性相互作用可以对细胞的定位进行引导,使得细胞群体更有效地聚集从而形成初始的生物被膜结构[45,72]。在生物被膜内部,ECM在EPS的主导下可以形成蜂窝样的微管道结构,作为TFP结合和收缩的锚定位点,通过引导细胞的S-运动形成特定的ECM-细胞空间分布[73]。除了EPS以外,黄色粘球菌的S-运动也受到环二鸟苷酸(Bis-(3′-5′)-cyclic dimeric guanosine monophosphate,c-di-GMP)的调控。高浓度的c-di-GMP会减少pilA基因的转录并降低TFP的组装,从而抑制依赖于TFP的S-运动过程。这在一定程度上解释了成熟的生物被膜中,高细胞浓度的区域细胞运动减弱并且被膜结构趋于稳定的现象[74]。因此,独立存在并且协调运作的双运动系统使得黄色粘球菌在不同培养条件下能够有效聚集并形成生物被膜,显著提升了其对复杂自然环境的适应能力。
4 黄色粘球菌的群体捕食行为
黄色粘球菌是细菌中捕食类群的典型代表,可以把多种原核生物和少数高等的真核生物作为猎食目标[75]。当黄色粘球菌形成非发育型的生物被膜后,以“狼群战术”为策略的群体捕食过程变得更加高效[29]。处于生物被膜内部的细胞呈涟漪状(Ripple)进行群体扩展和搜寻,并保持与被捕食对象在细胞数量上的相对优势[76]。黄色粘球菌庞大的基因组能够编码产生丰富的降解酶和具有抗细/真菌活性的抗生素[77],通过外膜囊泡(Outer membrane vesicles)的包裹分泌到胞外[78],从而成为其在捕食过程中的有效武器。在生物被膜结构中,通过电镜观察,外膜囊泡的数量大大增加,并在胞外形成高度有序的囊泡链连接生物被膜内相邻的细胞[78]。在液体环境中,黄色粘球菌对于大肠杆菌的捕食呈现出细胞接触的依赖性,捕食者与猎物之间可以共同聚集形成悬浮于液体的特殊生物被膜。如果黄色粘球菌的EPS产生能力下降,无法形成生物被膜,其捕食大肠杆菌的能力也会大大减弱[79]。
5 黄色粘球菌亲缘识别与群体感应系统
在一般的培养条件下,黄色粘球菌极少与其他类群细菌形成混合的生物被膜,这可能取决于其扮演的捕食者角色。但是,即使是近缘的不同粘球菌或者黄色粘球菌的不同分离株也很难形成混合的生物被膜或者是复合的子实体结构。例如,将黄色粘球菌与变绿粘球菌Myxococcus virescens混合后,它们的细胞各自发生聚集并独立形成纯合的子实体,并且其中一个菌株的生孢率被一定程度地抑制[80]。随后的研究表明,在黄色粘球菌中可能存在多个进行自我/非我细胞的识别(Self/non-self recognition)机制,进而实现种群的领地化和生殖分割(Reproductive segregation)。对于非同类细胞,黄色粘球菌通常以抑制或者菌落不融合的策略将它们排除在自己形成的生物被膜之外[81],但这一过程的具体机制仍然未知。当黄色粘球菌发生突变丧失形成发育型生物被膜和粘孢子的能力后,极少数的突变株可以作为欺骗者(Cheater)坐享野生株间的细胞通讯和公共资源,获得接近原始状况下的生孢率[82]。当然,这种欺骗行为一旦蔓延开来有可能导致整个群体的衰退和灭亡。对于同类细胞,黄色粘球菌可以通过细胞间的物理性接触并在TraA/B系统介导下进行外膜层交换[83],实现各自私有资产的双向共享[84-85],这在同类细胞形成的生物被膜中可能是一个广泛进行的生物过程。
群体感应(Quorum sensing)系统在细菌生物被膜的形成和解聚过程中发挥了重要作用[86],但是人们对于黄色粘球菌中的群体感应系统知之甚少。在形成发育型生物被膜过程中,由多种特定浓度混合氨基酸构成的A-信号曾被认为可以作为群体感应的信号,但是后续的研究更多地证实了其作为饥饿诱导信号的功能[87],在细胞密度感知方面没有得到有力的证据支持。高丝氨酸内酯类(Acyl-homoserine lactones,AHLs)化合物是革兰氏阴性细菌常用的群体感应信号分子[88]。黄色粘细菌自身不合成AHLs,但是却能对邻近猎物细胞所释放的AHLs进行响应,刺激细胞的运动并加速向猎物细胞的入侵,整个群体的捕食能力也随之提高。同时,黄色粘球菌对 AHLs侧链的长度呈现出非线性依赖,说明对 AHLs的响应是由自身特异性信号转导所介导的而与AHLs自身物化性质无关[89]。
6 黄色粘球菌的分化发育
在持续性饥饿诱导并存在充足的外源性钙离子条件下,黄色粘球菌的非发育型生物被膜开始进入分化发育阶段,并最终形成发育型的子实体结构[33]。细胞进一步从四周开始向中央发生不可逆的聚集和互相堆积,形成圆顶状凸起;原始未分化的细胞堆中细胞有序地重排或成串排列,由ECM介导形成特定形状的子实体;柄和孢子囊壁等特殊结构组分逐渐形成;子实体内的细胞发生分化,大部分细胞在堆积过程中会进入 PCD过程,只有约5%的杆状营养细胞会完成分化形成的球形粘孢子;同时,大约占总数15%的细胞依然以杆状的形式围绕在子实体周围,这或许是黄色粘球菌为了在营养恢复时能够快速地利用营养和解聚生物被膜而进化出的应对策略[35]。在这一复杂的形态转变过程中,涉及多个信号调控系统。
从目前的结果来看,至少有A(asg)、B(bsg)、C(csg)、D(dsg)和E(esg)五类信号分子在黄色粘球菌分化发育过程中起到了核心作用[32]。A信号作为营养条件的感应信号,在细胞饥饿2 h后(发育早期)开始感知饥饿状态并可能调控细胞密度的感应。在A信号通路中,asgA基因编码的杂交传感激酶N端具有RR结构域,C端具有能够自磷酸化的HK结构域;asgB基因编码DNA结合蛋白;asgC基因编码的σ70(RpoD)同系物能够与(p)ppGpp互相作用。B信号通路的bsgA基因编码ATP依赖的蛋白酶,参与热激、营养枯竭等胁迫条件的应答,其突变体在细胞聚集和孢子形成方面存在缺陷,在饥饿后约2 h表现出早期发育的停滞。虽然 B信号的生化特征和受体蛋白目前尚不清楚,但是可以确定的是当B信号产生之后,A信号便开始在胞内累积,B信号同时参与了下游 C信号调控的多个过程。C信号在细胞饥饿6 h后开始应答,以剂量依赖的方式诱导细胞聚集、发育基因的表达和子实体的形成。与A信号类似,C信号需要严谨型反应的调控,并依赖于csgA基因编码的短链乙醇脱氢酶同源蛋白发挥功能。关于D信号的研究相对较少,但是dsg基因编码的翻译起始因子在发育过程中至关重要,其突变体在饥饿后5 h表现出发育的停滞。E信号的esg基因则编码支链酮酸脱氢酶,参与黄色粘球菌脂质/膜等多种不同代谢途径,相关突变体同样表现出早期发育的停滞[32]。
黄色粘球菌对于饥饿信号的严谨反应可导致(p)ppGpp的累积[35]并激活特定的双鸟苷酸环化酶,使得细胞内c-di-GMP水平显著提升,这对后续的发育过程至关重要。降低c-di-GMP的浓度会引起发育过程中的非自主性EPS累积缺陷,影响最终的子实体构建[90]。这些第二信使类分子可以进一步起始后续的由一系列相互关联的转录激活因子构建的基因调控网络(Gene regulatory networks,GRNs)[35]。在这一网络中,存在一个信号应答增强子结合蛋白(Signal-responsive enhancer-binding proteins,EBPs)级联系统和一个由转录因子 MrpC与FruA主导的对饥饿及短程C信号进行响应的级联系统。这两个系统在转录水平上相互交联,并且通过MrpC与FruA蛋白协同结合在多个启动子区域而实现信息集成(Signal integration)。为了保证多细胞分化发育过程的实现,黄色粘球菌进化出了一套独特的GRNs,比芽孢杆菌Bacillus和链霉菌Streptomyces生孢过程的GRNs更为复杂和高等。
形成富含抗逆性粘孢子的子实体是黄色粘球菌分化发育的终极目标,也是黄色粘球菌适应自然环境的一种生存策略。子实体的形成保证了黄色粘球菌在陆地环境中起始一个新的生命周期时所需的高细胞密度。但是,只有少数营养细胞能够最后分化形成粘孢子,大量的细胞在发育型生物被膜的形成后期发生了自溶现象,其实质是进行了PCD过程。据报道,在黄色粘球菌 DZF1菌株中,PCD过程是由MazF/MrpC毒素-抗毒素系统所介导。mazF基因编码的mRNA干扰酶能够特异性识别 ACA序列并对胞内mRNA进行切割,从而有效抑制细胞内蛋白的合成和细胞生长[26]。但是后续的研究表明,mazF基因并非参与了所有黄色粘球菌的PCD过程。例如,将mazF基因敲除后,黄色粘球菌DK1622菌株的PCD现象并没有消失,并且MazF只作为mRNA转录的负调控因子发挥功能[91]。
7 小结与展望
黄色粘球菌能够形成复杂的单种群细菌生物被膜以适应不同的外界环境条件,其复杂性不仅表现在生物被膜的结构、调控网络的构建和不同途径的选择等方面,更体现在驱动形成过程的各种细胞行为方面。细胞在群体水平上实现了亲缘识别、相互协作、分工分化以及异类竞争等不同功能,使得黄色粘球菌的细胞行为大多具备了多细胞水平的社会性特征,并与真核生物显示出很多相似性,成为一类“高等”的原核生物。将黄色粘球菌作为一个研究模式系统,不仅有利于进一步揭示细菌生物被膜所涉及的复杂分子机制,更有可能在进化水平深刻理解多细胞真核生物中协作性结构的发生与分化过程。
对于黄色粘球菌的生物被膜,尚有大量的具备重要科学意义的问题有待回答。在其生物被膜形成过程中,作为控制系统的GRNs需要进一步阐明,了解其中的一些关键节点和调控分子的作用机制,回答细胞怎样感知饥饿信号并进行放大、细胞如何决定其最终命运以及分化细胞如何进行行为协调等基础问题,从而将单细胞行为与多细胞的分化模式建立可靠的理论联系。同时,黄色粘球菌的众多细胞行为都呈现出接触依赖性(Contact-dependent manner),既包括细胞-细胞接触类行为,例如亲缘细胞识别、捕食行为和C信号传递等过程,又包括细胞-基质接触类行为,例如A-运动和细胞粘附等过程。因此,对于黄色粘球菌细胞外膜层及其附属结构的详细表征将有利于深入了解其生物被膜中发生的细胞沟通和社会性行为协调机制。最后,黄色粘球菌能够产生复合型的多功能性ECM,其中生物大分子之间的相互作用机理对于研究生物被膜形成尤为重要。例如:eDNA可能以一种物理有序的方式与 EPS紧密交织并相互作用,从而在ECM中遵循类似的构建和分布模式,但我们对这一作用的化学机制和两种大分子的结构构建过程了解不多;通过TFP-EPS相互作用引导的S-运动,黄色粘球菌可以实现生物被膜中的细胞聚集和定位,然而保证这一识别过程中的特异性分子基础依然未知。由于 EPS、eDNA和 TFP在多个能够形成生物被膜的病原细菌类群中广泛存在,相关的结果还可以为生物被膜感染的防治提供有价值的线索。
[1]Vert M, Doi Y, Hellwich KH, et al.Terminology for biorelated polymers and applications(IUPAC Recommendations2012).Pure Appl Chem,2012,84(2):377–410.
[2]Flemming HC, Wingender J, Szewzyk U, et al.Biofilms: an emergent form of bacterial life.Nat Rev Microbiol,2016,14(9):563–575.
[3]Stoodley P, Sauer K, Davies DG, et al.Biofilms as complex differentiated communities.Annu Rev Microbiol,2002,56(1):187–209.
[4]Sutherland I.Biofilm exopolysaccharides: a strong and sticky framework.Microbiology,2001,147(Pt1):3–9.
[5]Flemming HC, Wingender J.The biofilm matrix.Nat Rev Microbiol,2010,8(9):623–633.
[6]Bhinu VS.Insight into biofilm-associated microbial life.J Mol Microbiol Biotechnol,2005,10(1):15–21.
[7]Nadell CD, Drescher K, Foster KR.Spatial structure, cooperation and competition in biofilms.Nat Rev Microbiol,2016,14(9):589–600.
[8]Røder HL, Sørensen SJ, Burmølle M.Studying bacterial multispecies biofilms: where to start?Trends Microbiol,2016,24(6):503–513.
[9]de la Fuente-Núñez C, Reffuveille F, Fernández L,et al.Bacterial biofilm development as a multicellular adaptation: antibiotic resistance and new therapeutic strategies.Curr Opin Microbiol,2013,16(5):580–589.
[10]Römling U, Kjelleberg S, Normark S, et al.Microbial biofilm formation: a need to act.J Intern Med,2014,276(2):98–110.
[11]Srey S, Jahid IK, Ha SD.Biofilm formation in food industries: a food safety concern.Food Control,2013,31(2):572–585.
[12]Davidson I, Scianni C, Hewitt C, et al.Mini-review: assessing the drivers of ship biofouling management—aligning industry and biosecurity goals.Biofouling,2016,32(4):411–428.
[13]Azeredo J, Azevedo NF, Briandet R, et al.Critical review on biofilm methods.Crit Rev Microbiol,2017,43(3):313–351.
[14]Wrótniak-Drzewiecka W, Brzezińska AJ, Dahm H,et al.Current trends in myxobacteria research.AnnMicrobiol,2016,66(1):17–33.
[15]Herrmann J, Fayad AA, Müller R.Natural products from myxobacteria: novel metabolites and bioactivities.Nat Prod Rep,2017,34(2):135–160.
[16]Muñoz-Dorado J, Marcos-Torres FJ, García-Bravo E, et al.Myxobacteria: moving, killing, feeding,and surviving together.Front Microbiol,2016,7:781.
[17]Velicer GJ, Mendes-Soares H, Wielgoss S.Whence comes social diversity? Ecological and evolutionary analysis of the myxobacteria//Yang ZM, Higgs PI, Eds.Myxobacteria: Genomics,Cellular and Molecular Biology.Norfolk: Caister Academic Press,2014:1–29.
[18]Zhang Y, Ducret A, Shaevitz J, et al.From individual cell motility to collective behaviors:insights from a prokaryote,Myxococcus xanthus.FEMS Microbiol Rev,2012,36(1):149–164.
[19]O'Toole G, Kaplan HB, Kolter R.Biofilm formation as microbial development.Annu Rev Microbiol,2000,54(1):49–79.
[20]Kolenbrander PE, Jakubovis NS, Chalmer NI.Multispecies interactions and biofilm community development//Whitworth DE, Ed.Myxobacteria:Multicellularity and Differentiation.Washington,DC: ASM Press,2008:453–461.
[21]Nan BY, Zusman DR.Uncovering the mystery of gliding motility in the myxobacteria.Annu Rev Genet,2011,45(1):21–39.
[22]Berleman JE, Chumley T, Cheung P, et al.Rippling is a predatory behavior inMyxococcus xanthus.J Bacteriol,2006,188(16):5888–5895.
[23]Berleman JE, Scott J, Chumley T, et al.Predataxis behavior inMyxococcus xanthus.Proc Natl Acad Sci USA,2008,105(44):17127–17132.
[24]Rendueles O, Zee PC, Dinkelacker I, et al.Rapid and widespread de novo evolution of kin discrimination.Proc Natl Acad Sci USA,2015,112(29):9076–9081.
[25]Tzeng L, Singer M.DNA replication during sporulation inMyxococcus xanthusfruiting bodies.Proc Natl Acad Sci USA,2005,102(40):14428–14433.
[26]Nariya H, Inouye M.MazF, an mRNA interferase,mediates programmed cell death during multicellularMyxococcusdevelopment.Cell,2008,132(1):55–66.
[27]Diodati M, Gill R, Plamann L, et al.Initiation and early developmental events//Whitworth DE, Ed.Myxobacteria, Multicellularity and Differentiation.Washington, DC: ASM Press,2008:43–76.
[28]Mercier R, Mignot T.Regulations governing the multicellular lifestyle ofMyxococcus xanthus.Curr Opin Microbiol,2016,34:104–110.
[29]Berleman JE, Kirby JR.Deciphering the hunting strategy of a bacterial wolfpack.FEMS Microbiol Rev,2009,33(5):942–957.
[30]Kuner JM, Kaiser D.Fruiting body morphogenesis in submerged cultures ofMyxococcus xanthus.J Bacteriol,1982,151(1):458–461.
[31]Jelsbak L, Søgaard-Andersen L.Pattern formation:fruiting body morphogenesis inMyxococcus xanthus.Curr Opin Microbiol,2000,3(6):637–642.
[32]Bretl DJ, Kirby JR.Molecular mechanisms of signaling inMyxococcus xanthusdevelopment.J Mol Biol,2016,428(19):3805–3830.
[33]Kaiser D.Coupling cell movement to multicellular development in myxobacteria.Nat Rev Microbiol,2003,1(1):45–54.
[34]McDougald D, Rice SA, Barraud N, et al.Should we stay or should we go: mechanisms and ecological consequences for biofilm dispersal.Nat Rev Microbiol,2012,10(1):39–50.
[35]Kroos L.Highly signal-responsive gene regulatory network governingMyxococcusdevelopment.Trends Genet,2017,33(1):3–15.
[36]Konovalova A, Petters T, Søgaard-Andersen L.Extracellular biology ofMyxococcus xanthus.FEMS Microbiol Rev,2010,34(2):89–106.
[37]Behmlander RM, Dworkin M.Biochemical and structural analyses of the extracellular matrix fibrils ofMyxococcus xanthus.J Bacteriol,1994,176(20):6295–6303.
[38]Lu A, Cho K, Black WP, et al.Exopolysaccharide biosynthesis genes required for social motility inMyxococcus xanthus.Mol Microbiol,2005,55(1):206–220.
[39]Black WP, Schubot FD, Li Z, et al.Phosphorylation and dephosphorylation among Dif chemosensory proteins essential for exopolysaccharide regulation inMyxococcus xanthus.J Bacteriol,2010,192(17):4267–4274.
[40]Berleman JE, Vicente JJ, Davis AE, et al.FrzS regulates social motility inMyxococcus xanthusby controlling exopolysaccharide production.PLoS ONE,2011,6(8): e23920.
[41]Yang Z, Lux R, Hu W, et al.PilA localization affects extracellular polysaccharide production and fruiting body formation inMyxococcus xanthus.Mol Microbiol,2010,76(6):1500–1513.
[42]Moak PL, Black WP, Wallace RA, et al.The Hsp70-like StkA functions between T4P and Dif signaling proteins as a negative regulator of exopolysaccharide inMyxococcus xanthus.Peer J,2015,3: e747.
[43]Weimer RM, Creighton C, Stassinopoulos A, et al.A chaperone in the HSP70 family controls production of extracellular fibrils inMyxococcus xanthus.J Bacteriol,1998,180(20):5357–5368.
[44]Li Y, Sun H, Ma XY, et al.Extracellular polysaccharides mediate pilus retraction during social motility ofMyxococcus xanthus.Proc Natl Acad Sci USA,2003,100(9):5443–5448.
[45]Hu W, Gibiansky ML, Wang J, et al.Interplay between type Ⅳ pili activity and exopolysaccharides secretion controls motility patterns in single cells ofMyxococcus xanthus.Sci Rep,2016,6:17790.
[46]Hu W, Lux R, Shi WY.Analysis of exopolysaccharides inMyxococcus xanthususing confocal laser scanning microscopy//Delcour AH,Ed.Bacterial Cell Surfaces.Totowa, NJ: Humana Press,2013:121–131.
[47]Lux R, Li Y, Lu A, et al.Detailed three-dimensional analysis of structural features ofMyxococcus xanthusfruiting bodies using confocal laser scanning microscopy.Biofilms,2005,1(4):293–303.
[48]Merroun ML, ben Omar N, González-Muñoz MT,et al.Myxococcus xanthusbiomass as biosorbent for lead.J Appl Microbiol,1998,84(1):63–67.
[49]Merroun ML, ben Omar N, Alonso E, et al.Silver sorption toMyxococcusxanthusbiomass.Geomicrobiol J,2001,18(2):183–192.
[50]Hu W, Wang J, McHardy I, et al.Effects of exopolysaccharide production on liquid vegetative growth, stress survival, and stationary phase recovery inMyxococcus xanthus.J Microbiol,2012,50(2):241–248.
[51]Curtis PD, Atwood J Ⅲ, Orlando R, et al.Proteins associated with theMyxococcusxanthusextracellular matrix.J Bacteriol,2007,189(21):7634–7642.
[52]Kearns DB, Bonner PJ, Smith DR, et al.An extracellular matrix-associated zinc metalloprotease is required for dilauroyl phosphatidylethanolamine chemotactic excitation inMyxococcus xanthus.J Bacteriol,2002,184(6):1678–1684.
[53]Okshevsky M, Meyer RL.The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms.Crit Rev Microbiol,2015,41(3):341–352.
[54]Whitchurch CB, Tolker-Nielsen T, Ragas PC, et al.Extracellular DNA required for bacterial biofilm formation.Science,2002,295(5559):1487.
[55]Dragoš A, Kovács ÁT.The peculiar functions of the bacterial extracellular matrix.Trends Microbiol,2017,25(4):257–266.
[56]Hu W, Li L, Sharma S, et al.DNA builds and strengthens the extracellular matrix inMyxococcus xanthusbiofilms by interacting with exopolysaccharides.PLoS ONE,2012,7(12):e51905.
[57]Liao SM, Klein MI, Heim KP, et al.Streptococcus mutansextracellular DNA is upregulated during growth in biofilms, actively released via membrane vesicles, and influenced by components of the protein secretion machinery.J Bacteriol,2014,196(13):2355–2366.
[58]Jennings LK, Storek KM, Ledvina HE, et al.Pel is a cationic exopolysaccharide that cross-links extracellular DNA in thePseudomonas aeruginosabiofilm matrix.Proc Natl Acad Sci USA,2015,112(36):11353–11358.
[59]Okshevsky M, Regina VR, Meyer RL.Extracellular DNA as a target for biofilm control.Curr Opin Biotechnol,2015,33:73–80.
[60]Vlassov VV, Laktionov PP, Rykova EY.Extracellular nucleic acids.Bioessays,2007,29(7):654–667.
[61]Wang J, Hu W, Lux R, et al.Natural transformation ofMyxococcus xanthus.J Bacteriol,2011,193(9):2122–2132.
[62]Shi WY, Lux R.Focal adhesion: getting a grasp on myxobacterial gliding.Nat Chem Biol,2007,3(4):205–206.
[63]Burrows LL.Pseudomonas aeruginosatwitching motility: type Ⅳ pili in action.Annu Rev Microbiol,2012,66(1):493–520.
[64]Moine A, Agrebi R, Espinosa L, et al.Functional organization of a multimodular bacterial chemosensory apparatus.PLoS Genet,2014,10(3):e1004164.
[65]Guzzo M, Agrebi R, Espinosa L, et al.Evolution and design governing signal precision and amplification in a bacterial chemosensory pathway.PLoS Genet,2015,11(8): e1005460.
[66]Mauriello EMF, Mignot T, Yang ZM, et al.Gliding motility revisited: how do the myxobacteria move without flagella? Microbiol Mol Biol Rev,2010,74(2):229–249.
[67]Faure LM, Fiche JB, Espinosa L, et al.The mechanism of force transmission at bacterial focal adhesion complexes.Nature,2016,539(7630):530–535.
[68]Nan BY, McBride MJ, Chen J, et al.Bacteria that glide with helical tracks.Curr Biol,2014,24(4):R169–R173.
[69]Sun H, Zusman DR, Shi WY.Type Ⅳ pilus ofMyxococcus xanthusis a motility apparatus controlled by the frz chemosensory system.Curr Biol,2000,10(18):1143–1146.
[70]Gibiansky ML, Hu W, Dahmen KA, et al.Earthquake-like dynamics inMyxococcus xanthussocial motility.Proc Natl Acad Sci USA,2013,110(6):2330–2335.
[71]Shi W, Zusman DR.The two motility systems ofMyxococcus xanthusshow different selective advantages on various surfaces.Proc Natl Acad Sci USA,1993,90(8):3378–3382.
[72]Hu W, Hossain M, Lux R, et al.Exopolysaccharide-independent social motility ofMyxococcus xanthus.PLoS ONE,2011,6(1):e16102.
[73]Berleman JE, Zemla M, Remis JP, et al.Exopolysaccharide microchannels direct bacterial motility and organize multicellular behavior.ISME J,2016,10(11):2620–2632.
[74]Skotnicka D, Petters T, Heering J, et al.Cyclic di-GMP regulates type IV pilus-dependent motility inMyxococcus xanthus.J Bacteriol,2016,198(1):77–90.
[75]Keane R, Berleman J.The predatory life cycle ofMyxococcus xanthus.Microbiology,2016,162(1):1–11.
[76]Zhang HY, Vaksman Z, Litwin DB, et al.The mechanistic basis ofMyxococcus xanthusrippling behavior and its physiological role during predation.PLoS Comput Biol,2012,8(9):e1002715.
[77]Goldman BS, Nierman WC, Kaiser D, et al.Evolution of sensory complexity recorded in a myxobacterial genome.Proc Natl Acad Sci USA,2006,103(41):15200–15205.
[78]Berleman JE, Allen S, Danielewicz MA, et al.The lethal cargo ofMyxococcus xanthusouter membrane vesicles.Front Microbiol,2014,5:474.
[79]Pan HW, He XS, Lux R, et al.Killing ofEscherichia colibyMyxococcus xanthusin aqueous environments requires exopolysaccharidedependent physical contact.Microb Ecol,2013,66(3):630–638.
[80]Smith DR, Dworkin M.Territorial interactions between twoMyxococcusspecies.J Bacteriol,1994,176(4):1201–1205.
[81]Vos M, Velicer GJ.Social conflict in centimeter-and global-scale populations of the bacteriumMyxococcus xanthus.Curr Biol,2009,19(20):1763–1767.
[82]Velicer GJ, Kroos L, Lenski RE.Developmental cheating in the social bacteriumMyxococcus xanthus.Nature,2000,404(6778):598–601.
[83]Pathak DT, Wei XM, Bucuvalas A, et al.Cell contact-dependent outer membrane exchange in myxobacteria: genetic determinants and mechanism.PLoS Genet,2012,8(4): e1002626.
[84]Wei XM, Pathak DT, Wall D.Heterologous protein transfer within structured myxobacteria biofilms.Mol Microbiol,2011,81(2):315–326.
[85]Nudleman E, Wall D, Kaiser D.Cell-to-cell transfer of bacterial outer membrane lipoproteins.Science,2005,309(5731):125–127.
[86]Hong SH, Hegde M, Kim J, et al.Synthetic quorum-sensing circuit to control consortial biofilm formation and dispersal in a microfluidic device.Nat Commun,2012,3:613.
[87]Downard J, Ramaswamy SV, Kil KS.Identification of esg, a genetic locus involved in cell-cell signaling duringMyxococcus xanthusdevelopment.J Bacteriol,1993,175(24):7762–7770.
[88]Papenfort K, Bassler BL.Quorum sensing signal—response systems in Gram-negative bacteria.Nat Rev Microbiol,2016,14(9):576–588.
[89]Lloyd DG, Whitworth DE.The myxobacteriumMyxococcus xanthuscan sense and respond to the quorum signals secreted by potential prey organisms.Front Microbiol,2017,8:439.
[90]Skotnicka D, Smaldone GT, Petters T, et al.Aminimal threshold ofc-di-GMP is essential for fruiting body formation and sporulation inMyxococcus xanthus.PLoS Genet,2016,12(5):e1006080.
[91]Boynton TO, McMurry JL, Shimkets LJ.Characterization ofMyxococcus xanthusMazF and implications for a new point of regulation.Mol Microbiol,2013,87(6):1267–1276.
(本文责编 陈宏宇)
Biofilm formation dominated by sophisticated social behaviors inMyxococcus xanthus
Chuandong Wang1, Yan Wang1, Yue Zheng1, Kunmei Zhang1, Wei Hu1, Wenyuan Shi2,and Yuezhong Li1
1State Key Laboratory of Microbial Technology,School of Life Sciences,Shandong University,Jinan250100,Shandong,China
2School of Dentistry,University of California,Los Angeles,CA90095,USA
Myxococcus xanthusis a Gram-negative soil bacterium capable of performing sophisticated cellular behaviors and growing one of the most intricate bacterial single-species biofilms in nature.During the process of biofilm formation,social behaviors ofM.xanthuscells dominate key steps of the biofilm establishment,e.g., cellular motility on solid surface,predatory behavior by the grouped cells, kin recognition in the community, fruiting body development, myxospore differentiation, and programmed cell death.This review introduces the recent research progress about theM.xanthusbiofilms.
Myxococcus xanthus, biofilm, cellular behavior, sociality
May15,2017;Accepted:June27,2017
Wei Hu.Tel/Fax: +86-531-88364288; E-mail: hw_1@sdu.edu.cn

王川东, 王艳, 郑悦, 等.黄色粘球菌基于复杂社会性细胞行为的生物被膜.生物工程学报,2017,33(9):1582–1595.
Wang CD, Wang Y, Zheng Y, et al.Biofilm formation dominated by sophisticated social behaviors inMyxococcus xanthus.Chin J Biotech,2017,33(9):1582–1595.
Supported by:National Natural Science Foundation of China(Nos.31570065,31370110), China Postdoctoral Science Foundation Grant(No.2016M592177), Shandong Innovation and Transformation of Achievements Grant(No.2014ZZCX02601).
国家自然科学基金(Nos.31570065,31370110),中国博士后科学基金(No.2016M592177),山东省科技重大专项(No.2014ZZCX02601)资助。
时间:2017-08-04
http://kns.cnki.net/kcms/detail/11.1998.Q.20170804.1028.002.html
胡玮 山东大学生命科学学院教授,博士生导师,微生物技术国家重点实验室主任助理,中国微生物学会基础微生物学专业委员会委员。主要研究领域包括粘细菌细胞行为过程、生物膜构建、次级代谢产物和微生物肥料研发等。迄今已发表论文50余篇,其中SCI收录30多篇;参与撰写学术专著4部;申请专利28项,其中已有11项获得授权;多次受邀在本领域国际学术年会上作大会报告。主持国家863计划、国家自然基金面上项目以及山东省重大科技专项等科研课题8项,并与国内外的多个企业合作进行项目研究。

