玉米须黄酮利用肝癌细胞降糖实验研究
王秋实,李凤林
(1.吉林农业大学食品工程学院,长春130118;2.吉林农业科技学院食品工程学院,吉林132101)
玉米须黄酮利用肝癌细胞降糖实验研究
王秋实1,2,李凤林2※
(1.吉林农业大学食品工程学院,长春130118;2.吉林农业科技学院食品工程学院,吉林132101)
对肝癌HepG2细胞进行玉米须黄酮降糖实验的研究。通过提取得到的黄酮分别设置低、中、高浓度的剂量组以及阳性、模型和空白实验,通过细胞实验得到中高浓度的玉米须黄酮对葡萄糖和甘油三酯进行消耗来起到降糖作用,对葡萄糖-6-磷酸的分解起到抑制来达到降糖作用,对葡萄糖激酶分解葡萄糖起到促进来达到降糖作用。为缓解糖尿病奠定了基础。
黄酮;肝癌细胞;降糖
玉米须黄酮的提取工艺现阶段比较完善,然而玉米须黄酮具有许多功能价值有待于研究。当今最为常见的一种疾病应当属于糖尿病,糖尿病在全球的患病比例非常大,并且对其治疗也没有十分好的方法,本研究就针对降糖方面进行了细胞层次的实验,通过实验来验证玉米须黄酮对降糖的效果[1-4]。
1 材料与方法
1.1 实验材料
选取提取好的玉米须黄酮作为样品,并将其冷冻干燥成粉末,人肝癌细胞(HepG2)。
1.2 实验仪器
电子显微镜(SK2009H):赛克数码有限公司,酶标仪(SPECTRA MAX 190):上海普迪生物技术有限公司,CO2培养箱(BPN-50CH):赛德仪器有限公司。
1.3 实验方法
1.3.1 肝癌HepG2细胞的培养[5](1)肝癌HepG2细胞的复苏:从液氮罐中取出冻存的细胞冻存管,将其迅速放在37℃的水浴锅中,静止解冻1min,待完全溶解后,放入超净工作台中,将细胞悬液转移至灭菌好的离心管中,以1000r/min离心10min,弃去培养液,再向离心管中加入10mL新的培养液,将其制成细胞悬液后,将细胞放入37℃、5%CO2培养箱中培养24h,每天再同一时间换细胞培养液进行培养,并观察生长情况。(2)肝癌HepG2细胞的传代培养:将复苏培养好的细胞弃去培养液,向每个培养板的孔中加入2mL无钙、镁的PBS或HANKS溶液进行漂洗培养的贴壁肝癌HepG2细胞一次后弃去漂洗液。在每个培养孔中加入1mL胰蛋白酶进行消化,消化要在37℃条件下进行,轻轻摇动培养板,使细胞表面布满消化液,在显微镜下观察,当大约一半的细胞变圆时,加一定的完全培养液终止消化。用吸管反复吹洗每个培养板孔壁,吹洗时要慢,以免破坏细胞。然后以1100r/ min离心10min,弃去培养液,进行细胞计数。(3)肝癌HepG2细胞的冻存:先将细胞转移到冻存管中,将冻存管放入4℃冰箱中40min,然后转移到-20℃冰箱60min,置于-80℃冰箱中冷冻24h,最后可放入液氮罐中长期冻存。培养好肝癌HepG2细胞后,再分别加入黄酮,其浓度为100、200、500、1000µg/mL,进行培养,并且做空白、模型和阳性对照实验。
1.3.2 玉米须黄酮对肝癌HepG2细胞增殖的毒性研究利用MTT法研究玉米须黄酮对肝癌HepG2细胞增殖的影响,取密度为5.0×104个/mL,每个孔100µL的对数生长期肝癌HepG2细胞,接种至96孔培养板中,培养24h后,配制提取的黄酮浓度为0、5、10、20、40、80µg/mL的溶液,加入到96孔培养板中,每孔加入100µL,继续培养24h后,再向96孔培养板中加入10µLMTT,在37℃条件下培养4h,弃去上层培养液,向96孔培养板中加100µL DMSO,振摇10min,在450nm处用酶标仪测吸光度。实验时进行三组平行试验,结果取平均值。

1.3.3 肝癌HepG2细胞高糖模型的建立(1)胰岛素浓度对葡萄糖消耗量的影响:在培养的细胞中加入等量的葡萄糖进行培养,再向加葡萄糖培养的细胞中加入不同浓度的胰岛素,其中胰岛素浓度分别为:10-5、10-6、10-7、10-8、10-9mmol/L,继续进行培养,得到不同浓度对葡萄糖消耗的量。(2)胰岛素浓度对肝癌HepG2细胞存活率的影响:在相同数目的细胞培养板中分别加入不同浓度的胰岛素,其中胰岛素浓度分别为:10-5、10-6、10-7、10-8、10-9mmol/L,然后进行培养细胞,观察细胞的存活情况。
1.3.4 玉米须黄酮对肝癌HepG2细胞培养液中葡萄糖的影响首先将试剂盒中R1试剂和R2试剂等量混匀最为实验的工作液,在96孔板中分别加入1mL工作液,加入不同浓度培养细胞的培养液10µL,并做空白对照,加完培养液后混匀,在37℃水浴加热15min,待显色稳定后,利用酶标仪在450nm处测其吸光度值。
1.3.5 玉米须黄酮培养的肝癌HepG2细胞对甘油三酯(TG)的影响将培养好的细胞悬液取出,以1000r/min离心10min,弃去上清液,用pH为7的磷酸盐缓冲液清洗后,以以1000r/min离心10min,弃去上清液,加入0.3mLpH为7的磷酸盐缓冲液进行匀浆,在冰水浴条件下将细胞超声破碎30s备用。在96孔板中加入工作液250µL,再加入破碎好的细胞样品10µL,并做空白对照,在37℃恒温培养10min,利用酶标仪在450nm处测其吸光度值。
1.3.6 玉米须黄酮培养的肝癌HepG2细胞对葡萄糖-6-磷酸酶(G-6-Pase)的影响首先将试剂盒中孔板进行洗涤,每孔加满洗涤液,静置1min后甩尽孔内洗涤液,在滤纸上拍干,如此方法洗涤5次。在指定标准品孔内加不同浓度的标准品50µL,在样品指定孔中加入超声破碎的细胞样品10µL,再加样品稀释液40µL,并作空白对照。处空白外,向孔板中加入辣根过氧化物酶(HRP),标记的检测抗体100µL,用封板膜封住孔板,在37℃水域反应60min。弃去液体拍干后加入洗涤液,静置1min,弃去洗涤液,拍干,按此方法重复5次。每孔加入试剂盒底物A、B各50µL,37℃避光孵育15min。每孔加入终止液50µL,15min内利用酶标仪在450nm处测其吸光度值。
1.3.7 玉米须黄酮培养的肝癌HepG2细胞对葡萄糖激酶(GK)的影响首先将试剂盒中孔板进行洗涤,每孔加满洗涤液,静置1min后甩尽孔内洗涤液,在滤纸上拍干,如此方法洗涤5次。在指定标准品孔内加不同浓度的标准品50µL,在样品指定孔中加入超声破碎的细胞样品10µL,再加样品稀释液40µL,并作空白对照。处空白外,向孔板中加入辣根过氧化物酶(HRP),标记的检测抗体100µL,用封板膜封住孔板,在37℃水域反应60min。弃去液体拍干后加入洗涤液,静置1min,弃去洗涤液,拍干,按此方法重复5次。每孔加入试剂盒底物A、B各50µL,37℃避光孵育15min。每孔加入终止液50µL,15min内利用酶标仪在450nm处测其吸光度值。
2 结果与分析
2.1 玉米须黄酮对肝癌HepG2细胞毒性实验验证结果见图1。
由图1可知,经过玉米须黄酮培养过的细胞的细胞活力较好,没有对肝癌HepG2细胞的增殖造成抑制的作用,所以可以用玉米须黄酮培养肝癌HepG2细胞进行降糖实验的研究。
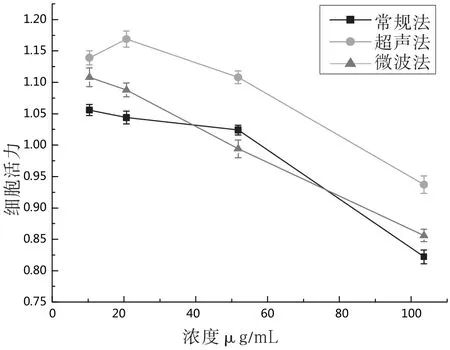
图1 不同方法提取的黄酮对细胞活力的影响
2.2 肝癌HepG2细胞高糖模型建立的结果
胰岛素浓度对葡萄糖消耗量的影响结果见图2,胰岛素浓度对肝癌HepG2细胞存活率的影响见图3。
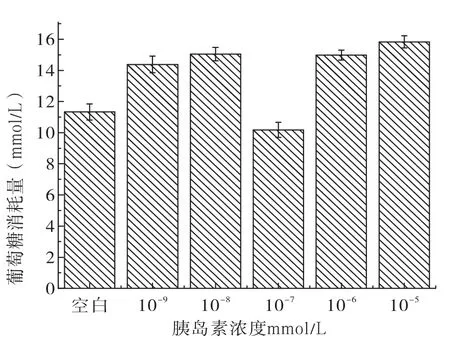
图2 胰岛素浓度对葡萄糖消耗量的影响
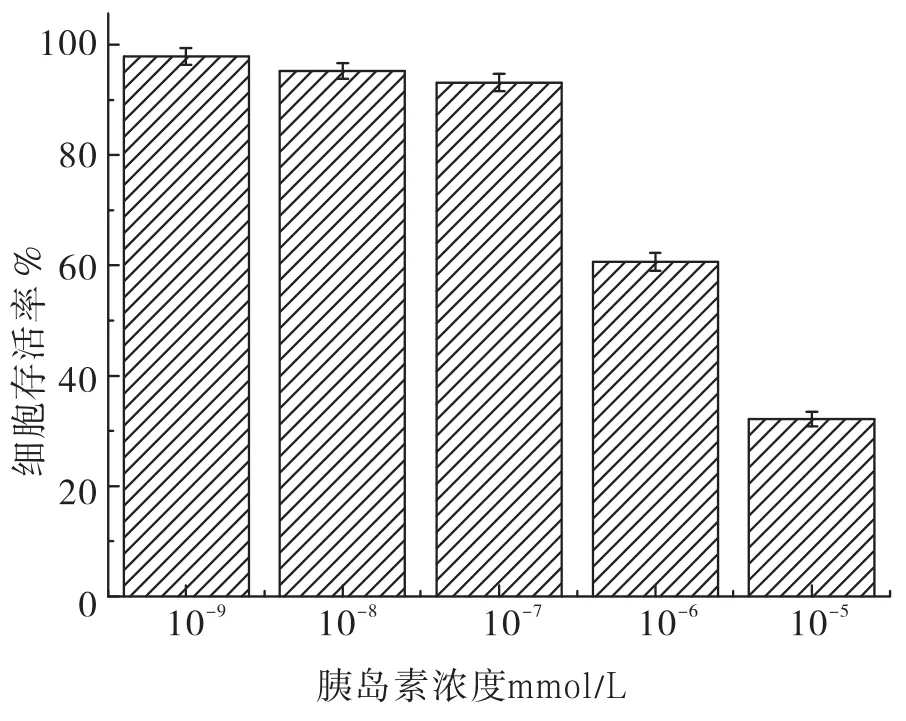
图3 胰岛素浓度对肝癌HepG2细胞存活率的影响
由图2、图3可知,葡萄糖的消耗量随着胰岛素浓度的变化,在10-7mmol/L时,葡萄糖的消耗量最少,而肝癌HepG2细胞存活率是随着胰岛素浓度的增加而降低,由此选择了最佳的胰岛素浓度10-7mmol/L进行建立高糖细胞模型。
2.3 玉米须黄酮对肝癌HepG2细胞培养液中葡萄糖的实验见图4。
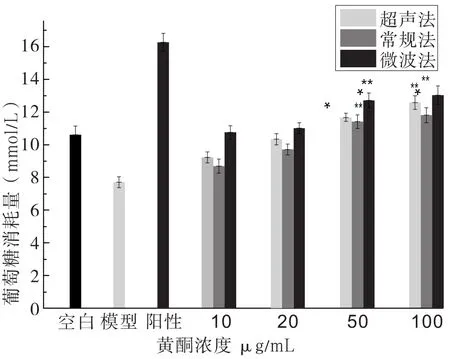
图4 玉米须黄酮对肝癌HepG2细胞培养液中葡萄糖消耗量的影响
通过测细胞培养液中葡萄糖的消耗量来判断降糖效果,其中细胞培养液中的葡萄糖消耗量越多,则细胞降糖效果越好。其中常规法提取的黄酮对细胞培养液中葡萄糖消耗量是随着黄酮浓度的升高呈现上升的趋势,通过显著性差异分析,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为100µg/mL时,葡萄糖消耗量显著(P<0.05)。超声波辅助法提取的黄酮对细胞培养液中葡萄糖消耗量是随着黄酮浓度的升高呈现上升的趋势,通过显著性差异分析,在黄酮浓度为50µg/mL和100µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为50µg/mL时,葡萄糖消耗量显著(P<0.05)。微波法提取的黄酮对细胞培养液中葡萄糖消耗量是随着黄酮浓度的升高,在黄酮浓度从20µg/mL增加到50µg/mL之间葡萄糖消耗量明显增加,当黄酮浓度再增加到100µg/mL时,葡萄糖消耗量呈现平缓趋势,那么在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为100µg/mL时,葡萄糖消耗量显著(P<0.05)。通过三种方法相比较得到,葡萄糖消耗量:微波法>超声波法>常规法,即降糖效果:微波法>超声波法>常规法。
2.4 玉米须黄酮培养的肝癌HepG2细胞对甘油三酯(TG)的实验见图5。
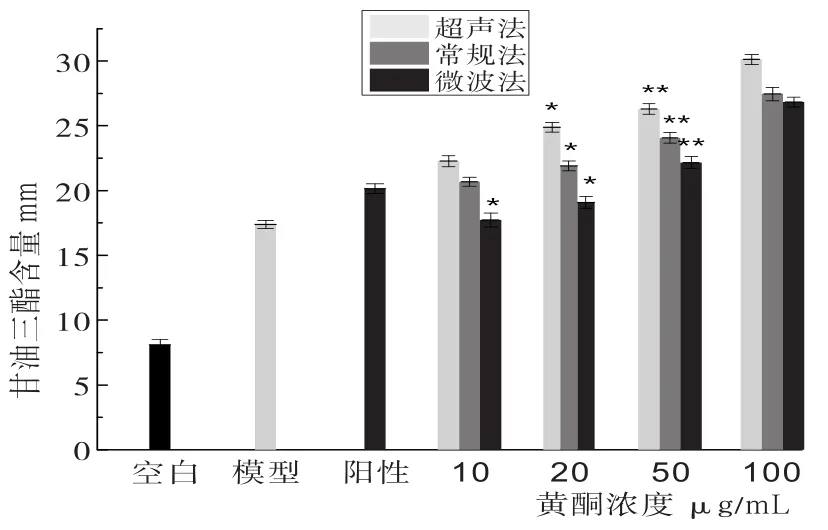
图5 玉米须黄酮培养的肝癌HepG2细胞对甘油三酯(TG)的影响
将培养的肝癌HepG2细胞破碎处理后,测定肝癌HepG2细胞对甘油三酯分解能力,其中细胞对甘油三酯消耗的越多,对葡萄糖消耗量就会减少。所以甘油三酯含量越少降糖效果越显著。其中常规法提取的黄酮培养细胞分解甘油三酯的能力随着黄酮浓度的增加呈现平缓上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为20µg/mL时,葡萄糖消耗量显著(P<0.05)。超声波法提取的黄酮培养细胞分解甘油三酯的能力随着黄酮浓度的增加呈现平缓上升的趋势,但在50µg/mL~100µg/mL时,甘油三酯的消耗量明显增加,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为10µg/mL和20µg/mL时,葡萄糖消耗量显著(P<0.05)。微波法提取的黄酮培养细胞分解甘油三酯的能力随着黄酮浓度的增加呈现平缓上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为20µg/mL时,葡萄糖消耗量显著(P<0.05)。通过三种方法相比较,得到分解甘油三酯的能力为:微波法<常规法<超声波法,即降糖效果:微波法>常规法>超声波法。
2.5 玉米须黄酮培养的肝癌HepG2细胞对葡萄糖-6-磷酸酶(G-6-Pase)的实验见图6。
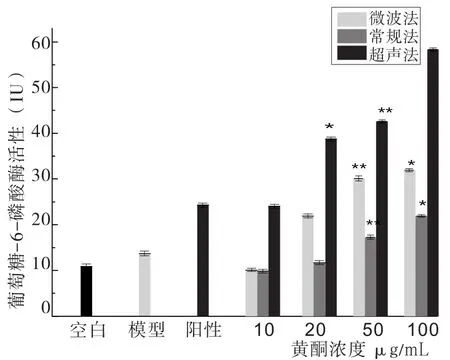
图6 玉米须黄酮培养的肝癌HepG2细胞对葡萄糖-6-磷酸酶(G-6-Pase)的影响
将培养的肝癌HepG2细胞破碎处理后,测定肝癌HepG2细胞对葡萄糖-6-磷酸酶的酶活力大小,因为葡萄糖-6-磷酸酶对葡萄糖-6-磷酸具有分解作用,导致产生葡萄糖,所以其酶活力越低降糖效果越好。其中常规法提取的黄酮培养细胞对葡萄糖-6-磷酸酶的酶活力大小随着黄酮浓度的增加呈现平缓上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为100µg/mL时,葡萄糖消耗量显著(P<0.05)。超声波法提取的黄酮培养细胞对葡萄糖-6-磷酸酶的酶活力大小随着黄酮浓度的增加呈现上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为20µg/mL时,葡萄糖消耗量显著(P<0.05)。微波法提取的黄酮培养细胞对葡萄糖-6-磷酸酶的酶活力大小随着黄酮浓度的增加呈现上升的趋势,在黄酮浓度为50µg/mL~100µg/mL之间葡萄糖-6-磷酸酶的活力增长十分平缓,基本接近停止增长,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为100µg/mL时,葡萄糖消耗量显著(P<0.05)。通过三种方法相比较,得到葡萄糖-6-磷酸酶的酶活力大小为:常规法<微波法<超声波法,即降糖效果:常规法>微波法>超声波法。
2.6 玉米须黄酮培养的肝癌HepG2细胞对葡萄糖激酶(GK)的实验见图7。
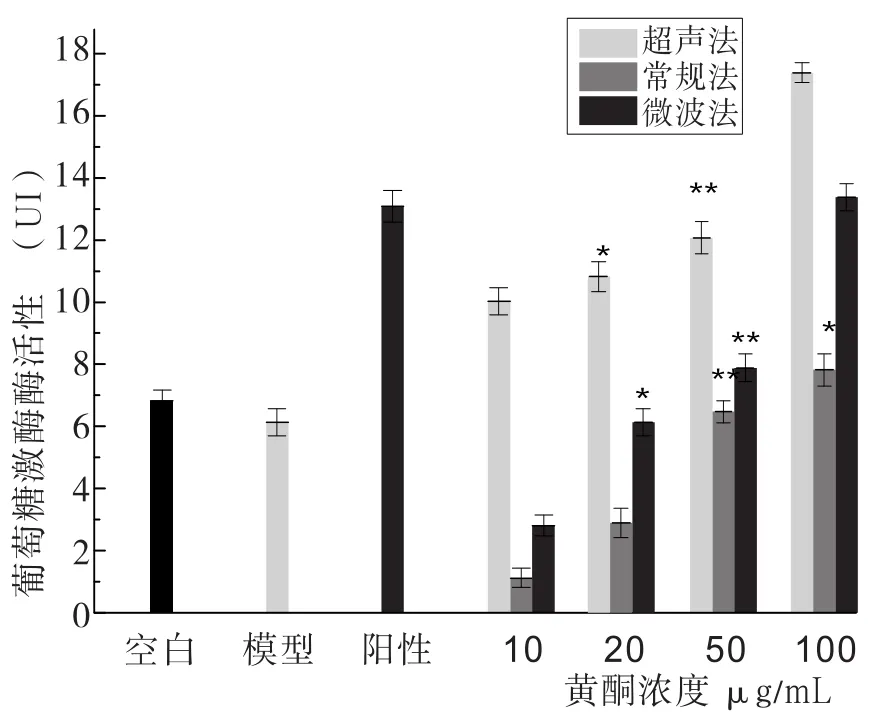
图7 玉米须黄酮培养的肝癌HepG2细胞对葡萄糖激酶(GK)的影响
将培养的肝癌HepG2细胞破碎处理后,测定肝癌HepG2细胞对葡萄糖激酶的酶活力大小,因为葡萄糖激酶对葡萄糖具有分解作用,所以其酶活力越高降糖效果越好。其中常规法提取的黄酮培养细胞对葡萄糖激酶的酶活力大小随着黄酮浓度的增加呈现上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为100µg/mL时,葡萄糖消耗量显著(P<0.05)。超声波法提取的黄酮培养细胞对葡萄糖激酶的酶活力大小随着黄酮浓度的增加呈现上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为20µg/mL时,葡萄糖消耗量显著(P<0.05)。微波法提取的黄酮培养细胞对葡萄糖激酶的酶活力大小随着黄酮浓度的增加呈现上升的趋势,在黄酮浓度为50µg/mL时,葡萄糖消耗量极显著(P<0.01),在黄酮浓度为20µg/mL时,葡萄糖消耗量显著(P<0.05)。通过三种方法相比较,得到对葡萄糖激酶的酶活力的大小为:超声波法>微波法>常规法,即降糖效果:超声波法>微波法>常规法。
3 结论
通过玉米须黄酮培养肝癌HepG2细胞,对培养液中葡萄糖的消耗量、细胞对甘油三酯(TG)、葡萄糖-6-磷酸酶(G-6-Pase)、葡萄糖激酶(GK)的作用影响,反应出玉米须黄酮的降糖消耗比较明显,并且每种方法提取的黄酮对各个指标的影响也不完全相同。其中培养液中葡萄糖的影响,通过测细胞培养液中葡萄糖的消耗量得出:微波法>超声波法>常规法,即降糖效果:微波法>超声波法>常规法;甘油三酯(TG)的影响,通过测破碎后细胞对甘油三酯试剂盒中含量得出:微波法<常规法<超声波法,即降糖效果:微波法>常规法>超声波法;葡萄糖-6-磷酸酶(G-6-Pase)的影响,通过测破碎后细胞对葡萄糖-6-磷酸酶的酶活力得出:常规法<微波法<超声波法,即降糖效果:常规法>微波法>超声波法;葡萄糖激酶(GK)的影响,通过测破碎后细胞对葡萄糖激酶的酶活力得出:超声波法>微波法>常规法,即降糖效果:超声波法>微波法>常规法。虽然每种方法的降糖效果有所不同,但每种方法的降糖效果都比较显著。
[1] Ebrahimzadeh M A,Pourmorad F,Hafezi S.Antioxidant activities of Iranian corn silk[J].Turkish Journal of Biology,2008,32(1):43-49.
[2] Maksimovic Z,MalencicD,Kovacevic N.Polyphenol contents and antioxidant antivity of Maydis stigma extracts[J].Bioresource Technology,2005,96(8):873-877.
[3] Halbwrith H,Martens S,Wienand U,et al.Biochemical formation of anthocyanins in silk tissue of Zea mays[J].Plant Science,2003,16(4):489-495.
[4] Kuo S.M..Antiproliferative potency of sruturally distinct dietary flavonoids on human colon cancer cells[J].Nutrition Program,1996,110:41-48.
[5] Ghazali R.A.,Waring R.H..The effects of flavonoids on human phenolsulphotransferases:potentialindrugmrtabolismand chemoprevention[J].Life Sciences,1999,65(16):1625-1632.
[6] 林董,何爱明,吴丽萍,等.MTT法测定8种中草药体外肝癌细胞SMMC-7721活性[J].安徽农业科技,2009,37(34):17264-17266.
Study on Hypoglycemic Effect of Corn Flavonoids on Hepatocellular Carcinoma Cells
WANG Qiushi1,2,LI Fenglin2
(1.Jilin Agriculture University School of Food Engineering,Changchun 130118;2.Jilin Agricultural Science and Technology University School of Food Engineering,Jilin 132101)
Study on Hypoglycemic Effect of Corn Flavonoids on HepG2 Cells.The low level,medium and high concentration of the flavonoids were set up by the extracted flavonoids,and the positive,the model and the blank experiment were carried out.The medium and high concentration of cornflavonoids were used to induce glucose and triglycerides to be hypoglycemic.The decomposition of glucose-6-phosphate to play a role in the inhibition of hypoglycemic action,the glucose kinase decomposition of glucose play a role in promoting hypoglycemic effect.Lay the foundation for the alleviation of diabetes.
Flavonoids;hepatoma cells;hypoglycemic
R285
A
2017-04-23
吉林农业科技学院2014年种子基金
王秋实(1993-),男,吉林省四平市人,吉林农业科技学院2015级食品加工与安全专业硕士研究生。
※为本文通讯作者
责任编辑:建德锋

