维持性血液透析患者心血管钙化进展的相关影响因素分析
陈佩玲 龚德华 徐 斌 何群鹏 周敏林 章海涛 刘志红
·论著·
维持性血液透析患者心血管钙化进展的相关影响因素分析
陈佩玲 龚德华 徐 斌 何群鹏 周敏林 章海涛 刘志红
目的:探讨维持性血液透析(MHD)患者心血管钙化进展的影响因素。 方法:选择MHD>6月的患者104例,完善相关实验室检查,胸部螺旋CT检测冠状动脉钙化评分(CACS,Agston法),腹部侧位平片检测腹主动脉钙化评分(AACS,Kauppila法),心脏超声检测心脏瓣膜钙化情况。随访观察3年,探讨心血管钙化进展情况及其影响因素。 结果:随访基线时钙化总阳性率为69.23%,随访3年后钙化总阳性率升至81.18%,CACS、AACS、心脏瓣膜钙化均较基线明显加重。Logistic回归分析显示舒张早期和舒张晚期二尖瓣口最大血液速度之比(E/A值)、时间平均血磷、时间平均钙磷乘积、基线CACS、碳酸钙的使用均是CACS进展的独立危险因素(P<0.05)。研究期间17例(16.34%)患者死亡,因心脑血管疾病死亡患者基线钙化情况更为严重。 结论:MHD患者心血管钙化发生率高,且随透析时间延长逐年加重,临床血磷、钙磷乘积等指标控制达标情况及基线CAC等均影响远期CAC进展。
维持性血液透析 心血管钙化 影响因素
心血管疾病(CVD)是慢性肾脏病(CKD)的主要死亡原因,占终末期肾病(ESRD)患者死亡原因的50%以上[1],血管钙化患病率随着CKD的进展而增加,CKD 3期为40%,CKD 5D期增至80%~90%[2],是公认的ESRD患者CVD的主要病因,尤以冠状动脉钙化(CAC)最常见,被认为是严重心血管病变的标志之一,是心血管事件的强有力的预测因子。本研究是一项单中心、前瞻性、观察性研究,对维持性血液透析(MHD)患者进行了长达3年的随访,观察心血管钙化进展情况,分析钙化进展的影响因素与远期预后。
对象和方法
研究对象选择2013年6月至9月在南京总医院国家肾脏疾病临床医学研究中心治疗>6个月的成年(18~75岁)MHD患者,预计生存期>6个月。排除甲状腺切除术后、心律失常、多发性骨髓瘤、淀粉样变性、冠状动脉支架植入、截肢、严重的周围血管病变、恶性肿瘤或合并严重感染者等。透析方案为3次/周,4 h/次,透析液钙浓度1.5 mmol/L,血流量200~300 ml/min,透析液流量500 ml/min。本研究经本院伦理委员会审核通过,所有研究对象均签署知情同意书。
研究方法
基线数据收集 记录患者性别、年龄、透析龄、吸烟史、饮酒史及钙磷代谢用药情况。透析次日早晨测量体重、腹围、血压;抽空腹血查血常规、肝功能、生化、血脂、超敏C反应蛋白(hs-CRP)、铁蛋白、同型半胱氨酸、血清全段甲状旁腺激素(iPTH)、25羟维生素D[25(OH)D];记录透析前后尿素,计算透析充分性。降压治疗的靶目标为血压<140/90 mmHg,根据KDIGO指南使用调节钙磷的药物。
影像学检查 于透析次日行胸部螺旋CT平扫,并采用Siemens CaScoring钙化积分软件得到冠状动脉钙化积分(CACS,Agaston评分)[3];拍摄腹部侧位平片,采用Kauppila法得到腹主动脉钙化积分(AACS)[4];行心脏彩超检查,在主动脉瓣、二尖瓣尖部或二尖瓣环发现>1 mm的强回声,定义为心脏瓣膜钙化,并测量左心室射血分数、舒张早期和舒张晚期二尖瓣口最大血流速度之比(E/A)、左心室心肌质量指数。
随访 所有患者每半年规律检测血钙、磷、iPTH,每年检测25(OH)D和成纤维细胞生长因子23(FGF-23),并依据检测结果调整患者药物。3年后复查冠状动脉CT、腹部侧位片、心脏超声,并再次评估患者CACS、AACS、心脏瓣膜钙化情况。
相关计算公式和定义 随访血清学指标包括钙、磷、钙磷乘积(Ca×P)、iPTH、25(OH)D及lgFGF-23(FGF-23数据变异度大,将其转换为lgFGF-23),采用随访水平曲线下面积除以总随访时间得到平均时间血清水平,分别为TA-Ca、TA-P、TA-Ca×P、TA-iPTH、TA-25(OH)D及TA-lgFGF-23。
校正钙(mg/dl)=血钙(mg/dl)+0.8×[4-血清白蛋白(g/dl)]
CACS进展定义为第3年CACS较基线数值升高超过30或升高10%以上[5]。CAC轻中度钙化定义为CACS 0~400;CAC重度钙化定义为CACS>400[6]。
统计学分析采用SPSS 24.0软件进行统计学分析。正态分布计量资料以均数±标准差表示,偏态分布资料以中位数(四分位间距)表示。计数资料的组间比较采用χ2检验或Fisher精确检验,等级资料多组间的比较采用Kmskal-wallis H检验。Logistic回归单变量分析的入选标准为P≤0.25,多变量回归设定入选变量α=0.05,剔除变量α=0.10。P<0.05为差异有统计学意义。
结 果
患者一般资料共入组104例患者,其中男性 66例(63.46%),女性 38例(36.54%),平均年龄 50.57±12.87岁(19~75岁),平均透析龄6.37±5.97年。原发病为慢性肾小球肾炎37例(35.58%)、IgA肾病7例(6.73%)、高血压肾损害8例(7.69%)、糖尿病肾病10例(9.62%)、多囊肾4例(3.85%)、尿酸性肾病2例(1.92%)、狼疮性肾炎4例(3.85%)、ANCA相关性血管炎1例(0.96%),Alport综合征1例(0.96%)及病因不明30例(28.85%)。
随访情况随访3年期间死亡17例,1例行肾移植,1例转异地透析,共85例患者完成了随访并纳入后续分析。本组患者TA-Ca>2.5 mmol/L比例为11.76%,TA-P>1.78 mmol/L的比例为40%,TA-iPTH>600 pg/ml比例为36.47%。使用碳酸钙降磷治疗比例为58.82%,11.76%使用碳酸镧降磷;控制iPTH使用骨化三醇比例为87.06%,西那卡塞比例为12.94%,同时使用骨化三醇和西那卡塞比例为9.41%,两者均未使用者比例为9.41%(表1)。
影像学检查结果显示,基线钙化总发生率为69.23%,3年后升高至81.18%。CAC、AAC及心脏瓣膜钙化的发生率均较基线有明显升高。其中三个部位均发生钙化的患者比例从25.96%升至31.76%(表2)。
影响CAC进展危险因素分析完成3年随访的85例患者中,CACS未进展36例,进展49例(表3)。进展与未进展者基线透析充分性、基线E/A、基线CACS、TA-Ca×P、TA-P、TA-lgiPTH、TA-lgFGF-23、基线低密度脂蛋白、西那卡塞、碳酸钙服用情况均存在统计学差异(表3)。
以随访CACS是否进展为因变量进行多变量Logistic回归分析,选择P≤0.25的指标用逐步回归法建立模型,结果显示基线E/A值、TA-P、TA-Ca×P、基线CACS、碳酸钙的使用均是CACS进展的独立危险因素(P<0.05)(表4)。
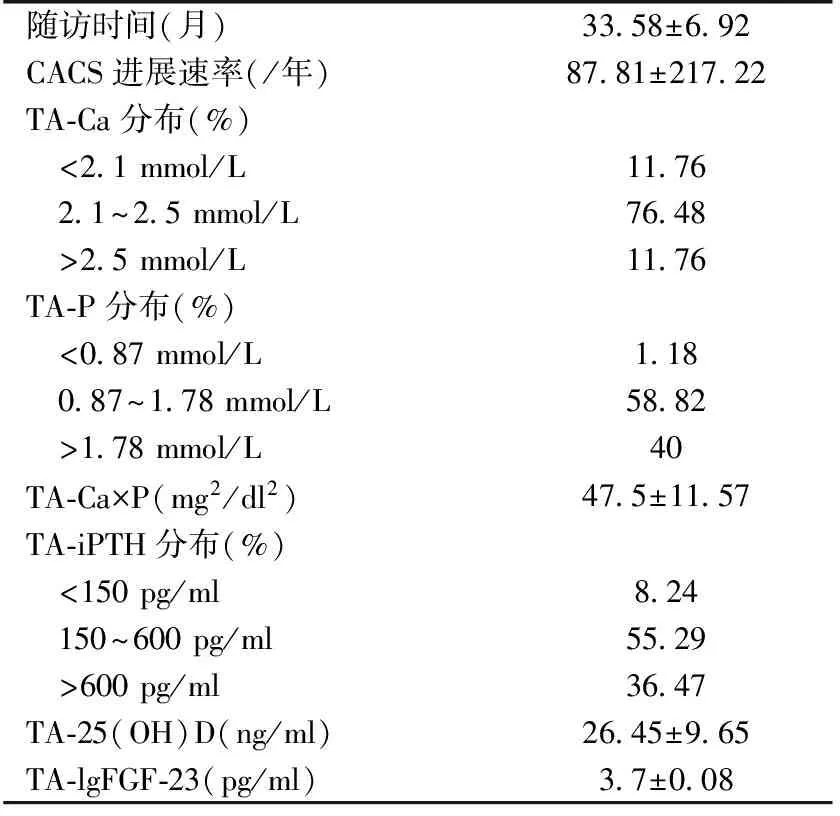
表1 所有维持性血液透析患者随访情况
CACS:冠状动脉钙化积分;TA-Ca:时间平均血钙;TA-P:时间平均血磷;TA-Ca×P:时间平均钙磷乘积;TA-lgiPTH:时间平均全段甲状旁腺激素的对数;TA-25(OH)D:时间平均25羟维生素D;TA-lgFGF-23:时间平均成纤维细胞生长因子的对数
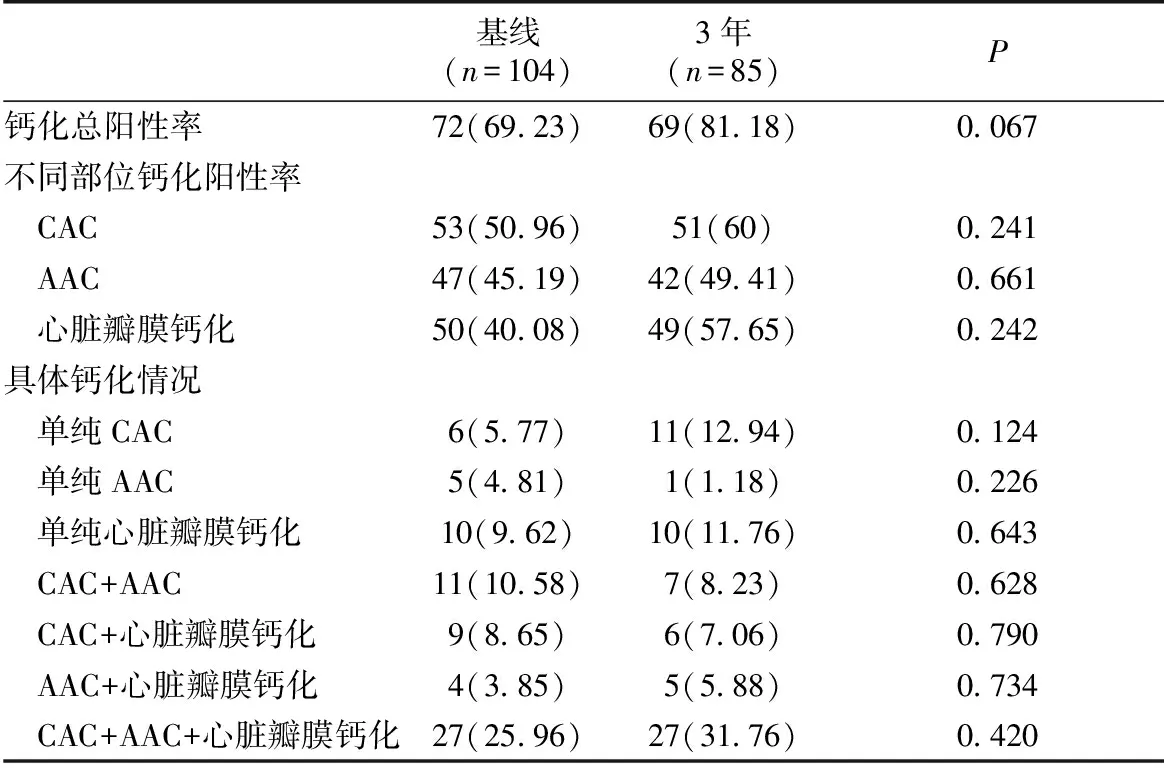
表2 MHD患者随访3年心血管钙化分布变化情况[n(%)]
MHD:维持性血液透析;CAC:冠状动脉钙化;AAC:腹主动脉钙化
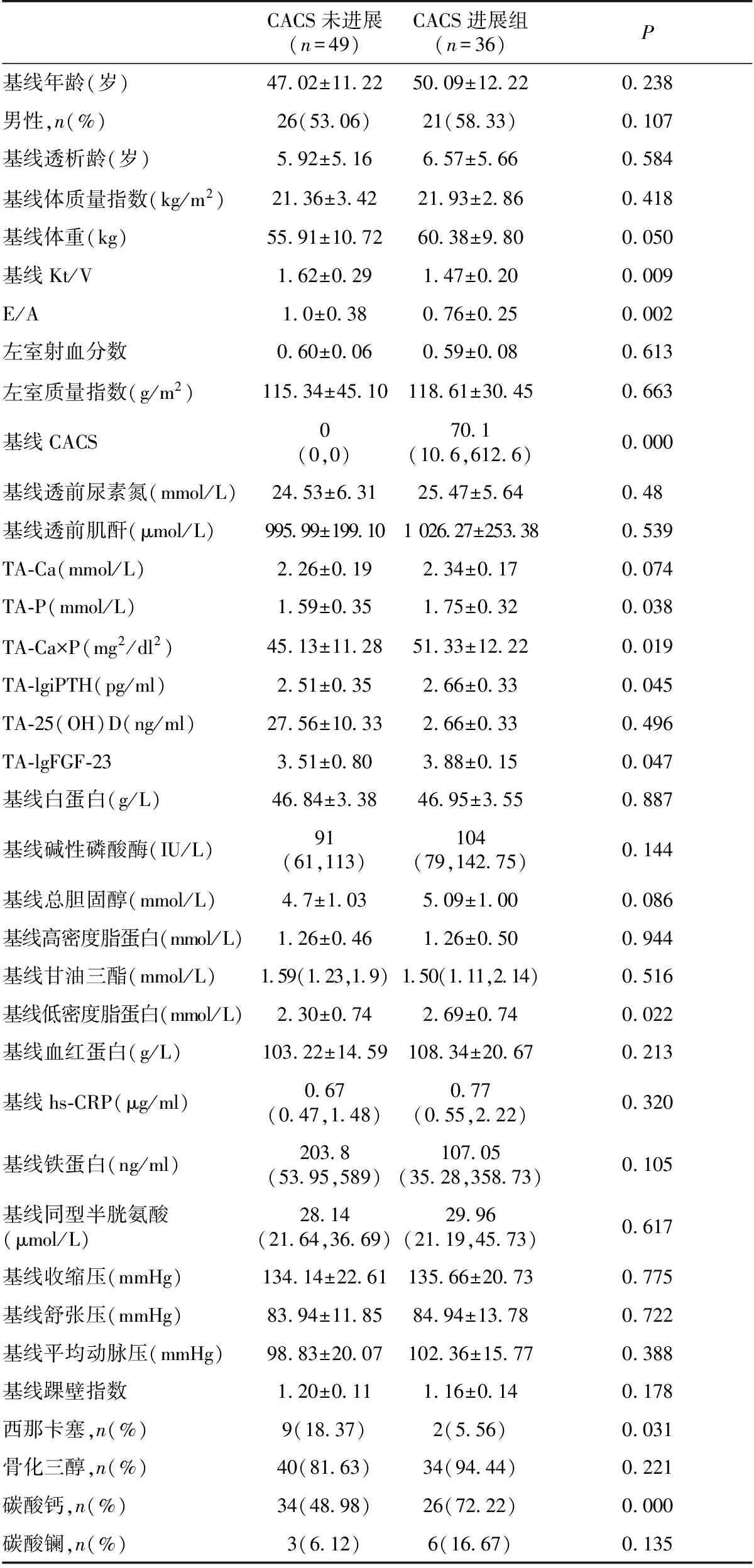
表3 CAC钙化进展组与未进展组一般情况比较
CAC:冠状动脉钙化;Kt/V:尿素清除指数;E/A:舒张早期和舒张晚期二尖瓣口最大血液速度之比;CACS:冠状动脉钙化积分;TA-Ca:时间平均血钙;TA-P:时间平均血磷;TA-Ca×P:时间平均钙磷乘积;TA-lgiPTH:时间平均全段甲状旁腺激素的对数,TA-25(OH)D:时间平均25羟维生素D;hs-CRP:高敏C反应蛋白
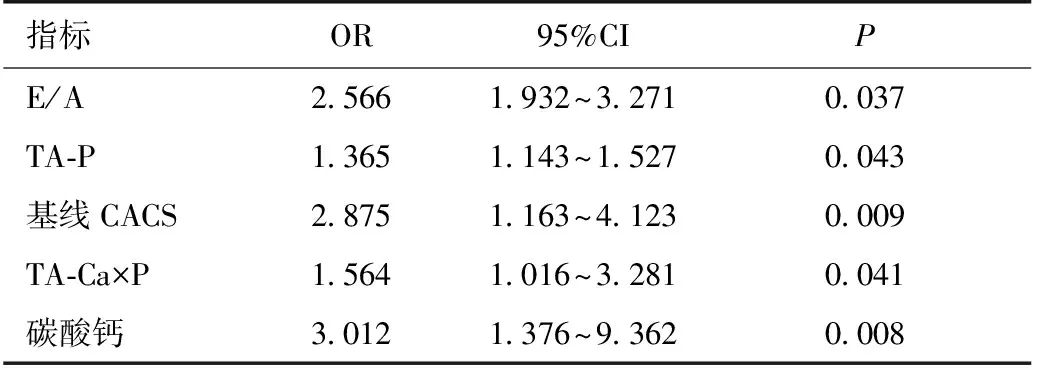
表4 CAC进展影响因素的多变量逻辑回归分析
CAC:冠状动脉钙化;CACS:冠状动脉钙化积分;TA-P:时间平均血磷;TA-Ca×P:时间平均钙磷乘积;E/A:舒张早期和舒张晚期二尖瓣口最大血液速度之比
远期预后随访期间共17例(16.35%)患者死亡,CAC无钙化组3例(2.88%),CAC轻中度钙化组8例(7.69%),CAC重度钙化组6例(5.77%)。死因分别为脑血管意外6例、心血管意外10例、车祸1例。无钙化组生存率高于轻中度钙化组(P=0.027)和重度钙化组(P=0.008)。三组生存率分别:1年 98%、94.1%、82.4% ;2年94.1%、86.1%、76.5%;3年94.1%、77.8%、70.6%。
16例患者(94.12%)死于心脑血管疾病,比较因心脑血管疾病死亡患者与存活患者心血管钙化情况,结果显示基线CACS、AACS和心脏瓣膜钙化均存在统计学差异(表5)。
表5心脑血管疾病相关死亡患者与存活患者基线心血管钙化情况比较
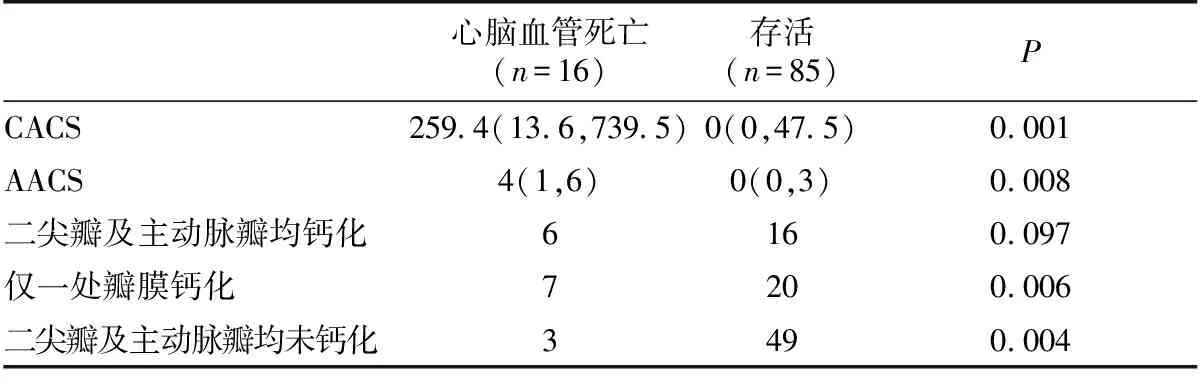
心脑血管死亡(n=16)存活(n=85)PCACS259 4(13 6,739 5)0(0,47 5)0 001AACS4(1,6)0(0,3)0 008二尖瓣及主动脉瓣均钙化6160 097仅一处瓣膜钙化7200 006二尖瓣及主动脉瓣均未钙化3490 004
CACS:冠状动脉钙化积分;AACS:腹主动脉钙化积分
讨 论
近年来,随着肾脏替代治疗技术的发展与普及,血液透析患者生存寿命呈上升趋势,但CVD仍是目前ESRD患者主要死亡原因之一[7],心血管钙化是CVD的独立危险因素。有研究报道,MHD患者血管钙化发生率为80%~90%[8]。本研究中基线时患者钙化发生率为69.23%,3年后检测心血管钙化发生率高达81.18%,表2所示基线与随访3年后钙化总阳性率间无统计学差异,但考虑到随访期间死亡患者(17例)在基线时存在心血管钙化者占82.35%(14例),若这部分患者3年后仍存活,则总体钙化总阳性率更高,且具有统计学差异。
贾凤玉等[9]研究结果显示患者高龄、贫血、高血钙、血脂异常是CACS>100的独立危险因素。Shobeiri等[10]研究发现高磷血症是血管钙化的独立危险因素,与CKD患者的病死率呈正相关,血磷每上升0.32 mmol/L,相对死亡危险性增加6%[11]。另有研究[11]指出接受透析治疗的CKD患者其摄入钙总量更多,且剂量越高,患者钙化程度越高,两者呈正相关。本文中CACS进展组患者服用碳酸钙比例明显高于未进展组,且多变量回归分析显示碳酸钙是CACS进展的独立危险因素(OR=3.102,P<0.05)。本研究中随访期间患者血磷控制达标率为58.82%,高磷患者比例高达40%,CACS进展组患者血磷水平明显高于未进展组,具有统计学差异。因此,临床中应严格控制血钙、血磷达标,对合并血管钙化的高磷血症患者,建议使用非含钙磷结合剂。对持续存在高钙血症的高磷血症患者,不建议使用含钙磷结合剂。本研究未发现血红蛋白、血脂、血钙等指标对CAC进展的影响,可能与本研究中血红蛋白、血脂、血钙达标率高有关,随访期间TA-Ca(2.26±0.19)达标患者比例为76.48%。若将死亡病例均纳入CAC进展组,相较85例随访患者结果,两组间年龄、性别(男性)存在统计学差异,分析发现,死亡病例中多为高龄、男性患者。
心血管系统钙化是造成MHD患者CVD高发生率和高死亡率的重要因素之一[11],与AACS相比,CACS对CKD患者心血管事件的预测价值最高[12]。且已有研究表明,CACS进展是心血管事件的独立危险因子,其对心血管事件发生的预测价值高于传统心血管危险因素[10]。本研究结果显示基线CACS水平对远期CAC进展有一定的影响。有研究显示,基线CACS对于CAC的进展有重要的预警作用[13]。因此,临床中除定期监测患者血液学相关指标以外,尚需进行相关影像学检查明确患者心血管钙化情况。
另有研究发现CAC与患者远期预后相关,CACS越高,死亡率越高,心血管事件发生率越高[6]。因本研究死亡率低、样本量小,未进一步分析CAC对远期预后的影响,但CAC进展的相关影响因素如血磷、iPTH、基线CAC均是临床中常见监测指标,为此,临床中应定期监测相关指标变化情况,指导临床工作。
本研究局限性在于这是一项单中心研究,样本量较小,随访时间相对较短,心血管事件发生率相对较低,未能明确血管钙化对心血管事件发生率的影响。因样本量较小,患者死亡率相对较低,未进一步通过COX回归分析影响生存率的相关危险因素。
总之,本研究发现MHD患者心血管钙化发生率高,且随透析时间延长逐年加重,临床血磷、钙磷乘积等指标控制达标情况及基线CAC等均影响远期CAC。故临床工作中应尽量控制血钙、血磷、iPTH等指标达标,充分评估患者血管钙化风险,并依据相应结果指导临床用药。
1 Go AS, Chertow GM,Fan D,et al.Chronic kidney disease and the risks of death,cardiovascular events,and hospitalization.N Engl J Med,2004,351(13):1296-1305.
2 Karohl C,D'Marco Gascón L,Raggi P.Noninvasive imaging for assessment of calcification in chronic kidney disease.Nat Rev Nephrol,2011,7(10):567-577.
3 Agatston AS,Janowitz WR,Hildner FJ,et al.Quantification of coronary artery calcium using ultrafast computed tomography.J Am Coll Cardiol,1990,15(4):827-832.
4 Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta:a 25-year follow-up study.Atherosclerosis,1997,132(2):245-250.
5 Budoff MJ,Hokanson JE,Nasir K,et al.Progression of coronary artery calcium predicts all-cause mortality.JACC Cardiovasc Imaging,2010,3(12):1229-1236.
6 Block GA,Raggi P,Bellasi A,et al.Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patients.Kidney Int,2007,71(5):438-441.
7 Rayner HC,Pisoni RL,Bommer J,et al.Mortality and hospitalization in hemodialysis patients in five European countries:results from the Dialysis Outcomes and Practice Patterns Study(DOPPS).Nephrol Dial Transplant,2004,19(1):108-120.
8 Ketteler M,Biggar PH.Review article:Getting the balance right:assessing causes and extent of vascular caIccification in chronic kidney disease.Nephrology(Carlton),2009,14(4):389-394.
9 贾凤玉,刘志红.维持性血液透析患者心血管钙化的发生率及分布特点.肾脏病与透析肾移植杂志,2014,23(5):401-406.
10 Shobeiri N,Adams MA,Holden RM.Phosphate:an old bone molecule but new cardiovascular risk factor.Br J Clin Pharmacol,2014,77(1):39-54.
11 Wexler L,Brundage B,Crouse J,et al.Coronary artery calcification:pathophysiology,epidemiology,imaging methods,and clinical implications.A statement for health professionals from the American Heart Association.Writing Group.Circulation,1996,94(5):1175-1192.
12 Bellasi A,Ferramosca E,Muntner P,et al.Correlation of simpleimaging tests and coronary artery calcium measured by computed tomography in hemodialysis patients.Kidney Int,2006,70(9):1623-1628.
13 Bashir A,Moody WE,Edwards NC,et al.Coronary Artery Calcium Assessment in CKD:Utility in Cardiovascular Disease Risk Assessment and Treatment? Am J Kidney Dis,2015,65(6):937-948.
Progressionofcardiovascularcalcificationinhemodialysispatients
CHENPeiling,GONGDehua,XUBin,HEQunpeng,ZHOUMinlin,ZHANGHaitao,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective: To investigate the influencing factors of the progression of cardiovascular calcification in hemodialysis patients.Methodology104 cases of patients with maintenance hemodialysis (MHD) were enrolled in this respective study. Coronary artery calcification score (CACS, Agstonscores) was detected by chest spiral CT,abdominal aortic calcification score(AACS,Kauppila score)was determined by abdominal lateral radiographs,and the cardiac valve calcification was examined by cardiac ultrasound.ResultsThe baseline cardiovacular calcification rate was 69.23%,and it the progressed to 81.18% after 3 years of follow-up. The CACS, AACS and valve calcification were significantly worse than the baseline. Logistic regression analysis showed that the E peak/A peak ratio,time-average serum phosphorus(TA-P),time-average calcium phosphorus products (TA-Ca×P), Baseline CACS and calcium carbonate were independent risk factors of CACS progression, and there was statistical significance (P<0.05). During the study period, 17 patients (16.34%) died. Cardiovascular calcification was more significant noticed in patients died of cerebro-cadiovascular reasons.ConclusionThe incidence of vascular calcification in hemodialysis patients was high,and it increases gradually with the prolongation of dialysis time.The level of serum phosphorus、calcium phosphorus product index, baseline CACS were the factors affect the long-term CAC progression.
maintenance hemodialysis cardiovascular calcification influencing factor
2017-09-10
(本文编辑 律 舟)
10.3969/j.issn.1006-298X.2017.05.002
国家科技支撑计划课题(2015BAI12B02、2015BAI12B05)
南京大学附属金陵医院(南京总医院) 硕士研究生(陈佩玲) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
刘志红(E-mail:liuzhihong@nju.edu.cn)

