不同生育期光合碳在水稻-土壤系统中的分配*
于 鹏 张玉玲 王春新 安婷婷 邹洪涛 付时丰李双异 汪景宽 张玉龙
(沈阳农业大学土地与环境学院,农业部东北耕地保育重点实验室,沈阳 110866)
不同生育期光合碳在水稻-土壤系统中的分配*
于 鹏 张玉玲†王春新 安婷婷 邹洪涛 付时丰李双异 汪景宽 张玉龙
(沈阳农业大学土地与环境学院,农业部东北耕地保育重点实验室,沈阳 110866)
通过盆栽试验方法,采用13C脉冲标记技术和稳定同位素质谱分析技术,研究了三个生育期(返青期、分蘖期和抽穗期)光合碳在“水稻-土壤”系统中的同化率、分配比率及其在土壤中增加率的动态变化,探讨三个生育期光合碳在“水稻-土壤”系统中的运转、分配规律,为明确稻田生态系统中碳素循环过程提供理论依据。结果表明,分别在返青期、分蘖期和抽穗期进行一次13C脉冲标记(持续5 h)后,光合碳在“水稻-土壤”系统中的总同化率均随标记后天数的延长呈逐渐下降趋势,从标记后2 d至收获时,总同化率分别为75.92%~39.53%、70.01%~52.02%、86.38%~69.60%,且收获时与2 d时的同化率差异均达显著水平(p< 0.05),其被同化光合碳的损失率分别为47.93%、25.70%和19.43%;抽穗期光合碳同化率明显高于返青期和分蘖期,被同化光合碳的损失也明显低于返青期和分蘖期。三个生育期被同化的光合碳向水稻地上部分和地下部分(包括根和土壤)的运转呈互相消长关系,但向水稻地上部分的分配比率(平均为85.04%~73.10%)远大于向根的分配比率(平均为12.50%~22.04%)和土壤的分配比率(平均为1.70%~5.04%),且抽穗期光合碳向水稻地上部分中的分配比率大于分蘖期和返青期,向地下部分的分配比率则正好相反;此外,三个生育期被同化的光合碳在土壤中的增加率分别为0.08%~0.21%、0.09%~0.17%和0.19%~0.27%,抽穗期土壤中光合碳的增加率要大于返青期和分蘖期,且光合碳在土壤中也相对稳定。
水稻;光合碳;13C脉冲标记;同化率
光合碳是“大气-植物-土壤”系统碳循环的重要组成部分,同大气环境与土壤质量变化关系紧密[1],对陆地生态系统乃至全球碳循环均至关重要。水稻是我国主要的粮食作物,其种植面积逐年递增[2-3],稻田土壤具有明显的固碳潜力[4]。因此,研究光合碳在“水稻-土壤”系统中的分配及变化对科学评估稻田土壤的碳素循环具有重要的意义。碳稳定性同位素示踪技术能够清晰地显示出光合碳在“作物-土壤”系统中的流通,揭示其在作物和土壤中的转化与分配[5]。目前主要通过13C自然丰度法、连续标记法和脉冲标记法[6],来研究植物-土壤系统中光合碳的动态及周转[7-9]。光合碳经过作物的固定以根系沉积物(根系脱落物和根系分泌物)的形式向土壤中传输,是土壤有机碳的主要来源[10-11]。光合碳在土壤中的分配不仅受温度[12]、CO2浓度[13-14]、水分情况[15-17]、养分状况[5]等环境因素的影响,还受作物种类[18-19]、不同生育时期[7-8]等植物因素的影响。
在“水稻-土壤”系统中,标记时期、标记时长和标记方式等因素均影响光合碳向地下部和土壤中的分配。研究发现,在水稻分蘖期经过18 d14C连续标记培养,有10.2%~18.1%的净光合碳分配至土壤中,光合碳向地下部输入有利于土壤有机碳的积累[20],水稻早期光合碳主要运往地下部,灌浆期地下部分配比例大大降低[7],在水稻的6个生育时期分别进行13C脉冲标记,土壤有机碳的增量低于光合碳的净输入量,表明随着光合碳的输入,土壤原有有机碳发生了矿化分解[8],通过100 d的土壤培养实验,与土壤中原有的有机碳相比,输入的“新碳”易被微生物矿化分解,表明光合同化碳的输入对维持稻田土壤的碳汇功能具有重要作用[21]。此外,水稻光合碳的运转和分配量受施氮量的影响较大,而分配比例受施氮量的影响较小。在水稻返青至分蘖期进行36 d14C连续标记培养发现,在较高的施氮水平下,水稻地上部对光合碳的积累能力相对较强,光合碳通过根际沉积作用输入到土壤中的含量亦相对较高,施氮水平明显促进了水稻新鲜根际碳的沉积,且高氮水平下根际沉积的碳量高于低氮和中氮水平[22];在不同施氮量条件下,光合碳在水稻及土壤中的分配比例大致相同[7-8,20]。
当前,光合碳在“水稻-土壤”系统中的研究,多集中短期内连续标记的光合碳在水稻和土壤中的分配,而对于水稻整个生长期间,不同生育期光合碳在“水稻-土壤”系统中的运转过程、分配比例的动态变化规律尚不清楚。因此,本研究采用13C脉冲标记技术,分析水稻返青期、分蘖期和抽穗期光合碳在“水稻-土壤”中的同化率、分配比率的动态变化,探讨不同生育期光合碳在“水稻-土壤”系统中的运转与分配规律,为明确稻田生态系统中碳素循环过程提供理论依据。
1 材料与方法
1.1 供试材料
供试土壤采集自沈阳市新城子区连续种稻10年的稻田表层土壤,起源土壤类型为草甸土。采集后的土壤去除其中残根和石块等,风干后破碎,过2 cm筛,均匀混合后备用。供试土壤pH 7.51,有机碳19.99 g kg-1,全氮1.93 g kg-1,碱解氮132.30 mg kg-1,有效磷4.49 mg kg-1,速效钾147.29 mg kg-1。
供试作物为水稻,水稻品种为沈农超级稻9816,水稻秧苗由沈阳农业大学水稻研究所提供。
1.2 试验设计
盆栽试验共设4个处理,分别为C0:水稻整个生育期间不进行13C标记;C1:在水稻返青期进行一次13C标记;C2:在水稻分蘖期进行一次13C标记;C3:在水稻抽穗期进行一次13C标记。每个处理均3次重复。每处理13C标记用量根据标记箱体的体积(箱体根据盆中水稻植株的高度可进行调节)、13CO2的浓度(以400 ml m-3计)以及连续标记次数(6次)计算,再根据标记处理的总盆数计算每处理每盆13C标记用量,即C1、C2和C3处理的13C用量分别为52.25 mg pot-1、83.44 mg pot-1和201.13 mg pot-1。各处理13C脉冲标记日期详见表1。

表1 13C脉冲标记和取样日期Table 1 13C pulse-labeling and sampling dates
盆栽试验采用聚乙烯塑料桶(直径φ23.5 cm×高20 cm),每桶装土5 kg(以烘干土计)。氮、磷、钾肥用量参照当地水稻田间生产的常规用量,施N为0.48 g kg-1,P2O5为0.16 g kg-1,K2O为0.19 g kg-1,其中氮肥为硫酸铵(含N 21%),分别以底肥、分蘖肥、穗粒肥按3∶4∶3的比例分三次施入;磷肥用过磷酸钙(含P2O512%),钾肥用氯化钾(含K2O 40%),磷肥与钾均作底肥一次性施入。于2015年5月25日进行秧苗定植(发育30 d秧苗,长势基本相同),每盆移栽3穴,每穴3株;在水稻生长过程中维持2~3 cm淹水层(成熟期除外)。此外,整个试验期间,除进行13C标记外,所有处理均放置在四周通透的遮雨棚内,以避免降雨的影响,而且C0处理与C1、C2、C3处理相距10 m以上的距离,以避免标记过程的影响。
1.3 13C脉冲标记
标记方法采用An等[23]的研究方法,并略作修改,装置见图1。每次标记前,用黑色塑料膜覆在桶的表面,避免水中藻类的光合作用,使水稻茎叶部分充分暴露出来。每次标记于晴天7∶00~13∶00进行(13C标记持续5 h):(1)利用氢氧化钠吸收装置吸收标记室内的12CO2,以提高13CO2的吸收同化率。用CO2分析仪监测标记室内CO2浓度,当其降至50 ml m-3左右时,关闭吸收装置。(2)13C标记。向一个装有Na213CO3(13C丰度为99%)的烧杯(1号)中注入足量盐酸(2 mol L-1),使标记室内13CO2浓度维持在360~400 ml m-3,当其浓度降至50 ml m-3左右时,以此步骤依次向装有等量Na213CO3的烧杯(2~6号)中注入等量盐酸,总计6次13C标记。(3)最后向装有等量Na212CO3(分析纯)烧杯(7号)中注入等量盐酸,以促进标记室内13CO2的同化,减少损失,当CO2浓度降至50 ml m-3左右时,整个标记过程结束。

图1 13C脉冲标记装置示意图Fig. 1 Schematic diagramof 13C pulse-labeling device
1.4 样品采集与分析
具体取样日期详见表1。各处理均采取破坏性取样,每次取样的前两天不进行补水,以保证取样时盆中表面无水层,植株样本采集时将根部的土尽量抖掉,用自来水洗净沥干后,沿根及穗(8月13日开始取样时有穗部分)的基部剪断,分为地上(包括茎叶和籽实)和根两部分,分别装在干净的纸袋中,然后杀青(105 ℃)、烘干(60 ℃),称重备用;盆中全部土壤在适宜含水量下充分混匀,一部分于4 ℃保存备用,另一部分自然风干,用于土壤有机碳、δ13C值以及其他指标的测定。取样时,土壤中细小的根系尽量挑出,归入根系部分。
土壤样本、植株样本中有机碳含量及其δ13C值均采用元素分析仪—稳定同位素比例质谱仪(Elementar vario PYRO cube-IsoPrime100 Isotope Ratio Mass Spectrometer,德国)联用测定。样品经高温燃烧后(燃烧管温度为920℃,还原管温度为600℃),通过TCD(Thermal Conductivity Detector)检测测定有机碳含量,剩余气体经CO2排出口(Vent)通过稀释器进入质谱仪,在质谱仪上测定δ13C值;仪器有机碳的检测范围为0~20 mg(绝对值),检测精度为 ≤ 0.1%(绝对值),稳定同位素比例质谱仪δ13C的检测精度为 ≤0.1‰)。由于土壤中不含碳酸钙(通过重铬酸钾容量法与元素分析仪法对原土进行测定,其测定结果基本一致),所以测量的全碳即为土壤的有机碳含量。其他基本理化性质采用常规方法。
1.5 数据处理

δ13C值及13C丰度(F):式中,RPDB为标准物质的13C与12C原子的比值,其值为0.0112372(标准物质为美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石(Peedee Belemnite,即PDB));Rsample为样品的13C与12C原子的比值。
各部分固定13C的量(13Ci)(不考虑呼吸作用的影响):
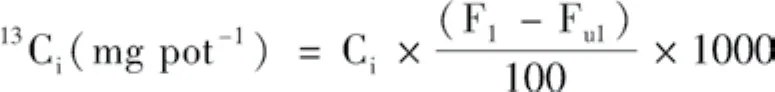
式中,Ci分别为标记处理中地上、根和土壤部分的碳量(g pot-1);Fl分别为标记处理中地上、根和土壤的13C丰度(%);Ful分别为不标记处理中地上、根和土壤的13C丰度(%)。
各部分固定13C的分配比率(P13Ci):

式中,13C固定是标记处理中地上、根和土壤固定的13C量之和(mg pot-1);13Ci同前。


式中,13C总是标记处理中标记所用的13C的总量(mg pot-1);13Ci同前。
水稻-土壤系统固定13C的损失率(P损失)

式中,13C固定(标记后第2天)、13C固定(收获期)分别代表标记处理标记后2 d、收获期时的13C固定(mg pot-1)。
土壤中13C的增加率(P增加):
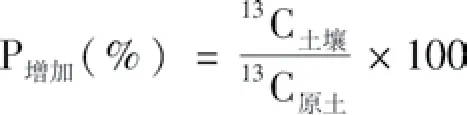
式中,13C土壤代表标记处理土壤部分固定的13C量(mg kg-1);13C原土为种植水稻前土壤中13C的含量(mg kg-1)。
采用Excel 2010进行数据整理分析,利用SPSS 18.0进行差异显著性检验(Duncan),所有测定结果为3次重复的平均值±标准误差(SE)。
2 结 果
2.1 不同生育期光合碳在水稻-土壤系统中的含量及同化率
三个生育期光合碳在水稻植株中的含量随标记后天数的延长呈逐渐减少趋势,返青期和分蘖期光合碳在土壤中的含量随标记后天数的延长呈先增加后减少趋势,而抽穗期光合碳在土壤中的含量则随标记后天数的延长呈现增加趋势,但其在水稻-土壤系统中总含量的变化趋势大致相同,即均表现为随标记后天数的延长呈逐渐减少趋势;此外,三个生育期光合碳主要分布在水稻植株体内(表2)。C1、C2和C3处理在水稻-土壤系统中的13C总量均在标记后2 d时为最大,分别为39.66、58.41和173.73 mg pot-1;在收获时为最小,分别为20.65、43.40和139.98 mg pot-1,且三个处理的13C总量均显著低于第2天时的13C总量(p<0.05)。
三个生育期光合碳在水稻-土壤系统中的同化率与其含量的分布规律相一致(表3)。C1、C2和C3处理在水稻-土壤系统中的总的同化率均随标记后天数的延长呈逐渐下降趋势;总的同化率分别由标记后第2天的75.92%、70.01%和86.38%下降至收获期时的39.53%、52.02%和69.60%,且第2天与收获时的同化率差异均达显著水平(p<0.05),光合碳的损失率分别为47.93%、25.70%和19.43%。此外,不同时期光合碳在水稻-土壤系统中的同化率差异较大,光合碳在标记后的2 d时,返青期和分蘖期标记光合碳的同化率明显低于抽穗期,而在收获期时,三个生育期标记光合碳的同化率大小依次为抽穗期>分蘖期>返青期。这表明在水稻生长发育过程中,返青期和分蘖期光合碳向水稻-土壤系统中运移和分配的数量明显低于抽穗期;随着水稻生长,返青期和分蘖期光合碳的损失则明显高于抽穗期。

表2 不同生育期光合碳(13C)在水稻-土壤系统中的含量变化Table 2 Change in photosynthetic carbon(13C)content in therice-soil system relative to growth stage(mg pot-1)

表3 不同生育期光合碳(13C)在水稻-土壤系统中的同化率Table 3 Assimilation rate ofphotosynthetic carbon(13C)in the rice-soil system relative to growth stage(%)
2.2 不同生育期光合碳在水稻-土壤系统中的分配比率
返青期(C1处理)和分蘖期(C2处理)被同化的光合碳在水稻-土壤系统中的动态分配规律大致相同,在水稻地上部分中的分配比率均随标记后天数的延长呈先下降后上升趋势,且均在抽穗期时(8月13日)为最低(图2a、2b);在根中的分配比率均随标记后天数的延长呈先上升后下降趋势,且均在抽穗期时(8月13日)为最高(图2d、2e);在土壤中的分配比率则略有差异,返青期的光合碳在土壤中的分配比率随标记后天数的延长呈先增加再降低然后再增加的趋势(图2g),而分蘖期时则表现为先增加后降低趋势(图2h)。抽穗期(C3处理)被同化的光合碳在水稻地上部分中的分配比率随标记后天数的延长呈缓慢下降趋势(图2c),而在根和土壤中的分配比率则均表现为缓慢增加趋势(图2i)。总体上,三个时期被同化的光合碳向水稻地上部分运转和向地下部分(包括根和土壤)的运转呈互相消长关系(图2)。
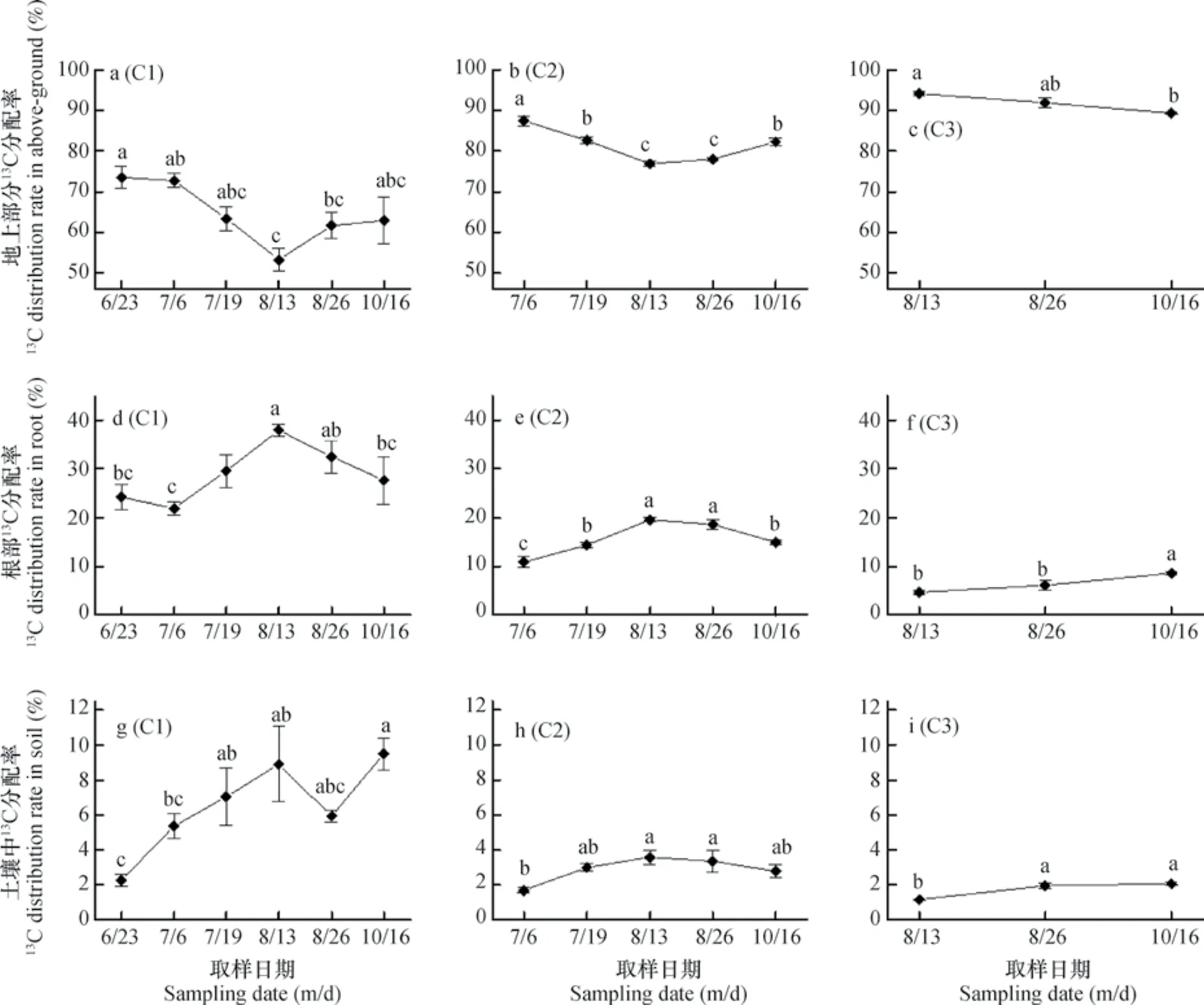
图2 不同生育期光合碳(13C)在水稻-土壤系统中的分配比率Fig. 2 Distribution rate of photosynthetic carbon(13C)in the rice-soil system relative to growth stage
返青期被同化的光合碳在水稻地上部分、根和土壤中的分配比率分别为73.51%~53.19%、21.93%~37.91%和2.26%~9.49%;分蘖期被同化的光合碳在水稻地上部分、根和土壤中的分配比率分别为8 7.4 3%~7 6.8 1%、10.89%~19.61%和1.69%~3.58%;抽穗期被同化的光合碳在水稻地上部分、根和土壤中的分配比率分别为94.17%~89.34%、4.68%~8.61%和1.15%~2.05%,可见,不同生育期被同化的光合碳在水稻地上部分、根和土壤中的分配比率虽然存在明显差异,但向水稻地上部分运转的比率远大于向根和土壤中运转的比率。此外,三个生育期被同化的光合碳向水稻地上部分中的分配比率依次为,抽穗期>分蘖期>返青期,向根和土壤中的分配比率则均表现为:返青期>分蘖期>抽穗期,这表明水稻生长过程中,返青期和分蘖期被同化的光合碳向地下部分(根和土壤)中运转的相对较多,有利于根系生长,而抽穗期被同化的光合碳向地上部分运转的相对较多,有利于稻穗的生长发育、促进籽实灌浆、饱满。
2.3 不同生育期土壤中光合碳的增加率
水稻返青期(C1处理)、分蘖期(C2处理)土壤中光合碳增加率动态变化的规律大体一致,均随标记后天数的延长呈先增加后降低趋势,而抽穗期(C3处理)则在增加后基本保持不变,但抽穗期土壤中光合碳的增加率要大于返青期和分蘖期(图3)。在返青期、分蘖期和抽穗期被同化的光合碳在土壤中的增加率分别为0.08%~0.21%、0.09%~0.17%和0.19%~0.27%,分别在标记后63 d(8月13日)、50 d(8月13日)和66 d(10月16日)时最大值,且均与标记2 d时的增加率达显著水平(p< 0.05)。

图3 不同生育期土壤中光合碳(13C)的增加率Fig. 3 Increasingrate of photosynthetic carbon(13C)in soil relative to growth stage
3 讨 论
3.1 光合碳在水稻-土壤系统内的同化
有研究发现,标记后短时间内,土壤中就可以检测到13C的存在[25],不同植物在生长期间向土壤分配的光合碳量不同,最高可达20%,而仅有2%~5%被转化为稳定的土壤有机碳[26]。此外,作物早期的根际沉积能力要强于后期[7],并且受土壤肥力[22]、耕作方式[23]等因素的影响。本研究中,三个生育期分别进行1次13C脉冲标记(连续5 h)的光合碳在水稻-土壤系统中的总固定量均随标记后天数的延长呈逐渐减少趋势,主要分布在水稻植株中,仅很小一部分进入到土壤中,且水稻收获时土壤中13C含量均高于标记后2 d时土壤中13C含量(表2),说明随着水稻的生长发育,光合碳在不断的向土壤中迁移与分配。此外,分别在水稻的三个生育期进行一次13C标记后光合碳在土壤中的同化率大小依次为返青期>分蘖期>抽穗期(表3),这说明水稻返青期和分蘖期的根际沉积能力明显强于抽穗期。
Zhu等[27]在水稻的分蘖期进行1次(持续7 h)13C脉冲标记后30 d取样时发现,在高、中、低土壤有机碳含量的三个处理中,光合碳在水稻-土壤系统中的损失分别为60%、48%、25%;Lu等[8]分别在水稻的6个生育期进行1次(持续6 h)13C脉冲标记发现,在水稻收获时,光合碳在水稻-土壤系统中的损失平均约为19.5%,这部分损失的光合碳主要是由于水稻植株与土壤微生物的呼吸作用所致[28]。本研究中,三个生育期分别进行1次13C脉冲标记(连续5 h)的光合碳在土壤中的同化率随标记后天数的延长呈上升趋势,但在水稻植株及整个水稻-土壤系统中的同化率则呈下降趋势,从标记后2 d至水稻收获时,整个水稻-土壤系统中被同化光合碳的损失率为19.43%~47.93%,平均为31.02%。由此可见,标记时期、标记次数、标记时长的不同是造成被同化光合碳损失率不同的重要因素。
3.2 光合碳在水稻-土壤系统中的分配
光合碳被植物固定后经韧皮部转运到地下部分[29],一部分用于根系生长,一部分以根系沉积物的形式进入到土壤中[30-31],进入土壤中的一部分由呼吸作用损失[28],同时又有小部分被根系重新吸收,转运到地上部[32-33]。刘萍等[7]研究表明,在两种施氮水平下,经过4次13C脉冲标记累计吸收的光合碳均有72%左右分配至水稻植株地上部分,约有7.21%~7.71%分配到水稻根系,其余分配到了土壤中。聂三安[34]对亚热带地区4种典型水稻土的研究发现,经过80 d13C连续标记,光合碳在水稻植株地上部分的分配比例均在85%左右,在根部的分配比例约为10%,5%分配到土壤中。本研究发现,不同生育期被水稻固定的光合碳在向水稻地上部、根和土壤中的分配比率因生育期不同而异,在返青期、分蘖期和抽穗期进行1次13C脉冲标记的光合碳(连续5 h)分配到地上部分的比例分别约为64.54%、81.41%和91.80%,分配到根系的比例分别约为28.96%、15.71%和6.48%,分配到土壤的比例分别约为6.50%、2.88%和1.72%;水稻返青期和分蘖期被同化的光合碳向地下部分(根和土壤)中运转分配的相对较多,有利于根系生长,而抽穗期被同化的光合碳则向地上部分运转分配的相对较多,有利于稻穗的生长发育、促进籽实灌浆、饱满。但总体上,三个生育期被同化的光合碳向水稻地上部分运转分配的最多、其次为根,向土壤中运转分配的最少,向水稻地上部分和向地下部分(包括根和土壤)的运转分配呈互相消长关系(图2)。此外,三个生育期被同化的光合碳虽然向根和土壤中的运转分配比率有明显差异,但在水稻收获时,光合碳在根中的分配比率均高于标记后2 d时的分配比率,表明不同生育期光合碳在水稻生长过程中向根部运转沉积,这一结果与刘萍等[7]的研究结果相一致;在土壤中的分配比率(2.1%~9.5%)也均高于标记后2 d时的分配比率,其数值高于Lu等[8]的研究结果(1%~5%),这可能与试验条件及试验中水稻的种植密度等因素不同有关。此外,水稻抽穗期土壤中光合碳的增加率要大于返青期和分蘖期,说明水稻在抽穗期通过根际沉积作用进入到土壤中的光合碳要多于返青期和分蘖期。本研究中,返青期(C1处理)土壤中光合碳增加率的波动相对较大,抽穗期(C3处理)相对较小,说明被水稻早期同化的光合碳运转分配到土壤中相对活跃、很不稳定[8,35],易转化与分解[36],而后期固定的光合碳运转分配到土壤中则相对稳定,易被土壤固定。
4 结 论
本试验条件下,光合碳在水稻-土壤系统中的同化和分配因生育时期不同而异。水稻在返青期、分蘖期和抽穗期分别进行一次13C脉冲标记后,光合碳在水稻-土壤系统中的总同化率均随标记后天数的延长呈逐渐下降趋势,抽穗期光合碳同化率明显高于返青期和分蘖期,光合碳的损失率则明显低于返青期和分蘖期。三个时期被同化的光合碳向水稻地上部分运转和向地下部分(包括根和土壤)的运转呈互相消长关系,但向水稻地上部分运转的比率远大于向根和土壤中运转的比率,抽穗期向水稻地上部分中的分配比率大于分蘖期和返青期,向地下部分的分配比率则正好相反。抽穗期土壤中光合碳的增加率要大于返青期和分蘖期,同时进入到土壤中的光合碳也较水稻生育前期稳定。
[1] 周广胜,王玉辉,许振柱,等. 中国东北样带碳循环研究进展. 自然科学进展,2003,13(9):917—922 Zhou G S,Wang Y H,Xu Z Z,et al. Carbon cycle research advances in North East China transit(In Chinese). Progress in Natural Science,2003,13(9):917—922
[2] 程勇翔,王秀珍,郭建平,等. 中国水稻生产的时空动态分析. 中国农业科学,2012,45(17):3473—3485 Cheng Y X,Wang X Z,Guo J P,et al. The temporalspatial dynamic analysis of China rice production(In Chinese). Scientia Agricultura Sinica,2012,45(17):3473—3485
[3] 刘珍环,李正国,唐鹏钦,等. 近30年中国水稻种植区域与产量时空变化分析. 地理学报,2013,68(5):680—693 Liu Z H,Li Z G,Tang P Q,et al. Spatial-temporal changes of rice area and production in China during 1980-2010(In Chinese). Acta Geographica Sinica,2013,68(5):680—693
[4] 潘根兴,李恋卿,郑聚锋,等. 土壤碳循环研究及中国稻田土壤固碳研究的进展与问题. 土壤学报,2008,45(5):901—914 Pan G X,Li L Q,Zheng J F,et al.Perspectives on cycling and sequestration of organic carbon in paddy soils of China(In Chinese). Acta Pedologica Sinica,2008,45(5):901—914
[5] Ge T D,Yuan H C,Zhu H H,et al. Biological carbon assimilation and dynamics in a flooded rice-soil system.Soil Biology & Biochemistry,2012,48(4):39—46[6] Kuzyakov Y,Domanski G. Model for rhizodeposition and CO2efflux from planted soil and its validation by 14C pulse labelling of ryegrass. Plant and Soil,2002,239(1):87—102
[7] 刘萍,江春玉,李忠佩.13C脉冲标记定量研究施氮量对光合碳在水稻-土壤系统中分布的影响. 土壤学报,2015,52(3):567—575 Liu P,Jing C Y,Li Z P. Quantitative research on effects of nitrogen application rate on distribution of photosynthetic carbon in rice-soil system using13C pluse labeling technique(In Chinese). Acta Pedologica Sinica,2015,52(3):567—575
[8] Lu Y H,Watanabe A,Kimura M. Input and distribution of photosynthesized carbon in a flooded rice soil. Global Biogeochemical Cycles,2002,16(4):32-1-32-8
[9] 聂三安,周萍,葛体达,等. 水稻光合同化碳向土壤有机碳库输入的定量研究:14C连续标记法. 环境科学,2012,33(4):1346—1351 Nie S A,Zhou P,Ge T D,et al. Quantifying rice(Oryza sativaL.)photo-assimilated carbon input into soil organic carbon pools following continuous14C labeling(In Chinese). Environmental Science,2012,33(4):1346—1351
[10] 金剑,王光华,刘晓冰,等. 作物生育期内光合碳在地下部的分配及转化. 生态学杂志,2008,27(8):1393—1399 Jin J,Wang G H,Liu X B,et al. Allocation and transformation of photosynthetic carbon belowground of crop during the growth period(In Chinese). Chinese Journal of Ecology,2008,27(8):1393—1399
[11] 李彦生,王光华,金剑. 大气CO2升高与农田土壤碳循环研究. 土壤与作物,2015,4(1):19—26 Li Y S,Wang G H,Jin J. Elevated atmospheric CO2in relation to farmland carbon cycling(In Chinese). Soil and Crop,2015,4(1):19—26
[12] 张立极,潘根兴,张旭辉,等. 大气CO2浓度和温度升高对水稻植株碳氮吸收及分配的影响. 土壤,2015,47(1):26—32 Zhang L J,Pan G X,Zhang X H,et al.Effect of experimental CO2enrichment and warming on uptake and distribution of C and N in rice plant(In Chinese).Soils,2015,47(1):26—32
[13] Li Z,Yagi K. Rice root-derived carbon input and its effect on decomposition of old soil carbon pool under elevated CO2. Soil Biology & Biochemistry,2004,36(12):1967—1973
[14] 马田,刘肖,李骏,等. CO2浓度升高对土壤-植物(春小麦)系统光合碳分配和积累的影响. 核农学报,2014,28(12):2238—2246 Ma T,Liu X,Li J,et al. Effects of elevated atmospheric CO2on the distribution and accumulation of photosynthetic carbon in soil-plant( spring wheat)system(In Chinese). Journal of Nuclear Agricultural Sciences,2014,28(12):2238—2246
[15] Mishra A,Salokhe V M. Rice root growth and physiological responses to sri water management and implications for crop productivity. Paddy & Water Environment,2011,9(1):41—52
[16] Pieters A J,Núñez M. Photosynthesis,water use efficiency,and δ13C in two rice genotypes with contrasting response to water deficit. Photosynthetica,2008,46(4):574—580
[17] Tian J,Pausch J,Fan M,et al. Allocation and dynamics of assimilated carbon in rice-soil system depending on water management. Plant and Soil,2013,363(1/2):273—285
[18] Mwafulirwa L,Baggs E M,Russell J,et al. Barley genotype influences stabilization of rhizodepositionderived c and soil organic matter mineralization. Soil Biology & Biochemistry,2016,95:60—69
[19] 安婷婷,汪景宽,李双异,等. 用13C脉冲标记方法研究施肥与地膜覆盖对玉米光合碳分配的影响. 土壤学报,2013,50(5):948—955 An T T,Wang J K,Li S Y,et al. Effect of fertilization and plastic film mulching on distribution of photosynthetically fixed carbon in maize:Explored with13C pulse labeling technique(In Chinese). Acta Pedologica Sinica,2013,50(5):948—955
[20] 谭立敏,吴昊,李卉,等. 不同施氮量下水稻分蘖期光合碳向土壤碳库的输入及其分配的量化研究:13C连续标记法. 环境科学,2014,35(5):1933—1938 Tan L M,Wu H,Li H,et al. Input and distribution of rice photosynthesized carbon in the tillering stage under different nitrogen application following continuous13C labeling(In Chinese). Environmental Science,2014,35(5):1933—1938
[21] 谭立敏,彭佩钦,李科林,等. 水稻光合同化碳在土壤中的矿化和转化动态. 环境科学,2014,35(1):233—239 Tan L M,Peng P Q,Li K L,et al. Dynamics of the mineralization and transformation of rice photosynthesized carbon in paddy soils —A batch incubation experiment(In Chinese). Environmental Science,2014,35(1):233—239
[22] Ge T D,Liu C,Yuan H C,et al. Tracking the photosynthesized carbon input into soil organic carbon pools in a rice soil fertilized with nitrogen. Plant and Soil,2015,392(1/2):17—25
[23] An T T,Schaeffer S,Li S Y,et al. Carbon fluxes from plants to soil and dynamics of microbial immobilization under plastic film mulching and fertilizer application using13C pulse-labeling. Soil Biology & Biochemistry,2015,80:53—61
[24] 杨兰芳,蔡祖聪. 玉米生长和施氮水平对土壤有机碳更新的影响. 环境科学学报,2006,26(2):280—286 Yang L F,Cai Z C. Effects of growing maize and N application on the renewal of soil organic carbon(In Chinese). Acta Scientiae Circumstantiae,2006,26(2):280—286
[25] Kaštovská E,Šantrůčková H. Fate and dynamics of recently fixed C in pasture plant-soil system under field conditions. Plant soil. Plant and Soil,2007,300(1):61—69
[26] Hütsch B W,Augustin J,Merbach W. Plant rhizodeposition-An important source for carbon turnover in soils. Journal of Plant Nutrition & Soil Science,2002,165(4):397—407
[27] Zhu Z K,Ge T D,Xiao M L,et al. Belowground carbon allocation and dynamics under rice cultivation depends on soil organic matter content. Plant and Soil,2016,DOI:10.1007/s11104-016-3005-z
[28] Kuzyakov Y,Ehrensberger H,Stahr K. Carbon partitioning and below-ground translocation by lolium perenne. Soil Biology & Biochemistry,2001,33(1):61—74
[29] 申建波,张福锁,毛达如. 根际微生态系统中的碳循环. 植物营养与肥料学报,2001,7(2):232—240 Shen J B,Zhang F S,Mao D R. Carbon cycling in rhizosphere microecological system(In Chinese).Plant Nutrition and Fertilizer Science,2001,7(2):232—240
[30] Pausch J,Kuzyakov Y. Photoassimilate allocation and dynamics of hotspots in roots visualized by14C phosphor imaging. Journal of Plant Nutrition and Soil Science,2011,174(1):12—19
[31] 王智平,陈全胜. 植物近期光合碳分配及转化. 植物生态学报,2005,29(5):845—850 Wang Z P,Chen Q S. Recemtly photosynthesized carbon allocation and turnover(In Chinese). Acta Phytoecologica Sinica,2005,29(5):845—850
[32] Ford C R,Wurzburger N,Hendrick R L,et al. Soil DIC uptake and fixation inPinus taedaseedlings and its C contribution to plant tissues and ectomycorrhizal fungi. Tree Physiology,2007,27(3):375—383
[33] Moore D J P,Gonzalez-Meler M A,Taneva L,et al.The effect of carbon dioxide enrichment on apparent stem respiration fromPinus taedaL. is confounded by high levels of soil carbon dioxide. Oecologia,2008,158(1):1—10
[34] 聂三安.14C连续标记下水稻同化碳向土壤有机碳库传输的定量研究. 长沙:湖南农业大学,2011 Nie S A. Quantitative research on transformation of assimilative carbonto soil organic carbon poolsunder14C econtinuous labeling. Changsha:Hunan Agricultural University,2011
[35] Staddon P L,Ostle N,Dawson L A,et al. The speed of soil carbon throughput in an upland grassland is increased by liming. Journal of Experimental Botany,2003,54(386):1461—1469
[36] Kuzyakov Y,Domanski G. Carbon input by plants into the soil. Review. Journal of Plant Nutrition and Soil Science,2000,163(4):421—431
Distribution of Photosynthetic Carbon in Rice-Soil System Relative to Rice Growth Stage
YU Peng ZHANG Yuling†WANG Chunxin AN Tingting ZOU Hongtao FU Shifeng LI Shuangyi WANG Jingkuan ZHANG Yulong
(Key Laboratory of Northeast Arable Land Conservation,Ministry of Agriculture,College of Land and Environmental Science,Shenyang Agricultural University,Shenyang110866,China)
【Objective】Photosynthetic carbon(C),an important link of the carbon cycle in the atmosphere-plant-soil system,is closely related to the atmospheric environment and changes in soil quality,and plays a crucial role in the terrestrial ecosystem and global C cycling. Rice is one of the main grain crops in China,whose planting area is increasing year by year. Paddy soil is obviously quite high in C sequestration potential. Therefore,it is of vital significance to explore distribution of photosynthetic C in the paddy soil system and its variation to scientific evaluation of C cycling in paddy soil. 【Method】13C pulse-labeling and stable isotopic mass spectrometry technologies were employed to study variation of the assimilation rate and distribution ratio of photosynthetic C and their increasing rates in the rice-soil system relative to growth stage(regreening,tillering and heading stages)of the rice plants growing in a pot experiment. 【Result】The objectives of this study were toexplore turnover and distribution dynamics of photosynthetic C in therice-soil system at three different growth stages of the plants and to provide a theoretical basis for further researches on C cycling and renewal of soil organic C in the paddy ecosystem. Results show that photosynthetic C gradually decreased in total assimilation rate with the each passing day after13C pulse-labeling(duration 5 h)of the rice-soil system conducted,separately,at the beginning of each growth stage. The total assimilation rate reached 75.92%~39.53%,70.01%~52.02% and 86.38%~69.60% and the loss rate of assimilated photosynthetic C 47.93%,25.70% and 19.43%,respectively,during the period from Day 2 after the labeling at the regreening,tillering and heading stageperiod. The assimilation rate of photosynthetic C was significantly higher in the heading stage than in the regreening and tillering stages,while an opposite trend was observed of the loss rate of photosynthetic C. The transformation of the photosynthetic C was offset between the above-ground and under-ground(including roots and soil)parts of rice in three growth stages. While the distribution ratio of photosynthetic C was much larger in the aboveground(mean 85.04%~73.10%)part than in the root(mean 12.50%~22.04%)and soil(mean 1.70%~5.04%). The distribution ratio of photosynthetic C was higher aboveground,but lower underground at the heading stage than at the tillering and regreening stages.In addition,the increasing rate of photosynthetic C in soil during the three growth periods was 0.08%~0.21%,0.09%~0.17% and 0.19%~0.27%,respectively. The increasing rate of photosynthetic C in soil was higher during the heading period than during the regreening stage and tillering stage,and the photosynthetic C during the period was relatively stable in soil.【Conclusion】Under the experimental conditions,the assimilation and distribution of photosynthetic C in the rice-soil system varied with growth of the plants. The assimilation rate and distribution ratio of photosynthetic C aboveground was significantly higher at the heading stage than at the regreening and tillering stages,and the loss rate of photosynthetic C was significantly lower. The increasing rate of photosynthetic C in soil was higher at the heading stage than at the regreening stage and tillering stage,and the photosynthetic C at that stage was relatively stable in soil.
Rice;Photosynthetic C;13C pulse-labeling;Assimilation rate
154.4
A
10.11766/trxb201702140475
* 国家重点研发计划项目(2017YED0300707)和国家自然科学基金项目(41571280,41101276)资助 Supported by the National Key Research and Development Program(No. 2017YED0300707)and the National Natural Science Foundation of China(Nos. 41571280 and 41101276)
† 通讯作者 Corresponding author,E-mail:yuling_zhang@163.com
于 鹏(1989—),男,内蒙古呼伦贝尔人,硕士研究生,从事土壤改良与土壤肥力方面研究。E-mail:yupengtrx@163.com
2017-02-14;
2017-04-27;优先数字出版日期(www.cnki.net):2017-05-11
(责任编辑:卢 萍)

