扁平苔藓皮损中缺氧诱导因子1α、血管内皮生长因子和蛋白激酶B的表达
冯珺 白莉 张学良
037003山西大同,同煤集团总医院皮肤科(冯珺、张学良);山西医科大学第一医院皮肤科(白莉)
扁平苔藓皮损中缺氧诱导因子1α、血管内皮生长因子和蛋白激酶B的表达
冯珺 白莉 张学良
037003山西大同,同煤集团总医院皮肤科(冯珺、张学良);山西医科大学第一医院皮肤科(白莉)
目的探讨扁平苔藓皮损中缺氧诱导因子1α(HIF⁃1α)、血管内皮生长因子(VEGF)和蛋白激酶B(P⁃Akt)的表达与血管形成及凋亡的关系。方法免疫组化法和TUNEL法检测32例扁平苔藓患者皮损和20例脂肪瘤皮肤石蜡标本HIF⁃1α、VEGF和P⁃Akt表达和细胞凋亡情况,同时用CD34标记血管内皮细胞,计算微血管密度(MVD)。结果HIF⁃1α、VEGF和P⁃Akt在32例扁平苔藓组皮损表皮角质形成细胞中均有不同程度的表达(++~+++),HIF⁃1α表达部位为细胞核,VEGF和P⁃Akt表达部位为细胞质,高于对照组HIF⁃1α、VEGF和P⁃Akt(-~++)的表达,两组比较,差异有统计学意义(均P<0.01)。扁平苔藓组皮损处MVD为(21.27±6.54)个/高倍视野(×200),对照组MVD为(10.26±1.10)个/高倍视野(×200),两组比较,差异有统计学意义(t=5.607,P<0.01)。扁平苔藓组表皮层角质形成细胞的凋亡指数(72.81%±9.234%)显著高于对照组(28.16%±3.464%),两组比较,差异有统计学意义(t=8.431,P< 0.01)。扁平苔藓皮损中HIF⁃1α、VEGF和P⁃Akt的表达水平间均呈正相关(r值分别为0.625,0.453,0.455,均P< 0.01)。HIF⁃1α、VEGF和P⁃Akt的表达与MVD均呈正相关(r值分别为0.721,0.646,0.671,均P< 0.01)。结论HIF⁃1α及其下游靶基因VEGF、P⁃Akt在扁平苔藓的发病中可能起一定的作用。
扁平苔藓;缺氧诱导因子1,α亚基;血管内皮生长因子类;蛋白激酶类;细胞凋亡
近年来,缺氧微环境在慢性炎症性皮肤病及皮肤肿瘤发生、发展中的重要性备受关注。一些研究发现,皮损处缺氧微环境可能与银屑病及口腔扁平苔藓的发病有关[1⁃3],但组织缺氧是否参与皮肤扁平苔藓的研究鲜有报道。缺氧诱导因子1α(HIF⁃1α)是组织细胞耐受缺氧微环境的重要因子,在组织缺氧微环境下,HIF⁃1α表达上调,可使细胞适应缺氧环境。血管内皮生长因子(VEGF)可诱导血管生成,促进细胞的增殖,是HIF⁃1α的下游靶基因。蛋白激酶B(Akt)是PI3K⁃Akt信号转导通路的关键因子,是VEGF发挥作用的重要通路。本研究通过检测扁平苔藓皮损中HIF⁃1α、VEGF、P⁃Akt表达,并用CD34抗体标记血管内皮细胞,计算皮损处微血管密度(MVD),再用TUNEL法检测皮损处细胞凋亡的情况,探讨组织缺氧、血管生成、角质细胞增殖及凋亡在扁平苔藓发病中的作用。
对象与方法
一、资料
1.对象:收集2012—2015年手术切除后经组织病理检查证实的扁平苔藓石蜡标本32例,其中男15例,女17例,年龄29~65岁,平均44.5岁。取材部位:四肢25例,躯干7例,3个月内局部及全身均未使用过糖皮质激素及其他免疫抑制剂,临床资料来自门诊病历。选择同期取自我院外科皮下脂肪瘤患者20例皮肤作为对照组,取材部位为躯干或四肢,其中男10例,女10例,年龄21~67岁,平均46岁。两组性别和年龄差异无统计学意义,有可比性。所有组织均制成石蜡标本备用。本研究通过医院医学伦理委员会批准,患者均签署知情同意书。
2.试剂:兔抗人HIF⁃1α多克隆抗体(武汉博士德生物公司);兔抗人P⁃Akt(S473)多克隆抗体(美国Bioworld公司);兔抗人VEGF单克隆抗体、即用型二步法检测试剂盒PV6000、DAB显色剂、TUNEL试剂盒(北京中杉金桥生物技术有限公司)。
二、方法
1.免疫组化法:石蜡切片脱蜡至水化,3%H2O2溶液消除内源性过氧化物酶活性。分别滴加HIF⁃1(1∶50)、VEGF(原液)、P⁃Akt(1∶50)、CD34(原液)。PBS代替一抗作为阴性对照,再滴加二步法试剂PV6000。DAB显色,苏木素复染、脱水封片。TUNEL法:石蜡切片脱蜡至水化,加3%H2O2甲醛。滴加蛋白酶K工作液,37℃孵育30 min;滴加新鲜配置的TUNEL反应液,37℃孵育60 min,并做阴性对照。滴加POD,37℃孵育30 min,DAB显色,苏木素复染、脱水封片。结果 判断:HIF⁃1α、VEGF及P⁃Akt阳性表达,每张切片均观察整体染色情况,在×200视野下选择5个有代表性的区域,每区计算200个细胞。阳性细胞数计分:阳性数<5%计0分;阳性数6%~35%计1分;阳性数36%~70%计2分;阳性数>70%计3分。着色强度计分:不着色计0分;弱着色(淡棕黄色)计1分;强着色(明显棕黄色)计2分。阳性分级:以上两项相加,≤ 2为(⁃);3分为(+);4分为(++);5分为(+++)。MVD测定方法:被染成棕黄色或棕褐色、界限清楚的内皮细胞或内皮细胞团簇均作为一个血管计数。每张切片在×100光镜下挑选血管分布最高区域,在×200镜下选择5个视野,计数微血管个数,计算MVD值。凋亡检测结果以胞核着棕黄色为凋亡细胞,每张切片随机选取5个高倍视野(×400),每个视野计数250个角质形成细胞的凋亡百分比,取平均值为凋亡指数。
2.统计学分析:所得数据用SPSS11.5统计软件分析,组间比较用方差分析和t检验,指标间相关性用Pearson相关分析,P<0.05为差异有统计学意义。
结 果
一、免疫组化结果
HIF⁃1α表达定位于细胞核,呈棕黄色颗粒状表达。在对照组表皮中HIF⁃1α表达弱,在扁平苔藓皮损处HIF⁃1α表达于除角质层以外的表皮全层。扁平苔藓组皮损组织中,HIF⁃1α阳性表达明显高于对照组,两组比较差异有统计学意义(P<0.01)。VEGF表达定位于胞质,呈棕黄色颗粒状表达。在对照组的表皮中VEGF表达弱,主要在基底层细胞及皮脂腺组织中表达。扁平苔藓组中,VEGF阳性表达明显高于对照组,两组比较差异有统计学意义(P<0.01)。P⁃Akt表达定位于胞质,呈棕黄色颗粒状表达。在对照组表皮中P⁃Akt表达弱,主要在基底层细胞及皮脂腺、汗腺组织中表达。扁平苔藓组织中,P⁃Akt阳性表达明显高于对照组,两组比较差异有统计学意义(P<0.01)。见表1,图1~3。
CD34的表达及MVD的测定,CD34在对照组及扁平苔藓组皮损的真皮层中血管内皮细胞的胞质中均为阳性表达。扁平苔藓皮损处MVD为(21.27±6.54)个/高倍视野(×200),对照组MVD为(10.26± 1.10)个/高倍视野(× 200),两组比较,差异有统计学意义(t=5.607,P<0.01)。见图4。
二、凋亡检测
对照组阳性细胞散在分布于颗粒层及棘层,凋亡指数为(28.16±3.464)。扁平苔藓组凋亡细胞主要位于表皮的基底层、棘层、和部分真皮浅层浸润的淋巴细胞,凋亡指数为(72.81±9.234)。扁平苔藓组凋亡指数明显高于对照组(t=8.431,P<0.01)。见图5。

表1 扁平苔藓组和对照组缺氧诱导因子1α(HIF⁃1α)、血管内皮生长因子(VEGF)、蛋白激酶(P⁃Akt)的表达

图1 缺氧诱导因子1α在扁平苔藓组和对照组的表达(×100) 1A:扁平苔藓组棘细胞层和基底细胞层角质形成细胞和少数真皮浅层浸润的淋巴细胞胞核染色阳性;1B:对照组仅在少数棘层角质形成细胞呈弱阳性表达

图2 血管内皮生长因子在扁平苔藓组和对照组中的表达(×100) 2A:扁平苔藓组棘细胞层和基底细胞层的角质形成细胞和部分血管内皮细胞胞质呈阳性表达;2B:对照组仅在基底层角质形成细胞胞质呈弱阳性表达

图3 蛋白激酶B在扁平苔藓组和对照组的表达(×100) 3A:扁平苔藓组棘细胞层、基底层和血管内皮细胞胞质呈阳性表达;3B:对照组仅在基底层胞质呈弱阳性表达
三、相关性分析
经Pearson相关分析,在扁平苔藓组HIF⁃1α与VEGF(r=0.625,P<0.01),VEGF与P⁃Akt(r=0.453,P<0.01),P⁃Akt与HIF⁃1α(r=0.455,P<0.01)的表达呈正相关。HIF⁃1α、VEGF 和 P⁃Akt的表达与MVD均呈正相关(r值分别为0.721,0.646,0.671,P<0.01)。
讨 论
HIF⁃1α是机体低氧应答时诱导基因表达和恢复细胞内环境稳定的一个核心调节因子。缺氧条件下,细胞产生HIF⁃1α与靶基因中的HRE结合点结合,促进其转录,引起一系列细胞对缺氧的适应性反应,在保持机体的氧稳态具有重要的病理生理学意义。目前已知HIF⁃1α的靶基因有60多种,通过对靶基因的调控来调节糖代谢、氧运输、细胞的生长与凋亡[4]。已有研究表明,缺氧条件下人角质形成细胞株HIF⁃1α表达增高,并诱导血管生成,促进角质形成细胞增殖。VEGF是目前所知作用最强的促血管生成因子,与其受体结合后刺激血管内皮细胞增殖,促进新生血管形成。在低氧组织中HIF⁃1α可诱导VEGF表达,并产生相应的生理作用,促进新生血管形成。PI3K/Akt信号通路是近年来研究较多的细胞生存通路之一,在提高细胞对缺氧的耐受性和调节细胞增殖、凋亡中起着重要的作用。PI3K/Akt通路由PI3K和Akt组成,Akt被磷酸化后(P⁃Akt)可上调HIF⁃1α表达,提高组织细胞对低氧环境的耐受性。
扁平苔藓是一种慢性复发性炎症性皮肤病,其病理学改变有毛细血管的增生,表皮角质形成细胞的增生与调亡共存。本研究发现,HIF⁃1α、VEGF和P⁃Akt在脂肪瘤皮肤中均呈阴性或弱阳性表达,而在扁平苔藓皮损组织中表达明显增高;应用CD34标记皮损组织血管,发现扁平苔藓皮损处血管数目也明显高于脂肪瘤皮肤。研究结果提示,扁平苔藓皮损处由于角质形成细胞过度增殖可能导致氧需求增加和局部氧供给相对不足。扁平苔藓皮损组织中的角质形成细胞为适应局部组织的低氧环境产生HIF⁃1α,可能诱导 VEGF表达,进一步激活PI3K/Akt信号通路的关键因子Akt,磷酸化的Akt(P⁃Akt)有可能再促使HIF⁃1α表达增高,促进细胞增殖,加剧局部皮损处缺氧微环境。本研究还显示,扁平苔藓患者皮损中HIF⁃1α、VEGF和P⁃Akt的表达与MVD值亦呈明显正相关,提示扁平苔藓患者皮损HIF⁃1α、VEGF和P⁃Akt的表达增高与其血管增殖密切相关。此外,扁平苔藓皮损处因缺氧也可能通过Caspase依赖的线粒体通路促进细胞凋亡,最终使扁平苔藓皮损处角质形成细胞处于增殖和凋亡亢进的病理性平衡。本研究初步证明了HIF⁃1α、VEGF和P⁃Akt在扁平苔藓的发生、发展和新血管生成中可能起到协同作用,但其具体机制还需进一步研究。
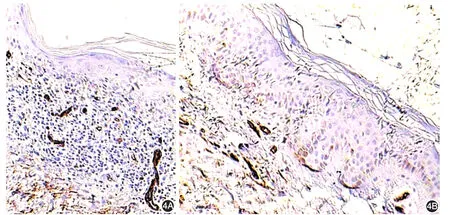
图4 CD34在扁平苔藓组和对照组中的表达(×100) 4A:扁平苔藓组血管内皮细胞胞质呈阳性表达,微血管数目较多;4B:对照组微血管数目较少
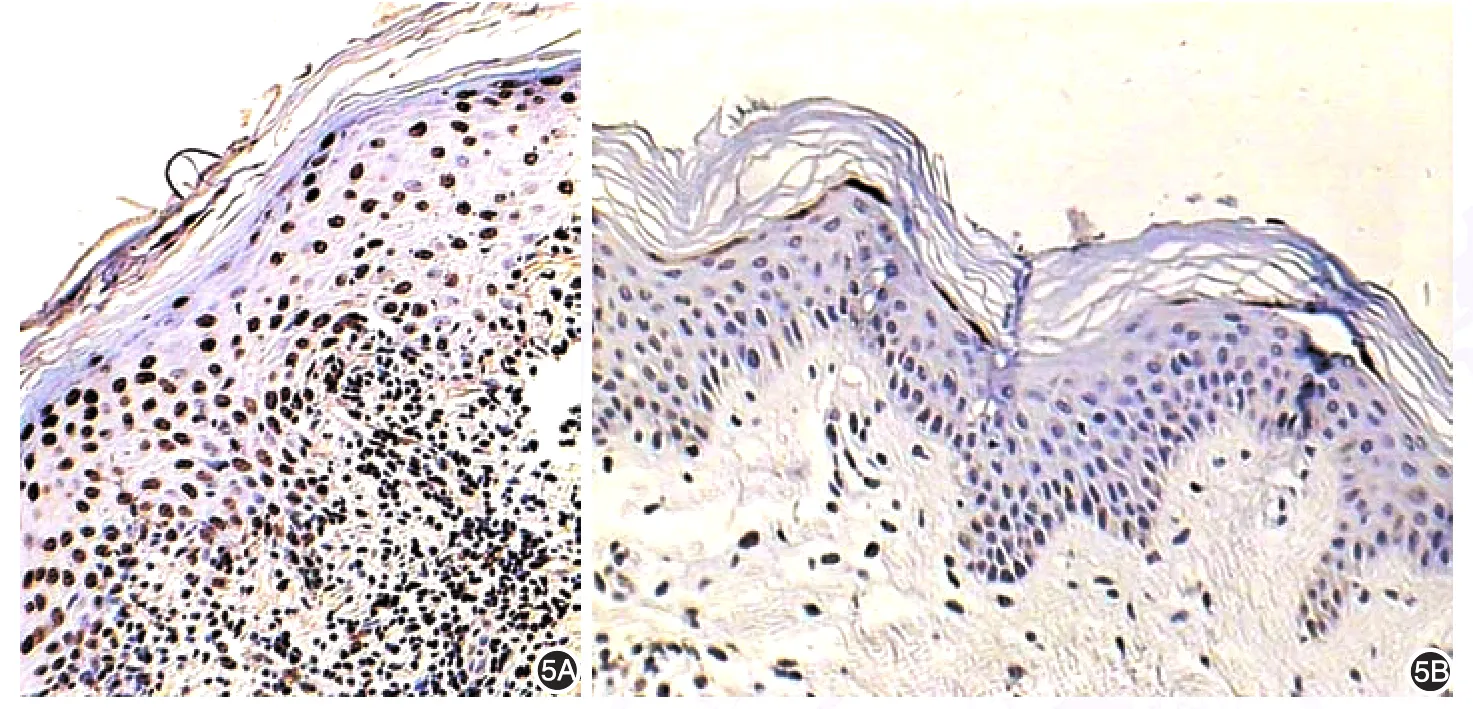
图5 细胞凋亡在扁平苔藓组和对照组中的表达(×100) 5A:扁平苔藓组凋亡细胞主要位于棘细胞层和基底层和部分真皮浅层浸润的淋巴细胞中,且数量较多;5B:对照组凋亡细胞位于颗粒层及少数棘层
[1]Rosenberger C,Solovan C,Rosenberger AD,et al.Upregulation of hypoxia⁃inducible factors in normal and psoriatic skin[J].J Invest Dermatol,2007,127(10):2445⁃2452.DOI:10.1038/sj.jid.5700874.
[2]de CarvalhoFraga CA,Alves LR,Marques⁃Silva L,et al.High HIF⁃1α expression genotypes in oral lichen planus[J].Clin Oral Investig,2013,17(9):2011⁃2015.DOI:10.1007/s00784⁃013⁃0920⁃8.
[3]Ding M,Xu JY,Fan Y.Altered expression of mRNA for HIF⁃1alpha and its target genes RTP801 and VEGF in patients with oral lichen planus[J].Oral Dis,2010,16(3):299⁃304.DOI:10.1111/j.1601⁃0825.2009.01645.x.
[4]Lando D,Gorman JJ,Whitelaw ML,et al.Oxygen⁃dependent regula⁃tion of hypoxia⁃inducible factors by prolyl and asparaginyl hydroxylation[J].Eur J Biochem,2003,270(5):781⁃790.DOI:10.1046/j.1432⁃1033.2003.03445.x.
Expression of hypoxia⁃inducible factor 1α,vascular endothelial growth factor and protein kinase B in lichen planus lesions
Feng Jun,Bai Li,Zhang Xueliang
Department of Dermatology,General Hospital of Datong Coal Mining Group,Datong 037003,Shanxi,China(Feng J,Zhang XL);Department of Dermatology,First Hospital of Shanxi Medical University,Taiyuan 030001,China(Bai L)
Bai Li,Email:baili@medmail.com
ObjectiveTo explore relationships of expression of hypoxia⁃inducible factor⁃1α(HIF⁃1α),vascular endothelial growth factor(VEGF)and protein kinase B(P⁃Akt)with angiopoiesis and cell apoptosis.MethodsBiopsy specimens were collected from skin lesions of 32 patients with lichen planus and normal skin of 20 patients with lipomyoma,and subjected to paraffin embedding.Immunohistochemical staining was performed to measure expression of HIF⁃1α,VEGF and P⁃Akt,and TUNEL technique was used to detect apoptosis of keratinocytes in these paraffin⁃embedded tissue sections.Microvessel density(MVD)wasassessedbycountingCD34⁃labeledvascularendothelialcells.ResultsHIF⁃1α,VEGFandP⁃Akt were moderately or strongly expressed in lichen planus lesions,but absent or weakly expressed in normal skin of controls,and the expression of HIF⁃1α,VEGF and P⁃Akt was significantly higher in the lichen planus group than in the control group(allP< 0.01).HIF⁃1α was mainly expressed in nuclei of keratinocytes,while VEGF and P⁃Akt were expressed in the cytoplasm of keratinocytes.In addition,the lichen planus group showed significantly increased MVD(21.27±6.54vs.10.26±1.10 microvessels/high⁃power(200 ×)field,t=5.607,P< 0.01)and apoptosis rate of keratinocytes(72.81% ± 9.234%vs.28.16% ±3.464%,t=8.431,P<0.01)compared with the control group.Pearson correlation analysis showed that there were positive correlations between HIF⁃1α and VEGF expression,between VEGF and P⁃Akt expression,and between P⁃Akt and HIF⁃1α expression in the lichen planus group(r=0.625,0.453,0.455,respectively,allP< 0.01),and expression of HIF⁃1α,VEGF and P⁃Akt was all positively correlated with MVD(r=0.721,0.646,0.671,respectively,allP< 0.01).ConclusionHIF⁃1α and its downstream target genes VEGF and P⁃Akt may play a certain role in the occurrence of lichen planus.
Lichen planus;Hypoxia⁃inducible factor 1,alpha subunit;Vascular endothelial growth factors;Protein kinases;Apoptosis
白莉,Email:baili@medmail.com
10.3760/cma.j.issn.0412⁃4030.2017.01.005
2016⁃06⁃27)
(本文编辑:吴晓初)

