TAK1基因沉默对TNF-a诱导的滑膜细胞IL-6、IL-8表达的影响*
莫选荣, 谢江文, 吕国菊, 柯于平, 罗心静△
(1. 台州学院医学院基础部, 浙江 台州 318000; 2. 宁波市鄞州区第二医院心内科, 浙江 宁波 315000)
TAK1基因沉默对TNF-a诱导的滑膜细胞IL-6、IL-8表达的影响*
莫选荣1, 谢江文2, 吕国菊2, 柯于平1, 罗心静1△
(1. 台州学院医学院基础部, 浙江 台州 318000; 2. 宁波市鄞州区第二医院心内科, 浙江 宁波 315000)
目的观察转化生长因子β激活激酶1(TAK1)基因沉默对肿瘤坏死因子a(TNF-a)诱导的滑膜细胞中促炎介质白介素-6(IL-6)和白介素-8(IL-8)表达的影响,以探讨TAK1在类风湿关节炎(RA)发病中的作用。方法采取脂质体转染方法将TAK1特异性的小干扰RNA(siRNA)和阴性对照RNA(scRNA)导入类风湿关节炎的滑膜成纤维细胞株MH7A细胞,然后分别用20 ng/ml TNF-a刺激后,检测细胞内IL-6、IL-8 mRNA的表达和培养上清中IL-6和IL-8分泌情况以及p38、ERK、JNK、p65磷酸化的水平和抑制性蛋白IκBα的变化情况。结果siRNA-TAK1转染72 h后滑膜细胞中TAK mRNA和蛋白表达的平均抑制率分别为75%和55%。siRNA-TAK1转染下调TNF-a诱导状态下IL-6和IL-8的表达,并能抑制p38、JNK、p65磷酸化和增加IκBα水平。结论TAK1基因沉默能抑制TNF-a诱导的滑膜细胞IL-6、IL-8表达,可能与其抑制JNK和p38MAPK的活化及NF-κB的活化有关。
类风湿关节炎;滑膜细胞;炎症介质;TAK1
类风湿关节炎(rheumatoid arthritis, RA)是一种以关节滑膜炎症和进行性关节破坏为特征的慢性自身免疫性疾病。关节滑膜成纤维细胞在滑膜炎症和关节破坏中起重要作用,被认为是治疗RA的关键靶细胞[1]。研究表明,滑膜成纤维细胞被炎症细胞因子IL-1和TNF-a激活后合成和分泌促炎介质IL-6、IL-8和基质金属蛋白酶(matrix metalloproteinase,MMP),
使RA炎症反应持续存在并加重关节破坏。而丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPKs)和核因子-κB(nuclear factor- kappa B,NF-κB)信号转导通路在RA炎症介质过度表达中发挥重要作用[2-4]。
转化生长因子β激活激酶1(transforming growth factor-β-activating kinase 1,TAK1)属于丝裂原活化蛋白激酶(mitogen activated protein kinase kinase kinase,MAPKKK)家族成员之一,能被多种促炎细胞介质包括TNF-a、IL-1和LPS激活。活化的TAK1通过激活MAPKK3/6(MKK3/6)导致MAPK途径及NF-κB途径活化而参与炎症、免疫反应等病理生理过程[5]。目前已有研究发现,在RA患者滑膜组织及促炎介质诱导的滑膜细胞中TAK1表达显著升高[6, 7],但其在RA病变中的作用及机制至今仍未阐明。
本研究应用RNA干扰技术阻遏RA滑膜成纤维细胞中TAK1的表达,观察TAK1基因沉默对TNF-a诱导的IL-6、IL-8表达的影响,并探讨其可能机制。
1 材料与方法
1.1 细胞株
类风湿关节炎患者的滑膜成纤维细胞株MH7A(日本)购自广州吉妮欧生物科技有限公司。
1.2 主要试剂
兔抗TAK1多克隆抗体(美国Abcam公司);兔抗p-P38多克隆抗体、兔抗p-JNK多克隆抗体、兔抗p-ERK多克隆抗体、兔抗p-p65多克隆抗体、兔抗IκBα多克隆抗体(均购于美国Cell signaling公司);兔抗GAPDH单克隆抗兔(美国Santa cruz公司);羊抗兔Ig(美国Santa cruz公司);PVDF膜和ECL化学发光液(美国Millipore公司);IL-6和IL-8 ELISA试剂盒(美国RD公司);power SYBR green PCR master mix (美国Applied Biosystems);first strand cDNA synthesis kit (美国Thermo scientific公司);Trizol reagent (美国Invitrogen公司);Lipofectamine RNAimax (美国Invitrogen公司);胎牛血清(美国Life Technologies公司);DMEM(美国Life Technologies公司);重组TNF-a蛋白(美国RD公司);TAK1小干扰RNA(siRNA)序列及阴性对照ScRNA序列由上海吉玛公司合成;TAK1siRNA,正义链为5’GGACAUUGCUUCUA CAAAU3’,反义链为5’GAGUGAAUCUGGA CGUUUA3’.定量PCR引物TAK1、IL-6、IL-8和GAPDH引物由上海捷瑞生物公司合成(表1)。

Tab. 1 Human primers used for quantitative PCR
1.3 滑膜细胞的培养及分组
将MH7A滑膜成纤维细胞株用10%胎牛血清的高糖DMEM培养基培养,并于37℃、5%的CO2的培养箱中孵育。当细胞密度达到90%时,用0.25%胰酶消化并接种于6孔板,实验分为6组,正常对照组(ctrl)、TAK1 siRNA转染组(siTAK1)、阴性siRNA转染组(scRNA)、单纯TNF-a组(TNF)、TAK1 siRNA转染+TNF-a组(siTAK1+TNF)、阴性siRNA转染+TNF-a组(sc+TNF)。每组细胞数接种3复孔,每孔细胞数为5×105。室温下将20 nmol/L TAK1 siRNA或scRNA RNAiMax混合物分别转染siTAK1组、siTAK1+TNF组和scRNA组、sc+TNF组滑膜细胞。于37℃、5%的CO2的培养箱中孵育后72 h换液,ctrl组、siTAK1组和scRNA组换为含10%胎牛血清DMEM培养液,TNF组、siTAK1+TNF组、sc+TNF组换为终浓度为20 ng/ml的TNF-a培养基。37℃条件下继续培养4 h或24 h,分别收集细胞或上清用于 IL-6和IL-8 mRNA和蛋白质表达分析。
1.4 TAK1 siRNA转染
按照Lipofectamine RNAiMax试剂盒的操作说明进行,将20 nmol/L TAK1 siRNA或ScRNA和RNAiMax混合物转染滑膜细胞,分别用定量PCR和Western blot检测抑制效果。
1.5荧光定量PCR法检测IL-6和IL-8mRNA的表达
滑膜细胞经TNF-a处理4 h后,收集细胞,采用Trizon法提取总RNA。按cDNA合成试剂盒的操作说明,将RNA经逆转录成cDNA。PCR反应总体积为20 μl,包括10 μl power SYBR green PCR master mix, 100 ng cDNA and 0.2 mol/L 正义和反义引物。循环参数:95℃ 5 min预变性,95℃变性1 min,60℃复性和延伸30 s,共40个循环。最后72℃延伸5 min。GAPDH作为内参对照,定量采用比较Ct 法 (2-ΔΔCt)。
1.6Westernblot法检测磷酸化P38、JNK、ERK及p65、IκBα蛋白的表达
滑膜细胞经TNF-a处理15 min后,收集细胞,加入RIPA裂解液冰上裂解30 min,高速离心,收集蛋白上清。采用BCA法测定蛋白浓度,取20~30 μg蛋白上清与上样缓冲液混合,100℃煮沸10 min,样本经10% SDS-PAGE电泳分离后,采用湿转法(380 mA,50~60 min)将蛋白转移至PVDF膜上。将膜浸入含有5%脱脂奶粉的封闭液中,室温封闭2 h。然后加入羊抗兔TAK1抗体(1:1 000)、羊抗兔p-P38抗体(1:1 000)、兔抗p-JNK多克隆抗体(1:1 000)、兔抗p-ERK多克隆抗体(1:1 000)、兔抗p-p65多克隆抗体(1:1 000)、兔抗IκBα多克隆抗体(1:500)、羊抗兔GAPDH抗体(1:1 000)等,4℃孵育过夜,漂洗后,加入HRP标记的羊抗兔Ig (1:5 000),反应1 h。ECL化学发光底物检测膜上的抗原-抗体复合物, 置凝胶成像系统成像,灰度分析。GAPDH为内参照物。
1.7 酶联免疫吸附法(ELISA)
TNF-a处理滑膜细胞24 h后,收集细胞培养上清,用ELISA法检测上清中IL-6和IL-8,具体步骤按试剂盒说明书进行。
1.8 统计学处理
2 结果
2.1 TAK1基因沉默效果的评价
荧光定量PCR结果显示,与未处理的滑膜细胞相比,siRNA TAK1转染滑膜细胞48~72 h后TAK1 mRNA表达量显著降低(P<0.05),而scRNA转染的滑膜细胞TAK1 mRNA表达量与未处理细胞相比则无显著差异。siRNA转染滑膜细胞72 h时TAK1 mRNA表达抑制效果最佳,平均抑制效率为75%(图1A)。Western blot结果显示,siRNA TAK1转染48~72 h后滑膜细胞TAK1蛋白表达量与正常对照相比显著降低(P<0.05),而scRNA转染的滑膜细胞TAK1 蛋白表达量与正常细胞相比则无显著差异。siRNA转染滑膜细胞72 h时TAK1蛋白平均抑制效率为55%(图1B)。

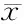
Human fibroblast-like synoviocyte lines, MH7A cells,were left untreated (Ctrl) or transiently transfected with siRNA TAK1 (si-TAK1) or scrambled siRNA (scRNA) for the indicated times. The expression of TAK1 mRNA and protein was assessed by real-time PCR (A) and by Western blot (B) respectively
*P<0.05vsthe untreated cells (Ctrl)
2.2 TAK1基因沉默对IL-6和IL-8表达的影响
荧光定量PCR结果显示,与未处理的正常细胞相比,基础状态时siRNA TAK1转染的滑膜细胞IL-6和IL-8 mRNA的表达呈下降趋势,但并没有显著性差异。TNF-a刺激4 h时,IL-6和IL-8 mRNA的表达明显升高。siRNA转染能显著抑制TNF-a诱导的IL-6和IL-8 mRNA的表达(P<0.05)。而scRNA转染的滑膜细胞IL-6和IL-8 mRNA表达与正常细胞相比则无显著差异(图2A、2C)。ELISA实验显示,TNF-a 刺激24 h时,滑膜细胞分泌的IL-6和IL-8明显升高。siRNA转染显著抑制TNF-a诱导的滑膜细胞IL-6和IL-8蛋白的生成和分泌(P<0.05)。而scRNA转染的滑膜细胞分泌的IL-6和IL-8与正常细胞相比则无显著差异(图2B、2D)。

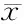
Human fibroblast-like synoviocyte lines, MH7A cells, were transiently transfected with siRNA TAK1 (si-TAK1) or scrambled siRNA (scRNA) for 72 h, then incubated with TNF-α (20 ng/ml) for 4 h or 24 h. IL-6 (A, B) and IL-8 (C, D) expression was assessed by real-time PCR and ELISA)
*P<0.05vsthe untreated cells (Ctrl);#P<0.05vsTNF-α group
2.3 TAK1基因沉默对MAPK活化的影响
Western blot结果显示,与scRNA转染的滑膜细胞相比,siRNA转染能显著抑制TNF-a诱导的P38和JNK的磷酸化,对TNF-a诱导的ERK的磷酸化无显著影响(图3)。
2.4 TAK1基因沉默对NF-kB活化的影响
Western blot结果显示,与scRNA转染的滑膜细胞相比, siRNA TAK1转染能显著抑制基础状态或TNF-a刺激下滑膜细胞p65的磷酸化,并且能上调 IκBa 的表达(图4)。
3 讨论
实验关节炎动物和临床患者关节炎的研究表明,滑膜成纤维细胞是类风湿关节炎(RA)关节滑膜炎症和关节破坏的主要效应细胞[8]。滑膜成纤维细胞能被促炎细胞因子TNF-a、IL-1激活并合成和分泌促炎介质。其中IL-6和IL-8是RA滑膜成纤维细胞合成和分泌的主要促炎介质[9],在RA关节滑膜炎症和骨质破坏中起到重要作用。IL-6被认为是参与炎症的重要细胞因子,它不仅能促进T淋巴细胞的活化和B淋巴细胞的分化,还能调节急性反应期蛋白及其它炎症介质的生成,参与多种自身免疫性疾病,包括RA的病理过程。IL-8是重要的趋化因子,能趋化募集血液中的中性粒细胞、单核细胞及淋巴细胞,在这些炎性细胞的渗出中起重要作用。RA患者的血浆和关节液中IL-6和IL-8水平显著升高,并且与RA病变的活动性呈正相关[10]。RA患者或实验性关节炎大鼠实验表明,封闭这些细胞因子及与其受体能显著缓解病情进展和减轻关节炎症状[11, 12]。我们和其他学者研究表明MAPKs和NF-κB信号转导途径参与了RA滑膜细胞中IL-6和IL-8生成的调节[3, 13,15]。


Human fibroblast-like synoviocyte lines, MH7A cells, were transiently transfected with siRNA TAK1 (si-TAK1) or scrambled siRNA (scRNA) for 72 h, then incubated with TNF-α (20 ng/ml) for 15 min. The phosphorylation of P38,JNK and ERK was examined by Western blot
*P<0.05

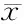
Human fibroblast-like synoviocyte lines, MH7A cells, were transiently transfected with siRNA TAK1 (si-TAK1) or scrambled siRNA (scRNA) for 72 h, then incubated with TNF-α (20 ng/ml) for 15 min. The levels of p-p65 and nuclear factor of kappa light polypeptide gene enhancer in B-cells in hibitor, alpha(IκBa) was examined by Western blot
*P<0.05
TAK1作为MAPKKKs 家族成员之一,与免疫细胞胞质中TAK1结合蛋白(TAK1-binding protein,TAB1/2)结合形成复合物,通过激活MAPKK3/6(MKK3/6)后,再进一步激活P38、JNK和ERK等MAPK信号转导途径[5]。近年来发现TAK1在类风湿关节炎滑膜组织表达明显升高,并且可能与实验性关节炎病变进展有关[6]。体外实验表明,TAK1在IL-1诱导的RA滑膜细胞中表达显著升高,抑制其表达则显著下调金属蛋白酶3(MMP-3)和IL-6的表达[14]。我们应用siRNA高效抑制滑膜细胞TAK1表达,结果发现,TAK1基因沉默能抑制TNF-a诱导的IL-6和IL-8的表达,表明TNF-a通过TAK1诱导了IL-6和IL-8基因表达。我们研究提示TAK1可能参与滑膜细胞炎症介质IL-6和IL-8的过度表达而在RA发病中起重要作用。
为了进一步阐明TAK1调控炎症因子的分子机制,我们检测了TAK1对下游MAPK途径信号分子P38,JNK和ERK活化的影响,结果发现,TAK1基因沉默滑膜细胞后TNF-a诱导的P38、JNK磷酸化水平明显减少,而ERK磷酸化水平并没有明显改变,表明TAK1可能激活P38、JNK信号途径调节TNF-a诱导的IL-6和IL-8表达。
作为炎症反应信号转导途径上游重要的激酶,TAK1除了参与MAPK信号途径的调节外,也参与NF-κB信号途径的活化。NF-κB 是调节炎症反应重要的转录因子,一般是由p65和p50 亚单位组成的异源二聚体。在未激活状态下, NF-κB 与抑制蛋白IκB 结合以无活性的形式存在于胞浆。当细胞受炎症介质激活后解除 IκB 对NF-κB 的抑制作用,促进NF-kB核易位,继而激发炎症相关基因的表达[16]。研究表明,TAK1与TAK1结合蛋白(TAB1)结合,激活NF-κB诱导激酶(NIK)和IkB激酶(IKK),参与IL-1β激活的NF-κB活性的调节[5]。我们也观察了TAK1基因沉默对TNF-a诱导的滑膜细胞NF-κB途径活化的影响。Western blot结果发现滑膜细胞中TAK1表达阻遏后,NF-κB(p65)磷酸化水平降低,而抑制性蛋白IκBα的表达升高,这些结果表明TAK1基因沉默能抑制TNF-a诱导的NF-κB的活化。以上结果表明,TAK1参与滑膜细胞NF-κB途径的活化调节而参与RA炎症。
总之,我们实验结果表明TAK1参与TNF-a诱导的滑膜细胞炎症介质IL-6和IL-8表达的调节,其机制可能与其激活下游信号分子JNK、P38及NF-κB活化有关,TAK1在RA滑膜炎症反应调节中可能起重要调节作用,并可能作为RA治疗中的一种新的靶点。我们下一步动物实验将进一步验证TAK1基因沉默对实验性关节炎动物滑膜炎症和关节破坏的影响。
[1] Sato S, Sanjo H, Takeda K,etal. Essential function for the kinase TAK1 in innate and adaptive immune responses[J].NatImmunol, 2005, 6(11): 1087-1095.
[2] Meyer LH, Pap T. MAPK signalling in rheumatoid joint destruction: can we unravel the puzzle[J].ArthritisResTher, 2005, 7(5): 177-178.
[3] Neff L, Zeisel M, Sibilia J,etal. NF-kappaB and the MAP kinases/AP-1 pathways are both involved in interleukin-6 and interleukin-8 expression in fibroblast-like synoviocytes stimulated by protein I/II, a modulin from oral streptococci[J].CellMicrobiol, 2001, 3(10): 703-712.
[4] Hammaker D, Sweeney S, Firestein GS. Signal transduction networks in rheumatoid arthritis[J].AnnRheumDis, 2003, 62(Suppl 2): ii86-89.
[5] Delaney JR, Mlodzik M. TGF-beta activated kinase-1: new insights into the diverse roles of TAK1 in development and immunity[J].CellCycle, 2006, 5(24): 2852-2855.
[6] Geurts J, van den Brand BT, Wolf A,etal. Toll-like receptor 4 signalling is specifically TGF-beta-activated kinase 1 independent in synovial fibroblasts[J].Rheumatology(Oxford), 2011, 50(7): 1216-1225.
[7] Hammaker DR, Boyle DL, Chabaud-Riou M,etal. Regulation of c-Jun N-terminal kinase by MEKK-2 and mitogen-activated protein kinase kinase kinases in rheumatoid arthritis[J].JImmunol, 2004, 172(3): 1612-1618.
[8] Mor A, Abramson SB, Pillinger MH. The fibroblast-like synovial cell in rheumatoid arthritis: a key player in inflammation and joint destruction[J].ClinImmunol, 2005,115(2): 118-128.
[9] Georganas C, Liu H, Perlman H,etal. Regulation of IL-6 and IL-8 expression in rheumatoid arthritis synovial fibroblasts: the dominant role for NF-kappa B but not C/EBP beta or c-Jun[J].JImmunol, 2000, 165(12): 7199-7206.
[10]Matsumoto T, Tsurumoto T, Shindo H. Interleukin-6 levels in synovial fluids of patients with rheumatoid arthritis correlated with the infiltration of inflammatory cells in synovial membrane[J].RheumatolInt, 2006, 26(12): 1096-1100.
[11]Hennigan S, Kavanaugh A. Interleukin-6 inhibitors in the treatment of rheumatoid arthritis[J].TherClinRiskManag, 2008, 4(4): 767-775.
[12]Choy E. Inhibiting interleukin-6 in rheumatoid arthritis[J].CurrRheumatolRep, 2008, 10(5): 413-417.
[13]Nanki T, Nagasaka K, Hayashida K,etal. Chemokines regulate IL-6 and IL-8 production by fibroblast-like synoviocytes from patients with rheumatoid arthritis[J].JImmunol, 2001, 167(9): 5381-5385.
[14]Klatt AR, Klinger G, Neumuller O,etal. TAK1 downregulation reduces IL-1beta induced expression of MMP13, MMP1 and TNF-alpha[J].BiomedPharmacother, 2006, 60(2): 55-61.
[15]罗心静, 莫选荣, 周玲玲. Hsp72对类风湿关节炎滑膜细胞IL-6、IL-8表达及NF-kB活化的影响[J]. 中国应用生理学杂志, 2012, 28(4): 336-339.
[16]张国霞, 周爱玲, 张贵萍, 等. 大鼠海马神经元 TLR4 介导的 MyD88 依赖途径在神经炎症中的作用[J]. 中国应用生理学杂志, 2013, 29(1): 42-46.
EffectsofTAKgenesilencingontheexpressionsofIL-6andIL-8inducedbyTNF-αinfibroblast-likesynoviocytes
MO Xuan-rong1, XIE Jiang-wen2, LV Guo-ju2, KE Yu-ping1, LUO Xin-jing1△
(1. Department of Basic Medical Sciences, School of Medicine of Taizhou University, Taizhou 318000;2. Department of Cardiology, Yingzhou District Second people's Hospital, Ningbo 315000, China)
Objective: To investigate the effects of silencing transforming growth factor-β activating kinase 1 (TAK1)on the expressions of IL-6 and IL-8 induced by TNF-α in fibroblast-like synoviocytes, and to explore the role of TAK1 in rheumatoid arthritis (RA).MethodsThe synthesized TAK1 siRNA and scrambled siRNA (ScRNA) were transferred into cultured RA fibroblast-like synoviocyte line MH7A by lipofectamine. The expressions of the pro-inflammatory mediator IL-6 and IL-8 and the levels of phospho-P38(p-P38), phospho-C-Jun NH2-terminal kinase(p-JNK), phospho-extracellular signal-regulated kinase(p-ERK), phospho-p65(p-p65) and nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor, alpha(IκBa) were examined.ResultsSilencing of TAK was demonstrated in synoviocytes transfected by TAK siRNA. TAK1 silencing markedly attenuated the expression of IL-6 and IL-8 in the presence of TNF-α. TAK1 silencing inhibited the activation of p38 and JNK MAPK. TAK1 silencing also inhibited activation of nuclear factor-κB (NF-κB).ConclusionTAK1 silencing attenuated the expression of IL-6 and IL-8 in synoviocytes induced by TNF-αviainhibiting the activation of p38, JNK MAPK and NF-κB.
rheumatoid arthritis; synoviocytes; inflammatory mediators; TAK1
R392.12
A
1000-6834(2017)05-471-05
10.12047/j.cjap.5494.2017.113
国家自然科学基金面上项目(81373139);浙江省自然科学基金(LY16H100001);浙江省医药卫生科研项目(2015KYA206)
2016-09-09
2017-05-12
△
Tel: 15068647955; E-mail: luoxjing@126.com

