腹腔注射给药Ghrelin对小鼠神经再生的影响*
赵志红
(天津市环湖医院神经内科,天津 300350)
腹腔注射给药Ghrelin对小鼠神经再生的影响*
赵志红
(天津市环湖医院神经内科,天津 300350)
目的 探讨腹腔注射给药Ghrelin对小鼠海马神经再生的影响。方法 本研究将小鼠随机分为Ghrelin组及对照组,两组均腹腔注射相同剂量BrdU (100 mg/kg, 早晚各1次,连续5天),目的用来标记海马齿状回颗粒细胞下区(Subgranular Zone,SGZ)增生的细胞。处理组小鼠给予腹腔注射Ghrelin(80 μg/kg, 一天一次,连续8 d),而对照组注射等量的生理盐水。1周后进行免疫组化分析。结果 BrdU 免疫阳性(BrdU+)细胞在海马齿状回中广泛表达; Ghrelin处理组BrdU+细胞数显著多于生理盐水对照组(t=3.43,P<0.01)。结论 腹腔注射Ghrelin(80 μg/kg)促进海马齿状回神经再生。
Ghrelin ;BrdU;海马;神经再生
Ghrelin是一种肽类激素,由28个氨基酸构成,起初被发现是从鼠的胃中分离出的,且其受体为生长激素促泌素受体(GHSR)[1],多肽类Ghrelin由胃内分泌细胞产生及分泌[2],随后释放到全身体循环发挥相应的效应。迄今为止,GHS-R1a是发现的唯一一个有功能的Ghrelin受体,这种典型的受体,即G蛋白偶联的7-跨膜受体,最开始是在垂体和下丘脑中表达[3]。此外, GHS-R1a也在海马齿状回也有高度表达,大量研究已经证实,Ghrelin影响垂体激素的分泌、食欲、代谢、胃肠功能系统。但关于Ghrelin对神经细胞的影响的研究几乎未涉及过,本研究将探讨腹腔注射给药Ghrelin对小鼠海马神经再生的影响。
1 材料和方法
1.1材料
该实验选用的小鼠,为成熟雄性小鼠(C57/Bl6),2~3个月,体重约25~30 g,在北京维通利华公司购买。小鼠生活的环境:室温(22±1)℃,湿度 (40%±5%),且24 h昼夜循环饲养,饮水和进食自由。
1.2重要试剂与相关仪器
Ghrelin:由美国phoenix公司提供,用0.9%盐水配成300 μM溶液,并冻存于80 ℃,当使用时再稀释所需浓度。BrdU:购买于美国sigma公司, 直接用0.1 MPBS溶液配成100 mg/kg。一抗:BrdU抗体(Rat),美国ABD公司产品, (11)二抗:Alexa Fluor 488 chicken anti-Rat,美国Invitrogen公司产品;封闭用羊血清、甘油、Triton-X-100、PBS缓冲液由上海试剂一厂产品。CM-1900冰冻切片机(Leica,德国);LSM高灵敏度激光共聚焦显微镜(Zeiss, Jena, 德国)。
1.3实验方法
1.3.1分组 将小鼠随机分为Ghrelin组及对照组,每组20只,两组均腹腔注射相同剂量BrdU(100 mg/kg,早晚各1次,连续5天),目的用来标记海马齿状回颗粒细胞下区(Subgranular Zone,SGZ)增生的细胞。处理组小鼠给予腹腔注射Ghrelin(80 μg/kg, 一天一次,连续8天),而对照组注射等量的生理盐水。
1.3.2取材及标本制备 将小鼠用8%水合氯醛溶液(400 mg/kg)充分麻醉后,开胸,充分暴露心脏,将针头从心尖刺入左心室,快速灌注生理盐水,待双肺变白换为4%多聚甲醛溶液,灌注30 min后断颅取脑,置于4%多聚甲醛溶液中24 h。然后把脑组织转移至30%蔗糖中,浸泡约24~48 h,用包埋液把小鼠脑包埋好,放置到振动式切片机固定好,制作为50 μm厚度的水平面脑片,背侧海马的脑片全部收藏(24~32张),分为4套,每套6~8张脑片,后置于24孔板里,并放置4 ℃冰箱保存。各只小鼠挑选1套脑片,行免疫荧光染色。
1.3.3免疫荧光染色步骤 对所选脑片采用漂染法,并行免疫荧光染色。操作步骤如下:将脑片用0.1 MPBS漂洗3次,后转到1 N盐酸(HCl)孵育半小时,该过程在45 ℃水浴锅进行,目的是使DNA变性(将其双链打开),转到0.1 MPBS漂洗3次,每10 min漂洗一次,后将所有脑片置于封闭液中孵育1 h,目的是减轻或消除一些非特异性反应,本次之后不漂洗,后转到一抗溶液[BrdU (Rat 1∶500)](由封闭液配制),再孵育48~72 h,该过程需避光并在4 ℃摇床进行,使脑片充分接触;转到0.1 M PBS漂洗3次,每10 min漂洗一次;再转至封闭液配制的二抗溶液中,该过程在常温即可,但需锡箔纸包裹,且避光孵育2 h,转到0.1 MPBS漂洗3次,每10 min漂洗一次;将脑片转到载玻片上,需较暗的环境下进行,后避光晾干,滴上含甘油的保护液,用盖玻片封闭,最后将处理好的脑片全部置于4 ℃冰箱内备用;用荧光共聚焦显微镜扫描计数。
1.4统计分析
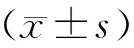
2 结 果
2.1BrdU+细胞在海马齿状回表达
箭头所示绿色信号为BrdU+细胞,见图1,两组荧光免疫组化结果显示,BrdU+细胞在海马齿状回均广泛表达(200倍)。
2.2两组BrdU+细胞数比较
Ghrelin处理组BrdU+细胞数(202.91±11.83)与生理盐水对照组(157.20±6.17)比较,见图2,差异有显著意义(t=3.43,P<0.01)。

图1 两组BrdU+细胞的表达

图2 两组BrdU+细胞数比较
3 讨 论
海马齿状回颗粒细胞下区(subgranular zone,SGZ)神经元具有干细胞特点,即自我更新和多向分化等潜能,因此被称为神经干细胞(adult neural stem cell,ANSC)。在啮齿动物中,SGZ的细胞再生功能自始至终存在,但是并随着年龄的增加而逐渐减弱[4]。本研究结果揭示了海马齿状回神经细胞具有再生能力,同时证明了Ghrelin促进海马齿状回神经再生。5-溴脱氧尿核苷(5’-bromo-2’-deoxyuridine,BrdU),一种胸苷类似物,参与细胞有丝分裂DNA合成,且同内源性胸苷相互竞争性的结合到DNA中。研究显示,BrdU一旦结合到DNA中,就持续存在,而且随着细胞有丝分裂逐步传递给下一代。应用特异性的抗体作用于已固定的的脑组织,发现在几天,几周,几个月,或是几年之后仍可检测BrdU标记的神经元[5]。通常来说,小鼠腹腔注射BrdU,可通过血脑屏障,这是关于神经细胞再生相关研究的金标准。BrdU标记可以检测到神经再生中增生细胞[6-8]。在啮齿类动物中,SGZ每天都会产生许多新生的神经元,通常在给药BrdU三天后,BrdU标记的新生神经细胞数目达到最高峰,其后新生神经元随时间推移因凋亡逐渐减少。狭义神经再生是指成熟中枢神经系统中细胞的增殖和神经元的分化。广义神经再生除了该项内容,还包括另一阶段即新形成的神经元的存活,本研究证实了腹腔给药 Ghrelin促进海马齿状回神经再生。但外源性Ghrelin是否可以保护脑缺氧缺血而造成的细胞死亡,仍需进一步研究。倘若可以提高神经元存活,又是通过何种机制呢,需进一步研究探讨。
记忆功能障碍相关性疾病与海马神经元病态有密切关系,相对比较常见的是与缺血性脑损伤及癫痫等疾病。相关研究显示,在缺血性脑损伤中,记忆力减退及认知功能障碍可由海马神经元缺失或退化引起。常见的生长因子,比如胰岛素样生长因子-1、血管内皮生长因子,可直接作用于海马新神经元再生,或者间接途径通过神经营养促进作用而提高海马新生神经元存活[9]。而另一些研究证明,在癫痫后出现的记忆损害与神经再生也有相关联系,即抑制海马神经再生[10-11]。腹腔注射Ghrelin促进海马齿状回的神经再生,然而海马神经损害可以被缺血性脑损伤及癫痫所诱发,综上所述,给药Ghrelin刺激海马神经再生,这一促进效应在提高认知能力以及抑制神经元缺失或凋亡等方面都起着重要作用,这一说法好像合乎情理,但仍需进一步研究探讨核实。
[1] Hosoda,H.et al.Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue[J]. Biochem. Biophys. Res. Commun,2006,279:909-913.
[2] Bednarek,M.A.et al. Structure-function studies on the new growth hormone-releasing peptide, ghrelin: minimal sequence of ghrelin necessary for activation of growth hormone secretagogue receptor 1a[J]. Med. Chem,2010,43:4370-4376.
[3] Gnanapavan S,Kola B,Bustin SA,et al.The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans[J]. Clin Endocrinol Metab,2002,87:2988-2990.
[4] Kojima M,Hosoda H,Date Y,et al. (2003) Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J]. Nature,2003,402:656-660.
[5] Kojima,M, Kangawa, K. Ghrelin: structure and function[J].Physiol.Rev,2012,85, 495-522.
[6] Izquierdo I,Medina JH,Vianna MR,et al. Separate mechanisms for short- and long-term memory[J]. Behav Brain Res,2015,103(1):1-11.
[7] Izquierdo I,Barros DM,Mello e Souza T,et al. Mechanisms for memory types differ[J]. Nature,2008,393(6686):635-636.
[8] Izquierdo I,Izquierdo LA,Barros DM,et al. Differential involvement of cortical receptor mechanisms in working, short-term and long-term memory[J]. JH Behav Pharmacol,2013,9(5-6):421-427.
[9] Grote HE,Hannan AJ.Regulators of adult neurogenesis in the healthy and diseased brain[J]. Clin Exp Pharmacol Physiol,2014,34:533-545.
[10] 刘艳,徐珞. 隔核在海马ghrelin调控学习记忆的作用[J]. 中华行为医学与脑科学杂志,2011,47(6):474-476.
[11] Butler CR,Zeman AZ.Recent insights into the impairment of memory in epilepsy: transient epileptic amnesia,accelerated long-term forgetting and remote memory impairment[J].Brain,2015,131:2243-2263.
Effects of intraperitoneal injection of Ghrelin on neural regeneration in mice
ZHAO Zhi-hong
(Dept.of Neurology,Tianjin Huanhu Hospital,Tianjin 300350,China)
Objective:To explore the effect of intraperitoneal injection of Ghrelin on hippocampus neurogenesis.Methods: Mice were randomly divided into Ghrelin group and control group.Both groups were given intraperitoneal injection of equal BrdU (100 mg/kg, twice a day, continuous injection of 5 days) to mark proliferating cells of the hippocampal dentate gyrus Subgranular Zone(SGZ). Ghrelin was given intraperitoneal injection (80 μg/kg, once a day, continuous injection of 8 days), the control group mice were offered same volume normal saline. After 1 week, both were immunohistochemical analysis.Results:BrdU-immunopositive cells widely expressed in the hippocampal dentate gyrus, the number of BrdU+ cells observed in Ghrelin treatment groups were significantly much more than that in control groups(t=3.43,P<0.01).Conclution:Our results indicated that intraperitoneal injection of Ghrelin (80 μg/kg) induced neurogenesis in hippocampus.
Ghrelin;BrdU;hippocampus;neurogenesis
赵志红(1985—),女,天津人,医师,硕士,主要从事神经内科工作。
R741
A
1004-7115(2017)10-1126-03
10.3969/j.issn.1004-7115.2017.10.015
2017-08-18)

