负载型铂催化剂催化氧化甲醛的研究进展
崔维怡,惠继星,谭乃迪
负载型铂催化剂催化氧化甲醛的研究进展
崔维怡1,惠继星2,谭乃迪3
(1吉林化工学院化工清洁生产技术吉林省高校重点实验室,吉林吉林132022;2中国石油吉林石化公司研究院,吉林吉林132021;3吉林化工学院化学与制药工程学院,吉林吉林132022)
建筑和装饰材料中缓慢释放的甲醛是一种主要的室内空气污染物,长期暴露在较低浓度的甲醛环境里会严重危害人类的身体健康。催化氧化法是一种非常有效的消除甲醛技术,能在较为温和的条件下将甲醛完全转化为二氧化碳和水。负载型铂催化剂对甲醛催化氧化反应表现出较为优异的催化性能,受到广泛研究和关注。本文综述了近年来该类催化剂的研究进展,主要探讨了制备方法、载体种类和形貌、添加助剂及反应条件参数等因素对负载型铂催化剂上甲醛催化氧化性能的影响;并归纳了一部分甲醛催化氧化的反应机理。分析认为:负载型铂催化剂在低温条件下具有很强的活化分子氧的能力,从而使其对甲醛低温催化氧化反应表现出很高的催化活性。另外还对负载型铂催化剂未来的研究发展方向进行了展望:应通过优化和改进催化剂制备方法和策略,提高铂原子的利用率,产生更多的表面/界面活性中心,继而进一步提高催化剂的性能;借助一些先进的表征技术如氧同位素示踪技术和理论计算的方法深入研究甲醛催化氧化反应机理等基础问题。
甲醛;催化;氧化;负载型铂催化剂;活性
甲醛是一种重要的经济化学品,同时也被世界卫生组织认定为严重的环境污染物,是导致人类罹患癌症和畸变等严重疾病的罪魁祸首之一[1-3]。在过去的20年里,中国的甲醛工业得到了空前发展,生产量和消耗量占全球甲醛总量的三分之一,是世界上最大的甲醛生产者和消费者,其中超过65%的甲醛产量用来生产胶合板、纤维板等木材家具制品所用的树脂——是室内空气甲醛污染的主要来源[4]。甲醛具有高毒性,严重危害人类身体健康,暴露在甲醛污染的环境下,短期内会出现眼睛刺痛、鼻刺痛、咽喉痛;长期会引起慢性中毒、损害神经系统、引起染色体突变、癌变等问题[5-7]。当前,人们大部分时间都是在室内度过的,室内空气质量已经引起了人们广泛的关注。针对室内空气污染物甲醛,世界卫生组织颁布了室内甲醛的限定浓度为0.1mg/m3,一些国家,例如日本和英国,非职业性室内甲醛浓度限定为0.1mg/m3,加拿大、德国和新加坡的甲醛浓度限定为0.123mg/m3,我国也发布了室内甲醛的限定浓度标准[4],见表1。因此,当前亟待解决的问题就是消除室内空气中的甲醛,满足严格的环境标准和人类健康的需要。
近年来,由装修导致的室内甲醛浓度超标严重危害人体健康的事件频频被报道,越来越多的学者致力于解决甲醛污染治理问题并做了大量的研究。目前,国内外一些空气净化技术,如吸附法[8]、光催化氧化法[9]、热催化氧化法[10-12]、等离子氧化法[13]和生物降解法[14]等都被研究用来消除室内空气中的甲醛污染。传统的吸附法虽然能够消除甲醛,但是受到吸附剂的吸附容量、失活和再生更换等问题限制;光催化法和等离子体技术能有效净化室内甲醛,但需要光源和额外的设备,并且在净化甲醛过程中还易产生有毒的副产物;生物降解法对甲醛消除是一个环境友好的方法,但是降解速率较低,微生物的生命周期一直是一个问题。热催化氧化法在室温下就可以将甲醛氧化生成二氧化碳和水,并且反应过程中节省能源、操作简单、环境友好,其高效的甲醛消除能力成为广受瞩目的研究热点。当前广泛应用于该方法的催化材料主要分为:非贵金属催化剂(Co3O4[15]、MnO[16]、CeO2[17])和贵金属催化剂(Au/CeO2[18]、Pt/Fe2O3[19]、Pd/TiO2[20]、Ag/MnO2[21])两类。其中,负载型铂催化剂性能优异,例如,Pt/TiO2[22]、Pt/SiO2[23]、Pt/AlOOH[24]、Pt/NiO[25]等(表2)在室温下就可将甲醛全部分解,被认为是一种具有广阔应用前景的甲醛消除技术。近年来该技术受到人们广泛的关注,获得了较大进展。本文着重介绍了负载型铂催化剂应用在甲醛催化氧化反应中影响催化性能的因素、催化反应机理及发展趋势。
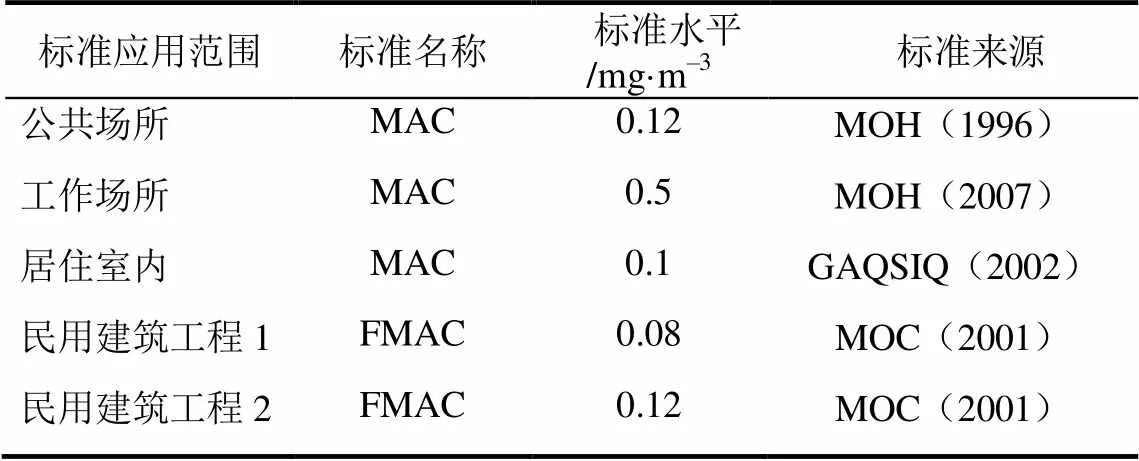
表1 我国室内甲醛浓度限定标准
注:MAC为甲醛最大浓度;FMAC为游离甲醛最大浓度;MOH为卫生部;GAQSIQ为质量监督检验检疫总局;MOC为建设部。
1 影响甲醛催化氧化性能的因素
在甲醛氧化反应中,有许多因素影响着催化性能,例如,制备方法、载体的形貌结构、添加助剂和反应条件参数等都会对催化效率产生一定作用。本文主要从以下几个因素进行综述。
1.1 制备方法的影响
催化剂制备方法上的差异主要表现在铂粒子尺寸、表面氧化价态、金属分散度、表面氧物种以及金属载体相互作用等方面,在甲醛氧化反应中,催化剂这些方面的因素都与催化性能密切相关。
HUANG等[29-31]研究发现,采用浸渍法得到的Pt/TiO2催化剂中铂粒子尺寸要比沉积沉淀法小,高活性的Pt/TiO2催化剂中贵金属铂粒子的尺寸在1~4nm。对于Pt/TiO2-R-650催化剂,铂粒子尺寸为10.1nm,TOF为104.39s−1,进一步增大铂粒子尺寸,TOF就会下降。在一定的粒径范围内,较小的粒子尺寸可以增大铂粒子的比表面积和利用率,但是粒子尺寸对催化活性的影响并不是简单的关系,还与铂粒子的几何形状和表面电子之间的相互作用有关。此外,铂的氧化价态也影响着催化剂活性,该小组[30]又比较了被还原的和未被还原的Pt/TiO2催化剂上甲醛催化氧化性能。结果表明,采用3种不同还原过程(硼氢化钠还原、氢气还原和光还原沉积)的浸渍法和硼氢化钠还原沉积沉淀法制备的Pt/TiO2催化剂,在一定(13mg·m–3HCHO,120000h−1GHSV,50% RH)条件下,几乎将甲醛完全转化。这归因于被还原的铂粒子高度分散在TiO2的表面上,并形成带电荷的金属铂粒子,促进了电子转移形成较多的活性氧物种。特别是采用硼氢化钠还原浸渍法制备出的0.1% Pt/TiO2性能优异,在室温下将甲醛100%分解。
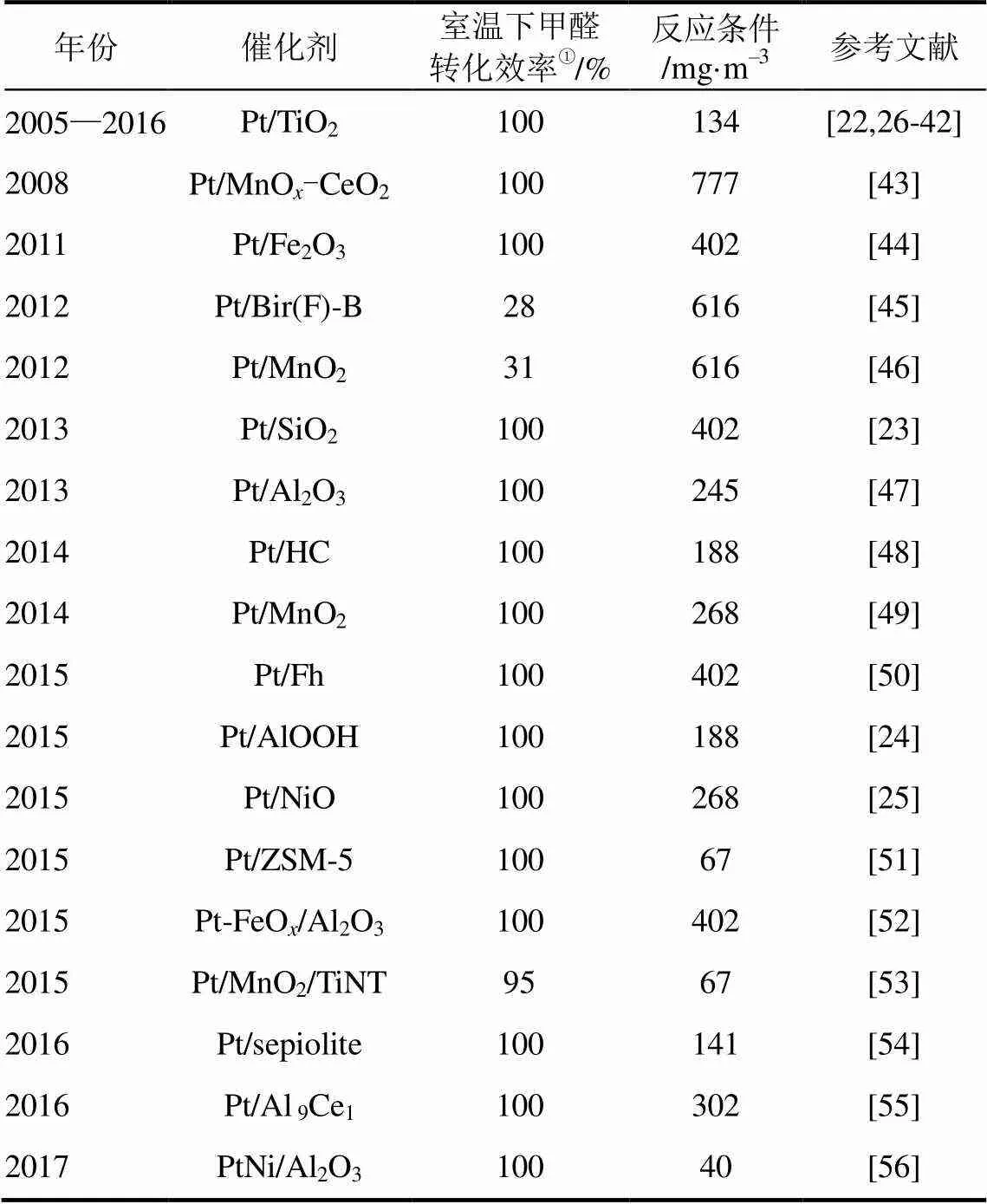
表2 应用在甲醛氧化反应中的负载型铂催化剂
①室温–25℃。
不同的制备方法会影响载体的结构、载体与贵金属铂之间的相互作用。AN等[44]采用浸渍法、胶体沉积法和沉积沉淀法制备了Pt/Fe2O3催化剂。结果发现,制备方法影响着Pt粒子和载体Fe2O3之间的MSI相互作用,进一步改变了Fe2O3的结构和性质,胶体沉积法制备的催化剂对甲醛氧化具有较高的催化性能。研究还发现,这种相互作用有益于Pt粒子在Fe2O3的表面高度分散,并且削弱了位于Pt/FeO界面处Fe—O键的强度,提高了活性氧物种的迁移效率。LIU等[45]报道了制备过程中对铂前体采取不同方法进行还原,结果发现,采用KBH4还原的片状Bir负载铂的Pt/Bir(F)-B催化性能较高,主要归因于不同的制备方法形成了载体的不同比表面积、孔结构和铂粒子的不同分散性。
1.2 载体形貌的影响
在甲醛氧化反应中,气体的传递是非常重要的过程,而这一过程与催化剂载体的形貌、尺寸等微观结构密切相关,从而对催化剂的催化性能和材料对气体的阻力都产生较大的影响。通过选择合适的制备方法和实验条件来控制催化剂的形貌和尺寸,进而调整催化剂材料的催化性能。
CHEN等[36]通过电化学腐蚀法合成出结构有序的TiO2纳米管阵列(TiNT),然后采用浸渍法制备出Pt/TiNT催化剂。结果发现,Pt/TiNT催化效率较高,这主要是由于TiNT载体具有规则有序的整体块状结构促进了Pt粒子的均匀分散,同时TiNT载体与Pt粒子二者之间产生了相互协同作用。NIE 等[37]采用具有多级孔结构的TiO2电纺纤维(TF)和商业TiO2(P25)作为载体合成出Pt/TF和Pt/P25催化剂进行性能对比分析,如图1和图2所示,结果发现Pt/TF催化剂表现出较高的催化活性是由于载体的多级孔结构提高了Pt粒子的分散,促进了反应物与产物的传递扩散。QI等[38-39]采用水热合成法制备出分层介孔结构和空心链介孔结构的TiO2载体,具有较大的比表面积和最佳的孔径尺寸,能够促进Pt粒子在孔道内外高度分散,提高了甲醛氧化反应活性,在室温下可以将90.6%和100%的甲醛转化为CO2和H2O。
YU等[46]比较了茧状、海胆状和巢状3种不同结构的MnO2载体上负载Pt催化剂的催化性能。结果发现,比表面积与催化剂的催化活性之间并不存在决定性的关系。茧状、海胆状和巢状3种不同结构的MnO2载体的比表面积分别是247.6m2/g、62.3m2/g和56.9m2/g,如图3所示。然而,具有较小比表面积的巢状Pt/MnO2活性最佳,在70℃时将甲醛完全分解。这是由于巢状MnO2表面形成了较易吸附甲醛的孔通道结构,而茧状MnO2虽然具 有较高的比表面积,但结晶程度较高,阻碍了甲醛分子的吸附。CHEN等[51]通过浸渍法制备得到的Pt/ZSM-5催化剂具有较强的甲醛吸附能力和中间产物储备能力,并且Pt粒子高度分散在ZSM-5载体上,室温下甲醛在该催化剂上完全分解。

图1 TF的SEM和Pt/TF的TEM照片
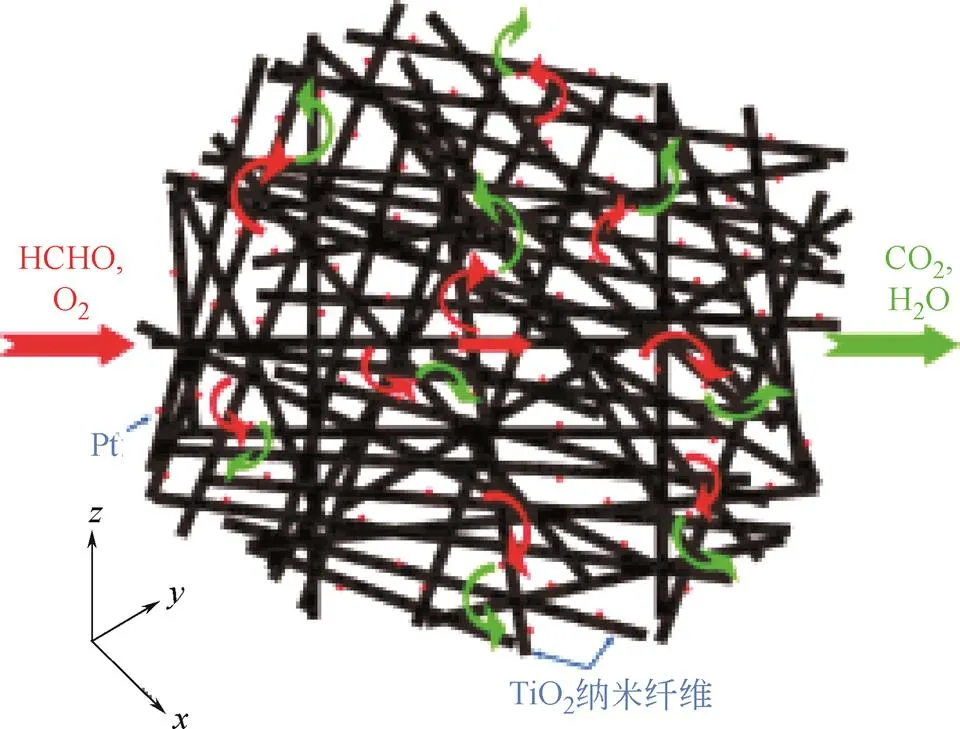
图2 反应物(HCHO和O2)和产物(CO2和H2O)在多级孔结构的Pt/TF催化剂上进行快速扩散的说明

图3 3种不同纳米结构的MnO2的SEM[(a),(c),(e)]和TEM[(b),(d),(f)]照片
(a),(b)—茧状MnO2;(c),(d)—海胆状MnO2;(e),(f)—巢状MnO2; (d),(f)内插—相应的HRTEM 照片
近期,JARONIEC等采用微乳液法合成出Fh[50]、AlOOH[24]、Al2O3[47]以及NIE等合成出NiO[25]等各种介孔材料,作为载体来制备负载铂催化剂应用到甲醛氧化反应中,研究结果也显示了具有介孔或者微孔结构的载体能够提高反应气体和产物气体的流通速度,增强载体的甲醛吸附能力。此外,Fh和AlOOH载体表面还拥有丰富的羟基,促进了氧的活化,从而提高了催化剂的催化性能,在室温下就可以将甲醛完全转化。
1.3 制备过程中助剂或离子的影响
一般来说,一些额外添加的助剂或带入的离子会对反应产生不同的效果。在甲醛氧化反应中,添加碱金属盐、氨基基团、吸附的卤素离子等对催化性能产生了不同的影响。
ZHANG 等[32]将碱金属(K+、Li+和Na+)添加到Pt/TiO2催化剂中,碱金属离子能够促进Pt/TiO2表面的羟基和甲酸盐进行反应,Pt/TiO2催化剂活性得到显著提高。NIE 等[33]发现NaOH修饰的Pt/TiO2催化剂也得到相似的结果。CHEN等[49]在制备Pt/MnO2催化剂时进行不同碱金属盐(Na2CO3、Na2SO4和NaNO3)的修饰。结果显示不同的碱金属盐对铂纳米粒子尺寸,MnO2载体的形貌和催化剂的比表面积产生了很大的影响,并进一步影响着催化剂的催化性能。Na+能够促进Pt/MnO2催化剂的催化活性,而留在载体上的阴离子覆盖了氧化锰表面的活性位,它们对催化剂的促进作用顺序如下:CO32–>SO42–>NO3–。
LIU等[34]研究了在低浓度甲醛催化反应中通过ATPS修饰法制备出的双活性位Pt/TiO2催化剂的催化性能。在反应中,甲醛浓度为6.7mg/m3时,双活性位Pt/TiO2产生的催化效率是单活性位Pt/TiO2的2.8倍。这主要是由于具有亲和能力的氨基基团在低浓度(6.7mg/m3)甲醛反应中,可以捕捉到较多的甲醛分子或甲酸盐分子,从而使双活性位Pt/TiO2的催化效率得到显著提升。
对于影响催化剂活性和稳定性的卤素中毒和失活再生现象,YU等[40-42]在甲醛催化氧化反应中对Pt/TiO2催化剂开展研究。结果发现,吸附卤素离子的Pt/TiO2催化效率明显降低。这是由于卤素离子具有较强的吸附作用,很容易吸附到Pt粒子表面,严重阻碍了氧原子在Pt粒子表面的吸附和活化。催化活性如下:F-Pt-P25>Cl-Pt-P25>Br-Pt-P25>I-Pt-P25,随着卤素离子的半径增大,失活速率增大。同时,他们又发现通过NaOH洗涤,中毒后的Pt/FTiO2-NS催化剂催化活性可以获得再生。
1.4 反应条件参数的影响
一般而言,反应过程的条件参数如空速、甲醛初始浓度、反应气中水汽的含量和铂负载量等都会影响甲醛的转化效率。
许多学者对空速与甲醛转化率之间关系的研究得到相似的结果:提高空速降低了催化效率。ZHANG等[22]考察了Pt/TiO2催化剂上空速为GHSV=50000h–1、100000h–1和200000h–1时,甲醛的转化率分别为100%、97%和58%,这是由于提高空速缩短了甲醛分子与催化剂的接触反应时间。此外,HUANG等[29]研究了甲醛初始浓度在6.3~38mg/m3范围的甲醛转化效率:6.7mg/m3时为100%,13mg/m3时为99.1%,27mg/m3时为98.2%,40mg/m3时为95.8%,甲醛的消除效率随着初始浓度增大而降低。水汽的存在对于实际应用过程中甲醛催化氧化反应是不可避免的影响因s素,一些文献报道了适量的水汽能够促进甲醛氧化。AN等[23]发现在反应体系中添加3%的水汽对甲醛催化氧化起着积极促进的作用,Pt/Fe2O3-300催化剂在室温25℃条件下,甲醛转化率从85%提高到100%。HUANG等[29]对Pt/TiO2进行不同的相对湿度条件反应,得到如下结果:25%≈50%>75%> 97.5% ≫0%(13mg/m3HCHO,25℃,GHSV 80000h−1),说明过多的水分子会覆盖一部分活性位,从而导致甲醛转化率轻微下降。
此外,对于铂负载量的影响,NIE等[33]发现,在质量分数0.05%~1%范围内,随着Pt/TiO2催化剂中铂负载量的增大,HCHO的消除速率和CO2的生成速率也在增大。当铂负载质量分数增大至2%时,氧化活性没有发生明显变化。这主要是由于在制备过程中,铂负载量的增大导致铂粒子发生聚集,因此铂活性位并没有明显增多。目前大多数具有较高催化活性的负载型铂催化剂中铂的负载量质量分数≥0.5%[19,22-25],众所众知,铂价格昂贵、资源匮乏,因此铂的含量是影响催化剂成本高低和实际应用过程中能否推广的主要因素,众多学者都在积极进行低含量、高性能贵金属铂催化剂的研制工作。HUANG等[29]制备的质量分数0.1%Pt/TiO2催化剂在甲醛初始浓度6.7~40mg/m3,空速为40000~240000h–1范围内保持较高的活性和稳定性;CHEN等制备的一系列具有较低铂含量的催化剂:0.4%Pt/ZMS-5[51]、0.3%PtNi/Al2O3[56]、0.2%Pt/ MnO2/TiNT[53]、0.1%Pt/TiO2[29],在30℃时能将甲醛完全转化并稳定运行100h以上。减少铂的负载量、制备高性能贵金属铂催化剂将是今后发展的一个方向。
2 负载型铂催化剂催化氧化甲醛的反应机理
甲醛氧化反应不是一个简单的过程,它在催化剂表面的吸附和表面转换过程非常复杂,因此,目前甲醛催化氧化机理并没有统一的说法。许多学者在MVK机理的基础上,提出了一些不同的甲醛反应历程。
HE等[26-27]报道了甲醛在TiO2上负载Pt催化剂表面的反应机理。从图4可以看出,甲醛催化氧化过程中的主要中间产物分别为二氧亚甲基(DOM)、甲酸盐和CO物种。甲醛被吸附到催化剂表面后形成DOM物种,随后形成甲酸盐物种,在活性较高的Pt/TiO2表面上反应继续进行,甲酸盐被分解为CO物种,CO最后被氧化生成CO2。其中,反应过程中最为关键的步骤是CO物种的生成。此后,该小组[32]又报道了甲醛在Na-Pt/TiO2上新的反应途径。与Pt/TiO2催化剂反应机理不同,Na+的加入在催化剂表面形成了丰富的羟基基团,改变了反应路径:HCHO—→CHOO−+·OH—→CO2+H2O。这是因为甲酸盐物种与羟基反应要比甲酸盐物种分解为CO物种更为容易。NIE等[33]也发现了制备时添加NaOH的Pt/TiO2表面上有着相似的反应途径,如 图5。
JARONIEC小组[24,50]通过红外技术分别研究了载体表面拥有丰富羟基基团的Pt/AlOOH和Pt/Fh催化剂上甲醛的催化氧化历程。结果发现,甲醛分子很容易与载体表面上的羟基通过氢键结合,氧分子吸附在Pt粒子的表面上并分裂为活性氧物种。在Pt/AlOOH中,甲醛分子上的C和H受到活性氧物种攻击后形成甲酸盐中间体物种,接着表面的羟基与其发生反应生成CO2和H2O。在Pt/Fh中,带有亲电性的碳原子受到活性氧物种攻击形成DOM, C—H受到另一个活性氧物种攻击形成DOM、甲酸物种和羟基。然后甲酸进一步氧化生成CO2和H2O。此外,NIE等[25]也发现,甲醛分子和氧分子吸附到Pt/NiO催化剂的表面后,氧分子在Pt粒子表面分裂为活性氧物种与甲醛反应形成甲酸,甲酸进一步的反应分为两种路径:一种是直接被氧化为碳酸,然后继续分解为CO2和H2O;另一种是甲酸直接分解为CO和H2O,然后继续被活性氧物种氧化为CO2和H2O。MA等[54]在探讨Pt/sepiolite催化剂上甲醛的反应历程时也得到与Pt/AlOOH相似的说法,如 图4。
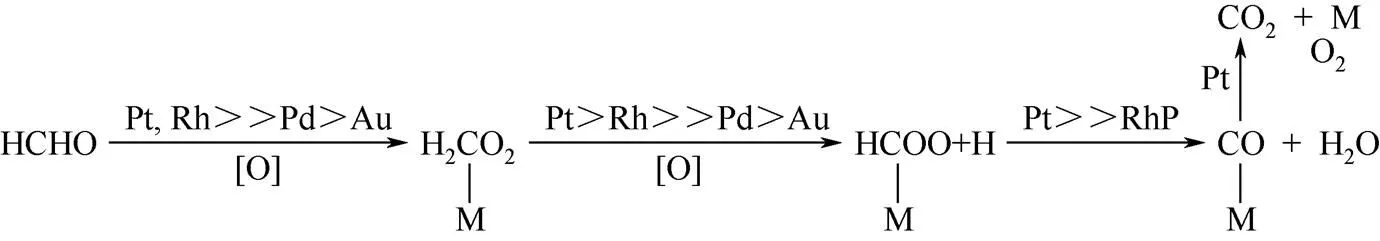
图4 TiO2负载的Pt、Rh、Pd和Au催化剂上甲醛催化氧化的反应流程
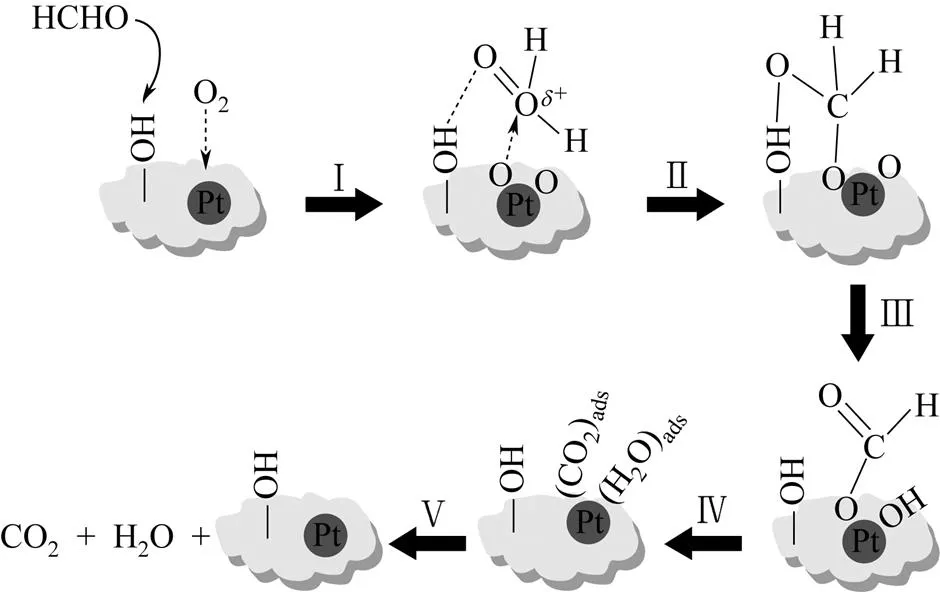
图5 Pt/Fh 和Pt/Fe3O4催化剂上甲醛催化氧化的反应路径
CHEN等[36,51]通过原位红外技术考察了具有结构有序的纳米管阵列载体结构的Pt/TiNT和高比表面积的Pt/ZSM-5(BET为313.6m2/g)上甲醛氧化的反应历程。在这两种催化剂的反应历程中都存在着储存阶段和氧化阶段。对于Pt/TiNT,在第一阶段,化学吸附的甲醛分子和氧分子反应生成甲酸盐物种,然后甲酸盐分解为CO和H2O;第二阶段,CO与氧分子或者化学吸附氧物种反应生成CO2。而在Pt/ZSM-5催化剂表面上,甲醛分子吸附在表面上并生成甲酸盐物种储存起来,然后在表面与氧分子或吸附的氧物种发生反应生成CO2和H2O。
ZHU等[42]研究了Pt/TiO2催化剂上卤素中毒效应。结果发现,Pt原子的5d空轨道能接受外来的电子,氧分子与Pt相互作用将它的电子转移到Pt原子的5d空轨道上形成Pt—O键,随后氧分子在Pt原子表面再分裂为活性氧物种与邻近吸附的甲醛分子发生反应。在反应过程中出现卤离子后,Pt原子的空轨道也能促进电子从卤离子转移到Pt原子上,形成Pt—X配位键。由于Pt—X的键能高于 Pt—O键,活性位被卤离子占据后阻止了氧分子的吸附和激活,从而导致Pt/TiO2催化剂失活。
目前,负载型铂催化剂催化氧化甲醛的机理研究尚有许多问题需要解决,例如,在催化氧化的过程中活性氧物种的传递、—OH在甲醛分解过程中的作用机理等。
3 结论和展望
甲醛是比较典型的室内空气污染物,长期暴露在较低浓度的甲醛环境里会严重危害人类的身体健康,许多学者做了很多努力去消除室内空气中的甲醛污染并取得了一定的成果。本文主要介绍了负载型铂催化剂的进展,主要讨论了如制备方法、载体形貌、添加助剂和反应条件参数等影响催化性能的因素,以及一些有关反应机理的说法。负载型铂催化剂活化分子氧的能力较强,对甲醛消除表现出相对较高的催化活性和稳定性。此外,能耗较低、环境友好和不需要额外能源等优点使该方法具有良好的实际应用前景,目前已引起环境催化领域的学者们广泛的关注。但是,众所周知,贵金属铂价格昂贵、资源匮乏成为发展的瓶颈,阻碍了负载型铂催化剂在实际应用中的推广;非贵金属虽然价格低廉、资源丰富,但是在甲醛消除反应中呈现出较差的低温活性。因此,开发出使用环境温和、成本较低并且高效的负载型铂催化剂仍然是一个重要的挑战。在以后的研究中结合载体选择和制备条件优化来减少铂金属的负载量,尝试提高铂原子的使用效率增加催化活性位,来提高催化甲醛的效率。此外,甲醛催化氧化机理的研究是一个复杂过程,在文献中报道的并不多,研究反应机理对于深度理解甲醛氧化过程是非常必要的,在以后的研究中,可以借助一些原位在线分析技术,例如,在研究—OH在甲醛分解过程中的作用机理时,采用氧同位素跟踪技术来研究反应产物中氧的明确来源,从而进一步探讨甲醛催化氧化机理。
[1] ANN P,MAGNUS B. Formaldehyde[J]. Dermatitis,2015,26:1-6.
[2] TUNGA S,SIBEL M,RAINER M. Formaldehyde in the indoor environment[J]. Chemical Reviews,2010,110:2536-2572.
[3] 何运兵,纪红兵,王乐夫.室内甲醛催化氧化脱除的研究进展[J].化工进展,2007,26(8):1104-1109.
HE Y B,JI H B,WANG L F. Development of the removal of indoor formaldehyde with catalytic oxidation[J]. Chemical Industry and Engineering Progress,2007,26(8):1104-1109.
[4] TANG X J,BAI Y,DUONG A,et al. Formaldehyde in China:production,consumption,exposure levels,and health effects[J]. Environment International,2009,35:1210-1224.
[5] ZHAI L,ZHAO J,XU B,et al. Influence of indoor formaldehyde pollution on respiratory system health in the urban area of Shenyang,China[J]. African Health Sciences,2013,13:137-143.
[6] PEDER W,GUNNAR D N. Non-cancer effects of formaldehyde and relevance for setting an indoor air guideline[J]. Environment International,2010,36:788-799.
[7] 李玮,黄丽丽,翟友存,等. 新型 Cu-Mn/TiO2和 Cu-Mn/γ-Al2O3甲醛催化氧化催化剂的研制及活性[J]. 化工进展,2015,34(1):127-132.
LI W,HUANG L L,ZHAI Y C,et al. Catalytic oxidation of formaldehyde over Cu-Mn catalysts supported on TiO2and γ-Al2O3dioxide[J].Chemical Industry and Engineering Progress,2015,34(1):127-132.
[8] ABDUNASER M E,MICHAEL A M,SIDDHARTH V P,et al. Removal of formaldehyde from air using functionalized silica supports[J]. Environmental Science & Technology,2012,46:13354-13360.
[9] DARIA K,MOHAMAD S,JAVIERA C S,et al. Adsorption and photocatalytic oxidation of formaldehyde on a clay-TiO2composite[J]. Journal of Hazardous Materials,2012,211/212:233-239.
[10] JHON Q T,SEBASTIEN Y,BELLAT J P,et al. Formaldehyde:catalytic oxidation as a promising soft way of elimination[J]. ChemSusChem,2013,6:578-592.
[11] NIE L H,YU J G,JARONIEC M,et al. Room-temperature catalytic oxidation of formaldehyde on catalysts[J]. Catalysis Science & Technology,2016,6:3649-3669.
[12] BAI B Y,QIAO Q,LI J H,et al. Progress in research on catalysts for catalytic oxidation of formaldehyde[J]. Chinese Journal of Catalysis,2016,37:102-122.
[13] 董冰岩,施志勇,何俊文,等.脉冲放电等离子体协同Mn/TiO2-分子筛、Fe/TiO2-分子筛、Cu/TiO2-分子筛催化剂降解甲醛[J]. 化工进展,2015,35(9):3337-3344.
DONG B Y,SHI Z Y,HE J W,et al. Research of pulse discharge plasma combined with Mn/TiO2-molecular、Fe/TiO2-molecular、Cu/TiO2-molecular sieve catalysts decomposition of formaldehyde[J]. Chemical Industry and Engineering Progress,2015,35(9):3337-3344.
[14] LU N,PEI J J,ZHAO Y X,et al. Performance of a biological degradation method for indoor formaldehyde removal[J]. Building and Environment,2012,57:253-258.
[15] WANG Z,WANG W Z,ZHANG L,et al. Surface oxygen vacancies on Co3O4mediated catalytic formaldehyde oxidation at room temperature[J]. Catalysis Science & Technology,2016,6:3845-3853.
[16] ZHANG J H,LI Y B,WANG L,et al. Catalytic oxidation of formaldehyde over manganese oxides with different crystal structures[J]. Catalysis Science & Technology,2015,5:2305-2313.
[17] HUANG Y C,LI H B,BALOGUN M S,et al. Three-dimensional TiO2/CeO2nanowire composite for efficient formaldehyde oxidation at low temperature[J]. RSC Advances,2015,5:7729-7733.
[18] XU Q L,LEI W Y,LI X Y,et al. Efficient removal of formaldehyde by nanosized gold on well-defined CeO2nanorods at room temperature[J]. Environmental Science & Technology,2014,48:9702-9708.
[19] AN N H,YU Q S,LIU G ,et al. Complete oxidation of formaldehyde at ambient temperature over supported Pt/Fe2O3catalysts prepared by colloid-deposition method[J]. Journal of Hazardous Materials,2011,186:1392-1397.
[20] LI Y B,ZHANG C B,HE H,et al. Influence of alkali metals on Pd/TiO2catalysts for catalytic oxidation of formaldehyde at room temperature[J]. Catalysis Science Technology,2016,6:2289-2295.
[21] BAI B Y,QIAO Q,ARANDIYAN H,et al. Three-dimensional ordered mesoporous MnO2-supported Ag nanoparticles for catalytic removal of formaldehyde[J]. Environmental Science & Technology,2016,50:2635-2640.
[22] ZHANG C B,HE H,TANAKA K. Perfect catalytic oxidation of formaldehyde over a Pt/TiO2catalyst at room temperature[J]. Catalysis Communications,2005,6:211-214.
[23] AN N H,ZHANG W L,YUAN X L,et al. Catalytic oxidation of formaldehyde over different silica supported platinum catalysts[J]. Chemical Engineering Journal,2013,215/216:1-6.
[24] YAN Z X,XU Z H,YU J G,et al. Enhanced formaldehyde oxidation on CeO2/AlOOH-supported Pt catalyst at room temperature[J]. Applied Catalysis B:Environmental,2016,199:458-465.
[25] NIE L H,MENG A Y,TENG F,et al. Hierarchically macro-mesoporous flowerlike Pt/NiO composite microspheres for efficient formaldehyde oxidation at room temperature[J]. RSC Advances,2015,5:83997-84003.
[26] ZHANG C B,HE H,TANAKA K. Catalytic performance and mechanism of a Pt/TiO2catalyst for the oxidation of formaldehyde at room temperature[J]. Applied Catalysis B:Environmental,2006,65:37-43.
[27] ZHANG C B,HE H. A comparative study of TiO2supported noble metal catalysts for the oxidation of formaldehyde at room temperature[J]. Catalysis Today,2007,126:345-350.
[28] PENG J,WANG S. Performance and characterization of supported metal catalysts for complete oxidation of formaldehyde at low temperatures[J]. Applied Catalysis B:Environmental,2007,73(3/4):282-291.
[29] HUANG H B,LEUNG D Y C. Complete elimination of indoor formaldehyde over supported Pt catalysts with extremely low Pt content at ambient temperature[J]. Journal of Catalysis,2011,280(1):60-67.
[30] HUANG H B,LEUNG D Y C,YE D. Effect of reduction treatment on structural properties of TiO2supported Pt nanoparticles and their catalytic activity for formaldehyde oxidation[J]. Journal of Materials Chemistry,2011,21:9647-9652.
[31] HUANG H B,HU P,HUANG H L,et al.Highly dispersed and active supported Pt nanoparticles for gaseous formaldehyde oxidation:influence of particle size[J]. Chemical Engineering Journal,2014,252:320-326.
[32] ZHANG C B,LIU,F D,ZHAI Y P,et al. Alkali-metal-promoted Pt/TiO2opens a more efficient pathway to formaldehyde oxidation at ambient temperatures[J]. Angewandte Chemie-International Edition,2012,51:9628-9632.
[33] NIE L H,YU J G,LI X Y,et al. Enhanced performance of NaOH-modified Pt/TiO2toward room temperature selective oxidation of formaldehyde[J]. Environmental Science & Technology,2013,47:2777-2783.
[34] LIU B T,HSIEH C H,WANG W H,et al. Enhanced catalytic oxidation of formaldehyde over dual-site supported catalysts at ambient temperature[J]. Chemical Engineering Journal,2013,232:434-441.
[35] ZHOU P,YU J G,NIE L H,et al.Dual-dehydrogenation-promoted catalytic oxidation of formaldehyde on alkali-treated Pt clusters at room temperature[J]. Journal Materials Chemical A,2015,3:10432-10438.
[36] CHEN H Y,RUI Z B,JI H B. Monolith-like TiO2nanotube array supported Pt catalyst for HCHO removal under mild conditions[J].Industrial & Engineering Chemistry Research,2014,53:7629-7636.
[37] NIE L H,YU J G,FU J W,et al. Complete decomposition of formaldehyde at room temperature over a platinum-decorated hierarchically porous electrospun titania nanofiber mat[J]. ChemCatChem,2014,6:1983-1989.
[38] QI L F,HO W K,WANG J L,et al. Enhanced catalytic activity of hierarchically macro-/mesoporous Pt/TiO2toward room temperature decomposition of formaldehyde[J]. Catalysis,Science,Technology,2015,5:2366-2377.
[39] QI L F,CHENG B,YU J G,et al.High-surface area mesoporous Pt/TiO2hollow chains for efficient formaldehyde decomposition at ambient temperature[J]. Journal of Hazardous Materials,2016,301:522-530.
[40] ZHOU P,ZHU X F,YU J G,et al. Effects of adsorbed F,OH,and Cl ions on formaldehyde adsorption performance and mechanism of anatase TiO2nanosheets with exposed{001} facets[J].ACS Applied Materials Interfaces,2013,5:8165-8172.
[41] NIE L H,ZHOU P ,YU J G,et al. Deactivation and regeneration of Pt/TiO2nanosheet-type catalysts with exposed (001) facets for room temperature oxidation of formaldehyde[J]. Journal of Molecular Catalysis A:Chemical,2014,390:7-13.
[42] ZHU X F,CHENG B,YU J G,et al. Halogen poisoning effect of Pt-TiO2for formaldehyde catalytic oxidation performance at room temperature[J]. Applied Surface Science,2016,364:808-814.
[43] TANG X,CHEN J,HUANG X,et al. Pt/MnO-CeO2catalysts for the complete oxidation of formaldehyde at ambient temperature[J]. Applied Catalysis B:Environmental,2008,81(1/2):115-121.
[44] AN N H,WU P,LI S Y,et al. Catalytic oxidation of formaldehyde over Pt/Fe2O3catalysts prepared by different method[J]. Applied Surface Science,2013,285P :805-809.
[45] LIU L L,TIAN H,HE J H,et al. Preparation of birnessite-supported Pt nanoparticles and their application in catalytic oxidation of formaldehyde[J]. Journal of Environmental Sciences,2012,24(6):1117-1124.
[46] YU X H,HE J H,WANG D H,et al. Facile controlled synthesis of Pt/MnO2nanostructured catalysts and catalytic performance for oxidative decomposition of formaldehyde[J]. Journal Physical. Chemistry C,2012,116:851-860.
[47] NIE L H,MENG A Y,YU J G,et al.Hierarchically macro-mesoporous Pt/Al2O3composite microspheres fo efficient formaldehyde oxidation at room temperature[J]. Scientific Reports,2013,3215:1-7.
[48] NIE L H,ZHANG Y Q,YU J G. Efficient decomposition of formaldehyde at room temperature over Pt/honeycomb ceramics with ultra-low Pt content[J]. Dalton Transactions,2014,43:12935-12942.
[49] CHEN Y,HE J H,TIAN H,et al. Enhanced formaldehyde oxidation on Pt/MnO2catalysts modified with alkali metal salts[J]. Journal of Colloid and Interface Science,2014,428:1-7.
[50] YAN Z X,XU Z H,YU J G,et al. Highly active mesoporous ferrihydrite supported Pt catalyst for formaldehyde removal at room temperature[J]. Environmental Science & Technology,2015,49:6637-6644.
[51] CHEN H Y,RUI Z B,WANG X Y,et al. Multifunctional Pt/ZSM-5 catalyst for complete oxidation of gaseous formaldehyde at ambient temperature[J]. Catalysis Today,2015,258:56-63.
[52] CUI W Y,YUAN X L,WU P,et al. Catalytic properties of Al2O3supported Pt-FeOcatalysts for complete oxidation of formaldehyde at ambient temperature[J]. RSC Adances,2015,5:104330-104336.
[53] CHEN H Y,TANG M N,RUI Z B,et al. MnO2promoted TiO2nanotube array supported Pt catalyst for formaldehyde oxidation with enhanced efficiency[J]. Industrial Engineering Chemistry Research,2015,54:8900-8907.
[54] MA Y,ZHANG G K. Sepiolite nanofiber-supported platinum nanoparticle catalysts toward the catalytic oxidation of formaldehyde at ambient temperature:efficient and stable performance and mechanism[J]. Chemical Engineering Journal,2016,288:70-78.
[55] YAN Z X,XU Z H,YU J G,et al. Enhanced formaldehyde oxidation on CeO2/AlOOH-supported Pt catalyst at room temperature[J]. Applied Catalysis B:Environmental,2016,199:458-465.
[56] YANG T F,HUO Y,LIU Y,et al. Efficient formaldehyde oxidation over nickel hydroxide promoted Pt/Al2O3with a low Pt content[J]. Applied Catalysis B:Environmental,2017,200:543-551.
Research progress on catalytic oxidation of formaldehyde over supported platinum catalysts
CUI Weiyi1,HUI Jixing2,TAN Naidi3
(1The Key Laboratory of Chemical Cleaner Production Technology of Jilin Province,Jilin Institute of Chemical Technology,Jilin 132022,Jilin,China;2Research Institute of Jilin Petrochemical Company,Ltd.,PetroChina,Jilin 132021,Jilin,China;3College of Chemical and Pharmaceutical Engineering,Jilin Institute of Chemical and Technology,Jilin 132022,Jilin,China)
Formaldehyde(HCHO),emitted from buildings and decorative materials,is a major indoor air pollutant. Long-term exposure to low concentration of HCHO may cause serious health problems to human being. Catalytic oxidation of HCHO is one of the most effective approaches since it can completely convert HCHO into CO2and H2O at relatively mild operating conditions. Among numerous catalyst systems,supported platinum(Pt)catalysts have been extensively studied due to their superior catalytic performance for the oxidation of HCHO. In this paper,the recent progresses of the supported Pt catalysts in catalytic oxidation of HCHO have been summarized,and the main factors that influence the catalytic properties have been reviewed in terms of preparation methods,the types and the morphologies of the supports,the addition of promoters,as well as the reaction conditions. Besides,the reaction mechanisms for catalytic oxidation of HCHO over some supported Ptcatalysts have also been summarized. It is believed that the outstanding ability of the supported Pt catalysts to activate oxygen molecules at low-temperature is mainly responsible for their excellent catalytic performance in low-temperature oxidation of HCHO. The opportunities for future research are as follows: to further enhance the catalytic activity of the supported Pt catalysts by improving the utilization of Pt atoms and producing more surface/interface active sites through optimizing catalyst preparation methods and strategies; to deeply reveal the reaction mechanisms for catalytic oxidation of HCHO over some representative supported Pt catalysts by combining some advanced characterization techniques like oxygen isotopic tracer technique and theroretical computations.
formaldehyde;catalysis;oxidation;supported platinum catalysts;reactivity
TQ426
A
1000–6613(2017)10–3711–09
10.16085/j.issn.1000-6613.2017-0064
2017-01-11;
2017-05-20。
崔维怡(1977—),女,博士,副教授,主要从事环境催化研究。E-mail:cuiweiyi0119@163.com。
谭乃迪,博士,教授,硕士研究生导师。E-mail:tannaidi@ hotmail.com。

