AgInS2∶Mn@ZnS量子点在测定胰蛋白酶中的应用
吕鉴泉, 丁 然, 叶韵斯, 陈晓榆
(1.嘉应学院化学与环境学院,浙江梅州 514015;2.湖北师范学院化学化工学院,湖北黄石 435002)
胰蛋白酶(Trypsin)是一种肽链含有233个氨基酸残基和六对二硫键的丝氨酸家族蛋白酶[1],广泛存在于脊椎动物、蚕等生物体的消化系统内。在生命体内,胰蛋白酶通过催化分解羧肽酶原等其他酶的前体,从而在生物体的消化、新陈代谢和生命运转过程中发挥着十分重要的作用[2 - 3]。由于胰蛋白酶的重要生理功能,其分析检测技术成为化学、生物、医学等学科中倍受关注的热点[4]。对于胰蛋白酶的分析,分光光度法是常用的方法[5]。近年来,表面等离子体共振(SPR)[6]、共振光散射[7]、流动注射-化学发光[8]等技术也应用于胰蛋白酶的测定。特别是基于量子点(QDs)[9 - 13]、共轭聚电解质[14]等纳米荧光材料与胰蛋白酶的相互作用而建立的荧光共振能量转移方法更是引人注目,其主要措施是先将纳米荧光材料经过1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)的功能化处理,以方便于生物蛋白的结合[15]。
为了改善量子点的生物亲和性和增加其多元信号,本文在水相合成核壳结构AgInS2@ZnS QDs的基础上[16],通过Mn2+掺杂技术制备新型AgInS2∶Mn@ZnS QDs,利用胰蛋白酶能够选择性地猝灭AgInS2∶Mn@ZnS QDs的荧光和磷光,从而定量检测胰蛋白酶。
1 实验部分
1.1 仪器与试剂
F-4500型荧光光谱仪(日本,日立公司);U-3010型紫外分光光度计(日本,日立公司)。
胰蛋白酶购自Sigma公司,用pH=8.0的0.01 mol/L磷酸盐缓冲溶液(PBS)配制成浓度为1.0×10-4mol/L的贮备液,冰箱保存,用前稀释。牛血清白蛋白(BSA)购自武汉天源生物技术有限公司。实验所用其他试剂均为分析纯,购于国药集团化学试剂有限公司。实验所用水均为超纯水。
1.2 AgInS2∶Mn@ZnS QDs的合成
AgInS2∶Mn@ZnS QDs由本实验室在前文[16]合成AgInS2@ZnS QDs的基础上增加Mn2+掺杂措施来制备,其合成路线如图1所示。具体程序如下:(1)dBSA参照文献方法[17]合成。(2)AgInS2∶Mn QDs的合成:取10 mL的蒸馏水于50 mL三颈烧瓶中,加入0.1 mL 0.2 mol/L的In(NO3)3、80 μL 0.05 mol/L的AgNO3、0.1 mL 0.2 mol/L Mn2+和1 mL dBSA溶液,用1.0 mol/L NaOH溶液调节pH为7.5,加入5 mL 0.02 mol/L Na2S,于温度95 ℃在空气下回流搅拌5 h,得AgInS2∶Mn QDs制备液。(3)AgInS2∶Mn@ZnS QDs的合成:在AgInS2∶Mn溶液中加入0.1 mL 0.2 mol/L Zn(NO3)2,回流搅拌1.5 h,即可得AgInS2∶Mn@ZnS QDs制备液。(4)纯化:量子点制备液用乙醇沉降、过滤、水洗涤、离心出固体,50 ℃真空干燥,即可得AgInS2∶Mn@ZnS QDs。称取一定质量的该量子点,加入适当体积的0.01 mol/L的PBS,用水稀释到适当体积,作为AgInS2∶Mn@ZnS QDs实验溶液。

图1 AgInS2∶Mn@ZnS QDs的合成路线Fig.1 Schematic illustration for synthesis of AgInS2∶Mn@ZnS QDs
1.3 实验方法
荧光光谱仪的工作条件如下:工作电压为700 V,光谱通带宽度为10 nm,扫描速率为1 200 nm/min,测定温度25 ℃。荧光/磷光光谱测定:取0.5 mL 2.0×10-4mol/L AgInS2∶Mn@ZnS QDs溶液于10 mL比色管中,加入2 mL PBS(0.01 mol/L),加入适当体积的胰蛋白酶工作溶液,混匀,水稀释到刻度。在450 nm波长激发,在荧光光谱仪上记录溶液的荧光/磷光发射光谱变化。
2 结果与讨论
2.1 量子点的性能
分别采用红外(IR)光谱、X射线衍射(XRD)、扫描电镜(STM)对合成的量子点进行了表征。STM 图显示,AgInS2∶Mn@ZnS呈类球形颗粒分散,粒径为9~11 nm。IR光谱图中1 646 cm-1和1 521 cm-1峰证实dBSA基团在AgInS2∶Mn@ZnS 的存在。AgInS2∶Mn和AgInS2∶Mn@ZnS的XRD谱峰大致相同,但经加Zn壳后,衍射强度增大,说明AgInS2∶Mn@ZnS QDs有更好的晶体结构。
图2是AgInS2∶Mn和AgInS2∶Mn@ZnS的紫外-可见吸收、荧光和磷光光谱。由图可见,AgInS2∶Mn在545 nm处有一荧光峰,597 nm发射磷光;AgInS2∶Mn@ZnS荧光、磷光峰分别处于560 和607 nm。参照文献方法[18],分别测定了AgInS2、AgInS2∶Mn和AgInS2∶Mn@ZnS的荧光量子产率,它们的荧光量子产率分别为11.8% 、13.3%和43.2%。结果说明,AgInS2QDs经过Mn2+掺杂和加ZnS壳,改善AgInS2的结构并优化了其光学性能。
2.2 酸度对AgInS2∶Mn@ZnS荧光/磷光的影响
实验考察了pH值对AgInS2∶Mn@ZnS QDs荧光/磷光的影响,结果见图3。从图中可以看出,在pH=5.5~8.5范围内,荧光(560 nm)与磷光(607 nm)的变化趋势基本相同,它们的强度在pH=8.0的溶液中达到最大。实验中,选取pH=8.0的PBS为测试环境。
2.3 AgInS2∶Mn@ZnS对胰蛋白酶的选择性识别
探讨了在pH=8.0的PBS中AgInS2∶Mn@ZnS QDs与等浓度的过氧化物酶(Peroxidase)、葡萄糖氧化酶(GOx)、牛血清白蛋白(BSA)、血红蛋白(Hemoglobin)、胰蛋白酶(Trypsin)和溶菌酶(Lysozyme)等六种常见蛋白质的相互作用(图4)。结果表明,六种蛋白质中只有胰蛋白酶猝灭AgInS2∶Mn@ZnS的荧(560nm)/磷光(607 nm)最为显著,说明AgInS2∶Mn@ZnS对胰蛋白酶有特异性识别。

图2 AgInS2∶Mn和AgInS2∶Mn@ZnS的紫外-可见吸收、荧光和磷光光谱图Fig.2 UV-Vis(a),fluorescence(b) and phosphorescence spectra(c) of 4.0×10-4 mol/L AgInS2∶Mn(―) and 4.0×10-4 mol/L AgInS2∶Mn@ZnS(…) QDs

图3 pH值对AgInS2∶Mn@ZnS QDs的荧光和磷光的影响Fig.3 Effect of pH on the fluorescence and phosphorescence of AgInS2∶Mn@ZnS QDs
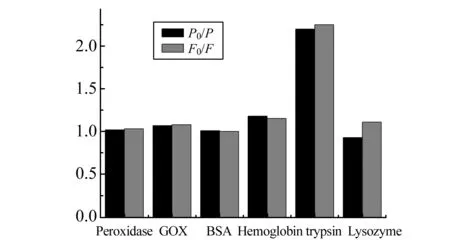
图4 胰蛋白酶对AgInS2∶Mn@ZnS QDs荧光和磷光的选择性识别Fig.4 Selective recognition of AgInS2∶Mn@ZnS QDs as a fluorescent and phosphorescent probe for trypsin
2.4 胰蛋白酶的分析性能
工作中通过将不同质量的胰蛋白酶加入到AgInS2∶Mn@ZnS溶液中,分别测定其荧光和磷光发射,来确定检测胰蛋白酶的性能。实验表明,在0~20 μmol/L胰蛋白酶的存在下,随着胰蛋白酶浓度增大,AgInS2∶Mn@ZnS的荧光峰、磷光峰波长不变,而荧光强度和磷光强度呈现不同程度的降低,浓度为20 μmol/L时,荧光/磷光强度达到最小。
图5分别给出量子点溶液的荧光和磷光与胰蛋白酶浓度的线性响应关系。在0.5~4 μmol/L胰蛋白酶范围内,量子点的荧光呈现线性降低,其线性回归方程为:F0/F=1.023+0.0927c(R=0.9975),对胰蛋白酶的检测限为0.05 μmol/L。在0.5~3.5 μmol/L胰蛋白酶范围内,量子点的磷光呈线性降低,其线性方程为:P0/P=0.989+0.138c(R=0.9940),对胰蛋白酶的检测限为0.047 μmol/L。与文献方法[9 - 15]比较,检测限和线性响应范围基本相当,但本文方法无需对量子点进行功能化处理。
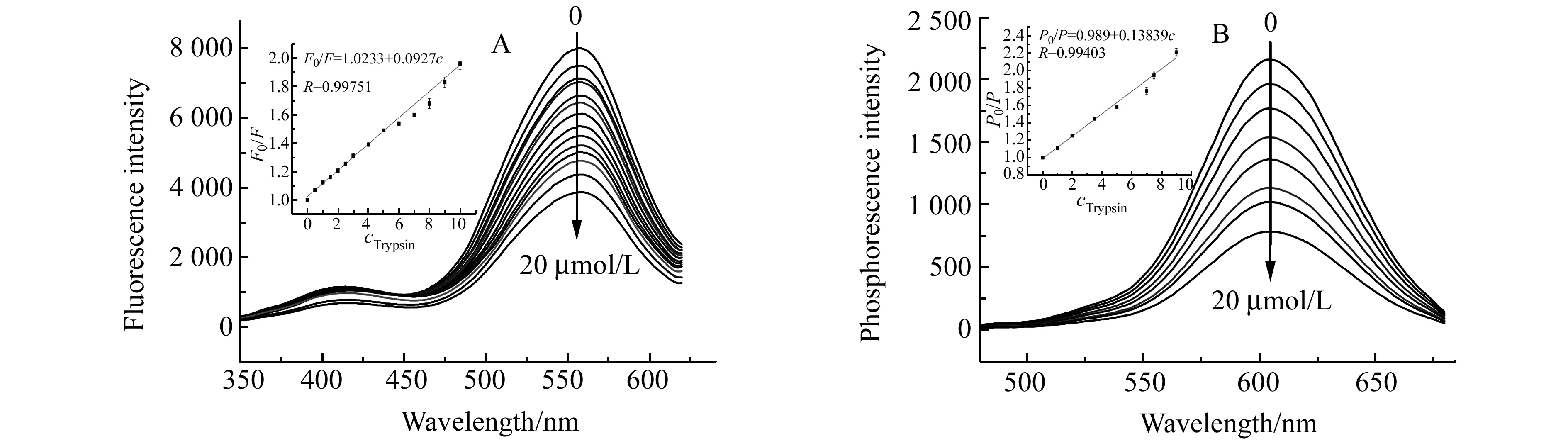
图5 胰蛋白酶浓度对AgInS2∶Mn@ZnS QDs的荧光(A)和磷光(B)的影响 Fig.5 Effect of the concentration of trypsin on fluorescence(A) and phosphorescence(B) of AgInS2∶Mn@ZnS QDs
2.5 样品分析
取5位志愿者(a患有感冒,b~e均健康)的尿液,按2010年版药典方法[19]预处理,用本文方法测定其中胰蛋白酶含量,几种尿液中均未检出胰蛋白酶;加入标准胰蛋白酶进行回收率实验,其加标回收率为94.1%~107.2%。同时,用药典建议的紫外-可见分光光度法进行对照实验,两者结果相符。
3 结论
利用胰蛋白酶选择性猝灭AgInS2∶Mn@ZnS QDs的荧光/磷光,建立了测定胰蛋白酶的新方法,该方法具有仪器设备简单、操作方便、灵敏度高等优点,用于实际样品分析的测定结果令人满意。

