偏肿革裥菌锰过氧化物酶的分级纯化*
张玉龙 池玉杰 冯连荣,2
(1. 东北林业大学林学院 哈尔滨 150040; 2. 辽宁省杨树研究所 盖州 115213)
偏肿革裥菌锰过氧化物酶的分级纯化*
张玉龙1池玉杰1冯连荣1,2
(1. 东北林业大学林学院 哈尔滨 150040; 2. 辽宁省杨树研究所 盖州 115213)
【目的】 研究白腐菌偏肿革裥菌(Lenzitesgibbosa)锰过氧化物酶(MnP)的分级纯化,以期得到L.gibbosaMnP的纯品和进行后续酶学性质研究。【方法】 在对L.gibbosa所产MnPs进行优化培养、获得大量MnPs粗酶液的基础上,通过硫酸铵(NH4)2SO4分级盐析、聚乙二醇(PEG)沉淀进行粗酶液浓缩、在起始缓冲液中进行透析、经DEAE-琼脂糖 CL-6B离子交换柱层析进行梯度洗脱和葡聚糖G-75凝胶过滤柱层析等方法对MnPs粗酶液进行纯化,并对分级纯化方法进行优化,对纯化浓缩后的纯酶样品采用SDS-PAGE方法进行酶纯度检验。【结果】 在75%、80%和85%这3种(NH4)2SO4饱和度中,85%的(NH4)2SO4是沉淀MnPs的适宜饱和度,在该饱和度下测得上清液中酶活为3.63 U·L-1,蛋白浓度为0.132 mg·mL-1,表明MnPs已基本沉淀完全; 试管小试法确定离子交换柱层析中上样的最适缓冲体系为pH7的Na2HPO4-NaH2PO4起始缓冲液; 离子交换柱层析后收集的洗脱液检测到3个蛋白吸收峰,其中只在第2个蛋白吸收峰中检测出MnP活性,该MnP活性值变化曲线与蛋白吸光值一致。这个活性峰经凝胶过滤柱层析后,洗脱结果只出现1个明显的蛋白吸收峰,在其中检测出较高的MnP活性; 浓缩后的冻干样品经SDS-PAGE电泳检测只在约40 kDa处有1条清晰的蛋白谱带,表明对MnP的纯化已达到电泳纯。【结论】 筛选出85%饱和度的(NH4)2SO4盐析法是初期沉淀与纯化L.gibbosa所产MnPs的最适方法; PEG浓缩法简便、易行、有效; 初期浓缩后再经过离子交换柱层析和凝胶过滤柱层析可以得到电泳纯的MnP纯化样品。
偏肿革裥菌; 锰过氧化物酶; 纯化; 离子交换柱层析; 电泳纯
Abstract: 【Objective】 This study aims to obtain pure manganese peroxidase produced by white-rot basidiomyceteLenzitesgibbosastrain CB-1 and study its characterizations in enzymology. 【Method】 On the basis of optimizing the culture ofL.gibbosaand obtaining massive crude manganese peroxidases (MnPs) solutions which were salted out by (NH4)2SO4, concentrated by polyethylene glycol (PEG) precipitation, and dialyzed against the initial buffer. The DEAE-Sepharose CL-6B ion exchange column chromatography, and Sephadex G-75 gel filtration column chromatography were used to purify MnP, and the purity of the purified MnP sample was detected by SDS-PAGE. 【Result】Among the three (NH4)2SO4concentrations of 75%, 80%, and 85%, 85% (NH4)2SO4was the optimum saturation for precipitation of MnPs. With 85% (NH4)2SO4precipitation, the MnP activity and protein concentration in the supernatant were only 3.63 U·L-1and 0.132 mg·mL-1, respectively, indicating that most MnPs had been precipitated. The initial buffer of Na2HPO4-NaH2PO4(pH=7) was fixed to be the optimal buffer system by small test tube method. Two higher and one lower protein absorption peaks were detected in the samples after ion exchange column chromatography, and the MnP activity was detected only in the second higher peak. After the second higher peak sample went through Sephadex G-75 gel filtration column and was eluted, one distinct protein absorption peak was detected in which there was a high MnP activity. A single and distinct MnP protein band around 40 kDa in concentrated lyophilized sample was detected by SDS-PAGE, indicating that the purity of purified MnP had come up to the electrophoresis pure. 【Conclusion】 The salting out method with 85% (NH4)2SO4was the optimal method for precipitating and purifying MnPs produced byL.gibbosain initial stage. PEG concentration method was proved simple, easy and effective. The purified MnP samples could be come up to the electrophoresis pure by the means of ion exchange chromatography and gel filtration chromatography after initial concentration.
Keywords:Lenzitesgibbosa; manganese peroxidases(MnPs); purification; ion exchange chromatography; electrophoresis pure
白腐菌分泌的锰过氧化物酶(MnPs)和漆酶能够降解木质素、多环芳烃、多氯联苯等含有芳香环的化合物和高聚物,在木质素天然聚合物的再利用及治理由农药、染料、军火、石油和煤残渣造成的环境污染方面有较好的应用前景(Novotnyetal., 1999; Tsutsumietal., 2001)。近年来国内外很多研究者进行了白腐菌的酶学研究,既包括产酶条件(Gilletal., 2003; Lankinenetal., 2005),也包括木质素降解酶的分离、纯化、特性和作用机制方面的研究(谢慧芳等, 2003; 程晓滨, 2007)。MnPs能氧化木质素的酚和非酚结构,是一种高效的木质素降解酶,其商品化应用具有很大的市场潜力,而酶制剂生产需要获得纯度较高的酶。目前已分离纯化到一些白腐菌的MnPs,如黄孢原毛平革菌(Phanerochaetechrysosporium)(Minoetal., 1988; Sundaramoorthyetal., 1994)、云芝栓菌(Trametesversicolor)(张连慧等, 2005)、乳白耙齿菌(Irpexlacteus)(Baborováetal., 2006)等。白腐菌偏肿革裥菌(Lenzitesgibbosa)能够产生漆酶和MnPs,是一种对木材和木质素降解能力较强的白腐菌,本实验室前期对其产MnPs的发酵条件进行优化并得到了大量的酶(张玉龙等, 2011),在实验室条件下对MnPs进行了分离纯化,可为进一步研究酶的催化特性及作用机制提供参考。本研究以期摸索如何提高酶的纯度,为实现纯酶在工业上的大规模实际应用酶的商品化生产奠定基础。
1 材料与方法
1.1菌种来源及活化、MnPs产酶培养与粗酶液的收集制备
L.gibbosa由东北林业大学林学院森林保护学科森林病虫病理实验室提供,试验前挑取冷藏于4 ℃冰箱试管内的菌种,接种于PDA平板培养基上,于28 ℃下进行活化培养7天。
优化后的产酶培养基(L-1)与培养条件: KH2PO40.2 g,MgSO4·7H2O 0.35 g,琥珀酸1.18 g,CaCl2·2H2O 0.1 g,果糖5 g,酒石酸铵15 mmol,Mn2+200 μmol,矿质元素溶液(不含Mn2+)10 mL,维生素溶液1.0 mL,Tween-80 0.25 mL,用4 mol·L-1NaOH调节pH至4.5,250 mL三角瓶中装液量为110 mL,用Ф=8 mm的打孔器打取在PDA平板培养基上生长的菌落边缘,将菌饼转接至灭菌后的三角瓶中,每个三角瓶加入5块菌饼,于27 ℃、150 r·min-1摇瓶,进行发酵产酶扩大培养。
粗酶液的收集: 在培养到15天达到产酶高峰时,将足够多的培养液收集在一起,用洁净纱布过滤,取滤液再用定性滤纸过滤即得到粗酶液,检测MnPs活性和蛋白浓度后用于纯化。
1.2MnPs活性检测、样品蛋白含量的测定与酶比活力的计算
用紫外分光光度计在470 nm处检测2,6-二甲氧基苯酚(2,6-DMP)在1 min氧化过程中吸光度的变化值,测定体系1 mL,其中pH4.5的丙二酸钠缓冲液(50 mmol·L-1)840 μL,MnSO4(10 mmol·L-1)50 μL,2,6-DMP(10 mmol·L-1)50 μL,酶液样品50 μL,H2O2(10 mmol·L-1)10 μL,反应起始于10 mmol H2O2的加入,以1 mL去离子水作为对照,酶活单位(U·L-1): 每分钟催化1 μmol 2,6-DMP所需的酶量。酶活性值=[106×V1×ΔA×N]/[V2×ε×Δt],式中:V1为反应总体积;V2为酶液的体积;N为酶液稀释倍数;ε为摩尔消光系数,ε470=49 600 mol·L-1cm-1; Δt为反应时间; ΔA为反应时间内吸光度的增量值。
在粗酶液浓缩过程中采用Bradford(1976)的考马斯亮兰法测定总蛋白含量,以牛血清白蛋白(BSA)为标准绘制标准直线,共测定5个样品,每个样品3次重复,以1.00 mL水溶液加入5.00 mL的考马斯亮兰工作液作为对照,得到标准直线方程。将未知样品液进行适当稀释,并记录稀释倍数。取1.00 mL稀释液放入试管中,加入5.00 mL考马斯亮蓝工作液,在分光光度计上测出在595 nm处的吸光值A595,带入标准直线方程,得出蛋白浓度。在柱层析洗脱液的快速连续检测时,采用紫外吸收法检测A280以获得蛋白含量变化的相对值。
样品中MnPs的总酶活力值(U)与总蛋白含量(mg)的比值即为酶的比活力。
1.3粗酶液浓缩与MnPs的纯化
通过硫酸铵盐析、透析、PEG浓缩、离子交换柱层析和凝胶过滤柱层析进行MnP的纯化。
1.3.1 粗酶液初期沉淀方法 用2种方法摸索粗酶液初期沉淀的最适方法后又进行了验证试验。1) 聚乙二醇(PEG)沉淀法 将105.6 mL 500 g·L-1的PEG 6000加入到收集的88 mL粗酶液中,缓慢搅拌60 min,至沉淀完全。然后在5 000g下离心30 min,收集上清液测定MnP酶活。
2) 硫酸铵逐级盐析法 按照4 ℃饱和度表(陆健等, 2005),准确称取与等浓度对应的研磨后的(NH4)2SO4粉末125、9.0和9.25g,将装有250 mL粗酶液的烧杯放在冰盒内,向杯内缓慢加入第1份(NH4)2SO4粉末,同时搅拌,使粗酶液中(NH4)2SO4饱和度达到75%。将此溶液分别装入50 mL洁净的离心管中,在12 000g下冷冻离心20 min,收集上清液测定MnP酶活后留作下一级沉淀用,依次使饱和度达到80%、85%。硫酸铵分级盐析分析在各个饱和度时上清液酶活和沉淀溶解液的酶活和蛋白含量。当上清液酶活变得非常小、沉淀溶解量以及沉淀溶解液的蛋白含量和酶活不再增加时,此时的(NH4)2SO4饱和度为盐析MnPs的最佳饱和度,该饱和度下透析浓缩后的样品液用于离子交换柱层析。
3) 85%饱和度的硫酸铵沉淀验证试验 用200 mL粗酶液进行沉淀效果的进一步验证。
1.3.2 透析与浓缩 将上述方法离心后的沉淀用尽可能少量的离子交换柱层析起始缓冲液(约2 mL)溶解后,测定沉淀溶解液中蛋白含量及MnP酶活并进行透析。透析过程在冰上进行,是将沉淀溶解液置于截留分子质量为8 000~14 000 Da的透析袋内,再浸入装有缓冲液的大烧杯内透析过夜,期间更换数次缓冲液并用磁力搅拌器搅拌,以除去其中的小分子盐类,并使蛋白溶解液在pH和离子强度上与离子交换柱层析的起始缓冲系统相一致。透析后在透析袋外面涂布PEG粉末浓缩到需要的体积(苏东海等, 2008),测定其中的蛋白含量和MnPs酶活后,用于离子交换柱层析。
1.3.3 试管小试法确定起始缓冲液和pH 根据本课题组已经克隆到的L.gibbosaMnP基因,得知3个成熟MnPs都有略大于4的酸性等电点,进一步通过试管小试法确定起始缓冲液及pH。取9支15 mL试管,每管加入1.5 mL琼脂糖离子交换剂; 配制9种浓度为0.5 mol·L-1和0.02 mol·L-1pH5.0~9.0的缓冲液(表1)。各取10 mL 0.5mol·L-1不同pH的缓冲液,加入9支试管中以平衡交换剂,混合一段时间后弃去上清液,再分别加入10 mL新鲜缓冲液,反复10次后可以使试管内的交换剂在pH上完全与缓冲液达到平衡; 再用10 mL 0.02 mol·L-1同一pH的缓冲液洗涤各试管中的交换剂,反复5次可确保试管内的交换剂在离子强度方面与起始缓冲液保持一致; 各试管中加入相同数量的(NH4)2SO4沉淀透析后酶活为104.23 U·L-1的样品液,混合放置5~10 min。使离子交换剂沉降,检测上清液中MnPs酶活,如果酶活接近于0说明MnPs完全被离子交换剂所吸附,沉降于底部; 若上清液中有少量酶活说明MnPs没有完全被交换剂吸附,上清液中存在少量MnPs。选择酶活接近于0和少量酶活之间的特定pH缓冲液作为起始缓冲液。

表1 试管小试法9种pH缓冲溶液Tab.1 Nine kinds of pH buffers in small test tube method
1.3.4 DEAE-Sepharose CL-6B离子交换柱层析 采用2.6 cm×20 cm的玻璃层析柱,用起始缓冲液清洗平衡整个系统并排除空气。按离子交换剂DEAE-琼脂糖凝胶 CL-6B湿胶∶起始缓冲液=3∶1的体积比搅匀后,用起始缓冲液调节pH到7,装柱12.5 cm,用至少2倍色谱柱体积的起始缓冲液平衡过夜,用枪小心将样品加到床面上,采用2种离子强度的洗脱缓冲液进行梯度洗脱,梯度混合器离出口近的容器放置的是离子强度为0.02 mol·L-1起始缓冲液,另一个放置的是1.5 mol·L-1NaCl极限缓冲液(87.75 g NaCl加入到1 000 mL起始缓冲液中)。2.5 mL·min-1流速洗脱至基线,在此期间离子强度从0.02~1.5 mol·L-1之间呈“S”形缓慢上升,自动收集器收集每管5 mL。测定各试管中的蛋白含量和MnPs酶活,合并相同的洗脱峰后,PEG浓缩同1.3.2,测定其中蛋白含量和MnPs酶活后,用于凝胶过滤柱层析。
1.3.5 Sephadex G-75凝胶过滤柱层析 采用1.6 cm×50 cm的玻璃层析柱,用0.07 mol·L-1NaCl洗脱液清洗平衡整个系统后灌胶,装柱高为29 cm。用移液枪吸取样品贴柱内壁旋转缓慢加入小于3.75 mL样品液,用洗脱液洗脱,54 s·mL-1流速洗脱至基线,自动收集器收集每管3 mL。检测各试管中的蛋白含量和MnPs酶活后合并相同的洗脱峰,PEG浓缩同1.3.2,测定其蛋白含量和酶活。此样品用液氮速冻后,用TFD5505型冷冻干燥机将样品冻干,之后的固体用极少量去离子水溶解,振荡均匀,在12 000 r·min-1下离心10 min得上清液,至此得到蛋白纯化样品,测定其蛋白含量和MnP酶活。
1.4SDS-PAGE电泳检测蛋白纯度
对1.3.5中得到的蛋白纯化样品,采用SDS-PAGE凝胶电泳法,以蛋白质Marker作为对照,检测L.gibbosaMnP的纯度。
2 结果与分析
2.1粗酶液初期沉淀的最适方法
PEG沉淀、硫酸铵逐级盐析和85%硫酸铵沉淀验证的结果见表2,其中回收率和纯化倍数分别为沉淀或透析后的总酶活力和比活力与粗酶液总酶活力和比活力的比值。酶比活力是酶纯度的量度,对于一种酶来说,其比活力越大纯度越高。虽然在PEG沉淀中酶的比活力很高,但酶的回收率过低,仅为15.3%,而用3种浓度的硫酸铵沉淀回收率都在43%以上。在硫酸铵逐级盐析中,用75%的(NH4)2SO4沉淀后,溶液呈乳黄色,浑浊,有细小泡沫浮在液面上,但仍不黏稠,表明仍有蛋白没有被沉淀下来; 取其离心后的上清液,继续向其中加入(NH4)2SO4粉末使饱和度达到80%时,溶液清亮; 继续经85%(NH4)2SO4沉淀后的上清液酶活仅为3.63 U·L-1,蛋白浓度为0.1 318 mg·mL-1,MnPs比活力仅为0.03,表明溶液内虽然还有较多的杂蛋白存在,但目的蛋白MnPs已基本沉淀完全,因此选择85%的浓度作为(NH4)2SO4沉淀MnPs的最适浓度。85%饱和度的(NH4)2SO4沉淀验证试验表明其回收率高达69.7%,作为分离纯化初期的步骤,应尽量使蛋白损失少而回收率高,因此选择85%饱和度的(NH4)2SO4作为初期沉淀MnPs的最适方法。
2.2起始缓冲液和pH筛选
以加入离子交换剂内的样品液酶活104.23 U·L-1为对照,不同试管内各缓冲液的pH与离子交换剂沉降后上清液中相对酶活的对比情况见图1,由于离子交换剂在缓冲液pH9的环境中无法沉淀,大部分悬浮于液体上部,并有泡沫出现,故去掉不计。由图1可知,经不同pH缓冲液平衡后的离子交换剂对MnP的吸附程度有明显差异。上清液中MnPs活力越高,表明该pH条件下离子交换剂对目的蛋白的吸附能力越弱; 反之酶活越低,则吸附能力越强。pH在6.5~8.5之间时离子交换剂对目的蛋白的吸附能力都较强,以pH 8时最高。考虑到使目的蛋白的静电荷量既可保证其结合在离子交换剂上,又不需在洗脱时洗脱液的离子强度很大或与原溶液pH相差悬殊等苛刻条件,本试验选择pH 7、离子强度为0.02 mol·L-1的Na2HPO4-NaH2PO4缓冲液作为离子交换层析的上样缓冲体系。
2.3离子交换柱层析洗脱峰蛋白含量和酶活检测
离子交换柱层析洗脱峰蛋白含量和酶活的检测结果见图2。为形成前面2个高的和后面1个低的蛋白吸收峰,重点检测这3个蛋白峰附近试管中的MnPs活性,结果在第2个蛋白吸收峰试管中检测到MnP活性并与蛋白吸光值大小相一致,收集其中32~42号试管中的流出洗脱液合并再浓缩,测得总蛋白含量为3.53 mg,总酶活力为68.37 U,MnPs比活力高达19.37,表明MnPs的纯度已经较高(表3)。DEAE-Sepharose CL-6B阴离子交换剂的电荷基团二乙基氨乙基带正电,装柱平衡后,与缓冲溶液中带负电的平衡离子PO43-结合。加样后采用改变离子强度的梯度洗脱方式,直接由缓冲物质提供离子强度,不额外往缓冲液中添加非缓冲盐,缓冲物质的浓度决定了离子强度,目的蛋白MnPs在低离子强度下被吸附,在高离子强度下被洗脱。样品液中可能还含有其他正电、负电和中性基团,负电基团可以与平衡离子PO43-进行可逆的置换反应而结合到离子交换剂上,而正电和中性基团则不能与离子交换剂结合,随流动相首先流出而先被去除。洗脱缓冲液的pH 7大于MnPs的等电点,目的蛋白MnPs分子羧基游离带负电,在低离子强度下能够很好地吸附于离子交换剂上,而其他一些等电点大于7的杂蛋白因为带有正电荷不能形成有效吸附,所以会首先被洗脱下来。随着洗脱液离子强度增加,洗脱液中的Cl-离子可以逐步与结合在离子交换剂上的各种负电基团进行交换,而将包括目的蛋白MnPs在内的各种负电基团置换出来,随洗脱液流出。与离子交换剂结合力小的负电基团先被置换出来,而与离子交换剂结合力强的稍后被置换出来,这样等电点介于4~7之间的各种蛋白和负电基团就会按其与离子交换剂结合力从小到大的顺序逐步被洗脱下来,从而达到分离目的。另一些等电点小于MnPs的杂蛋白吸附得比较牢固,在高离子强度下在MnPs之后被洗脱下来。
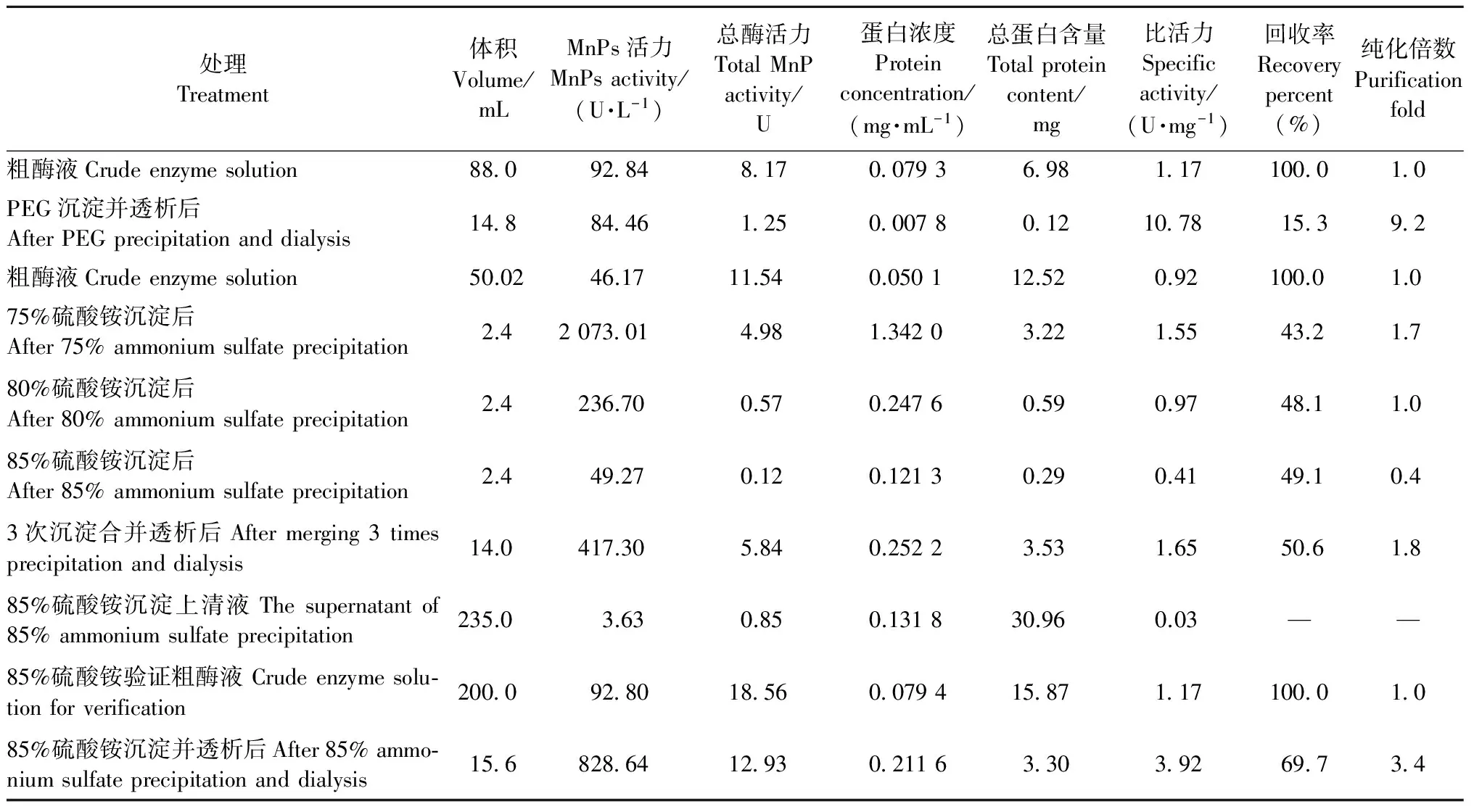
表2 不同处理方法粗酶液初期沉淀Tab.2 The results of different initial precipitation methods to crude MnPs solutions
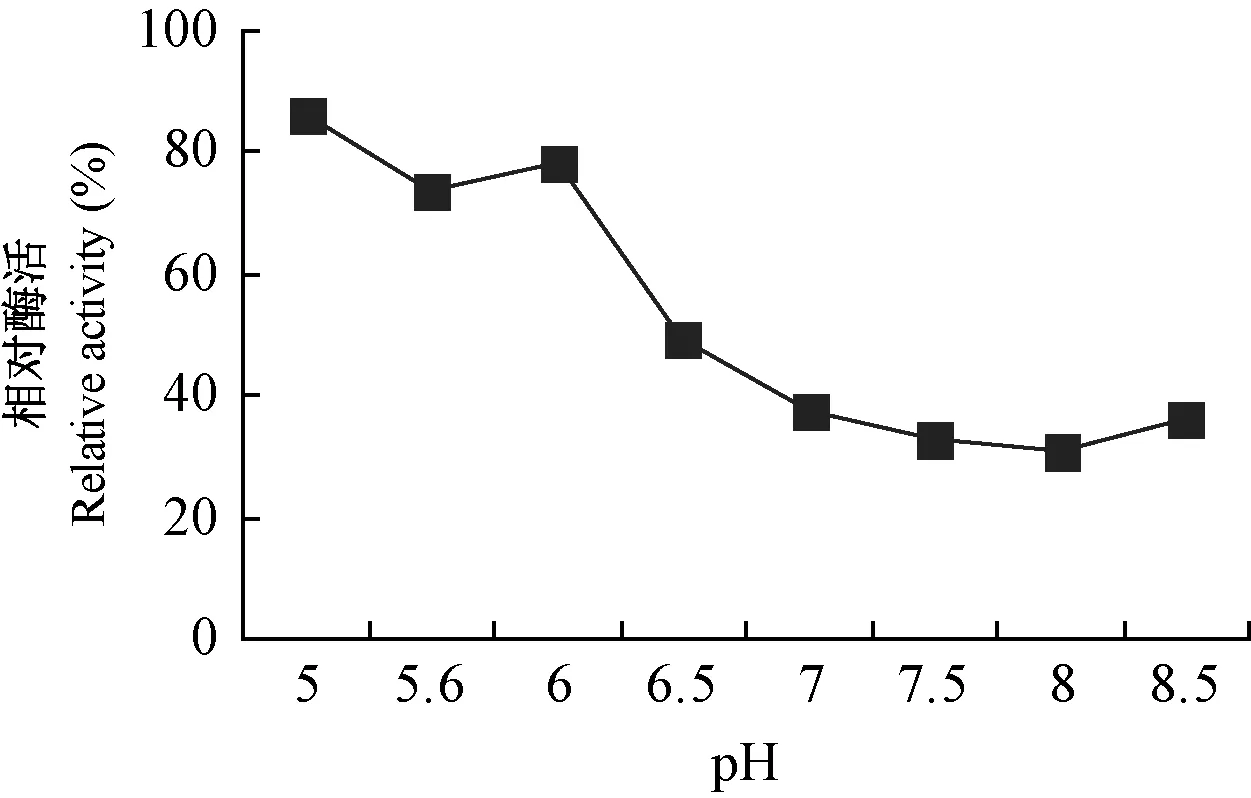
图1 试管小试法筛选起始缓冲液和pHFig.1 The initial buffer and its pH screened by small test tube method

图2 离子交换柱层析洗脱蛋白吸收峰和MnP活性Fig.2 The protein absorption peak and MnP activity in the samples after ion exchange chromatography
2.4凝胶过滤柱层析洗脱峰蛋白含量和酶活检测结果
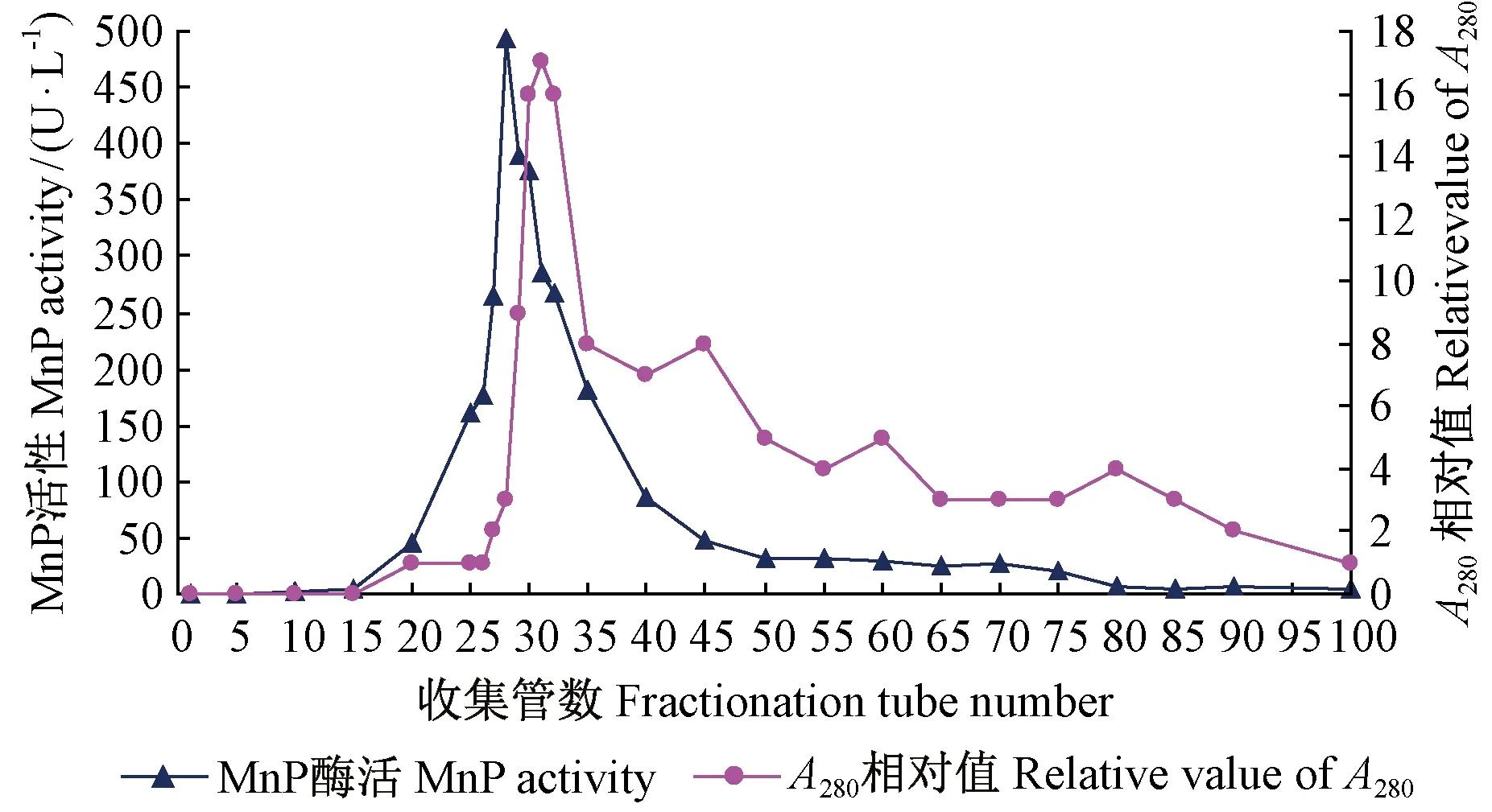
图3 凝胶过滤柱层析洗脱蛋白吸收峰和MnP活性Fig.3 The protein absorption peak and MnP activity in the samples after gel filtration chromatography
将离子交换柱层析第2个蛋白吸收峰的32~42号试管中所收集的洗脱液合并,经PEG浓缩后的样品继续进行Sephadex G-75凝胶过滤柱层析的洗脱结果见图3,只发现1个比较明显的蛋白吸收峰,并在其中检测出高MnP活性,其活性值与蛋白相对值走势基本相一致。分子筛的作用是大分子蛋白首先被洗脱下来,接下来是分子质量较小的。收集该蛋白吸收峰的20~45号试管中液体浓缩后,测定蛋白的含量及酶活性结果见表3,其中总蛋白含量为1.38 mg,总酶活力为58.46 U,MnPs比活力高达42.36 U·mg-1,表明MnPs的纯度已经很高。
2.5纯化总表和电泳结果
从粗酶液经85%硫酸铵沉淀并透析、离子交换柱层析、凝胶过滤柱层析、冷冻干燥等一系列纯化过程的总表见表3,其中冻干样品的总蛋白含量、总MnP活力和比活力分别为1.29、43.38和33.63,比凝胶过滤柱层析后浓缩的样品都有所下降,表明在冻干过程中失去了一部分MnP活性。SDS-PAGE检测的结果见图4,只在约40 kDa处有1条清晰的蛋白谱带,表明纯化后的MnP为单一组分,可见对L.gibbosaMnP的纯化已达到电泳纯。
表3纯化总表
Tab.3AsummaryofMnPpurification
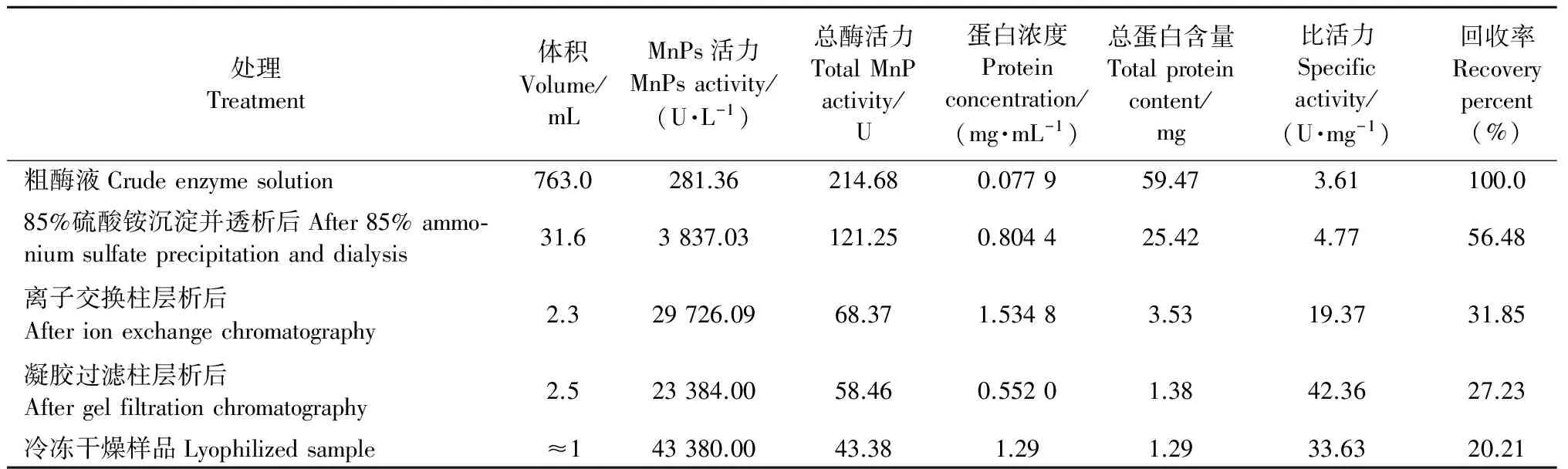
处理Treatment体积Volume/mLMnPs活力MnPsactivity/(U·L-1)总酶活力TotalMnPactivity/U蛋白浓度Proteinconcentration/(mg·mL-1)总蛋白含量Totalproteincontent/mg比活力Specificactivity/(U·mg-1)回收率Recoverypercent(%)纯化倍数Purificationfold粗酶液Crudeenzymesolution763.0281.36214.680.077959.473.61100.01.085%硫酸铵沉淀并透析后After85%ammo⁃niumsulfateprecipitationanddialysis31.63837.03121.250.804425.424.7756.481.3离子交换柱层析后Afterionexchangechromatography2.329726.0968.371.53483.5319.3731.855.4凝胶过滤柱层析后Aftergelfiltrationchromatography2.523384.0058.460.55201.3842.3627.2311.7冷冻干燥样品Lyophilizedsample≈143380.0043.381.291.2933.6320.219.3
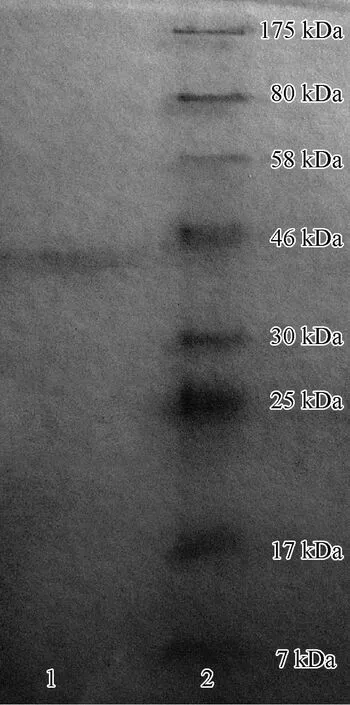
图4 纯化后MnP的SDS-PAGE图谱Fig.4 SDS-PAGE pattern of purified MnP1.纯化后的MnP Purified MnP; 2.Marker.
3 讨论
酶的纯化是一项技术含量高且繁琐的工作,要从生物体或其分泌物中纯化一种酶,往往需要多种方法协同使用。沉淀过程既要考虑蛋白沉淀完全、损失少,条件又要温和、酶活性损失小。各种纯化方法的选取,要遵循步骤少效率高并始终保持酶蛋白本身生化活性的原则,需要逐步通过预试验选取最佳的分离纯化方法。蛋白质沉淀主要分为有机溶剂沉淀法和盐析法,本试验由于未知L.gibbosaMnPs的沉淀特性,初期进行了PEG和硫酸铵2种沉淀方法的对比。PEG为亲水性极强的水溶性非离子型高聚物,在一定盐浓度条件下向溶液中加入PEG可引起大分子溶质的凝聚沉淀,常用于蛋白质、核酸、噬菌体等的分离。本试验选用PEG的分子质量为6 000,操作过程中溶液较黏稠,离心后沉淀体积较大,需要反复抽提,酶活和蛋白质损失较严重。同类研究表明,高分子质量的PEG效果较好。盐析法就是根据不同蛋白质在一定浓度盐溶液中溶解度降低程度的不同而达到彼此分离的方法,不同蛋白质在不同的中性盐浓度下析出,这与溶液的pH和蛋白质的等电点有关,利用此原理可以进行除去杂蛋白的初步纯化。硫酸铵因其溶解度大、温度系数小而被广泛用于盐析。本试验进行了不同硫酸铵饱和度对蛋白沉淀的效果,由于未知L.gibbosaMnPs的盐析特性,要分级试验确定盐析沉淀中硫酸铵的最佳饱和度,以尽量多地沉淀和获得目的蛋白MnP。结果表明,当硫酸铵浓度达到85%时,在蛋白沉淀后的上清液中MnP活性很低,表明MnP绝大部分已经沉淀。硫酸铵分级沉淀不仅条件温和、操作简便,且比PEG沉淀回收率高,所以选择硫酸铵沉淀法作为初级纯化方法。采用PEG涂布吸水法浓缩层析过程中的各洗脱峰,可以将20~30 mL的样品浓缩至5 mL以下,操作简便,效果很好。凝胶过滤层析后的样品经进一步冷冻干燥浓缩后,然后用极少量的去离子水溶解,离心后便得到纯化的MnP。
4 结论
85%饱和度的(NH4)2SO4盐析法是初期沉淀与纯化L.gibbosa所产MnPs的最适方法; PEG浓缩法简便、易行、有效; 试管小试法确定了离子交换柱层析中上样的最适缓冲体系为pH等于7、离子强度为0.02 mol·L-1的Na2HPO4-NaH2PO4起始缓冲液; 初期浓缩后再经过离子交换柱层析和凝胶过滤柱层析可以得到电泳纯的L.gibbosaMnP纯化样品。经过纯化获得了比活力相对很高的MnP。
程晓滨. 2007. 裂褶菌F17锰过氧化物酶的分离纯化及其对偶氮染料脱色的研究.合肥: 安徽大学硕士学位论文.
(Cheng X B. 2007. Purification of a new manganese peroxidase of the white-rot fungusSchizophyllumsp. F17, and decolorization of azo dyes by the enzyme. Hefei:MS thesis of Anhui University. [in Chinese])
陆 健,周楠迪,史 峰,等. 2005. 蛋白质纯化技术及应用. 北京: 化学工业出版社.
(Lu J, Zhou N D, Shi F,etal. 2005. The technique and application of protein purification. Beijing: Chemical Industry Press. [in Chinese])
苏东海,苏东民,杨国伟,等. 2008. 白腐菌TP21漆酶分离纯化及其部分酶学特性的研究. 河南工业大学学报,29(5): 54-57.
(Su D H, Su D M, Yang G W,etal. 2008. Research on purification and characterization of laccase from white rot fungi TP21.Journal of Henan University of Technology, 29(5): 54-57. [in Chinese])
谢慧芳,近藤隆一郎,李忠正. 2003. 白腐菌PhanerochaetesordidaYK-624.产锰过氧化物酶的生产及初步纯化. 林产化学与工业, 23(4): 22-26.
(Xie H F, Kondo R, Li Z Z. 2003. Production and purification of manganese peroxidase by white rot fungiPhanerochaetesordidaYK-624. Chemistry and Industry of Forest Products, 23(4): 22-26. [in Chinese])
张连慧,杨秀清,葛克山,等. 2005. 变色栓菌锰过氧化物酶同工酶的纯化及其性质研究. 微生物学报, 45(5): 711-715.
(Zhang L H, Yang X Q, Ge K S,etal., 2005. Purification and properties of manganese peroxidase fromTrametesversicolor. Acta Microbiologica Sinica, 45(5): 711-715. [in Chinese])
张玉龙, 池玉杰, 闫洪波. 2011. 偏肿栓菌产锰过氧化物酶条件优化. 林业科学, 48(8): 88-94.
(Zhang Y L, Chi Y J, Yan H B. 2011. Optimization of ferment conditions of manganese peroxidase produced byTrametesgibbosa. Scientia Silvae Sinicae, 48(8): 88-94. [in Chinese])
Baborová P, Möder M, Baldrian P,etal. 2006. Purification of a new manganese peroxidase of the white-rot fungusIrpexlacteus, and degradation of polycyclic aromatic hydrocarbons by the enzyme. Res Microbiol, 157(3): 248-253.
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein using the principle of protein-dye binding. Anal Biochem, 72(1/2):248-254.
Gill P K, Arora D S. 2003. Effect of culture conditions on manganese peroxidase production and activity by some white rot fungi. J Ind Microbiol Biotechnol, 30(1): 28-33.
Lankinen P, Hildén K, Aro N,etal. 2005. Manganese peroxidase ofAgaricusbisporus: grain bran-promoted production and gene characterization. Appl Microbiol Biotechnol, 66(4): 401-407.
Mino Y, Wariishi H, Blackburn N J,etal. 1988. Spectral characterization of manganese peroxidase, an extracellular heme enzyme from the lignin degrading BasidiomycetePhanerochaetechrysosporium. J Biol Chem, 263(15): 7029 -7036.
Novotny C, Erbanova P, Sasek V,etal. 1999. Extracellular oxidative enzyme production and PAH removal in soil by exploratory mycelium of white rot fungi. Biodegradation, 10(3): 159-168.
Sundaramoorthy M, Kishi K, Gold M H,etal. 1994. The crystal structure of manganese peroxidase fromPhanerochaetechrysosporiumat 2.06 Å resolution. J Biol Chem, 269(52): 32759-32767.
Tsutsumi Y, Haneda T, Nishida T.2001. Removal of estrogenic activities of bisphenol A and nonylphenol by oxidative enzymes from lignin-degrading basidiomycetes. Chemosphere, 42(3): 271-276.
(责任编辑 王艳娜)
GradingPurificationofManganesePeroxidasesfromLenzitesgibbosa
Zhang Yulong1Chi Yujie1Feng Lianrong1, 2
(1.SchoolofForestry,NortheastForestryUniversityHarbin150040; 2.ThePoplarInstituteofLiaoningProvinceGaizhou115213)
S718.81
A
1001-7488(2017)08-0064-07
10.11707/j.1001-7488.20170808
2016-05-17;
2016-11-09。
东北林业大学博士研究生自主创新基金项目(2572016AA04); 黑龙江省自然科学基金项目(C2016006)。
*池玉杰为通讯作者。

