褪黑素对大鼠胰岛瘤细胞INS-1胰岛素和Gαi/o蛋白基因表达的影响
赵益文,赵佳,庞全海
褪黑素对大鼠胰岛瘤细胞INS-1胰岛素和Gαi/o蛋白基因表达的影响
赵益文1,赵佳2,庞全海1
(1山西农业大学动物科技学院,山西太谷030801;2北京大学分子医学研究所,北京100871)
【目的】研究褪黑素对大鼠胰岛瘤细胞INS-1中胰岛素和Gαi/o蛋白基因表达的影响,探究褪黑素在mRNA水平对和1调节作用中可能存在的分子机制。褪黑素(melatonin, MT)是松果腺分泌的一种吲哚类神经内分泌激素,在机体内可调节胰岛素的分泌而使其呈现昼夜节律性分泌,影响葡萄糖昼夜代谢水平的变化进而维持机体血糖的相对恒定,故对于褪黑素影响胰岛素表达的研究可能会对褪黑素在胰岛素昼夜节律性分泌中的调控作用提供依据。【方法】将冻存的INS-1细胞复苏培养至第三代,INS-1细胞传代后,用RPMI1640培养基培养INS-1细胞约24—48 h,当细胞密度达60%—70%时,使用无血清无葡萄糖的RPMI1640洗2次,然后在INS-1细胞培养外液中分别加入不同浓度(0、10、20、30、50 mmol·L-1)的葡萄糖及100 nmol·L-1褪黑素和不同浓度葡萄糖孵育INS-1细胞12 h,观察和统计INS-1细胞的形态学变化。利用EasyPure® RNA Kit 提取INS-1细胞的总RNA,核酸蛋白测定仪测定细胞总RNA的浓度和纯度,其次利用甲醛变性琼脂糖凝胶电泳检测细胞的总RNA质量,TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录合成cDNA。利用Primer Premier 5.0引物设计软件,参考GenBank上已登录的基因序列进行1、12、和引物的设计。应用qRT-PCR法进行检测处理后的INS-1细胞1、12、和mRNA水平的变化。【结果】用含不同浓度葡萄糖培养液孵育INS-1细胞后,观察发现随着培养基中葡萄糖浓度含量的增加INS-1细胞突触的增长呈现先增加后减少的趋势,其中20 mmol·L-1葡萄糖处理组INS-1细胞突触的增长明显,而20 mmol·L-1葡萄糖和100 nmol·L-1褪黑素处理组INS-1细胞表面积增大,但突触增长却不明显;培养基中含不同浓度葡萄糖的处理组中,Insulin1 mRNA水平呈现先升后降的趋势,Gαi1 mRNA水平则呈现先降后升的趋势,其中20 mmol·L-1葡萄糖处理组,Insulin1 mRNA水平显著增加(<0.05),Gαi1 mRNA水平显著减少(<0.05),而Gαi2和Gαo则无显著变化(>0.05),因而Gαi1表现出与Insulin1 mRNA水平呈现负相关性而非Gαi2、Gαo与Insulin1 mRNA水平呈现负相关性;20 mmol·L-1葡萄糖和褪黑素处理组和20 mmol·L-1葡萄糖处理组相比,20 mmol·L-1葡萄糖和褪黑素处理组的Gαi1 mRNA水平显著增高(<0.05),且Insulin1和PKCα mRNA水平显著减少(<0.05),PKA mRNA水平则减少不显著(>0.05)。【结论】褪黑素能够抑制INS-1细胞1的表达,减少胰岛素的分泌导致INS-1细胞适应性增生。褪黑素与其受体结合后可促进1 mRNA水平增高而抑制的表达,使得1的表达受到抑制,胰岛素分泌减少,使血糖在夜间得以维持相对恒定。
褪黑素;INS-1细胞;葡萄糖;胰岛素;Gαi/o
0 引言
【研究意义】褪黑素(melatonin, MT)是由松果腺(pineal gland)分泌的一种吲哚类神经内分泌激素,由于其具有良好的水溶性和脂溶性,故可以通过各种膜结构进入细胞器而发挥作用[1]。MT在机体内可调节胰岛素(insulin)分泌,使其呈昼夜节律性分泌进而影响葡萄糖昼夜代谢水平的变化,维持机体血糖的相对恒定[2-3],还可在一定程度上改善糖尿病的后遗症[4]。MT对胰岛素昼夜节律性分泌作用的发挥是通过Gi蛋白调节其下游的cAMP[5]、cGMP[6-7]水平而实现的。Gαi/o蛋白有多种亚型,不同亚型在胰岛素分泌的不同方面起着调节作用。Gαi2/3可抑制腺苷酸环化酶(adenylyl cyclase, AC)的活性,Gαo1抑制L型Ca2+通道,Gαi1、Gαi2、Gαi3及 Gαo2还可在胰岛素释放时发挥抑制作用[8-9]。研究MT对INS-1细胞胰岛素和Gαi/o蛋白表达的影响可从mRNA水平上阐明其作用机制,对进一步探讨胰岛素昼夜节律性分泌具有重要意义。【前人研究进展】VAN CAUTER[10]等研究发现,夜晚摄入食物后血浆糖浓度相较于清晨会显著升高,而胰岛素的敏感性及β细胞对葡萄糖的响应能力则低于清晨,呈现昼夜节律的特性。然而当消除这种亮暗昼夜差异使其一直处于暗环境下并保持清醒状态时,血浆糖浓度水平在早晚所表现的这种节律性就会极大程度的减弱[11],昼夜节律系统与葡萄糖代谢极其相关[12-14],昼夜节律性一旦被打乱则有可能会导致糖尿病的发生[15-16]。PESCHKE等[17]和BODEN等[2]研究均表明,在白天血浆中胰岛素的浓度升高,夜晚胰岛素的浓度降低,而血浆中褪黑素浓度的变化则与胰岛素相反。基于此,许多学者研究了MT对胰岛素分泌的影响。SRINIVASAN等[18-19]研究发现,MT可抑制胰腺β细胞胰岛素的分泌,提高胰岛素的敏感性。BONNEFOND等[20-21]等的研究表明MT受体基因与二型糖尿病密切相关,可能有利于二型糖尿病的治疗。而MT对胰岛素的这种调节作用可能是通过Gαi/o蛋白来实现的[5-7]。然而,也有一些在体以及离体[22-23]的研究表明,MT可促进β细胞胰岛素的分泌。【本研究切入点】对于在mRNA水平上MT调控1和表达的作用机制,目前在国内外鲜有报道,MT在胰岛素分泌的昼夜节律性中的作用也尚不明确。【拟解决的关键问题】本研究通过在INS-1细胞培养外液中加入不同浓度的MT,观察和统计INS-1细胞形态学变化及1、12、和表达的变化,揭示MT调控胰岛素和Gαi/o蛋白基因表达的作用机制,为进一步探讨MT在胰岛素分泌的昼夜节律性中的作用提供依据。
1 材料与方法
1.1 试验时间及地点
本试验于2015年12月至2016年9月在北京大学分子医学研究所细胞分泌与代谢实验室进行。
1.2 试验材料
1.2.1 试验试剂 RPMI 1640培养基(ThermoFisher);胎牛血清(FBS)(Gibco);丙酮酸钠(Sigma);0.25%胰蛋白酶(Gibco);β巯基乙醇(Gibco);褪黑素(Solarbio);D-(+)-葡萄糖(Sigma);EasyPure® RNA Kit(TRANSGEN);HotMaster DNA polymerase(TIANGEN);TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix (TIANGEN);其他常用试剂均为国产分析纯。
1.2.2 试验材料 大鼠胰岛瘤细胞系(INS-1)购自美国模式培养物集存库(American type culture collection, ATCC)。将大鼠胰岛瘤细胞INS-1培养于含10%的新生胎牛血清、1%的丙酮酸钠、1‰ β-巯基乙醇的RPMI 1640培养基中,37℃,5%CO2培养箱中常规培养。
1.3 试验方法
1.3.1 INS-1细胞培养 将冻存的INS-1细胞自液氮罐中取出后放入37℃水浴,摇晃使其尽快融化。融化后用移液枪移入无菌离心管,加10倍体积培养液,混匀,1 000 r/min-1离心8 min,去上清,加少量新鲜培养液,将沉淀细胞吹打成细胞悬液,按1×105密度接种于培养瓶,培养箱孵育24 h使细胞复苏,48 h换液,培养至第4天即可进行传代培养。传代培养至第三代即可用其进行后续试验。
1.3.2 INS-1细胞的刺激试验 将生长良好的INS-1细胞进行传代,以1×105/24cm2密度接种于细胞培养皿,约24—48 h后细胞密度达60%—70%,使用无血清无葡萄糖的RPMI1640洗两次:
(1)换用无血清含不同浓度葡萄糖(0、10、20、30、50 mmol·L-1)的RPMI1640刺激12 h,提取总RNA;
(2)换用无血清含100 nmol·L-1褪黑素[5]及不同浓度葡萄糖(0、10、20、30、50 mmol·L-1)的RPMI1640刺激12 h,提取总RNA。
1.3.3 cDNA合成 按照 EasyPure® RNA Kit试剂盒操作说明提取总RNA,核酸蛋白测定仪ND-1000(Thermo)测定总RNA的浓度和纯度。0.9%—1.2%甲醛变性琼脂糖凝胶电泳检测总RNA质量。利用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒合成cDNA,采用20 μL反应体系:Total RNA 1 μL,Anchored Oligo(dT)18Primer 1 μL,2×TS Reaction Mix 10 μL,TS Enzyme Mix1 μL,gDNA Remover1μL,RNase-free Water 6 μL;反应条件:42℃ 30 min,85℃ 5 min;反转录产物可于-20℃长期保存。
1.3.4 引物设计与合成 利用Primer Premier 5.0引物设计软件,参考GenBank上已登录的1、2、、1、、和序列,设计7对特异性引物,由北京华大科技有限公司合成(表1)。
1.3.5 qRT-PCR 利用HotMaster DNA polymerase进行反应,每个样本设3次重复,另加3个无模板阴性对照。25 μL反应体系:ddH2O 18.25 μL,10×HotMaster Taq Buffer 2.5 μL,dNTP(2.5 mmol∙L-1)1 μL,5×SYBR 1 μL,正反向引物(10 μmol∙L-1)各0.5 μL,HotMaster DNA polymerase 0.25 μL,cDNA模板1.0 μL。反应条件:95℃ 10 s;95℃ 30 s,60℃ 30 s,72℃ 30 s,共40个循环;95℃ 15 s,60℃ 20 s,95℃ 15 s,溶解曲线;4℃ forever。根据荧光曲线的CT值计算定量结果。
1.4 图像分析与数据处理
实验数据用Excel 2013进行基本统计分析,采用GraphPad Prism 6软件进行图形绘制,结果均用“平均值±标准差(Means±SD)”表示,全部数据采用SPSS 17.0 统计软件进行单因素方差分析检验。
2 结果
2.1 褪黑素及葡萄糖对INS-1细胞形态学影响
将INS-1细胞分为5组,每组用不同浓度葡萄糖(0、10、20、30、50 mmol·L-1)的培养液进行孵育,12 h后倒置显微镜下观察细胞形态变化,发现随着葡萄糖浓度的增加,INS-1细胞表面积没有明显变化,但细胞突触的增长呈现先增加后减少的趋势,表现为贴壁细胞生长特征(图1-A-E)。此外,在用不同浓度葡萄糖处理的基础上加入100 nmol·L-1MT处理细胞12 h,分别对比加入MT前后INS-1细胞的变化,可见在20 mmol·L-1葡萄糖处理组细胞突触增长最为明显,而加入MT后细胞突触增长不明显,但细胞表面积明显增大(图1-C、H、K)。其他葡萄糖浓度与MT处理组细胞形态则没有明显变化(图1-A-K)。
2.21抑制INS-1细胞1的表达
为了筛选出与1表达相关的Gαi/o蛋白,将INS-1细胞分别用0、10、20、30、50 mmol·L-1葡萄糖和MT处理后,检测了12、及1基因的表达水平(图2-A-F)。如图2所示,1的表达水平在不同浓度葡萄糖处理组表现为先升后降的趋势,其中在20 mmol·L-1葡萄糖处理组表达显著升高(<0.05),而加入MT处理后1在各浓度葡萄糖处理组的表达水平均无显著差异(>0.05)。1的表达水平在不同浓度葡萄糖处理组表现为先降后升的趋势,其中在20 mmol·L-1葡萄糖处理组表达显著降低(<0.05),而加入MT处理后1在各浓度葡萄糖处理组的表达水平亦均无显著差异(>0.05)(图2-A、D)。2在10 mmol·L-1葡萄糖处理组表达水平显著降低(<0.05),加入MT处理后2在10 mmol·L-1葡萄糖处理组表达水平降低极显著(<0.01)(图2-B、E)。的表达水平在MT处理前后均无显著差异(>0.05)(图2-C、F)。此外,分别统计对比了在MT处理前和处理后12、及1在葡萄糖各浓度处理组的表达水平,20 mmol·L-1葡萄糖处理组1表达水平在MT处理后较处理前显著增加(<0.05)(图2-G),1表达水平在MT处理后较处理前显著减少(<0.05)(图2-I),其他组在MT处理前后无显著差异(>0.05)(图2-G-J)。
2.3 褪黑素抑制INS-1细胞1的表达
为了进一步探究MT与1间的相互作用关系,笔者分别检测了20 mmol·L-1葡萄糖处理INS-1细胞及20 mmol·L-1葡萄糖和MT同时处理INS-1细胞时1的表达水平并将两者进行对比,结果显示,20 mmol·L-1葡萄糖处理INS-1细胞时,1表达水平显著降低(<0.05),加入MT处理INS-1细胞时,1表达水平无显著差异(>0.05),但MT处理组1表达水平显著高于只有20 mmol·L-1葡萄糖处理组(<0.05)(图3-A)。此外为了筛选MT抑制1表达相关的蛋白激酶,分别检测了20 mmol·L-1葡萄糖处理组及20 mmol·L-1葡萄糖和MT处理组1、的表达水平,结果显示,20 mmol·L-1葡萄糖和MT处理组1和表达水平显著降低(<0.05),表达水平则无显著差异(>0.05)(图3-B)。

表1 基因引物序列
3 讨论
3.1 褪黑素抑制INS-1细胞增殖及1的表达
褪黑素是松果腺在夜间产生的一种胺类激素,光的刺激会抑制其分泌,并且MT作为昼夜节律性的周期信号,对机体的昼夜节律性的周期调节极其重要[24]。近年来许多研究均表明,MT对β细胞胰岛素分泌的昼夜节律具有调节作用[5-7],并可抑制β细胞胰岛素的分泌[5,18-19,25],但在mRNA水平上MT对胰岛素表达的影响却未见有报道。本试验中用不同浓度葡萄糖(0、10、20、30、50 mmol·L-1)的培养液孵育INS-1细胞,随着葡萄糖浓度的增加INS-1细胞突触的增长呈现先增加后减少的趋势,与ZHANG等[26]报道的高浓度葡萄糖抑制INS-1细胞增长低浓度葡萄糖促进INS-1细胞增长相一致,表现为贴壁细胞生长特征(图1-A-E),且20 mmol·L-1葡萄糖处理组细胞突触增长最为明显。然而,加入100 nmol·L-1MT处理INS-1细胞后,20 mmol·L-1葡萄糖及MT处理组突触增长不明显,细胞表面积却明显增大(图1-C、H),结合两组1的表达水平,20 mmol·L-1葡萄糖处理组1表达显著增加,20 mmol·L-1葡萄糖及MT处理组1表达增加不显著,且相较于20 mmol·L-1葡萄糖处理组1表达显著降低(图2),由此可知,20 mmol·L-1葡萄糖可促进INS-1细胞胰岛素的分泌并可促进细胞的增殖,当加入MT后,MT抑制了1的表达,胰岛素分泌减少[27],葡萄糖刺激INS-1细胞导致其适应性增生[28]。如上分析说明,MT能够抑制INS-1细胞的增殖,并可抑制INS-1细胞1的表达,减少胰岛素的分泌,导致INS-1细胞的增生。
3.2 褪黑素通过1抑制INS-1细胞1的表达
有研究显示, MT对胰岛素昼夜节律性分泌作用的发挥是通过Gi蛋白来实现的[5-7],但Gαi/o抑制型蛋白有多种亚型,MT是通过何种Gi蛋白抑制胰岛素分泌的目前尚未有明确报道。为了筛选出与1表达相关的Gαi/o蛋白,本试验首先检测了1及Gαi/o蛋白各亚型12的表达水平,统计比较了1与Gαi/o抑制型蛋白各基因表达水平的相关性。试验结果显示,的表达水平在20 mmol·L-1葡萄糖处理组及20 mmol·L-1葡萄糖和MT处理组均无显著差异(图2-C、F),表明与MT抑制1的表达无关。2虽然在10 mmol·L-1葡萄糖处理组及10 mmol·L-1葡萄糖和MT处理组表达水平均有显著性降低,但10 mmol·L-1葡萄糖处理组及10 mmol·L-1葡萄糖和MT处理组1表达水平却无显著性差异(图2-B、E),亦表明2与MT抑制1的表达无关。试验中1的表达水平在不同浓度葡萄糖处理组表现为先降后升的趋势,1的表达水平表现为先升后降的趋势,其中在20 mmol·L-1葡萄糖处理组1的表达显著升高,1表达显著降低,而加入MT处理后,1和1在各浓度葡萄糖处理组的表达水平均无显著差异(图2-A、D),而且1表达水平在MT处理后较处理前显著增加,1表达水平则显著减少,表明MT对1具有上调作用对1具有下调作用,由此表明,1与MT抑制1的表达不仅具有相关性且可抑制1的表达,而这种抑制作用可能是由于葡萄糖刺激INS-1细胞胰岛素分泌时,1可在一定程度上抑制细胞外液胰岛素浓度的上升以使其不至于升高过猛[29]。
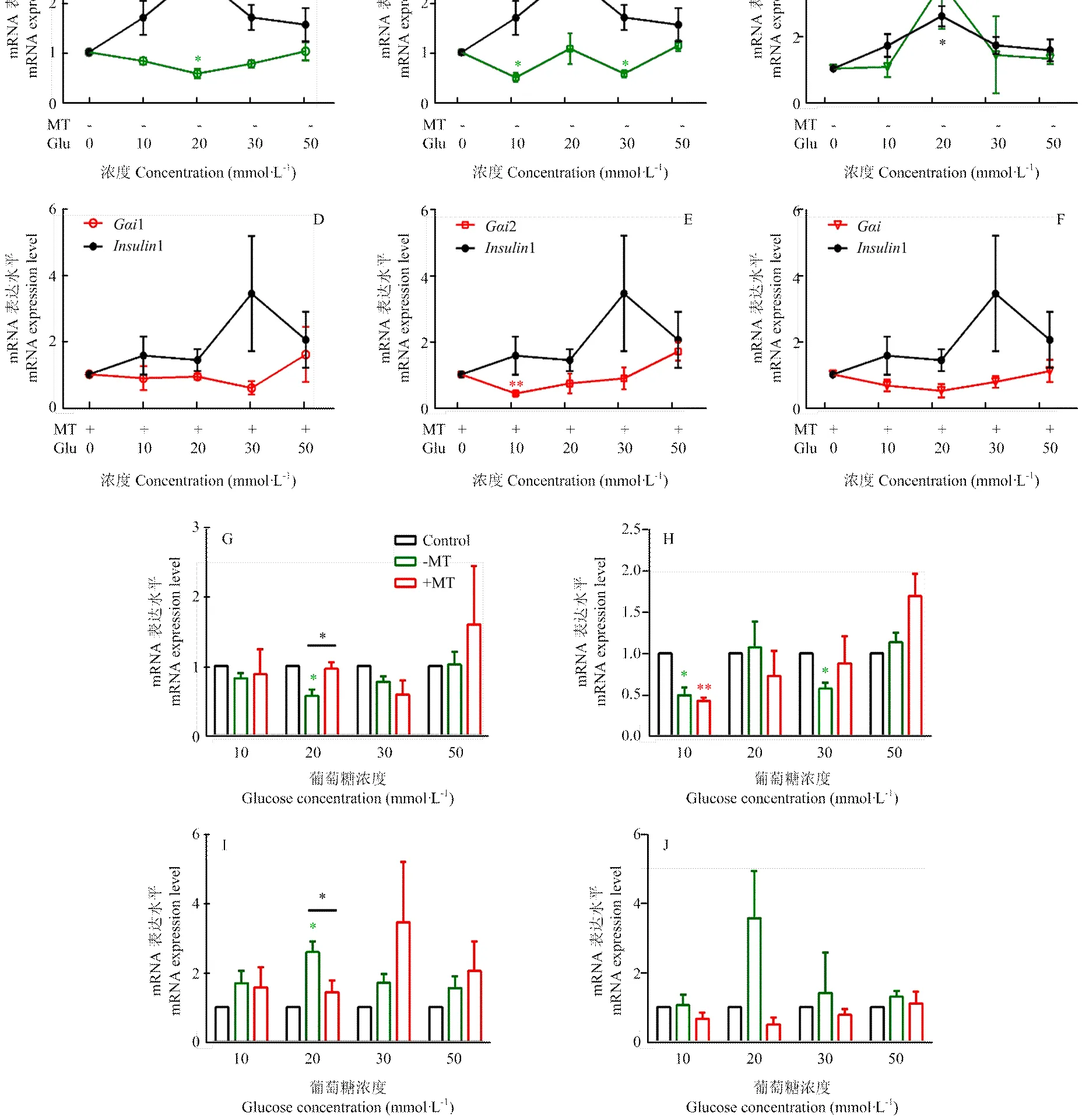
A—C. 葡萄糖处理Insulin1和Gαi1 (A), Gαi2 (B), Gαo (C)表达水平;D—F. 葡萄糖和100 nmol·L-1褪黑素处理Insulin1和Gαi1(D), Gαi2 (E), Gαo (F)表达水平;G-J.褪黑素处理前后Gαi1(G), Gαi2 (H), Insulin1(I), Gαo (J)表达水平对比;ns表示无显著差异;*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。下同
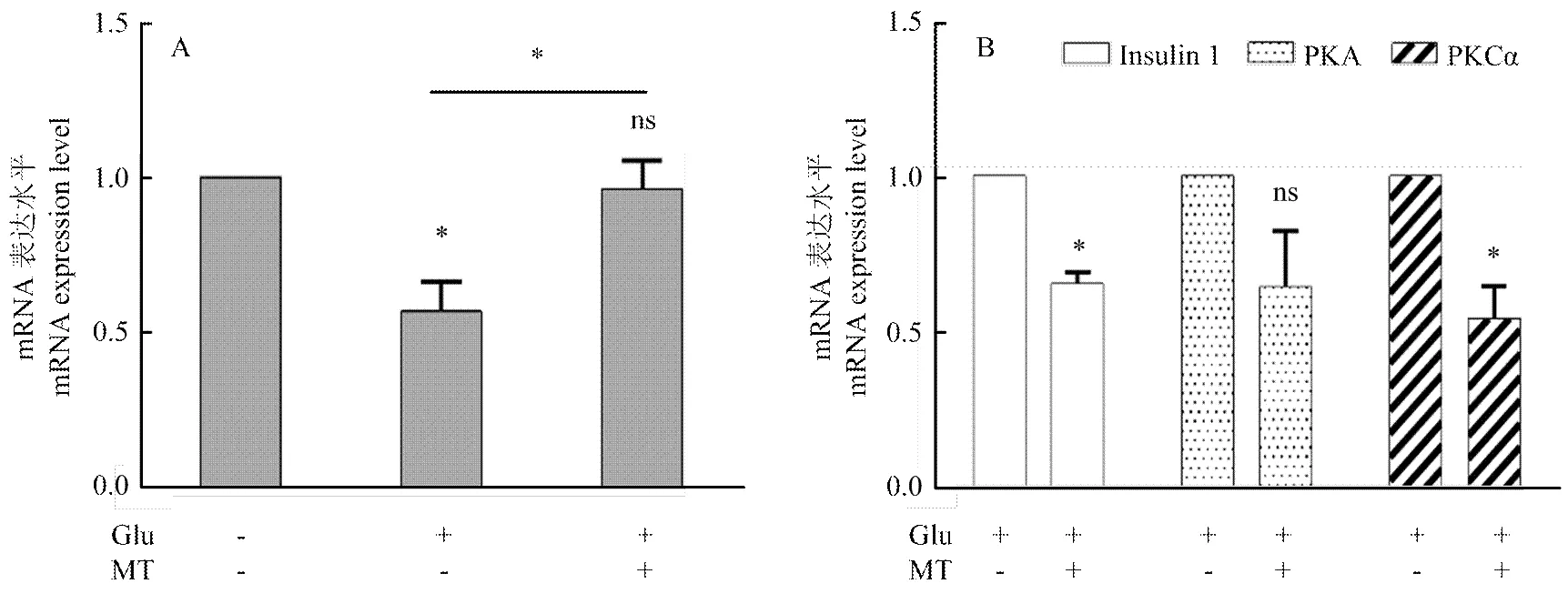
A. 褪黑素促进Gαi1的表达;B. 褪黑素处理Insulin1、PKA、PKCα表达水平
以上试验证明了1可抑制1的表达,而MT亦可抑制1的表达,为了进一步验证MT是否通过1而抑制1的表达,本试验检测了20 mmol·L-1葡萄糖处理组及20 mmol·L-1葡萄糖和MT处理组INS-1细胞1表达水平的变化并将两者进行对比,结果显示,20 mmol·L-1葡萄糖处理组,1表达水平显著降低,20 mmol·L-1葡萄糖和MT处理组,1表达水平无显著差异,而20 mmol·L-1葡萄糖和MT处理组1的表达水平则显著高于20 mmol·L-1葡萄糖处理组(图3-A),由此表明,MT可促进1的表达。
以上分析说明,1抑制INS-1细胞1的表达,MT促进INS-1细胞1的表达,而MT可抑制INS-1细胞1的表达,综上可知,MT可通过促进抑制型G蛋白1的表达从而抑制INS-1细胞1的表达,抑制胰岛素的分泌。
3.31通过抑制INS-1细胞1的表达
Gi蛋白可调节MT对胰岛素昼夜节律性的分泌,而这种调节作用的发挥是通过其下游cAMP[5]、cGMP[6-7]、PKA和PKC[30]等实现的。为了筛选MT抑制1表达相关的蛋白激酶,本试验检测了20 mmol·L-1葡萄糖处理组及20 mmol·L-1葡萄糖和MT处理组1、的表达水平,结果显示,20 mmol·L-1葡萄糖和MT处理组1和表达水平显著降低,表达水平则无显著差异(图3-B),表明表达水平的降低可抑制1的表达。此外,20 mmol·L-1葡萄糖和MT处理组1、和1的表达水平与20 mmol·L-1葡萄糖处理组相比,1表达水平显著增高,和1表达水平显著降低(图3),表明1表达水平的增高可抑制的表达。如上分析说明,加入MT处理INS-1细胞后,1表达水平增高,抑制了的表达,进而抑制了1的表达,由此表明1是通过来抑制INS-1细胞1表达的。
3.4 褪黑素抑制INS-1细胞1表达模式图
MT在机体内可调节胰岛素的分泌,使其呈昼夜节律性分泌进而影响葡萄糖昼夜代谢水平的变化,维持机体血糖的相对恒定[2-3]。夜晚胰腺β细胞分泌的胰岛素对MT非常敏感,胰岛素或MT稍有变动就有可能发生糖尿病的风险[27]。有研究报道,葡萄糖在体内代谢后通过cAMP信号通路激活PKA蛋白激酶,促进胰岛素的分泌,而MT可作用于Gi蛋白抑制腺苷酸环化酶(Adenylyl cyclase)的活性进而抑制cAMP的产生,从而抑制胰岛素的分泌[17,30]。本试验中首先检测了MT确实对葡萄糖诱导的1表达具有抑制作用(图4),与前人报道相符[18-19,30]。其次,本试验对与1表达抑制相关的抑制型Gαi/o蛋白进行了筛选,结果表明1表达的抑制与1的表达相关而与和2的表达无关(图2-A、D),且1可抑制1的表达。再次,本试验检测并对比了葡萄糖组及葡萄糖和MT组INS-1细胞1表达水平,结果表明MT可促进INS-1细胞1的表达(图3-A)。本试验检测了和蛋白激酶与1和1间的相互关系,发现1可抑制的表达进而抑制1的表达(图3-B)。以上分析表明,MT与MT受体结合后会促进与之偶联的1蛋白的表达,1的表达水平增高会抑制的表达,进而使得1的表达受到抑制,胰岛素分泌减少,使血糖在夜间得以维持相对恒定。
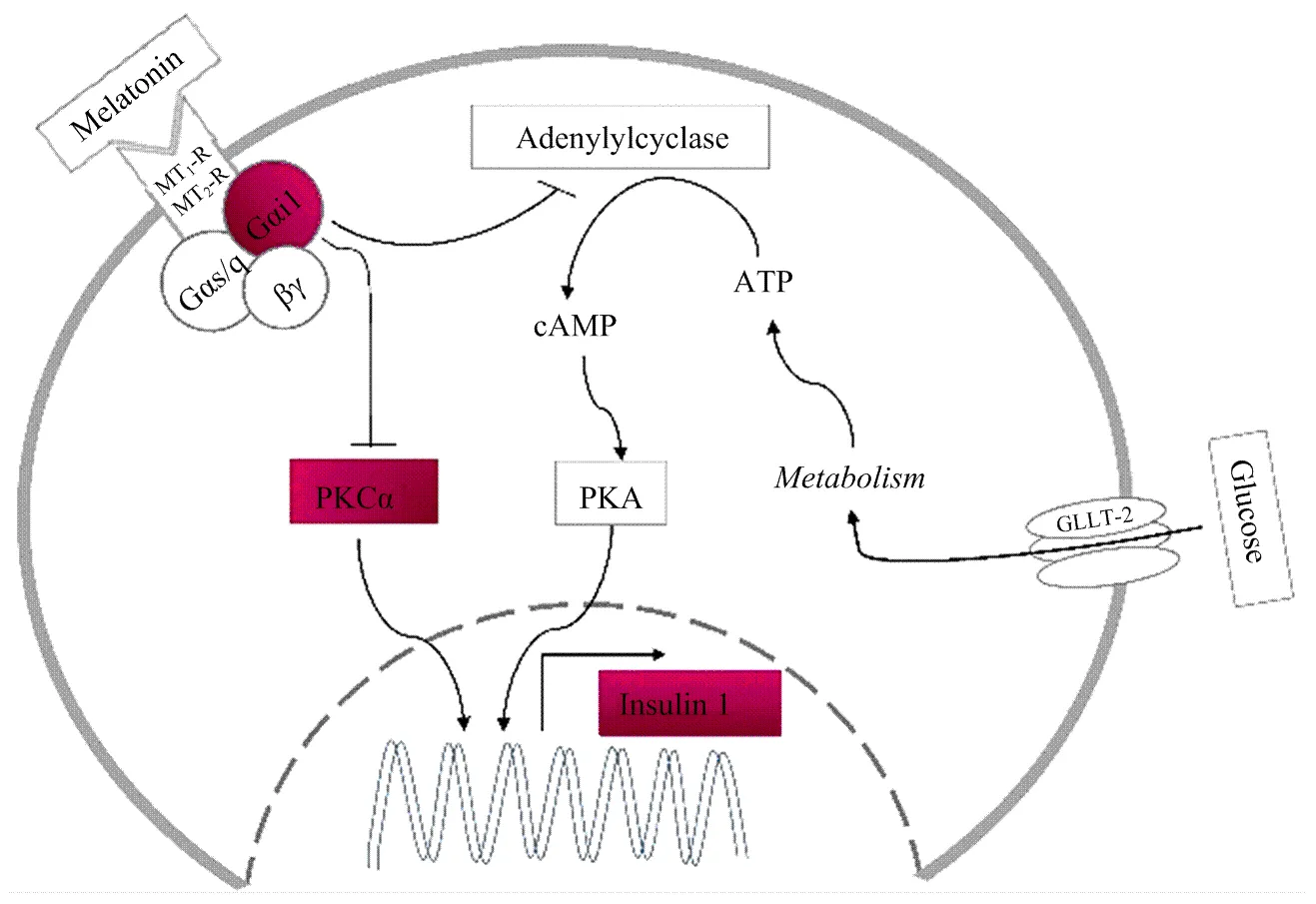
Melatonin:褪黑素;MT1-R:褪黑素受体1;MT2-R:褪黑素受体2;Adenylyl cyclase:腺苷酸环化酶;cAMP:环化腺核苷一磷酸;PKA:蛋白激酶A;PKCα:蛋白激酶Cα;Glucose:葡萄糖;Metabolism:代谢
4 结论
褪黑素能够抑制INS-1细胞1的表达,减少胰岛素的分泌,进而导致INS-1细胞适应性增生。夜间松果腺分泌的褪黑素与其受体结合后,可促进褪黑素受体偶联的抑制型Gαi1蛋白的表达,1的表达水平增高会抑制的表达,进而使得1的表达受到抑制,胰岛素分泌减少,使血糖在夜间得以维持相对恒定。
References
[1] 高超, 田秀芝, 张璐, 徐静, 汪锋, 卓志勇, 戴蕴平, 刘国世.外源褪黑素对牛卵母细胞体外成熟的影响. 中国农业科学, 2011, 44(17): 3634-3640.
GAO C, TIAN X Z, ZHANG L, XU J, WANG F, ZHUO Z Y, DAI Y P, LIU G S. Effect of exogenous melatonin (MT) in bovine oocytematuration., 2011, 44(17):3634-3640. (in Chinese)
[2] BODEN G, RUIZ J, URBAIN J L, CHEN X. Evidence for a circadian rhythm of insulin secretion., 1996, 271(2):E246-E252.
[3] GUARDIOLA-LEMAITRE B. Toxicology of melatonin., 1997, 12(6):697-706.
[4] CARDINALI D P, CANO P, JIMENEZ-ORTEGA V, ESQUIFINO A I. Melatonin and the metabolic syndrome: physiopathologic and therapeutical implications., 2011, 93(3):133-142.
[5] PICINATO M C, HABER E P, CIPOLLA-NETO J, CURI R, CARVALHO C R D O, CARPINELLI A R. Melatonin inhibits insulin secretion and decreases PKA levels without interfering with glucose metabolism in rat pancreatic islets., 2002, 33(3): 156-160.
[6] STUMPF I, MUHLBAUER E, PESCHKE E. Involvement of the cGMP pathway in mediating the insulin-inhibitory effect of melatonin in pancreatic beta-cells., 2008, 45(3):318-327.
[7] STUMPF I, BAZWINSKY I, PESCHKE E. Modulation of the cGMP signaling pathway by melatonin in pancreatic beta-cells., 2009, 46(2):140-147.
[8] SHARP G W. Mechanisms of inhibition of insulin release., 1996, 271(6): C1781-C1799.
[9] STRAUB S G, SHARP G W G. Evolving insights regarding mechanisms for the inhibition of insulin release by norepinephrine and heterotrimeric G proteins., 2012, 302(12): C1687-C1698.
[10] VAN CAUTER E, POLONSKY K S, SCHEEN A J. Roles of circadian rhythmicity and sleep in human glucose regulation 1., 1997, 18(5): 716-738.
[11] SHEA S A, HILTON M F, ORLOVA C, TIMOTHY AYERS R, MANTZOROS C S. Independent circadian and sleep/wake regulation of adipokines and glucose in humans., 2005, 90(5): 2537-2544.
[12] QIAN J, SCHEER F A J L. Circadian system and glucose metabolism: Implications for physiology and disease., 2016, 27(5): 282-293.
[13] MORRIS C J, YANG J N, SCHEER F A J L. The impact of the circadian timing system on cardiovascular and metabolic function., 2012, 199: 337.
[14] MORRIS C J, YANG J N, GARCIA J I, MYERSA S, BOZZIA I, WANGA W, BUXTONA O M, SHEAA S A, SCHEER F A J L. Endogenous circadian system and circadian misalignment impact glucose tolerance via separate mechanisms in humans., 2015, 112(17): E2225-E2234.
[15] SCHEER F A, HILTON M F, MANTZOROS C S, SHEA S A. Adverse metabolic and cardiovascular consequences of circadian misalignment., 2009, 106(11):4453-4458.
[16] PESCHKE E, BÄHR I, MÜHLBAUER E. Experimental and clinical aspects of melatonin and clock genes in diabetes., 2015, 59(1): 1-23.
[17] PESCHKE E. Melatonin, endocrine pancreas and diabetes., 2008, 44: 26-40.
[18] SRINIVASAN V, OHTA Y, ESPINO J, PARIENTE J A, RODRIGUEZ A B, MOHAMED M, ZAKARIA R. Metabolic syndrome, its pathophysiology and the role of melatonin., 2013, 7(1): 11-25.
[19] ZANUTO R, SIQUEIRA-FILHO M A, CAPERUTO L C, BACURAU R F, HIRATA E, PELICIARI-GARCIA R A, DO AMARAL F G, MARÇAL A C, RIBEIRO L M, CAMPOREZ J P, CARPINELLI A R, BORDIN S, CIPOLLA-NETO J, CARVALHO C R. Melatonin improves insulin sensitivity independently of weight loss in old obese rats., 2013, 55(2):156-165.
[20] BONNEFOND A, CLÉMENT N, FAWCETT K, YENGO L, VAILLANT E, GUILLAUME J L, DECHAUME A, PAYNE F, ROUSSEL R, CZERNICHOW S, HERCBERG S, HADJADJ S, BALKAU B, MARRE M, LANTIERI O, LANGENBERG C, BOUATIA-NAJI N. Rare MTNR1B variants impairing melatonin receptor 1B function contribute to type 2 diabetes., 2012, 44(3): 297-301.
[21] GAULTON K J, FERREIRA T, LEE Y, Raimiondo A, Mägi R. Genetic fine mapping and genomic annotation defines causal mechanisms at type 2 diabetes susceptibility loci., 2015, 47(12): 1415-1425.
[22] COSTES S, BOSS M, THOMAS A P, MATVEYENKO A V. Activation of melatonin signaling promotes β-cell survival and function., 2015, 29(5): 682-692.
[23] RUBIO-SASTRE P, SCHEER F A, GÓMEZ-ABELLÁN P, MADRID J A, GARAULET M. Acute melatonin administration in humans impairs glucose tolerance in both the morning and evening., 2014, 37(10): 1715-1719.
[24] MORRIS C J, AESCHBACH D, SCHEER F A J L. Circadian system, sleep and endocrinology., 2012, 349(1): 91-104.
[25] MÜHLBAUER E, ALBRECHT E, HOFMANN K, BAZWINSKY- WUTSCHKE I, PESCHKE E. Melatonin inhibits insulin secretion in rat insulinoma β-cells (INS-1) heterologously expressing the human melatonin receptor isoform MT2., 2011, 51(3): 361-372.
[26] ZHANG Z, LI J, JIANG X, LEI Y, LEI L, DE H C, HUA Z, HONG C. GLP-1 ameliorates the proliferation activity of INS-1 cells inhibited by intermittent high glucose concentrations through the regulation of cyclins., 2014, 10(2): 683-688.
[27] TUOMI T, NAGORNY C L F, SINGH P, ET A L. Increased melatonin signaling is a risk factor for type 2 diabetes., 2016, 23: 1067-1077.
[28] HULL R L, KODAMA K, UTZSCHNEIDER K M, CARR D B, PRIGEON R L, KAHN S E. Dietary-fat-induced obesity in mice results in beta cell hyperplasia but not increased insulin release: evidence for specificity of impaired beta cell adaptation., 2005, 48(7): 1350-1358.
[29] HELLMAN B, GRAPENGIESSER E. Glucose-induced inhibition of insulin secretion., 2014, 210(3): 479-488.
[30] SHARMA S, SINGH H, AHMAD N, PRIYANKA M, ARCHANA T. The role of melatonin in diabetes: therapeutic implications., 2015, 59(5): 391-397.
(责任编辑 林鉴非)
Effect of Melatonin onandExpression in Rat Insulinoma Cell Line
ZHAO Yiwen1, ZHAO Jia2, PANG Quanhai1
(1College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi;2Institute of Molecular Medicine, Peking University, Beijing 100871)
【Objective】To demonstrate the role of melatonin in the circadian secretion of insulin, the effect of melatonin onandexpression in rat insulinoma cell line (INS-1) and molecular mechanism were studied. As melatonin can regulate insulin secretion in a circadian manner, maintaining a homeostasis of blood glucose by regulating diurnal glucose metabolism, thus study on the effect of melatonin on expression of insulin may provide a basis for regulation of melatonin in circadian secretion of insulin.【Method】The cryopreserved INS-1 cells were passaged for at least three generations. After the passage of cells, INS-1 cells were cultured in RPMI1640 medium for about 24-48 h. When the cell confluency reached 60%-70%, washed with RPMI1640 without serum and glucose for two times. INS-1 cells were cultured in media supplemented with different concentrations of glucose(0, 10, 20, 30, and 50 mmol·L-1) and 100 nmol·L-1melatonin for 12 h treatment, then observation of morphological changes of INS-1 cells and statistical analysis were performed. The total RNA extracted from INS-1 cells by Easypure RNA kit, measuring the cells total RNA concentration and purity, then the quality of total RNA was measured by formaldehyde denaturing agarose gel electrophoresis. TranScript One-step Removal and Synthesis Supermix were used to synthesize cDNA by reverse transcription. Primer Premier 5.0 primer design software, reference gene sequence of GenBank were used to design primers. qRT-PCR was used to detect the changes of1,1,2,,andinmRNA level.【Result】After incubation of INS-1 cells with different concentrations of glucose, it was observed that the growth of cell synapse first increased and then decreased along with the increase of the concentration of glucose in the culture medium. In the 20 mmol·L-1glucose treatment group, the synaptic growth of INS-1 cells was increased significantly; in the 20 mmol·L-1glucose and melatonin co-treatment group, the area of INS-1 cells was increased, but the synaptic growth was not obvious. In the glucose treatment group, the mRNA level of1 showed a trend of increase and then reduction, especially was increased at 20 mmol·L-1(<0.05). The mRNA level of1 showed a trend of reduction and then increase, especially was reduced at 20 mmol·L-1(<0.05). The mRNA level of2 andwas not significantly reduced (>0.05). Thus,1 but not2 andshowed a negative correlation with1 mRNA level. Compared with 20 mmol·L-1glucose treatment group, the mRNA level of1 was significantly increased (<0.05) at 20 mmol·L-1glucose and melatonin co-treatment group, the mRNA level of1 andα was significantly reduced (<0.05), whereas the mRNA level ofwas not significantly reduced (>0.05).【Conclusion】Melatonin inhibits the expression of1 in INS-1 cells and reduces insulin secretion resulting in the adaptive hyperplasia of INS-1 cells. The binding of melatonin to its receptor can promote the increase of1 mRNA levels and inhibit the expression of, which leads to the inhibited expression of1 and decreased insulin secretion, so that blood glucose remains homeostatic during the night.
melatonin; INS-1 cells; glucose; insulin; Gαi/o
2017-03-21;接受日期:2017-06-28
国家重点研发计划(30972223,31272628)
赵益文,E-mail:yiwenz1103@163.com

