不同苦瓜品种皂苷含量组成及其抗氧化活性和α-葡萄糖苷酶的抑制活性
刘慧娟,张名位,张瑞芬,张雁,魏振承,马永轩,刘磊,邓媛元
不同苦瓜品种皂苷含量组成及其抗氧化活性和α-葡萄糖苷酶的抑制活性
刘慧娟1,2,张名位2,张瑞芬2,张雁2,魏振承2,马永轩2,刘磊2,邓媛元2
(1长江大学生命科学学院,湖北荆州 434020;2广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610)
【目的】比较不同品种苦瓜果肉中皂苷总含量、7种单体组成含量及抗氧化性和α-葡萄糖苷酶抑制活性差异,为明确苦瓜中主要皂苷单体组成含量,筛选高皂苷含量及高活性的苦瓜品种提供科学参考。【方法】采用香草醛-高氯酸法测定13个苦瓜品种皂苷总含量,高效液相法测定7种皂苷单体含量、总抗氧化能力指数(ORAC),并评价其抗氧化活性,采用4-硝基酚-2-D吡喃葡萄糖苷法测定α-葡萄糖苷酶抑制率,同时分析组成含量和活性之间的相关性。【结果】13个不同品种苦瓜果肉皂苷总含量呈显著性差异,含量变幅为(0.52—1.20)g/100gDW,平均值为0.79 g/100g DW,变异系数为21.65%。7种皂苷单体含量的平均值依次为:苦瓜苷A(Momorcharaside A)5.32 μg∙g-1DW,苦瓜皂苷A(Momordicoside A)25.42 μg∙g-1DW,Karaviloside XI 3.96 μg∙g-1DW,苦瓜皂苷F2(Momordicoside F2)66.95 μg∙g-1DW,苦瓜皂苷K(Momordicoside K)183.70 μg∙g-1DW,(23E)-3β,7β,25-trihydroxycucubita-5,23-dien-19-al 40.13 μg∙g-1DW,Kuguacin N 3.87 μg∙g-1DW。不同品种苦瓜总皂苷ORAC指数变幅为2 747.76—15 584.07 μmol Trolox∙g-1,平均值为8 879.48 μmol Trolox∙g-1,变异系数为34.91%;α-葡萄糖苷酶IC50值变幅为1.55—4.96 mg∙mL-1。【结论】不同品种苦瓜果肉皂苷总含量、单体组成含量、抗氧化活性和α-葡萄糖苷酶抑制率有显著差异。皂苷是苦瓜抑制α-葡萄糖苷酶活性的主要物质基础,但并非苦瓜抗氧化活性主要贡献物质。(23E)-3β,7β,25-trihydroxycucubita-5,23-dien-19-al是主要活性单体。
苦瓜;皂苷;抗氧化;α-葡萄糖苷酶
0 引言
【研究意义】苦瓜又名凉瓜,属葫芦科草本植物,是华南特色药用蔬菜。皂苷是苦瓜中的主要功能成分,具有降血糖、减肥、抗氧化等多种生理活性[1-3]。不同种类植物中皂苷的含量和组成及其活性不尽相同[4]。比较不同品种苦瓜果肉中皂苷的含量、组成及其降糖和抗氧化活性差异,筛选皂苷含量高,活性强的苦瓜品种,有利于指导苦瓜精深加工,开发以皂苷为主要功能因子的苦瓜健康食品新产品。【前人研究进展】张武君等[5]比较了福建种植的29个苦瓜品种果肉皂苷含量,变幅为0.90%—2.47%,均值为1.28%,根、茎皂苷含量接近或高于果实含量。田力东等[4]比较分析了两广地区主栽的35个苦瓜品种皂苷含量,变幅为1.17%—4.07%,果肉皂苷含量均值为1.96%,并且同一品种苦瓜果肉中皂苷含量大于籽粒。此外,已通过植物化学经典分离手段比较了云南玉溪产苦瓜和安宁产苦瓜果肉皂苷类化合物组成差异,均从中分离鉴定新化合物5个[6-7]。到目前为止,从苦瓜中分离得到葫芦烷型三萜皂苷已经有140多个[8]。据报道有降糖活性的单体14个,包括momordicosides Q、R、S、T和karaviloside XI等[9-12]。抗氧化活性单体7个,包括taiwacin A、taiwacin B、momordicoside K和3-O-(β-D-glucopyranosyl)-24β-ethyl-5α-chalesta-7, 22,25(27)-trien-3β-ol等[13-14]。【本研究切入点】虽然已有研究分别对不同品种苦瓜皂苷总含量和单个品种皂苷单体组成进行了分析,但极少关于皂苷单体组成含量在不同品种间的比较,更缺少基于品种皂苷单体组成含量和活性之间的相关性分析。【拟解决的关键问题】测定华南地区栽种的13个品种苦瓜果肉皂苷中的含量相对较多且文献报道活性相对较好的7种皂苷单体物质含量[15],比较皂苷的抗氧化和α-葡萄糖苷酶抑制活性,并分析其构效和量效关系,为苦瓜的精深加工和功能食品开发提供理论依据和科学指导。
1 材料与方法
1.1 供试材料
13个不同品种苦瓜种植于广东省农业科学院蔬菜研究所广州市白云基地试验田。2015年3月播种,7月收获。苦瓜初熟时收获,当天运回广东省农业科学院蚕业与农产品加工研究所农业部功能食品重点实验室。所有苦瓜品种名称及分类由广东省农业科学院蔬菜研究所从事苦瓜品种培育的张长远研究员提供。
1.2 试验材料
人参皂苷Rg1标准品购自中国药品生物制品检定研究所;Trolox、荧光素钠盐、葡萄糖醛酸、α-D-葡萄糖苷酶和对硝基苯基-α-D-吡喃葡萄糖购自美国Sigma公司;其余试剂均为国产分析纯。
1.3 仪器设备
SB-2000旋转蒸发仪(日本东京理化器械株式会社),TECAN infinite 200酶标仪(瑞士TECAN),LC1200高效液相色谱仪(美国Agilent),EYELA真空冷冻干燥仪(日本东京理化器械株式会社),TAISITE万能粉碎机(天津市泰斯特仪器有限公司),UV-2450紫外可见分光光度计(日本岛津有限公司)。
1.4 试验方法
1.4.1 苦瓜皂苷的提取制备 苦瓜洗净去籽切片,在电热鼓风机单层平铺,55℃下过夜烘干,万能粉碎机粉碎过60目筛。准确称取50.00 g苦瓜干粉按料液比1﹕10加甲醇在80℃下回流提取1 h,4 000 r/min、5 min离心过滤后分别收集滤渣和滤液。滤渣进行同样条件的二次提取,将两次提取的滤液合并浓缩至原来体积的1/5,浓缩液用石油醚萃取3次后取水相,再用乙酸乙酯萃取3次,水相最后再用正丁醇萃取3次,萃取均按照1﹕3体积操作。将得到的正丁醇相经60℃真空减压浓缩至浸膏物,用甲醇溶解后定容至100 mL,4℃保存备用[16-17]。
1.4.2 总皂苷含量的测定 测定方法以人参皂苷Rg1为标品,采用香草醛-高氯酸法[18]。取2 mL苦瓜甲醇溶液,水浴挥干甲醇,香草醛-高氯酸法反应后在560 nm下测定吸光值,每个样品做3个平行。代入标准曲线计算皂苷含量。皂苷含量以每100 g苦瓜粉干重计,表示为g/100g DW。
1.4.3 皂苷单体含量分析
1.4.3.1 待测样品的制备 苦瓜皂苷甲醇溶液经真空抽滤后收集滤液。滤液经MCI凝胶柱层析,25%甲醇水溶液600 mL,85%甲醇水溶液1 200 mL和丙酮600 mL依次洗脱。85%甲醇水洗脱部分浓缩得精制皂苷浸膏,并用甲醇溶解定容为待测样品。
1.4.3.2 混标的绘制 7种皂苷单体标准品名称及纯度分别为:苦瓜苷A(Momorcharaside A)95.759%、苦瓜皂苷A(Momordicoside A)97.728%、karaviloside XI 58.086%、苦瓜皂苷F2(Momordicoside F2)86.041%、苦瓜皂苷K(Momordicoside K)85.729%、Kuguacin N 94.918%、(23E)-3β,7β,25- trihydroxycucubita- 5,23-dien-19-al 97.976%。7种标品的结构如图1,分别精密称量上述标准品5.5、5.5、3.5、5.5、5.5、5.5和7 mg于50 mL容量瓶中用甲醇定容。从混标溶液中分别取1、5、10、15和20 μL溶液在HPLC进样分析,测各浓度标品的峰面积。各浓度进两针,最后取平均值。
1.4.3.3 HPLC条件 Momorcharaside A、Momordicoside A和karaviloside XI按以下液相条件分析[19]:流动相为乙腈/水(1—16 min,24%;16—20 min,24%—45%;20—45 min,45%—55%;45—60 min,55%—80%);温度30℃,流速1.0 mL∙min-1,检测波长为203和238 nm,进样量为20 μL。Momordicoside F2、Momordicoside K、Kuguacin N和(23E)-3β,7β,25-trihydroxy-cucubita- 5,23-dien-19-al的液相条件分析:流动相为乙腈/水(1—50 min,40%;50—68 min,40%—50%;68—88 min,50%—75%);温度30℃,流速1.0 mL∙min-1,检测波长203 nm,进样量为20 μL。记录峰面积,由标准曲线计算出各标品含量。单体组成含量以每g苦瓜粉干重计,表示为μg∙g-1DW。
1.5 ORAC值测定
测定方法参考Davalos等[20],略加修改,将苦瓜皂苷甲醇溶液用75 mmol∙L-1磷酸缓冲液(pH 7.4)稀释至一定浓度。在96孔板各孔分别加入20 μL磷酸缓冲液、20 μL不同浓度的Trolox标准品溶液、20 μL皂苷溶液,以及120 μL 0.96 μmol∙L-1荧光素工作液,37℃下孵育15 min。然后用多道移液器迅速在各孔加入新鲜配置60 μL的119 mmol∙L-1AAPH溶液。启动酶标仪,在37℃下以激发波长485 nm,发射波长538 nm连续测定各孔的荧光强度。每4.5 min重复测定,测35个循环。以磷酸缓冲液作为空白对照,每个孔测3个平行。以Net AUC的数值与Trolox浓度作标准曲线,以皂苷干基每g样品中所含Trolox当量(μmol TE∙g-1DW)表示。
1.6 α-葡萄糖苷酶抑制活性
皂苷的α-葡萄糖苷酶活性测定按照WU等[21]的方法,略作修改。取苦瓜甲醇溶液20 μL用0.1 mol∙L-1磷酸盐缓冲液(pH 6.8)稀释至200 μL,然后取50 μL和25 μL的0.5 U∙mL-1α-葡萄糖苷酶于96孔板中,37℃预孵育10 min。之后再加入25 min 10 mmol∙L-1的PNPG,37℃下孵育30 min。孵育结束后加入100 μL的0.2 mol∙L-1Na2CO3溶液终止反应,405 nm下测吸光度。同时设置样品背景对照组、空白对照组,酶活抑制率计算公式如下:
式中,A1为空白的吸光度;A2为背景的吸光度;A3为样品的吸光度。
1.7 统计分析
Excel和SPSS19.0软件进行数据处理和分析,数据结果以±SD表示,皂苷单体含量与活性之间采用双变量相关性分析,品种间差异比较采用LSD法。
2 结果
2.1 不同品种苦瓜皂苷总含量
13个不同品种苦瓜果肉皂苷总含量如表1所示,品种间具有显著差异(<0.05)。不同品种苦瓜果肉皂苷的含量变幅为(0.52—1.20)g/100g DW,平均值为0.79 g/100g DW,变异系数21.65%。皂苷含量最高的是白珍珠,最低的是油绿1302号,两者含量差异为2.31倍。

表1 不同品种苦瓜果肉皂苷总含量
不同小写字母表示组间差异显著(<0.05)。下同 The values marked by different letters are significantly different (<0.05). The same as below
2.2 不同品种苦瓜皂苷单体含量
13个不同品种苦瓜果肉皂苷中7种单体含量如表2所示。单体含量均值最高的是苦瓜皂苷K,为183.70 μg∙g-1DW,最少的是Kuguacin N,仅为3.87 μg∙g-1DW,前者为后者的47.47倍。苦瓜皂苷K含量变幅84.11—299.17 μg∙g-1DW,含量最高的品种是印尼-3号,最低的是印尼-1号。Kuguacin N含量变幅0.27—23.96 μg∙g-1DW,含量最高的品种是大顶7号,最低的是印尼-1号。单体总含量变幅为172.96—488.78 μg∙g-1DW,均值为329.35 μg∙g-1DW,含量最高的品种是大顶7号,最低的是大顶6号。
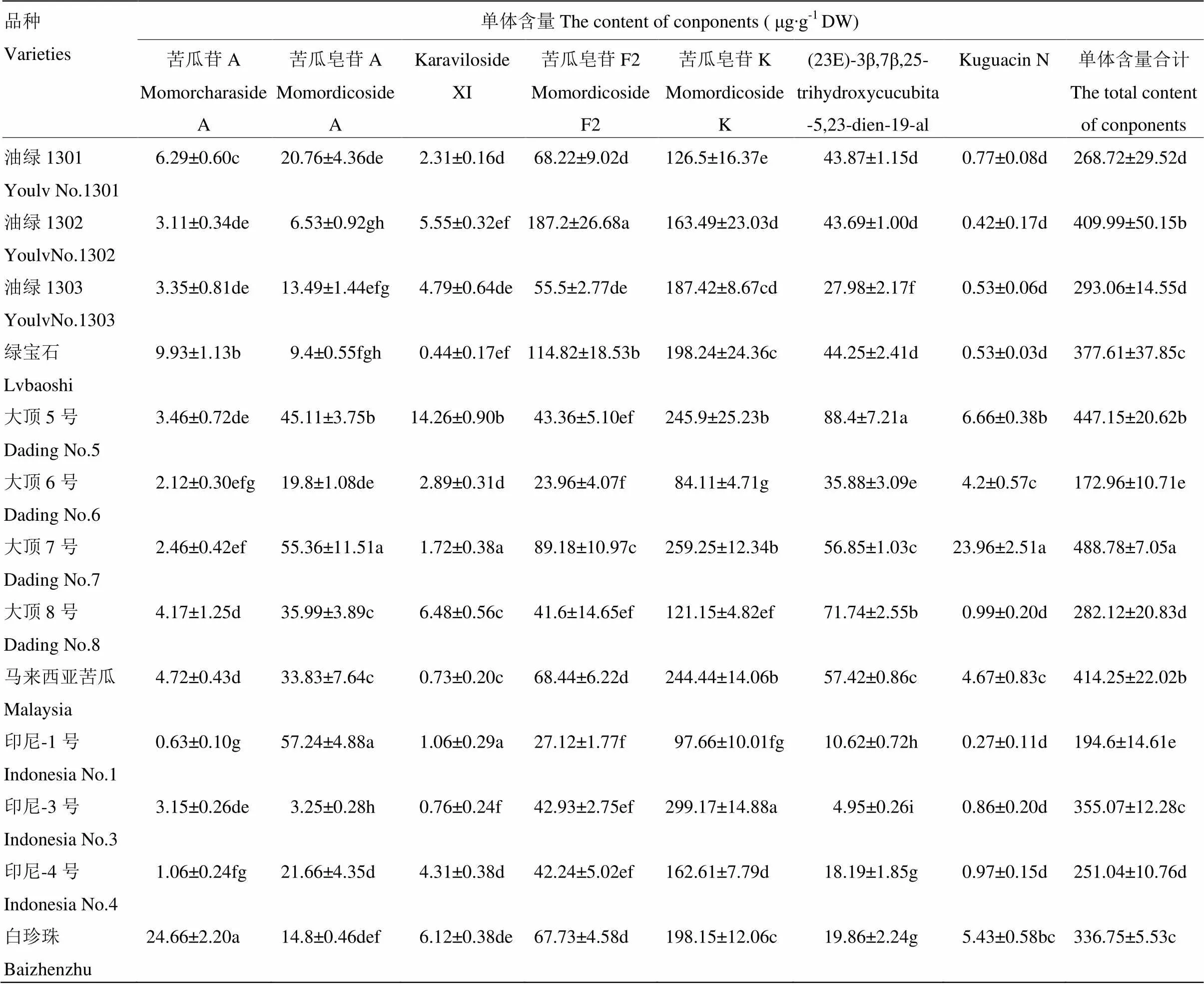
表2 不同品种苦瓜果肉中皂苷组成及含量
2.3 不同品种苦瓜皂苷的总抗氧化能力指数
13个不同品种的苦瓜皂苷ORAC指数如图2所示。不同品种苦瓜皂苷ORAC指数变幅为2 747.76— 15 584.07 μmol Trolox∙g-1,平均值为8 879.48 μmol Trolox∙g-1,变异系数为34.91%,表明不同品种间的抗氧化能力差异较大,抗氧化活性最高的是油绿1302号,最低的是马来西亚苦瓜,两者相差5.67倍。
2.4 不同品种苦瓜皂苷的α-葡萄糖苷酶抑制活性
13个不同品种苦瓜果肉皂苷的α-葡萄糖苷酶如表3所示。α-葡萄糖苷酶抑制活性最强的是印尼-4号,IC50值为1.55 mg∙mL-1;活性最弱的是大顶6号,IC50值为4.96 mg∙mL-1。
表3 不同品种苦瓜皂苷的α-葡萄糖苷酶IC50值
Table 3 The IC50 value of α-glucosidase of saponin from M. charantia (±SD)
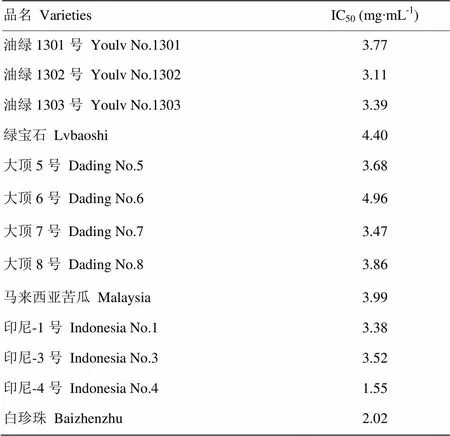
表3 不同品种苦瓜皂苷的α-葡萄糖苷酶IC50值
品名 VarietiesIC50 (mg∙mL-1) 油绿1301号Youlv No.13013.77 油绿1302号 Youlv No.13023.11 油绿1303号 Youlv No.13033.39 绿宝石 Lvbaoshi4.40 大顶5号 Dading No.53.68 大顶6号 Dading No.64.96 大顶7号 Dading No.73.47 大顶8号 Dading No.83.86 马来西亚苦瓜Malaysia3.99 印尼-1号Indonesia No.13.38 印尼-3号Indonesia No.33.52 印尼-4号Indonesia No.41.55 白珍珠 Baizhenzhu2.02
2.5 苦瓜皂苷总含量、单体含量与抗氧化及α-葡萄糖苷酶抑制活性间关系
苦瓜果肉中皂苷总含量与ORAC指数呈显著负相关关系(=-0.693,<0.05),与α-葡萄糖苷酶抑制活性呈显著正相关(=0.683,<0.05)。皂苷单体化合物苦瓜苷A与ORAC指数呈显著负相关(=-0.711,<0.05);而苦瓜皂苷A与ORAC指数呈正相关(=0.593,>0.05)。(23E)-3β,7β,25- trihydroxycucubita-5,23-dien-19-al与α-葡萄糖苷酶活性抑制率呈显著正相关(=0.659,<0.05),其他6种单体与α-葡萄糖苷酶活性抑制率均无明显相关性。此外,抗氧化活性与α-葡萄糖苷酶抑制活性之间也无明显相关性(表4)。
3 讨论
3.1 苦瓜品种皂苷含量
目前从苦瓜中分离得到的皂苷类化合物接近150种。按其结构可分为甾体类和三萜类。苦瓜皂苷以三萜皂苷为主,包括四环三萜和五环三萜。不同苦瓜品种由于其基因型和生长环境差异,皂苷的含量、组成及活性也有差异。曹晶晶等[22]测定了浙江栽培的41个品种苦瓜果肉皂苷含量,变幅为0.521%—5.221%,品种间差异为10倍。田力东等[4]比较两广地区35个品种苦瓜果肉皂苷含量,变幅为1.17%—4.07%,变异系数为32%。张武君等[5]比较福建产的29个品种苦瓜果肉皂苷含量,变幅为0.75%—2.47%,变异系数29.04%。本研究比较了目前广东主栽苦瓜品种和马来西亚、印尼引进苦瓜品种果肉皂苷含量,发现其含量平均值为0.79 g/100g DW,品种间皂苷差异为2.31倍。HABICH等[23]报道白苦瓜比其他品种含有更少的三萜皂苷。但本研究中白珍珠苦瓜(白色)皂苷含量最高。田力东等[4]测定的广西白(白色)苦瓜皂苷含量为1.97%,在测定的35种苦瓜里皂苷含量接近均值(1.96%)。说明皂苷含量与苦瓜果实颜色并无直接关系,可能更多的取决于遗传性状、栽培条件及成熟度等。
目前关于不同品种苦瓜皂苷单体组成及含量的比较分析较少。仅有张瑜等[19]对山东、河南、河北、江西4个产地苦瓜中皂苷元L含量的分析比较。本研究首次采用HPLC法对13个品种苦瓜果肉皂苷中的7种皂苷单体物质进行了定量分析,发现7种单体含量在不同品种苦瓜间存在显著性差异。
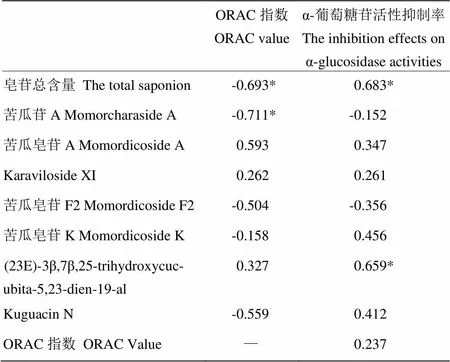
表4 不同品种苦瓜皂苷含量、单体组成对ORAC指数和抑制α-葡萄糖苷酶活性的相关性分析
*不同小写字母表示在0.05水平上存在显著差异
*Values with no letters in common in each column are significantly different (<0.05)
3.2 苦瓜品种皂苷含量及组成与活性的相关性
对不同品种苦瓜皂苷总含量、单体组成含量和ORAC值进行双变量相关性分析,发现皂苷含量与ORAC值呈显著负相关。油绿1302号皂苷含量最低,其ORAC值最高,皂苷含量最高的白珍珠ORAC值排在倒数第三。黄龙等[24]曾提出酚类物质是苦瓜抗氧化的重要活性物质基础。本研究也证实皂苷并非苦瓜果肉抗氧化活性的主要贡献物质。尽管如此,但苦瓜皂苷仍具有一定的抗氧化活性,其抗氧化能力远高于苦瓜多糖[25]。进一步相关性分析发现苦瓜苷A与ORAC值显著负相关,而苦瓜皂苷A与ORAC值呈正相关。苦瓜苷A和苦瓜皂苷A母核结构相同,只是C-3位置链接的糖分别为β-D-Galactopyranose-(1→6)- β-D-Ghicopyranosyl和β-D-Glc-(1→6)-β-D-Glcopyranosyl。糖基的不同导致了两者活性差异显著。已有研究证实皂苷类化合物的抗氧化活性与皂苷元配基的结构和糖残基的数量有关[17]。BI等[26]提出C-3位置糖链的种类和排列顺序对活性的影响至关重要,但糖苷配基中的双键则对活性影响不大;C-3位置上存在β-D- glucopyranosyl-(1→2)-[β-D-glucopyranosyl-(1→3)]-β-D-glucuronopyranosyl oligosaccharide是太白楤木根皮皂苷抗氧化作用的主要活性单元。此外,皂苷结构中的-OH基团能够阻止活性氧的产生,也是其抗氧化的重要作用位点[27]。
α-葡萄糖苷酶从低聚糖底物的非还原性末端断开α-1,4糖苷键,释放葡萄糖或将游离葡萄糖残基转移到另一糖底物形成α-1,6糖苷键,从而得到非发酵性低聚异麦芽糖或糖酯、糖肽等[28]。抑制该酶活性,能够有效控制餐后血糖水平,对2型糖尿病的预防和治疗有非常积极的效果[29]。已有研究证实苦瓜皂苷能够显著降低正常小鼠和2型糖尿病小鼠餐后血糖[30]。本研究对不同品种苦瓜皂苷总含量、单体组成含量和α-葡萄糖苷酶抑制率相关性分析发现,α-葡萄糖苷酶抑制率和皂苷含量呈显著正相关。并且α-葡萄糖苷酶抑制率与(23E)-3β,7β,25-trihydroxycucubita-5,23-dien-19-al呈显著正相关,表明皂苷是苦瓜抑制α-葡萄糖苷酶活性的主要物质基础,(23E)-3β,7β,25-trihydroxy-cucubita- 5,23-dien-19-al是其主要活性单体。Kuguacin N与(23E)- 3β,7β,25-trihydroxycucubita-5,23-dien-19-al结构类似,Kuguacin N在C-23有羰基取代,并在C-24和C-25间形成双键;(23E)-3β,7β,25-trihydroxycucubita-5,23- dien-19-al在C-25有羟基取代,并在C-23和C-24间形成双键。但Kuguacin N与α-葡萄糖苷酶抑制活性无显著相关性,α-葡萄糖苷酶与底物结合时,需要底物有恰当的羟基构象、阳离子、三角形的异头碳中心,并且有一个共价连接的环所形成的半椅状或椅状构型[31]。Kuguacin N与(23E)-3β,7β,25-trihydroxycucu- bita-5,23-dien-19-al在活性上的差别可能是由于Kuguacin N在C-23羰基的取代影响了其与α-葡萄糖苷酶的结合;而(23E)-3β,7β,25-trihydroxycucubita-5,23- dien-19-al在C-25的羟基更加利于其与α-葡萄糖苷酶结合。此外,虽然数据分析显示α-葡萄糖苷酶抑制率和皂苷含量、(23E)-3β,7β,25-trihydroxycucubita-5,23- dien-19-al含量之间显著相关,但其相关系数并不是太大(分别为0.683和0.659),因此推测苦瓜果肉皂苷中的7种单体物质或皂苷与其他多种营养成分之间还存在协同作用,有待进一步探讨验证。
4 结论
13个苦瓜品种果肉皂苷含量、抗氧化值和α-葡萄糖苷酶抑制活性具有显著的基因型差异。7种单体的含量在品种间也存在差异。皂苷是苦瓜抑制α-葡萄糖苷酶活性的主要物质基础,但并不是苦瓜抗氧化活性主要贡献物质。(23E)-3β,7β,25-trihydroxycucubita-5,23-dien-19-al是苦瓜抑制α-葡萄糖苷酶活性主要活性单体。研究结果可为苦瓜的精深加工和以皂苷为主要功能成分的健康食品开发提供参考。
References
[1] 王琪, 张名位, 孙远明, 张雁, 唐小俊, 魏振承, 张瑞芬, 刘军, 张粹兰. 苦瓜皂苷的超声-微波协同提取工艺优化. 广东农业科学, 2009(6): 120-126.
WANG Q, ZHANG M W, SUN Y M, ZHANG Y, TANG X J, WEI Z C, ZHANG R F, LIU J, ZHANG C L. Extraction of charantin inL. using ultrasonic-microwave synergistic extraction., 2009(6): 120-126. (in Chinese)
[2] POPOVICH D G, LI L, ZHANG W. Bitter Gourd triterpenoid extract reduces preadipocyte viability, lipid accumulation and adiponectin expression in 3T3-L1 cells., 2010, 48: 1619-1626.
[3] LIN K W, YANG S C, LIN C N. Antioxidant constituents from the stems and fruits of., 2011, 127: 609-614.
[4] 田力东, 张名位, 郭祀远, 张瑞芬, 池建伟, 魏振承, 张雁, 唐小俊. 不同苦瓜品种的皂苷含量及对α-葡萄糖苷酶活性抑制作用的比较. 中国农业科学, 2008, 41(10): 3415-3421.
TIAN L D, ZHANG M W, GUO S Y, ZHANG R F, CHI J W, WEI Z C, ZHANG Y, TANG X J. Comparison of saponin contents of different varieties ofL. and their inhibition on α-glucosidase activity., 2008, 41(10): 3415-3421. (in Chinese)
[5] 张武君, 黄颖桢, 林永胜, 张玉灿. 29个苦瓜品系不同部位皂苷含量比较分析. 福建农业学报, 2016, 31(6): 599-603.
ZHANG W J, HUANG Y Z, LIN Y S, ZHANG Y C. Comparative analysis of saponion contents in different parts of bitter gourds twenty-nine varieties., 2016, 31(6): 599-603. (in Chinese)
[6] CHEN J C, LAU C B, CHAN J Y, FUNG K P, LEUNG P C, LIU J Q, ZHOU L, XIE M J, QIU M H. The antigluconeogenic activity of cucurbitacins from., 2015, 81: 327-332.
[7] CHEN J C, TIAN R R, QIU M H, LU L, ZHENG Y, ZHANG Z. Trinorcucurbitane and cucurbitane triterpenoids from the roots of., 2008, 69: 1043-1048.
[8] 马成友. 苦瓜果实和滇杠柳的化学成分及其生物活性研究[D]. 昆明: 云南中医学院, 2012.
MA C Y. Study on comecal constitutions and their bioactives ofL. andLinn [D]. Kunming: Traditional Chinese Medicine of Yunnan University, 2012. (in Chinese)
[9] TAN M J, YE J M, TUME N, HOHNEN-BEHRENS C, KE C Q, TANG C P, CHEN T, WEISS H C, GESING E R, ROWLAND A, JAMES D E, YE Y. Antidiabetic activities of triterpenoids isolatedfrom bitter melon associated with activation of the AMPK pathway., 2008, 15: 263-273.
[10] NHIEM N X, KIEM P V, MINH C V, BAN N K, CUONG N X, TUNG N H, HA L M, HA D T, TAI B H, QUANG T H,NGOC T M, KWON Y L, JANG H D, KIM Y H. α-glucosidase inhibition properties of cucurbitane-type triterpene glycosides from the fruits of., 2010, 58(5): 720-724.
[11] CHANG C I, TSENG H I, LIAO Y W, YEN C H, CHEN T M, LIN C C, CHENG H L.andstudies to identify the hypoglycaemic constituents ofwild variant WB24., 2011, 125: 521-528.
[12] HARINANTENAINA L, TANAKA M, TAKAOKA S, ODA M, MOGAMI O, UCHIDA M, ASAKAWA Y.constituents and antidiabetic screening of the isolated major compounds., 2006, 54(7): 1017-1021.
[13] KAI W L, SHYH C Y, LIN C N. Antioxidant constituents from the stems and fruits of., 2011, 127: 609-614.
[14] LIU C H, YEN M H, TSANG S F, GAN K H, HSU S Y, LIN C N. Antioxidant triterpenoids from the stems of., 2010, 118: 751-756.
[15] WU S B, Yue G G, To M H, Keller A C, Lau C B, Kennelly E J. Transport in Caco-2 cell monolayers of antidiabetic cucurbitane triterpenoids fromfruits., 2014, 80(11): 907-911.
[16] DENG Y F, HE K, YE X L, CHEN X, HUANG J, LI X G, YUAN L J, JIN Y L, JIN Q, LI P P. Saponin rich fractions from(Mill.) Druce with more potential hypoglycemic effects., 2012, 141: 228-233.
[17] LU J M, WANG Y F, YAN H L, LIN P, GU W, YU J. Antidiabetic effect of total saponins from polygonatum kingianum in streptozotocin-induced daibetic rats., 2016, 179: 291-300.
[18] 朱群娣, 吴康郁, 袁伟彬. 苦瓜中总皂苷的比色法测定. 中医学报, 2014, 29(10): 1469-1472.
ZHU Q D, WU K Y, YUAN W B. Colorimetric method determination of total saponin fromL., 2014, 29(10): 1469-1472. (in Chinese)
[19] 张瑜, 关键, 崔炯谟, 赵余庆. HPLC测定不同产地苦瓜中降糖活性成分苦瓜皂苷元L含量. 中国中药杂志, 2010, 35(5): 620-622.
ZHANG Y, GUAN J, CUI J M, ZHAO Y Q. Quantification of hypoglycemic active components of diosgenin L inL. in different areas by HPLC., 2010, 35(5): 620-622. (in Chinese)
[20] DAVALOS A, GOMEZ C C, BARTOLOME B. Extending applicability of the oxygen radical absorbance capacity (ORAC- fluorescein) assay., 2004, 52: 48-54.
[21] WU T T, ZHOU X T, DENG Y F, JING Q, LIN M, YUAN L J. In vitro studies of(L.) DC extracts as inhibitors of key enzymes relvant for type2 diabetes and hypertension., 2011, 136(2): 305-308.
[22] 曹晶晶, 徐丽珊, 沈佳鑫, 俞金龙, 朱璞. 不同苦瓜品种多糖与皂苷的含量差异及最佳采摘期研究. 湖南农业科学, 2014(2): 63-66.
CAO J J, XU L S, SHEN J X, YU J L, ZHU P. Differences in contents of polysaccharide and saponion among different varieties ofL. and its optimal haversting period., 2014(2): 63-66. (in Chinese)
[23] HABICH S D, KING V, RODLOFF S, BORSCH C, MUELLER A S, PALLAUF J, YANG R Y, KRAWINKEL M B. Quantification of antidiabetic extracts and compounds in bitter gourd varieties., 2011, 126: 172-176.
[24] 黄龙, 邓媛元, 张名位, 张雁, 魏振承, 张瑞芬, 唐小俊. 不同苦瓜
品种果肉中酚类物质含量及抗氧化能力比较. 中国农业科学, 2011, 44(22): 4660-4668.
HUANG L, DENG Y Y, ZHANG M W, ZHANG Y, WEI Z C, ZHANG R F, TANG X J. Phenolic profiles and antioxidant activity ofL. of different varieties., 2011, 44(22): 4660-4668. (in Chinese)
[25] 邓媛元, 张名位, 刘接卿, 张雁, 张瑞芬, 魏振承, 遆慧慧, 刘磊, 邱明华. 不同品种苦瓜多糖含量及其抗氧化和α-葡萄糖苷酶抑制活性比较. 现代食品科技, 2014, 30(9): 102-108.
DENG Y Y, ZHANG M W, LIU J Q, ZHANG Y, ZHANG R F, WEI Z C, TI H H, LIU L, QIU M H. Comparison of the content, antioxidant activity and α-glucosidase inhibitory effect of polysaccharides fromL. species, 2014, 30(9): 102-108.(in Chinese)
[26] BI L L, TIAN X R, DOU F, HONG L J, TANG H F, WANG S W. New antioxidant and antiglycation active triterpenoid saponins from the root bark of Aralia taibaiensis., 2012, 83(1): 234-240.
[27] XI M M, HAI C H, TANG H F, CHEN M S, FANG K Q, LIANG X. Antioxidant and antiglycation properties of total saponins extracted from traditional Chinese medicine used to treat diabetes mellitus., 2008, 22: 228-237.
[28] 易菊阳, 梁钰婷, 陆兵, 吴昊, 黄桂华, 陈桂光, 梁智群. 高产α-葡萄糖苷酶黑曲霉的微波选育及发酵条件优化. 食品科学, 2014, 35(15): 145-150.
YI J Y, LIANG Y T, LU B, WU H, HUANG G H, CHEN G G, LIANG Z Q. Microwave breeding ofwith high α-glucosidase activity and optimization of its fermentation conditions., 2014, 35(15): 145-150. (in Chinese)
[29] SHODEHINDE S A, ADEMILUYI A O, OBOH G, AKINDAHUNSI A A. Contribution ofin the inhibition of α-amylase, α-glucosidase and angiotensin-I converting enzyme in streptozotocin induced rats., 2015, 133: 8-14.
[30] NAGARANI G, ABIRAMI A, SIDDHURAJU P. Food prospects and nutraceutical attributes ofspecies: A potential tropical bioresources., 2014, 3: 117-126.
[31] 陈海敏, 严小军, 林伟. α-葡萄糖苷酶抑制剂的构效关系. 中国生物化学与分子生物学报, 2003, 19(6): 780-784.
CHEN H M, YAN X J, LIN W. Relationship between structure and of α-glucosidase inhibitors., 2003, 19(6): 780-784. (in Chinese)
(责任编辑 赵伶俐)
Saponion Profiles and Antioxidant Activity, α-Glucosidase Inhibitory Activity ofof Different Varieties
LIU HuiJuan1,2, ZHANG MingWei2, ZHANG RuiFen2, ZHANG Yan2, WEI ZhenCheng2, MA YongXuan2, LIU Lei2, DENG YuanYuan2
(1College of Life Science, Yangtze University, Jingzhou 434020, Hubei;2Sericultura & Agri-Food Research Institute, Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods, Ministry of Agriculture/Guangdong Key Laboratory of Agricultural Products Processing, Guangzhou 510610)
【Objective】The content and composition of saponion of 13 differentvarieties as well as the antioxidant activity and inhibitory effect of α-glucosidase were studied. 【Method】Perchloric acid-vanilin-glacial method was used to determine saponin content, while HPLC method was used to measure the contents of 7 saponin components. In addition, their antioxidant activity was evaluated by oxygen radical absorbance capacity (ORAC). The 4-nitrophenyl-2-β-D-glucopyranoside method was used to measure the α-glucosidase inhibitory activity and to analyze the relationship between the components and the corresponding activity. 【Result】There is a significant difference in contents of saponin in 13 different varieties of.The content ranges of saponin were 0.52-1.20 g/100g DW, with an average value being 0.79 g/100g DW, and the coefficient of variability being 21.65%. The average contents of components were as follows: momorcharaside A 5.32 μg∙g-1DW, momordicoside A 25.42 μg∙g-1DW, karaviloside XI 3.96 μg∙g-1DW, momordicoside F2 66.95 μg∙g-1DW, momordicoside K 183.70 μg∙g-1DW, (23E)-3β,7β,25-trihydroxycucubita-5,23-dien-19-al 40.13 μg∙g-1DW, and kuguacin N 3.87 μg∙g-1DW. ORAC values of the 13varieties varied from 2 747.76 to 15 584.07 μmol Trolox∙g-1, the average value being 8 879.48 mol Trolox∙g-1, the coefficient of variability being 34.91% and the IC50value of alpha glucosidase varied from 1.55 to 4.96 mg∙mL-1. 【Conclusion】Significant differences in the components of saponin and the antioxidant activity and the inhibitory effect on α-glucosidase of different varieties ofwere detected. Saponin is the main active basis of α-glucosidase activity in, but not the main antioxidant substance. (23E)-3β,7β,25-trihydroxycucubita-5,23-dien-19-al is the major active compound.
; saponin; antioxidant; α-glucosidase
2017-01-25;接受日期:2017-04-24
广东省中国科学院全面战略合作专项资金竞争性分配项目(2013B091100011)、广东省省级科技计划项目(2016B070701012,2016A040403081)
刘慧娟,E-mail:lhj8401@163.com。通信作者邓媛元,E-mail:yuanyuan_deng@yeah.net

